Để sử dụng toàn bộ tiện ích nâng cao của Hệ Thống Pháp Luật vui lòng lựa chọn và đăng ký gói cước.
| BỘ Y TẾ | CỘNG HÒA XÃ HỘI CHỦ NGHĨA VIỆT NAM |
| Số: 13232/QLD-CL | Hà Nội, ngày 11 tháng 7 năm 2018 |
| Kính gửi: | - Sở Y tế tỉnh, thành phố trực thuộc Trung ương |
Căn cứ Biên bản làm việc ngày 29/6/2018 của Cục Quản lý Dược và Công ty cổ phần dược phẩm Agimexpharm;
Căn cứ Biên bản kiểm tra ngày 06/7/2018 của Đoàn kiểm tra theo Quyết định số 422/QĐ-QLD ngày 05/07/2018 của Cục trưởng Cục Quản lý Dược về việc kiểm tra đột xuất việc thực hiện quy định của pháp luật trong hoạt động sản xuất, kinh doanh thuốc Agifamcin 300, SĐK VD-14223-11 tại Công ty cổ phần dược phẩm Agimexpharm, Công ty TNHH MTV DP Huy Thảo. Theo đó, qua công tác kiểm tra giám sát, cơ quan kiểm tra chất lượng thuốc đã phát hiện trên thị trường có lưu hành một số hộp thuốc Agifamcin giả, trên nhãn ghi mạo danh nhà sản xuất Công ty cổ phần dược phẩm Agimexpharm và các thông tin SĐK, số lô, hạn dùng “thuốc viên nang Agifamcin 300 SĐK VD-14223-11, số lô 00916, HD 22/3/2019”. Thuốc giả được phân phối đồng thời với thuốc thật Agifamcin 300 SĐK VD-14223-11, số lô 00916, HD 22/3/2019 do Công ty cổ phần dược phẩm Agimexpharm sản xuất.
Để đảm bảo an toàn cho người sử dụng, Cục Quản lý Dược yêu cầu:
1. Đình chỉ lưu hành thuốc trên nhãn ghi: thuốc viên nang Agifamcin 300 SĐK VD-14223-11, số lô 00916, HD 22/3/2019 do Công ty cổ phần dược phẩm Agimexpharm sản xuất.
2. Công ty cổ phần dược phẩm Agimexpharm tiến hành thu hồi và tiếp nhận toàn bộ thuốc thật và thuốc giả trên nhãn ghi Agifamcin 300 SĐK VD-14223-11, số lô 00916, HD 22/3/2019 được trả về từ các cơ sở kinh doanh, sử dụng thuốc.
- Bảo quản biệt trữ thuốc thu hồi, trả về theo đúng quy định, phối hợp với Viện kiểm nghiệm thuốc trung ương hoặc Viện kiểm nghiệm thuốc Tp. HCM lấy mẫu, kiểm nghiệm mẫu thuốc thu hồi, trả về.
3. Sở Y tế tỉnh, thành phố trực thuộc Trung ương, Y tế các ngành:
- Thông báo cho các cơ sở kinh doanh, sử dụng thuốc ngừng ngay việc phân phối, sử dụng và thực hiện thu hồi, trả lại đơn vị đã cung cấp thuốc viên nang trên nhãn ghi: Agifamcin 300 SĐK VD-14223-11, số lô 00916, HD 22/3/2019.
- Phối hợp với các cơ quan truyền thông thông tin tới các cơ sở buôn bán, sử dụng thuốc và người dân biết để không buôn bán, sử dụng Agifamcin 300 giả có các dấu hiệu nhận biết theo bảng đính kèm công văn này.
- Tổ chức tiếp nhận thông tin báo cáo của các cơ sở sản xuất, kinh doanh, người sử dụng; phối hợp với các cơ quan chức năng kiểm tra xác minh, truy tìm nguồn gốc xuất xứ của thuốc giả nêu trên; xử lý các tổ chức, cá nhân vi phạm theo quy định hiện hành. Báo cáo kết quả về Cục Quản lý Dược và cơ quan liên quan.
4. Viện kiểm nghiệm thuốc Trung ương, Viện kiểm nghiệm thuốc Tp. HCM tiến hành lấy mẫu, kiểm tra chất lượng đối với các lô thuốc viên nang trên nhãn ghi: Agifamcin 300 SĐK VD-14223-11, số lô 00916, HD 22/3/2019 được thu hồi, trả về và bảo quản tại kho của Công ty cổ phần dược phẩm Agimexpharm.
- Thông báo kết quả kiểm tra chất lượng về Cục Quản lý Dược trước ngày 10/8/2018 để có căn cứ xử lý tiếp theo.
Cục Quản lý Dược thông báo để các đơn vị biết và thực hiện./.
|
| KT.CỤC TRƯỞNG |
MỘT SỐ ĐẶC ĐIỂM NHẬN BIẾT THUỐC AGIFAMCIN 300 GIẢ
(Đính kèm Công văn số 13232/QLD-CL ngày 11 tháng 7 năm 2018)
| Đặc điểm | THUỐC GIẢ | THUỐC THẬT |
| Hộp thuốc |
|
|
| Tên thuốc: Nét mỏng, rõ Logo màu xanh lá (sậm) | Tên thuốc: Nét đậm, rõ Logo màu xanh lá (sáng) | |
| Tờ hướng dẫn sử dụng |
|
|
| Kiểu chữ viết in nghiêng | Kiểu chữ viết đứng | |
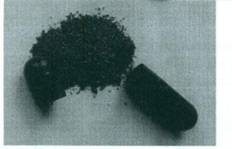
| Bột thuốc |
|
|
| Màu đỏ, có nhiều hạt | Bột màu đỏ, mịn |
- 1Quyết định 416/QĐ-QLD năm 2017 về rút số đăng ký lưu hành, đình chỉ lưu hành và thu hồi thuốc chứa hoạt chất phối hợp Trypsin và Bromelain, thuốc chứa hoạt chất phối hợp Domperidon và chất ức chế proton đang lưu hành tại Việt Nam do Cục trưởng Cục Quản lý dược ban hành
- 2Quyết định 442/QĐ-QLD năm 2017 về ngừng nhận hồ sơ cấp, gia hạn giấy đăng ký lưu hành thuốc, nguyên liệu làm thuốc và thu hồi giấy đăng ký lưu hành thuốc ra khỏi danh mục thuốc được cấp giấy đăng ký lưu hành tại Việt Nam do Cục trưởng Cục Quản lý Dược ban hành
- 3Quyết định 395/QĐ-QLD năm 2018 về ngừng nhận hồ sơ cấp, gia hạn giấy đăng ký lưu hành thuốc, nguyên liệu làm thuốc và thu hồi giấy đăng ký lưu hành thuốc ra khỏi danh mục thuốc được cấp giấy đăng ký lưu hành tại Việt Nam do Cục trưởng Cục Quản lý Dược ban hành
- 4Công văn 13441/QLD-CL năm 2018 về xử lý thuốc chứa dược chất do Cục Quản lý Dược ban hành
- 5Công văn 13125/QLD-CL năm 2018 về thu hồi thuốc sản xuất từ nguyên liệu Valsartan do Công ty Zhejiang Huahai Pharmaceutical - Trung Quốc sản xuất do Cục Quản lý Dược ban hành
- 6Công văn 1784/QLD-CL năm 2019 về thu hồi thuốc Pneumorel do Cục Quản lý Dược ban hành
- 7Công văn 1969/QLD-CL năm 2019 về thu hồi thuốc Fenspirol do Cục Quản lý Dược ban hành
- 1Quyết định 416/QĐ-QLD năm 2017 về rút số đăng ký lưu hành, đình chỉ lưu hành và thu hồi thuốc chứa hoạt chất phối hợp Trypsin và Bromelain, thuốc chứa hoạt chất phối hợp Domperidon và chất ức chế proton đang lưu hành tại Việt Nam do Cục trưởng Cục Quản lý dược ban hành
- 2Quyết định 442/QĐ-QLD năm 2017 về ngừng nhận hồ sơ cấp, gia hạn giấy đăng ký lưu hành thuốc, nguyên liệu làm thuốc và thu hồi giấy đăng ký lưu hành thuốc ra khỏi danh mục thuốc được cấp giấy đăng ký lưu hành tại Việt Nam do Cục trưởng Cục Quản lý Dược ban hành
- 3Quyết định 395/QĐ-QLD năm 2018 về ngừng nhận hồ sơ cấp, gia hạn giấy đăng ký lưu hành thuốc, nguyên liệu làm thuốc và thu hồi giấy đăng ký lưu hành thuốc ra khỏi danh mục thuốc được cấp giấy đăng ký lưu hành tại Việt Nam do Cục trưởng Cục Quản lý Dược ban hành
- 4Công văn 13441/QLD-CL năm 2018 về xử lý thuốc chứa dược chất do Cục Quản lý Dược ban hành
- 5Công văn 13125/QLD-CL năm 2018 về thu hồi thuốc sản xuất từ nguyên liệu Valsartan do Công ty Zhejiang Huahai Pharmaceutical - Trung Quốc sản xuất do Cục Quản lý Dược ban hành
- 6Công văn 1784/QLD-CL năm 2019 về thu hồi thuốc Pneumorel do Cục Quản lý Dược ban hành
- 7Công văn 1969/QLD-CL năm 2019 về thu hồi thuốc Fenspirol do Cục Quản lý Dược ban hành
Công văn 13232/QLD-CL năm 2018 về thu hồi thuốc Agifamcin 300 số lô 00916, HD 22/3/2019 do Cục Quản lý Dược ban hành
- Số hiệu: 13232/QLD-CL
- Loại văn bản: Công văn
- Ngày ban hành: 11/07/2018
- Nơi ban hành: Cục Quản lý dược
- Người ký: Nguyễn Tất Đạt
- Ngày công báo: Đang cập nhật
- Số công báo: Dữ liệu đang cập nhật
- Ngày hiệu lực: 11/07/2018
- Tình trạng hiệu lực: Kiểm tra