Để sử dụng toàn bộ tiện ích nâng cao của Hệ Thống Pháp Luật vui lòng lựa chọn và đăng ký gói cước.
| BỘ Y TẾ | CỘNG HÒA XÃ HỘI CHỦ NGHĨA VIỆT NAM |
| Số: 693/QĐ-QLD | Hà Nội, ngày 22 tháng 09 năm 2023 |
![]()
VỀ VIỆC BAN HÀNH QUY TRÌNH THAO TÁC CHUẨN TRONG HỆ THỐNG QUẢN LÝ CHẤT LƯỢNG THEO TIÊU CHUẨN ISO 9001:2015 ÁP DỤNG VÀO HOẠT ĐỘNG QUẢN LÝ NHÀ NƯỚC TẠI CỤC QUẢN LÝ DƯỢC
CỤC TRƯỞNG CỤC QUẢN LÝ DƯỢC
Căn cứ Nghị định số 95/2022/NĐ-CP ngày 15/11/2022 của Chính phủ quy định chức năng, nhiệm vụ, quyền hạn và cơ cấu tổ chức của Bộ Y tế;
Căn cứ Quyết định số 1969/QĐ-BYT ngày 26/4/2023 của Bộ trưởng Bộ Y tế quy định chức năng, nhiệm vụ, quyền hạn và cơ cấu tổ chức của Cục Quản lý Dược thuộc Bộ Y tế;
Căn cứ Quyết định số 388/QĐ-QLD ngày 29/5/2023 của Cục trưởng Cục Quản lý Dược về việc ban hành Quy định chức năng, nhiệm vụ, quyền hạn của Văn phòng và các phòng thuộc Cục Quản lý Dược;
Căn cứ yêu cầu thực tế công tác quản lý của Cục Quản lý Dược;
Theo đề nghị của Chánh Văn phòng Cục.
QUYẾT ĐỊNH:
Điều 1. Ban hành kèm theo Quyết định này 01 Quy trình thao tác chuẩn trong Hệ thống quản lý chất lượng theo tiêu chuẩn ISO 9001:2015 áp dụng vào hoạt động quản lý nhà nước tại Cục Quản lý Dược, cụ thể:
Quy trình tiến hành một cuộc kiểm tra, giám sát hậu mại và xử lý kết quả (mã số QT.VP.19.01 thay thế quy trình mã số QT.TR.12.01).
Điều 2. Quyết định này có hiệu lực kể từ ngày ký.
Điều 3. Các Ông/bà: Lãnh đạo Cục, Lãnh đạo Ban QMS, Chánh Văn phòng, Trưởng các phòng thuộc Cục Quản lý Dược chịu trách nhiệm thi hành Quyết định này./.
|
| CỤC TRƯỞNG |
|
CỤC QUẢN LÝ DƯỢC
QUY TRÌNH TIẾN HÀNH MỘT CUỘC KIỂM TRA, GIÁM SÁT HẬU MẠI VÀ XỬ lÝ KẾT QUẢ
MÃ SỐ: QT.VP. 19.01
|
| Cục Quản lý Dược | QT.VP.19.01 |
|
CỤC QUẢN LÝ DƯỢC | QUY TRÌNH TIẾN HÀNH MỘT CUỘC KIỂM TRA, GIÁM SÁT HẬU MẠI VÀ XỬ LÝ KẾT QUẢ | Mã số: QT.VP.19.01 Ngày ban hành: 22/9/2023 Lần ban hành: 01 Tổng số trang: |
| 1. Người có liên quan phải nghiên cứu và thực hiện đúng các nội dung của quy định này. 2. Nội dung trong quy định này có hiệu lực thi hành như sự chỉ đạo của Cục trưởng 3. Mỗi đơn vị chỉ được phân phối 01 bản. Khi các đơn vị có nhu cầu phân phối thêm tài liệu phải đề nghị với Ban QMS. File mềm được cung cấp trên mạng nội bộ để chia sẻ thông tin. | ||||||
| NƠI NHẬN (ghi rõ nơi nhận rồi đánh dấu X ô bên cạnh) | ||||||
|
| Lãnh đạo Cục |
| Phòng Đăng ký thuốc | |||
|
| Ban QMS |
| Phòng Quản lý chất lượng thuốc | |||
|
| Văn phòng Cục |
| Phòng Quản lý giá thuốc | |||
|
| Phòng Quản lý mỹ phẩm |
| Phòng Quản lý kinh doanh dược | |||
|
| Phòng Pháp chế - Hội nhập |
|
| |||
|
|
|
|
| |||
| BẢNG THEO DÕI TÌNH TRẠNG SỬA ĐỔI | ||||||
| STT | Ngày sửa đổi | Vị trí sửa đổi | Nội dung sửa đổi | Ghi chú | ||
|
| 30/6/2023 | Mã số QT | Từ QT.TR 12.01 sang QT.VP 19.01 | Cho phù hợp CNNV mới | ||
|
|
| Tài liệu tham chiếu | QĐ chức năng nhiệm vụ của Cục QLD |
| ||
|
|
|
|
|
| ||
|
|
|
|
|
| ||
|
|
|
|
|
| ||
|
|
|
|
|
| ||
|
|
|
|
|
| ||
|
| ||||||
1. MỤC ĐÍCH
Mô tả các bước tiến hành một cuộc kiểm tra, giám sát hậu mại đối với các cơ sở hoạt động trong lĩnh vực dược, mỹ phẩm (sau đây gọi tắt là các cơ sở), việc xử lý kết quả sau kiểm tra của Đoàn kiểm tra nhằm:
- Đảm bảo tất cả các đợt kiểm tra, giám sát hậu mại, việc xử lý kết quả sau kiểm tra của các Đoàn kiểm tra được thực hiện theo cùng một trình tự và phương pháp.
- Đảm bảo công tác kiểm tra, giám sát hậu mại và xử lý kết quả sau kiểm tra trong lĩnh vực dược, mỹ phẩm được thực hiện theo đúng quy định.
- Mọi thành viên trong Đoàn kiểm tra dễ dàng thực hiện nhiệm vụ.
2. PHẠM VI ÁP DỤNG:
Áp dụng cho hoạt động kiểm tra, giám sát hậu mại việc chấp hành/tuân thủ các quy định của pháp luật trong lĩnh vực dược, mỹ phẩm đối với các cơ sở hoạt động trong lĩnh vực dược, mỹ phẩm; việc xử lý kết quả sau kiểm tra, giám sát hậu mại của Đoàn kiểm tra của Cục Quản lý Dược.
3. TÀI LIỆU THAM CHIẾU
- Luật xử lý vi phạm hành chính số 15/2012/QH13 ngày 20 tháng 6 năm 2012.
- Luật sửa đổi, bổ sung một số điều của Luật Xử lý vi phạm hành chính số 67/2020/QH14 ngày 13/11/2020.
- Nghị định số 117/2020/NĐ-CP ngày 28 tháng 09 năm 2020 của Chính phủ quy định xử phạt vi phạm hành chính trong lĩnh vực y tế.
- Nghị định số 118/2021/NĐ-CP ngày 23 tháng 11 năm 2021 quy định quy định chi tiết một số điều và biện pháp thi hành luật xử lý vi phạm hành chính.
- Nghị định số 124/2021/NĐ-CP ngày 28/12/2021 của Chính phủ sửa đổi, bổ sung một số điều của Nghị định số 155/2018/NĐ-CP ngày 04/9/2018 của Chính phủ quy định xử phạt VPHC về an toàn thực phẩm và Nghị định số 117/2020/NĐ-CP ngày 28/9/2020 của Chính phủ quy định xử phạt VPHC trong lĩnh vực y tế.
- Quyết định số 1969/QĐ-BYT ngày 26 tháng 4 năm 2023 của Bộ Y tế Quy định chức năng, nhiệm vụ, quyền hạn và cơ cấu tổ chức của Cục Quản lý Dược.
- Các văn bản quy phạm pháp luật có liên quan đến lĩnh vực dược phẩm, mỹ phẩm, lĩnh vực kiểm tra, xử lý vi phạm.
4. TRÁCH NHIỆM THỰC HIỆN
- Người ra quyết định thành lập đoàn kiểm tra, Trưởng đoàn và các thành viên Đoàn kiểm tra, các Phòng chức năng thuộc Cục có trách nhiệm thực hiện đúng những quy định trong quy trình này.
- Lãnh đạo Cục, Lãnh đạo các phòng chức năng của Cục Quản lý Dược, các cán bộ, chuyên viên, chuyên gia liên quan của Cục QLD có trách nhiệm thực hiện, phối hợp kiểm tra, xử lý kết quả và bảo đảm những quy định trong quy trình này được thực hiện và tuân thủ.
5. GIẢI THÍCH TỪ NGỮ VÀ CHỮ VIẾT TẮT
- SOP: Quy trình chuẩn
- Cục QLD: Cục Quản lý Dược
- KT: Kiểm tra, giám sát hậu mại
- ĐKT: Đoàn kiểm tra, giám sát hậu mại.
- Phòng đầu mối: Là phòng chức năng thuộc cục Quản lý Dược, đầu mối đề xuất và thực hiện cuộc kiểm tra, giám sát hậu mại.
6. NỘI DUNG QUY TRÌNH
6.1 Quy định chung:
6.1.1. Nguyên tắc KT và xử lý kết quả:
- Việc kiểm tra, giám sát hậu mại và xử lý kết quả phải được thực hiện đúng quy định, tuân thủ các văn bản quy phạm pháp luật trong lĩnh vực dược phẩm, mỹ phẩm và văn bản pháp luật khác có liên quan.
- Việc kiểm tra, giám sát hậu mại và xử lý kết quả phải được thực hiện công khai, minh bạch, thống nhất và cùng một trình tự, phương pháp.
6.1.2. Hình thức của cuộc KT:
KT được thực hiện theo 02 hình thức:
- Kiểm tra theo kế hoạch: là kiểm tra theo các kế hoạch đã được Lãnh đạo Cục Quản lý Dược hoặc Lãnh đạo Bộ phê duyệt.
- Kiểm tra đột xuất: là kiểm tra khi có thông tin (đơn tố cáo, tố giác và theo phản ánh của người dân, các phương tiện thông tin đại chúng...) về các vi phạm trong lĩnh vực dược, mỹ phẩm hoặc theo yêu cầu quản lý, không thuộc kế hoạch đã được phê duyệt.
6.1.3. Tiêu chuẩn của Trưởng ĐKT:
Trưởng ĐKT, giám sát hậu mại phải đáp ứng các tiêu chuẩn sau:
- Là Lãnh đạo Cục hoặc Lãnh đạo các Phòng đầu mối thực hiện kiểm tra, giám sát hậu mại; có khả năng tổ chức, chỉ đạo các thành viên trong ĐKT thực hiện nhiệm vụ được giao.
- Có kinh nghiệm quản lý nhà nước về dược, mỹ phẩm và hiểu biết về các văn bản quy phạm pháp luật trong lĩnh vực dược, mỹ phẩm, phù hợp với nội dung kiểm tra.
- Trung thực, khách quan, am hiểu nghiệp vụ kiểm tra, có khả năng phân tích, đánh giá, tổng hợp những vấn đề liên quan đến nội dung, lĩnh vực được kiểm tra thuộc phạm vi quản lý của ngành.
- Không có xung đột lợi ích với đơn vị được phân công KT theo quy định của Luật phòng, chống tham nhũng và các văn bản có liên quan. Trong trường hợp phát hiện có xung đột lợi ích, trưởng ĐKT phải báo cáo người ra quyết định để kịp thời xem xét và điều chỉnh thành phần ĐKT.
6.1.4. Tiêu chuẩn của thành viên ĐKT:
Thành viên ĐKT, giám sát hậu mại phải đáp ứng các tiêu chuẩn sau:
- Là cán bộ, công chức, chuyên gia của Cục Quản lý Dược, Sở Y tế hoặc các đơn vị chức năng có liên quan.
- Có trình độ từ đại học trở lên, có kinh nghiệm trong lĩnh vực quản lý nhà nước về dược, mỹ phẩm từ 01 năm trở lên và hiểu biết về các văn bản quy phạm pháp luật trong lĩnh vực dược, mỹ phẩm.
- Trung thực, khách quan, có nghiệp vụ kiểm tra lĩnh vực thuộc phạm vi quản lý của ngành.
- Không có xung đột lợi ích với đơn vị được phân công KT theo quy định của Luật phòng, chống tham nhũng và các văn bản có liên quan. Trong trường hợp phát hiện có xung đột lợi ích, thành viên ĐKT phải báo cáo trưởng ĐKT và người ra quyết định KT để kịp thời xem xét, điều chỉnh thành phần ĐKT.
6.1.5. Thành phần Đoàn kiểm tra, giám sát hậu mại:
Thành phần ĐKT bao gồm:
- Trưởng đoàn là Lãnh đạo Cục hoặc Lãnh đạo phòng đầu mối.
- Thư ký đoàn: thuộc phòng đầu mối đề xuất cuộc KT. Trường hợp nội dung kiểm tra liên quan đến nhiều Phòng chức năng, Trưởng ĐKT có thể đề xuất người ra quyết định cử Thư ký đoàn cho phù hợp.
- Thành viên ĐKT:
+ Các phòng đầu mối đề xuất KT xây dựng thành phần ĐKT có đại diện là cán bộ, công chức, chuyên gia phòng chuyên môn liên quan đến lĩnh vực được kiểm tra, có đại diện Phòng Pháp chế - Hội nhập (khi cần thiết);
+ Đại diện các đơn vị có liên quan: Viện Kiểm nghiệm thuốc TW/ TP. Hồ Chí Minh, Sở Y tế địa phương, các Vụ, Cục, Thanh tra Bộ, các cơ quan chức năng khác (công an, thuế, hải quan,...) (khi cần thiết).
6.2. Sơ đồ quy trình một cuộc kiểm tra:
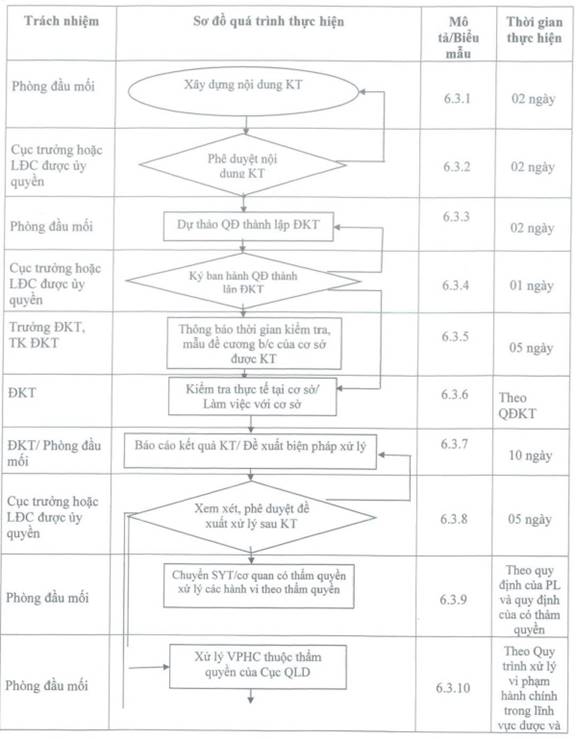

6.3 Mô tả sơ đồ quá trình tiến hành một cuộc kiểm tra, giám sát hậu mại về lĩnh vực dược, mỹ phẩm:
6.3.1. Xây dựng nội dung KT: 02 ngày làm việc
Căn cứ vào kế hoạch kiểm tra hậu mại của phòng đã được Lãnh đạo Cục phê duyệt, căn cứ nhu cầu thực tế của hoạt động KT, căn cứ vào các thông tin khiếu nại, tố cáo, các thông tin thu thập được từ phương tiện thông tin đại chúng và người dân, căn cứ chức năng nhiệm vụ, Phòng đầu mối xây dựng nội dung KT, đưa tiêu chí (nếu cần thiết) trình Cục trưởng xem xét.
6.3.2. Phê duyệt nội dung kiểm tra, giám sát hậu mại: 02 ngày làm việc
Căn cứ đề xuất của Phòng đầu mối, Cục trưởng hoặc LĐC được ủy quyền phê duyệt nội dung KT. Trong trường hợp đồng ý với đề xuất của phòng đầu mối, Lãnh đạo Cục chuyển Phòng đầu mối để thực hiện bước 6.3.3.
Trong trường hợp không đồng ý với đề xuất của Phòng đầu mối, chuyển lại bước 6.3.1 để thực hiện.
6.3.3. Xây dựng dự thảo Quyết định thành lập đoàn kiểm tra: 02 ngày làm việc
Căn cứ kế hoạch kiểm tra, nội dung KT đã được Lãnh đạo Cục phê duyệt, căn cứ ý kiến chỉ đạo của Lãnh đạo Cục đối với trường hợp kiểm tra đột xuất, căn cứ văn bản cử người của các đơn vị liên quan (nếu có), phòng đầu mối dự thảo quyết định thành lập đoàn trình Cục trưởng/LĐC được ủy quyền ký QĐ. QĐ thành lập đoàn theo biểu mẫu BM.VP.19.01/01, có các nội dung:
- Căn cứ pháp lý để thành lập ĐKT;
- Nội dung, phạm vi, đối tượng kiểm tra
- Thành phần đoàn kiểm tra.
- Nhiệm vụ đoàn kiểm tra
- Thời kỳ, thời hạn tiến hành KT;
- Hình thức của cuộc KT: KT theo kế hoạch hay KT đột xuất Phòng đầu mối cuộc KT xem xét dự thảo quyết định thành lập ĐKT.
Lãnh đạo phòng đầu mối trình quyết định thành lập ĐKT lên Cục trưởng.
6.3.4. Ký ban hành Quyết định thành lập ĐKT: 01 ngày làm việc
Cục trưởng hoặc LĐC được ủy quyền (Người ra quyết định thành lập ĐKT) xem xét phê duyệt
- Nếu không đồng ý hoặc có ý kiến chỉ đạo khác chuyển bước 6.3.3;
- Nếu đồng ý, ký quyết định thành lập ĐKT.
6.3.5. Thông báo thời gian KT và đề cương báo cáo của cơ sở: 05 ngày làm việc
- Căn cứ vào ý kiến chỉ đạo của Trưởng ĐKT, Thư ký ĐKT lập đề cương báo cáo các nội dung KT và thông báo cho đơn vị liên quan và cơ sở được kiểm tra thời gian KT và đề cương báo cáo (đã được Trưởng ĐKT phê duyệt) bằng văn bản hoặc bằng hình thức khác như thông báo trực tiếp cho người đại diện đơn vị, thông báo bằng email, điện thoại...đảm bảo các đơn vị liên quan và đối tượng kiểm tra nhận được thông tin đầy đủ về kế hoạch và nội dung kiểm tra (đối với ĐKT theo kế hoạch) trước khi ĐKT tiến hành kiểm tra.
- Đối với các ĐKT đột xuất, căn cứ ý kiến chỉ đạo của Trưởng ĐKT, thư ký ĐKT thông báo lịch kiểm tra cho các đơn vị liên quan và tiến hành kiểm tra thực tế tại cơ sở mà không cần báo trước với cơ sở được kiểm tra.
- Phòng đầu mối gửi Quyết định thành lập ĐKT cho các cơ sở được kiểm tra (đối với ĐKT theo kế hoạch) và các đơn vị liên quan.
6.3.6. Kiểm tra thực tế các hoạt động của cơ sở: thời hạn theo quyết định kiểm tra (nếu có)
- Tiến hành kiểm tra:
ĐKT tiến hành kiểm tra theo các nội dung trong Quyết định thành lập ĐKT. Trưởng đoàn có trách nhiệm phân công nhiệm vụ cụ thể cho mỗi thành viên ĐKT. Nội dung KT bao gồm các nội dung về pháp lý, chuyên môn và sự tuân thủ các quy định của pháp luật/chuyên môn liên quan. Việc KT bao gồm: kiểm tra thực tế cơ sở, vật chất, phương tiện hoạt động tại cơ sở và kiểm tra hồ sơ, tài liệu liên quan, sản phẩm liên quan ...
Trong quá trình kiểm tra, nếu phát sinh các nội dung ngoài phạm vi quyết định kiểm tra, Trưởng ĐKT xin ý kiến của người ra quyết định kiểm tra và xử lý theo chỉ đạo.
- Các phương pháp KT bao gồm:
+ Phỏng vấn người liên quan;
+ Nghiên cứu hồ sơ, tài liệu liên quan;
+ Thu thập bằng chứng;
+ Các biện pháp kỹ thuật khác (khi cần thiết);
- Dự thảo biên bản KT:
+ Thành viên ĐKT: Các thành viên ĐKT báo cáo về kết quả thực hiện nhiệm vụ được giao trong cuộc KT, nêu rõ nhận xét, đánh giá và cung cấp bằng chứng đối với các nhận xét, đánh giá đã tiến hành kiểm tra.
+ Thư ký ĐKT: Căn cứ vào báo cáo của các thành viên ĐKT, thư ký đoàn tập hợp báo cáo đánh giá của các thành viên và tổng hợp lại thành biên bản chung của ĐKT theo biểu mẫu BM.VP.19.01/02.
+ Đối với trưởng ĐKT: Trường ĐKT thống nhất dự thảo biên bản KT với các thành viên trong Đoàn kiểm tra.
+ Trong trường hợp có ý kiến khác nhau giữa các thành viên ĐKT, Trưởng ĐKT có quyền quyết định, các thành viên ĐKT có quyền bảo lưu các nội dung không nhất trí tại biên bản KT.
- Thông qua dự thảo biên bản KT:
Trưởng ĐKT:
+ Trưởng ĐKT thông báo dự thảo biên bản kiểm tra;
+ Trao đổi giải thích những nội dung, ý kiến còn chưa rõ trong dự thảo;
+ Ghi nhận những ý kiến của cơ sở vào biên bản;
+ Trưởng ĐKT, các thành viên tham gia ĐKT, đại diện của cơ sở cùng ký vào biên bản kiểm tra. Biên bản có dấu giáp lai của cơ sở hoặc có chữ ký của đại diện cơ sở vào từng trang biên bản.
- Nội dung biên bản kiểm tra: Biên bản kiểm tra được thực hiện theo mẫu BM.VP.19.01/02, phải có đầy đủ các nội dung sau:
+ Thông tin về đơn vị được kiểm tra, thành phần tham gia cuộc kiểm tra;
+ Thông tin về ĐKT, thời gian, địa điểm kiểm tra;
+ Kết quả KT: nêu rõ các nhận xét, đánh giá sau cuộc kiểm tra, chỉ rõ các hoạt động chưa tuân thủ/không tuân thủ các quy định của pháp luật, ghi rõ các hành vi vi phạm (nếu có), các biện pháp xử lý ĐKT áp dụng, nhằm ngăn chặn hậu quả do hành vi vi phạm gây ra, bao gồm: niêm phong hàng hóa, yêu cầu ngừng kinh doanh, không đưa vào sử dụng nguyên liệu, thành phẩm có dấu hiệu không đảm bảo chất lượng....
+ Danh sách các hồ sơ, tài liệu ĐKT thu thập từ cơ sở;
+ Ý kiến của cơ sở được kiểm tra;
+ Ý kiến ĐKT: phải ghi rõ đầy đủ hoạt động/hành vi vi phạm (nếu có) so với quy định hiện hành; ý kiến chưa thống nhất của thành viên ĐKT (nếu có);
+ Chữ ký của Trưởng ĐKT, thư ký ĐKT, các thành viên tham gia ĐKT và đại diện cơ sở được kiểm tra. Thư ký ĐKT có trách nhiệm ký từng trang biên bản. Biên bản KT có dấu giáp lai của cơ sở kiểm tra hoặc có chữ ký của đại diện cơ sở được kiểm tra tại từng trang biên bản. Trong trường hợp cơ sở được KT không ký Biên bản KT, ĐKT hoàn thiện biên bản, ghi rõ nội dung này vào Biên bản KT, các thành viên tham gia ĐKT ký từng trang biên bản.
- ĐKT tiếp nhận các hồ sơ tài liệu ghi trong biên bản kiểm tra, có xác nhận của cơ sở bằng dấu của cơ sở hoặc chữ ký của người có trách nhiệm của cơ sở được kiểm tra.
6.3.7. Báo cáo kiểm tra: 10 ngày làm việc
- Thư ký ĐKT dự thảo báo cáo KT theo BM.VP.19.01/03
- Căn cứ vào Biên bản kiểm tra và ý kiến của các thành viên ĐKT, ý kiến các phòng chuyên môn (nếu có) và hồ sơ tài liệu liên quan, thư ký ĐKT hoàn chỉnh báo cáo, gửi các thành viên ĐKT để xin ý kiến (nếu cần) trình Trường ĐKT xem xét và ký báo cáo KT gửi Cục trưởng và người ra quyết định kiểm tra. Trường hợp có ý kiến không thống nhất về nội dung báo cáo kiểm tra, trong báo cáo cần thể hiện đầy đủ ý kiến của các thành viên bao gồm ý kiến không thống nhất đó.
+ Trường hợp trưởng ĐKT là Cục trưởng: Báo cáo KT được đồng gửi người ký quyết định thành lập ĐKT, Phó Cục trưởng phụ trách lĩnh vực, Trưởng phòng đầu mối có liên quan;
+ Trường hợp trưởng ĐKT là Phó Cục trưởng phụ trách lĩnh vực: Báo cáo KT gửi Cục trưởng, người ký quyết định thành lập ĐKT và đồng gửi Trưởng phòng đầu mối có liên quan;
+ Trường hợp trưởng ĐKT là Phó Cục trưởng không phụ trách lĩnh vực được kiểm tra: Báo cáo KT gửi Cục trưởng, người ký quyết định thành lập ĐKT và đồng gửi Phó Cục trưởng phụ trách lĩnh vực, Trưởng phòng đầu mối có liên quan;
+ Trường hợp trưởng ĐKT là Trưởng phòng, Phó trưởng phòng: Báo cáo KT gửi Cục trưởng, người ký quyết định thành lập ĐKT và đồng gửi Phó Cục trưởng phụ trách lĩnh vực, Trưởng phòng đầu mối có liên quan.
- Báo cáo kiểm tra cần có đầy đủ thông tin nhận xét, đánh giá kết quả kiểm tra, chỉ rõ các hoạt động tuân thủ một phần, chưa/không tuân thủ (có bàng chứng kèm theo) và căn cứ vào các văn bản QPPL liên quan để xác định các hành vi vi phạm về chuyên môn phát hiện trong quá trình kiểm tra (nếu có), kiến nghị các biện pháp xử lý.
- Căn cứ báo cáo KT, trên cơ sở xem xét các nội dung đề xuất biện pháp xử lý của trưởng ĐKT và hồ sơ tài liệu liên quan, trưởng phòng đầu mối có liên quan có Phiếu trình người ra quyết định kiểm tra đề xuất các biện pháp xử lý (sau đây gọi tắt là Phiếu trình) đối với những nội dung có liên quan đến chức năng, nhiệm vụ của Phòng mình. Phiếu trình phải có kiến nghị các biện pháp quản lý nhà nước (nếu có), kiến nghị các biện pháp xử lý.
6.3.8. Phê duyệt đề xuất xử lý sau KT: 05 ngày làm việc
Căn cứ vào báo cáo của ĐKT và ý kiến của các phòng có liên quan, ý kiến chỉ đạo của người nhận báo cáo kiểm tra (nếu có), trên cơ sở xem xét các nội dung đề xuất biện pháp xử lý của trưởng ĐKT và hồ sơ tài liệu liên quan Trưởng phòng đầu mối có liên quan ký phiếu Trình trình Cục trường hoặc LĐC được ủy quyền ký quyết định kiểm tra, đề xuất các biện pháp xử lý (sau đây gọi tắt là Phiếu trình) đối với những nội dung có liên quan đến chức năng, nhiệm vụ của Phòng mình. Phiếu trình phải có kiến nghị các biện pháp quản lý nhà nước (nếu có), kiến nghị các biện pháp xử lý.
- Trường hợp không có hành vi vi phạm các quy định cần xử lý, Lãnh đạo Cục phê duyệt Phiếu trình và chuyển về Phòng đầu mối để lưu hồ sơ.
- Trường hợp đã đủ cơ sở về việc hành vi vi phạm của cơ sở thuộc thẩm quyền xử lý của Cục Quản lý Dược, đề xuất Lãnh đạo Cục phê duyệt Phiếu trình giao Phòng đầu mối xử lý vi phạm hành chính trong lĩnh vực dược, mỹ phẩm theo quy định; giao phòng có liên quan (nếu có) tham mưu Lãnh đạo Cục áp dụng biện pháp quản lý nhà nước sau kiểm tra theo quy định.
- Trường hợp đã đủ cơ sở để kết luận hành vi vi phạm thuộc thẩm quyền xử lý của Sở Y tế địa phương, và/hoặc các cơ quan có thẩm quyền khác (cơ quan Công an, Quản lý thị trường, Hải quan, các Bộ/Ngành liên quan...) hoặc chưa có đủ cơ sở để kết luận hành vi vi phạm mà việc xác minh nằm ngoài khả năng, thẩm quyền của Cục Quản lý Dược, đề xuất Lãnh đạo Cục phê duyệt Phiếu trình và chuyển Phòng đầu mối dự thảo công văn, phối hợp với Phòng PCHN (nếu cần), trình Lãnh đạo Cục để chuyển các cơ quan có thẩm quyền xem xét và xử lý theo thẩm quyền.
6.3.9. Chuyển Sở y tế địa phương hoặc cơ quan có thẩm quyền xử lý các hành vi thuộc thẩm quyền:
Căn cứ Phiếu trình đã được Cục trưởng xem xét, phê duyệt, trong trường hợp có đủ cơ sở kết luận có vi phạm hành chính trong lĩnh vực dược, mỹ phẩm thuộc thẩm quyền xử lý của Sở Y tế địa phương hoặc các cơ quan khác, Phòng đầu mối dự thảo công văn, trình Lãnh đạo Cục ký gửi các đơn vị (Sở Y tế, cơ quan Công an, Quản lý thị trường, Hải quan, Thanh tra Bộ, các Bộ/Ngành liên quan...) để tiếp tục kiểm tra, xác minh, xử lý vi phạm theo chức năng, nhiệm vụ.
ĐKT/Phòng đầu mối trực tiếp cung cấp hồ sơ tài liệu thu thập trong quá trình kiểm tra cho các cơ quan chức năng theo chỉ đạo của Lãnh đạo Cục.
6.3.10. Xử lý vi phạm hành chính thuộc thẩm quyền của Cục QLD:
Căn cứ Phiếu trình đã được Cục trưởng phê duyệt, đối với trường hợp đã xác định hành vi vi phạm trong lĩnh vực dược, mỹ phẩm thuộc thẩm quyền xử lý của Cục Quản lý Dược, Phòng đầu mối thực hiện theo Quy trình xử lý vi phạm hành chính trong lĩnh vực dược đối với các vi phạm trong lĩnh vực dược và Quy trình xử phạt vi phạm hành chính về mỹ phẩm đối với vi phạm trong lĩnh vực mỹ phẩm.
Trong trường hợp chưa đủ thông tin, căn cứ để xác định hành vi vi phạm của cơ sở hoặc cơ sở được kiểm tra có khiếu nại và cung cấp hồ sơ, bằng chứng chứng minh, Phòng đầu mối cuộc KT tiếp tục xem xét thêm thông tin hoặc kiểm tra lại cơ sở theo bước 6.3.6.
6.3.11. Lưu hồ sơ cuộc KT:
Trong vòng 30 ngày kể từ ngày kết thúc việc xử lý vi phạm, Phòng đầu mối cuộc KT thực hiện lưu trữ hồ sơ kiểm tra, tài liệu liên quan theo quy định hiện hành.
7. HỒ SƠ CỦA QUY TRÌNH
- Quyết định thành lập ĐKT, các văn bản bổ sung, sửa đổi quyết định KT (nếu có);
- Biên bản kiểm tra, biên bản làm việc, giấy mời cơ sở, các hồ sơ, tài liệu thu thập trong quá trình KT, báo cáo KT, Phiếu trình.
- Hồ sơ xử lý kết quả KT bao gồm các văn bản về xử lý và các văn bản có liên quan đến các kiến nghị xử lý.
- Báo cáo của cơ sở được KT; báo cáo tiến độ, báo cáo thực hiện nhiệm vụ của thành viên ĐKT.
8. BIỂU MẪU
- BM.VP.19.01/01: Mẫu Quyết định kiểm tra
- BM.VP.19.01/02: Mẫu Biên bản kiểm tra.
- BM.VP.19.01/03: Mẫu Báo cáo kiểm tra.
BM.VP.19.01/01: Quyết định Kiểm tra
| BỘ Y TẾ | CỘNG HÒA XÃ HỘI CHỦ NGHĨA VIỆT NAM |
| Số: /QĐ - QLD | Hà Nội, ngày .... tháng …. năm …. |
QUYẾT ĐỊNH
Về việc thành lập đoàn kiểm tra việc ……….. thời kỳ ….. tại (1)
CỤC TRƯỞNG CỤC QUẢN LÝ DƯỢC
Căn cứ Luật dược số 105/2016/QH13 ngày 06 tháng 4 năm 2016;
Căn cứ Nghị định số 54/2017/NĐ-CP ngày 08/5/2017 của Chính phủ quy định chi tiết một số điều và biện pháp thi hành Luật Dược;
Căn cứ Nghị định số 95/2022/NĐ-CP ngày 15/11/2022 của Chính phủ quy định chức năng, nhiệm vụ, quyền hạn và cơ cấu tổ chức của Bộ Y tế;
Căn cứ Quyết định số 1969/QĐ-BYT ngày 26/4/2023 của Bộ trưởng Bộ Y tế quy định chức năng, nhiệm vụ, quyền hạn và cơ cấu tổ chức của Cục Quản lý Dược thuộc Bộ Y tế;
Căn cứ...
Căn cứ kế hoạch....
Theo đề nghị của Trưởng Phòng …..
QUYẾT ĐỊNH:
Điều 1. Thành lập Đoàn kiểm tra việc.. (1) tại... (2) (hoặc) theo danh sách kèm theo Quyết định này.
Điều 2. Đoàn kiểm tra, gồm các Ông (Bà) có tên sau đây:
1 .................................................................................................................. , Trưởng Đoàn;
2 .................................................................................................. , Phó trưởng Đoàn (nếu có);
3 ............................................................................................................................ , Thư ký;
4 ...................................................................................................................... , Thành viên;
….
Điều 3. Đoàn kiểm tra có nhiệm vụ:
1.
2.
……..
3. Kiến nghị xử lý các vi phạm (nếu có) với người có thẩm quyền.
Điều 4. Hình thức kiểm tra:
Điều 5. Quyết định này có hiệu lực kể từ ngày ký ban hành, Đoàn kiểm tra sẽ tự giải thể sau khi hoàn thành nhiệm vụ.
Điều 6. Các Ông, Bà có tên tại Điều 2, Chánh văn phòng Cục, Lãnh đạo các phòng... (4), Thủ trưởng cơ sở được kiểm tra chịu trách nhiệm thi hành quyết định này./.
|
| CỤC TRƯỞNG/ người được ủy quyền |
(1). Nội dung, phạm vi, thời kỳ/thời hạn kiểm tra.
(2). Tên cơ sở kiểm tra.
(3). Hình thức kiểm tra: đột xuất hoặc theo kế hoạch.
(4). Tên các Phòng thuộc Cục có cán bộ tham gia Đoàn kiểm tra và có chức năng nhiệm vụ liên quan đến nội dung kiểm tra.
(5) Tên các đơn vị có cán bộ tham gia Đoàn kiểm tra hoặc có liên quan đến Đoàn kiểm tra
BM.VP.19.01/02: Biên bản kiểm tra
| CỤC QUẢN LÝ DƯỢC | CỘNG HÒA XÃ HỘI CHỦ NGHĨA VIỆT NAM |
|
| ……, ngày ... tháng ... năm ... |
BIÊN BẢN KIỂM TRA
Căn cứ Quyết định thành lập Đoàn kiểm tra số.../.../... của Cục trưởng Cục Quản lý Dược về việc....(1).
Hôm nay, hồi giờ ngày … tháng …. năm … tại …………….
Đoàn kiểm tra gồm có:
1 ………………., Trưởng đoàn;
2 ………………., Phó đoàn (nếu có);
3 ………………..- Thư ký ;
4 ………………..- Thành viên
Tiến hành kiểm tra tại cơ sở:
(2)
Đại diện cơ sở được kiểm tra:
1 ………………., chức vụ
2 ………………., chức vụ
I. Báo cáo của cơ sở:
II. Kết quả kiểm tra thực tế:
1. Kết quả kiểm tra của Đoàn kiểm tra liên quan đến nội dung trong quyết định kiểm tra.
2. Những vấn đề khác.
III. Đoàn kiểm tra tiếp nhận các hồ sơ, tài liệu
IV. Kết luận của Đoàn kiểm tra
IV. Ý kiến của cơ sở
Buổi làm việc kết thúc hồi …………..
Biên bản này đã được đọc lại cho mọi người có tên nêu trên nghe và ký xác nhận là đúng, được lập thành ...bản có giá trị pháp lý như nhau, gửi cơ sở được kiểm tra tra 01 bản, ...(3) lưu 01 bản, lưu Đoàn kiểm tra 01 bản.
| ĐẠI DIỆN CƠ SỞ | THƯ KÝ ĐOÀN KIỂM TRA | TRƯỞNG ĐOÀN KIỂM TRA |
| THÀNH VIÊN ĐKT |
|
|
(1). Nội dung ghi trong Quyết định kiểm tra.
(2). Tên cơ sở được kiểm tra.
(3). Tên đơn vị có cán bộ tham gia Đoàn kiểm tra (nếu cần thiết).
BM.VP.19.01/03: Báo cáo Kiểm tra.
| CỤC QUẢN LÝ DƯỢC | CỘNG HÒA XÃ HỘI CHỦ NGHĨA VIỆT NAM |
|
| ……., ngày ... tháng ... năm ... |
BÁO CÁO
Kiểm tra của Đoàn kiểm tra theo Quyết định số...
Kính gửi: Cục trưởng...
Thực hiện Quyết định kiểm tra số ……. ngày …./.../…. của Cục trưởng Cục Quản lý Dược về ……………………..
Từ ngày …./…../…. đến ngày …./…../….. Đoàn kiểm tra đã tiến hành kiểm tra trực tiếp tại ……(2) cơ sở, mời ……(3) cơ sở lên làm việc để kiểm tra, xác minh các nội dung ghi trong Quyết định kiểm tra.
Đoàn xin báo cáo kết quả kiểm tra như sau:
I. Kết quả kiểm tra trực tiếp tại các cơ sở
- Tóm tắt kết quả kiểm tra:
II. Nhận xét, kết luận (tổng quát của toàn bộ quá trình kiểm tra)
1. Các mặt đã đạt được
2. Các tồn tại
3. Các vấn đề cần tiếp tục xác minh, làm rõ hoặc chuyển sang cơ quan chức năng khác.
III. Các biện pháp đã xử lý theo thẩm quyền (nếu có)
IV. Kiến nghị các biện pháp xử lý
1. Cục Quản lý Dược có văn bản gửi các đơn vị... (4) để tiếp tục kiểm tra, xác minh, xử lý vi phạm, đối với các cơ sở...
2. Cục Quản lý Dược có văn bản áp dụng các biện pháp quản lý nhà nước đối với các cơ sở, cụ thể:
2.1. Cơ sở A
- Hành vi vi phạm, căn cứ lý:
- Biện pháp xử lý:
2.2. Cơ sở B
- Hành vi vi phạm, căn cứ lý:
- Biện pháp xử lý:
3. Cục Quản lý Dược sẽ tiến hành xử phạt VPHC đối với các cơ sở:
3.1. Cơ sở A:
- Hành vi vi phạm, căn cứ pháp lý
3.2. Cơ sở B:
- Hành vi vi phạm, căn cứ pháp lý
………
4. Các kiến nghị khác (nếu có)
V. Các đề xuất đối với các cơ quan quản lý
……………………………………………………………………………………………………
Trên đây là Báo cáo kết quả kiểm tra về …………….., Đoàn kiểm tra xin ý kiến chỉ đạo của ……………..
|
| TRƯỞNG ĐOÀN KIỂM TRA |
|
|
|
(1) Viết tắt của tên Phòng đầu mối thành lập Đoàn kiểm tra.
(2) Tổng số cơ sở kiểm tra.
(3) Tổng số cơ sở mời làm việc.
(4) Các đơn vị chức năng như Sở Y tế, công an...để thực hiện theo chức năng, nhiệm vụ.
- 1Quyết định 18/QĐ-QLD năm 2023 Quy trình thao tác chuẩn trong Hệ thống quản lý chất lượng theo tiêu chuẩn ISO 9001:2015 áp dụng vào hoạt động quản lý nhà nước tại Cục Quản lý Dược
- 2Quyết định 242/QĐ-QLD năm 2023 về Quy trình thao tác chuẩn trong Hệ thống quản lý chất lượng theo tiêu chuẩn ISO 9001:2015 áp dụng vào hoạt động quản lý nhà nước tại Cục Quản lý Dược
- 3Quyết định 397/QĐ-QLD năm 2023 về Quy trình thao tác chuẩn trong Hệ thống quản lý chất lượng theo tiêu chuẩn ISO 9001:2015 áp dụng vào hoạt động quản lý nhà nước tại Cục Quản lý Dược
- 4Quyết định 453/QĐ-QLD năm 2023 về Quy trình thao tác chuẩn trong Hệ thống quản lý chất lượng theo tiêu chuẩn ISO 9001:2015 áp dụng vào hoạt động quản lý nhà nước do Cục trưởng Cục Quản lý Dược ban hành
- 5Quyết định 658/QĐ-QLD năm 2023 về Quy trình thao tác chuẩn trong Hệ thống quản lý chất lượng theo tiêu chuẩn ISO 9001:2015 áp dụng vào hoạt động quản lý nhà nước tại Cục Quản lý Dược
- 6Quyết định 804/QĐ-QLD năm 2023 về Quy trình thao tác chuẩn trong Hệ thống quản lý chất lượng theo tiêu chuẩn ISO 9001:2015 áp dụng vào hoạt động quản lý nhà nước tại Cục Quản lý Dược
- 7Quyết định 178/QĐ-QLD năm 2024 về Quy trình thao tác chuẩn trong Hệ thống quản lý chất lượng theo tiêu chuẩn ISO 9001:2015 áp dụng vào hoạt động quản lý Nhà nước tại Cục Quản lý Dược
- 8Quyết định 205/QĐ-QLD năm 2024 về Quy trình thao tác chuẩn trong hệ thống quản lý chất lượng theo tiêu chuẩn ISO 9001:2015 áp dụng vào hoạt động quản lý nhà nước tại Cục Quản lý Dược
- 1Luật xử lý vi phạm hành chính 2012
- 2Luật Dược 2016
- 3Nghị định 54/2017/NĐ-CP hướng dẫn Luật dược do Chính phủ ban hành
- 4Luật Phòng, chống tham nhũng 2018
- 5Luật Xử lý vi phạm hành chính sửa đổi 2020
- 6Nghị định 117/2020/NĐ-CP quy định về xử phạt vi phạm hành chính trong lĩnh vực y tế
- 7Nghị định 118/2021/NĐ-CP hướng dẫn Luật Xử lý vi phạm hành chính
- 8Nghị định 124/2021/NĐ-CP sửa đổi Nghị định 115/2018/NĐ-CP quy định xử phạt vi phạm hành chính về an toàn thực phẩm và Nghị định 117/2020/NĐ-CP quy định xử phạt vi phạm hành chính trong lĩnh vực y tế
- 9Nghị định 95/2022/NĐ-CP quy định chức năng, nhiệm vụ, quyền hạn và cơ cấu tổ chức của Bộ Y tế
- 10Quyết định 18/QĐ-QLD năm 2023 Quy trình thao tác chuẩn trong Hệ thống quản lý chất lượng theo tiêu chuẩn ISO 9001:2015 áp dụng vào hoạt động quản lý nhà nước tại Cục Quản lý Dược
- 11Quyết định 242/QĐ-QLD năm 2023 về Quy trình thao tác chuẩn trong Hệ thống quản lý chất lượng theo tiêu chuẩn ISO 9001:2015 áp dụng vào hoạt động quản lý nhà nước tại Cục Quản lý Dược
- 12Quyết định 1969/QĐ-BYT năm 2023 quy định chức năng, nhiệm vụ, quyền hạn và cơ cấu tổ chức của Cục Quản lý Dược thuộc Bộ Y tế
- 13Quyết định 397/QĐ-QLD năm 2023 về Quy trình thao tác chuẩn trong Hệ thống quản lý chất lượng theo tiêu chuẩn ISO 9001:2015 áp dụng vào hoạt động quản lý nhà nước tại Cục Quản lý Dược
- 14Quyết định 453/QĐ-QLD năm 2023 về Quy trình thao tác chuẩn trong Hệ thống quản lý chất lượng theo tiêu chuẩn ISO 9001:2015 áp dụng vào hoạt động quản lý nhà nước do Cục trưởng Cục Quản lý Dược ban hành
- 15Quyết định 658/QĐ-QLD năm 2023 về Quy trình thao tác chuẩn trong Hệ thống quản lý chất lượng theo tiêu chuẩn ISO 9001:2015 áp dụng vào hoạt động quản lý nhà nước tại Cục Quản lý Dược
- 16Quyết định 804/QĐ-QLD năm 2023 về Quy trình thao tác chuẩn trong Hệ thống quản lý chất lượng theo tiêu chuẩn ISO 9001:2015 áp dụng vào hoạt động quản lý nhà nước tại Cục Quản lý Dược
- 17Quyết định 178/QĐ-QLD năm 2024 về Quy trình thao tác chuẩn trong Hệ thống quản lý chất lượng theo tiêu chuẩn ISO 9001:2015 áp dụng vào hoạt động quản lý Nhà nước tại Cục Quản lý Dược
- 18Quyết định 205/QĐ-QLD năm 2024 về Quy trình thao tác chuẩn trong hệ thống quản lý chất lượng theo tiêu chuẩn ISO 9001:2015 áp dụng vào hoạt động quản lý nhà nước tại Cục Quản lý Dược
Quyết định 693/QĐ-QLD năm 2023 về Quy trình thao tác chuẩn trong Hệ thống quản lý chất lượng theo tiêu chuẩn ISO 9001:2015 áp dụng vào hoạt động quản lý nhà nước tại Cục Quản lý Dược
- Số hiệu: 693/QĐ-QLD
- Loại văn bản: Quyết định
- Ngày ban hành: 22/09/2023
- Nơi ban hành: Cục Quản lý dược
- Người ký: Vũ Tuấn Cường
- Ngày công báo: Đang cập nhật
- Số công báo: Đang cập nhật
- Ngày hiệu lực: 22/09/2023
- Tình trạng hiệu lực: Kiểm tra


