Để sử dụng toàn bộ tiện ích nâng cao của Hệ Thống Pháp Luật vui lòng lựa chọn và đăng ký gói cước.
| BỘ Y TẾ | CỘNG HÒA XÃ HỘI CHỦ NGHĨA VIỆT NAM |
| Số: 3780/QĐ-BYT | Hà Nội, ngày 26 tháng 8 năm 2019 |
VỀ VIỆC PHÊ DUYỆT TÀI LIỆU “HƯỚNG DẪN LÂM SÀNG XỬ TRÍ U XƠ CƠ TỬ CUNG”
BỘ TRƯỞNG BỘ Y TẾ
Căn cứ Nghị định số 75/2017/NĐ-CP ngày 20/6/2017 của Chính phủ Quy định chức năng, nhiệm vụ, quyền hạn và cơ cấu tổ chức của Bộ Y tế;
Căn cứ Quyết định số 2013/QĐ-TTg ngày 14 tháng 11 năm 2011 của Thủ tướng Chính phủ về phê duyệt Chiến lược Dân số Sức khỏe sinh sản Việt Nam giai đoạn 2011-2020;
Theo đề nghị của Vụ trưởng Vụ Sức khỏe Bà mẹ - Trẻ em, Bộ Y tế;
QUYẾT ĐỊNH
Điều 1. Phê duyệt tài liệu “Hướng dẫn lâm sàng xử trí u xơ cơ tử cung” kèm theo Quyết định này.
Điều 3. Các ông, bà: Chánh Văn phòng Bộ, Vụ trưởng Vụ Sức khỏe Bà mẹ - Trẻ em, Chánh thanh tra Bộ và các Vụ trưởng, Cục trưởng, Tổng cục trưởng của Bộ Y tế; Giám đốc các Viện, Bệnh viện trực thuộc Bộ Y tế; Giám đốc các Học viện, Hiệu trưởng các trường Đại học có đào tạo nhân lực y tế; Thủ trưởng Y tế ngành; giám đốc Sở Y tế các tỉnh, thành phố trực thuộc Trung ương và Thủ trưởng các đơn vị liên quan chịu trách nhiệm thi hành Quyết định này./.
|
| KT. BỘ TRƯỞNG |
(Ban hành kèm theo quyết định số 3780/QĐ-BYT ngày 26 tháng 8 năm 2019 của Bộ trưởng Bộ Y tế)
BAN CHỈ ĐẠO
GS. TS. BS. Nguyễn Viết Tiến
GS. BS. Nguyễn Thị Ngọc Phượng
GS. TS. BS. Cao Ngọc Thành
GS. TS. BS. Trần Thị Phương Mai
ThS. BS. Nguyễn Đức Vinh
BAN CHUYÊN GIA
GS. TS. BS. Trần Thị Lợi
PGS. TS. BS. Lê Hồng Cẩm
PGS. TS. BS. Lưu Thị Hồng
ThS. BS. Tống Trần Hà
ThS. BS. Nghiêm Thị Xuân Hạnh
PGS. TS. BS. Nguyễn Vũ Quốc Huy
TS. BS. Vương Thị Ngọc Lan
Ths. BS. Hồ Mạnh Tường
PGS. TS. BS. Huỳnh Nguyễn Khánh Trang
BS. CKII. Nguyễn Hữu Dự
PGS. TS. BS. Trần Danh Cường
PGS.TS. BS. Lê Hoàng
PGS. TS. BS. Hồ Sỹ Hùng
ThS. BS. Lê Quang Thanh
TS. BS. Hoàng Thị Diễm Tuyết
TS. BS. Trần Đình Vinh
TS. BS. Huỳnh Thị Thu Thủy
BS. CKII. Hoàng Thị Mỹ Ý
ThS. BS. Nguyễn Thị Quý Khoa
PGS. TS. BS. Nguyễn Duy Ánh
TS. BS. Vũ Văn Tâm
BS. CKII. Nguyễn Bá Mỹ Nhi
BS. CKI. Âu Nhựt Luân
ThS. BS. Đặng Quang Vinh
TS. BS. Tạ Thị Thanh Thủy
TS. BS. Bùi Chí Thương
TS. BS. Trần Nhật Thăng
Trang 1 Chương I. Đại cương
Trang 3 Chương II. Dịch tễ học và các yếu tố nguy cơ
Trang 5 Chương III. Phân loại u xơ cơ tử cung
Trang 7 Chương IV. Triệu chứng lâm sàng của u xơ cơ tử cung
Trang 11 Chương V. Chẩn đoán u xơ cơ tử cung
Trang 15 Chương VI. Biến chứng u xơ cơ tử cung
Trang 18 Chương VII. Tiếp cận và xử trí các trường hợp u xơ cơ tử cung không có chỉ định can thiệp nội ngoại khoa
Trang 20 Chương VIII. Điều trị nội khoa u xơ cơ tử cung
Trang 27 Chương IX. Điều trị ngoại khoa u xơ cơ tử cung
Trang 36 Chương X. Các thủ thuật thay thế phẫu thuật
Trang 39 Chương XI. Chuẩn bị bệnh nhân trước phẫu thuật
Trang 42 Chương XII. U xơ cơ tử cung và hiếm muộn
Trang 45 Chương XIII. U xơ cơ tử cung trong thai kỳ
Trang 49 Chương XIV. Những điều cần ghi nhớ về xử trí u xơ cơ tử cung
Trang 54 Chương XV. Tóm tắt hướng dẫn lâm sàng xử trí u xơ cơ tử cung
Trang 60 Biểu đồ 1. Phác đồ xử trí u xơ cơ tử cung
Trang 61 Biểu đồ 2. U xơ cơ tử cung đã chẩn đoán xác định, có siêu âm
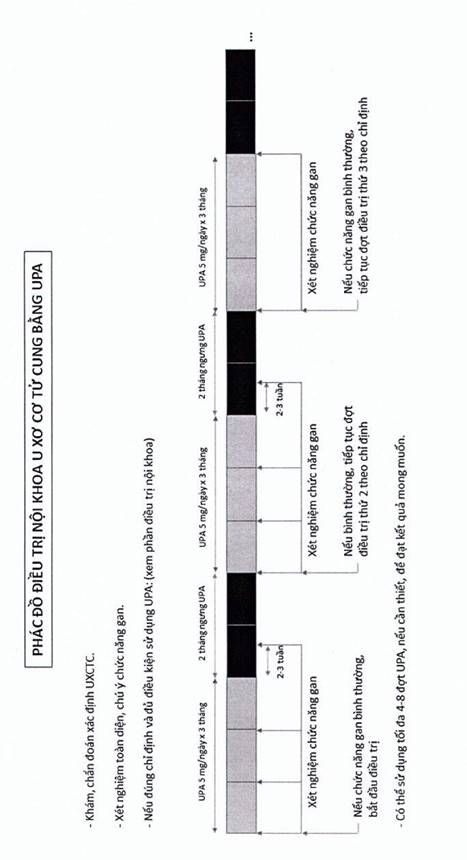
Trang 62 Biểu đồ 3. Phác đồ điều trị nội khoa u xơ cơ tử cung bằng UPA
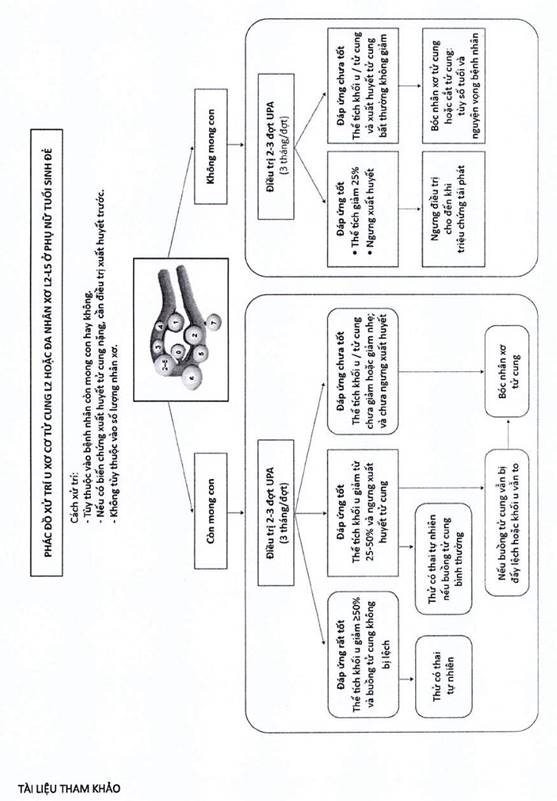
Trang 63 Biểu đồ 4. Phác đồ xử trí u xơ cơ tử cung L2 hoặc đa nhân L2-L5 ở phụ nữ tuổi sinh đẻ
Trang 64 Tài liệu tham khâo
U xơ cơ tử cung (leiomyoma - UXCTC), trước đây thường được gọi theo u xơ tử cung, là khối u lành tính không rõ nguyên nhân do sự phát triển quá mức của sợi cơ trơn và mô liên kết ở tử cung (Breech và cs, 2003). Bệnh có khuynh hướng di truyền.
UXCTC thường không có triệu chứng (Sciarra và cs, 1986), được phát hiện tình cờ qua khám hay siêu âm. Trong một số trường hợp u xơ gây biến chứng như cường kinh gây thiếu máu, đau vùng chậu, triệu chứng chèn ép... UXCTC có biến chứng gây ảnh hưởng đến chất lượng cuộc sống và ảnh hưởng đến khả năng sinh sản của người phụ nữ. Do thường không có triệu chứng nên không xác định được chính xác tần suất UXCTC trong dân số chung. Tỷ lệ mới mắc của UXCTC tăng theo tuổi, khoảng 20 - 50% nếu phụ nữ > 30 tuổi (Payson và cs, 2006) ước tính tỷ lệ mới mắc ở phụ nữ 50 tuổi là 70 % (Cao và cs, 2017; Khan và cs, 2014).
Chẩn đoán UXCTC dựa vào hỏi tiền căn, khám lâm sàng và chẩn đoán hình ảnh. Cần chẩn đoán phân biệt vớt sarcoma tử cung. Trong tổng số các trường hợp được cắt tử cung vì nhiều lý do, tỷ lệ sarcoma cơ trơn thân tử cung khoảng 0,26% bằng với tần suất 0,27% khi dân số được khảo sát là phụ nữ có khối u vùng chậu phát triển nhanh. Như vậy một UXCTC đã được phát hiện từ lâu đột ngột lớn nhanh ở người phụ nữ tuổi mãn kinh hay mới xuất hiện khi đã mãn kinh là một dấu hiệu nghi ngờ ác tính cao (Vilos và cs, 2015).
UXCTC không có triệu chứng không cần can thiệp. Không nên điều trị dự phòng để tránh biến chứng trong tương lai vì không có yếu tố tiên lượng đáng tin cậy về sự tiến triển của UXCTC. Trong một số trường hợp có thể điều trị dự phòng ngăn sẩy thai ở UXCTC dưới niêm (nếu người này dự định mang thai) và u xơ nằm trong dây chằng rộng gây tắc nghẽn đường tiết niệu đưa đến thận ứ nước.
UXCTC có triệu chứng (ra huyết âm đạo bất thường, đau, chèn ép) cần được điều trị. Phương thức và thời gian điều trị dựa trên một số yếu tố ảnh hưởng như: phân loại UXCTC, mức độ triệu chứng, kích thước, vị trí, số lượng khối u xơ, tuổi người bệnh, kế hoạch sinh sản và tiền căn sản khoa, tình trạng bệnh nội khoa kèm theo, nguy cơ thoái hóa ác tính, tình trạng sắp mãn kinh và mong muốn bảo tồn tử cung của người phụ nữ. Trong những năm qua UXCTC là một trong các chỉ định thường gặp nhất cho cắt tử cung trên toàn cầu. Tuy nhiên, cắt tử cung gây nhiều biến chứng cũng như tăng gánh nặng kinh tế cho người bệnh (Philippines Society for Reproductive Medicine, 2017).
Các thụ thể của estrogen (ER) và của progesterone (PR) được tìm thấy nhiều trên các sợi cơ của UXCTC hơn là trên các sợi cơ bình thường của tử cung. Như vậy cả hai hormones steroids, estrogen và progesterone đều có ảnh hưởng lên sự phát triển của UXCTC. Nếu bị cắt nguồn steroids, hầu hết các u xơ sẽ có chiều hướng thoái triển. Progesterone đóng vai trò quan trọng trong sự phát triển của UXCTC (Carranza và cs, 2015). Dựa trên đặc tính đó, điều trị nội khoa bằng cách điều hòa các thụ thể của hormones steroids đóng vai trò quan trọng trong điều trị UXCTC. Xuất phát từ những phương pháp điều trị mới ra đời đã được nghiên cứu và có những chứng cứ y học mức độ cao, hướng dẫn lâm sàng dành riêng cho xử trí u xơ cơ tử cung được ra đời. Nội dung của hướng dẫn sẽ bao gồm theo dõi không điều trị, điều trị nội khoa, điều trị ngoại khoa, đặc biệt với u xơ dưới niêm mạc, u xơ ảnh hưởng đến khả năng sinh sản và thai kỳ.
Mục tiêu của hướng dẫn thực hành lâm sàng xử trí UXCTC là đưa ra các khuyến nghị trong chẩn đoán và điều trị cho bệnh nhân UXCTC tại Việt Nam dựa trên các bằng chứng y khoa và kinh nghiệm lâm sàng hiện có, nhằm đưa đến cách xử trí thống nhất trong ngành sản phụ khoa Việt Nam.
DỊCH TỄ HỌC VÀ CÁC YẾU TỐ NGUY CƠ
UXCTC là khối u lành tính của tử cung phổ biến nhất ở phụ nữ. Đa số các trường hợp UXCTC không có biểu hiện lâm sàng (Pavone và cs, 2018), ước tính chỉ có khoảng 25% UXCTC có biểu hiện lâm sàng ở phụ nữ trong độ tuổi sinh sản và khoảng 25% trong số đó có triệu chứng nặng cần điều trị (Stewart và cs, 2017).
Tỉ lệ mới mắc UXCTC là 217 - 3.745/100.000 mỗi năm và tỉ lệ hiện mắc 4,5 - 68,6% (Stewart và cs, 2017). Các tỉ lệ này dao động rất nhiều, phụ thuộc vào phương pháp nghiên cứu và dân số nghiên cứu (đa số các nghiên cứu được tiến hành ở đối tượng phụ nữ có biểu hiện triệu chứng hoặc sau phẫu thuật) (Stewart và cs, 2017).
Có nhiều yếu tố nguy cơ làm gia tăng tỉ lệ phát sinh UXCTC bao gồm (Stewart và cs, 2017, Pavone và cs, 2018):
Tuổi. Tần suất xuất hiện UXCTC tăng theo tuổi (Pavone và cs, 2018). Phụ nữ trên 40 tuổi có nguy cơ bị UXCTC cao hơn 4 lần phụ nữ dưới 40 tuổi (OR 4,1; KTC 95%, 3,3 - 5,0) (Selo-Ojeme và cs, 2008). Phụ nữ ở nhóm tuổi 41 - 50 (RR, 10,4, KTC 95%, 3,8 - 30,2), nhóm tuổi từ 51 - 60 (RR 10,6, KTC 95%, 3,9 - 31,5) có nguy cơ phát hiện UXCTC cao hơn 10 lần nhóm tuổi 21-30 (Lurie và cs, 2005). Ngoài ra, khi tuổi của người phụ nữ gia tăng thì UXCTC cũng thường có kích thước lớn hơn, số lượng u xơ cũng nhiều hơn và tỷ lệ phải nhập viện vì UXCTC cũng cao hơn. Điều này phản ánh diễn tiến tự nhiên theo thời gian của UXCTC (DeWaay và cs, 2002). Tuy nhiên, tỉ lệ mắc bệnh sẽ giảm ở nhóm phụ nữ tuổi mãn kinh.
Chủng tộc. Tỉ lệ mới mắc UXCTC không khác biệt giữa người da trắng, châu Á và Mỹ Latin. Tuy nhiên, người da đen có nguy cơ phát triển UXCTC cao hơn 2 đến 3 lần. Ngoài ra, nguy cơ suốt đời đối với UXCTC là gần 70% ở người da trắng, và trên 80% ở người da đen. Phụ nữ da đen thường được chẩn đoán UXCTC ở độ tuổi trẻ hơn, u xơ thường nhiều và lớn hơn, đồng thời cũng gây ra các triệu chứng nghiêm trọng hơn ở các nhóm chủng tộc khác. Những khác biệt này phần nào gợi ý sự khác nhau về sinh tổng hợp estrogen, chuyển hóa và di truyền (Stewart và cs, 2017, Pavone và cs, 2018).
Tiền sử gia đình. Một nghiên cứu ở Thái Lan cho thấy, tiền sử gia đình bị UXCTC làm tăng nguy cơ cho người phụ nữ hơn 3 lần (OR 3,47; KTC 95%, 2,55 - 4,71) (Lumbiganon và cs, 1996).
Các yếu tố di truyền. Một số gene (như MED12, HMGA2, CYP1A1, và CYP1B1) (Styer và cs, 2016) và các bất thường nhiễm sắc thể (trisomy 12; đảo đoạn 12q, 6p, 10q, 13q; và mất đoạn 7q, 3q, 1p) (Mehine và cs, 2013) được tìm thấy có liên quan đến sự hình thành và phát triển của UXCTC.
Khoảng cách so với lần sinh con trước đây. Một số nghiên cứu cho thấy khoảng cách từ 5 năm trở lên làm tăng nguy cơ phát triến UXCTC lên 2-3 lần (Wise và cs, 2004, Terry và cs, 2010).
Giai đoạn tiền mãn kinh có nguy cơ bị UXCTC cao hơn đến 10 lần giai đoạn mãn kinh (Chiaffarino và cs, 1999). Đồng thời, tỷ lệ UXCTC có triệu chứng cũng cao hơn 3 lần (Templeman và cs, 2009).
Rối loạn chuyển hóa: Béo phì, kháng insulin, hội chứng buồng trứng đa nang, tăng lipid máu, tăng huyết áp... là những yếu tố gây ra hội chứng chuyển hóa và đều góp phần làm gia tăng nguy cơ phát triển UXCTC (Stewart và cs, 2017, Pavone và cs, 2018). Riêng phụ nữ có bệnh lý tăng huyết áp có thể làm gia tăng gần 5 lần (OR 4,90; KTC 95%, 2,31 - 10,38) nguy cơ phát triển UXCTC so với phụ nữ không tăng huyết áp (Takeda và cs, 2008).
Lối sống và chế độ ăn uống cũng có thể liên quan đến nguy cơ gia tăng UXCTC, tuy nhiên rất khó nghiên cứu và đánh giá vì có nhiều yếu tố nhiễu. Ít hoạt động thể chất và nhiều stress làm gia tăng nguy cơ bị UXCTC. Các loại thực phẩm chứa nhiều acid béo nguồn gốc động vật, sử dụng nhiều thịt bò, thịt đỏ, thiếu vitamin D, tiêu thụ nhiều thức uống có cồn, caffeine có nguy cơ làm gia tăng tỉ lệ UXCTC (Stewart và cs, 2017, Pavone và cs, 2018).
Các chất phụ gia sử dụng trong chế biến và bảo quản thực phẩm làm tăng nguy cơ phát triển UXCTC đến 3 lần (OR 3,17; KTC 95%, 2,25 - 4,46) (Shen và cs, 2013).
Bên cạnh đó, cũng có rất nhiều yếu tố được coi là yếu tố bảo vệ như mang thai và sinh con nhiều lần, hoạt động thể chất thường xuyên, ăn nhiều cá và rau xanh, trái cây, vitamin A có nguồn gốc động vật (Stewart và cs, 2017, Pavone và cs, 2018).
UXCTC được phân loại theo hai cách, theo tính chất và theo vị trí khối u.
Theo tính chất, u xơ có 2 dạng: không triệu chứng và có triệu chứng. Hầu hết UXCTC thuộc dạng không triệu chứng, thường không cần điều trị. UXCTC có triệu chứng cần được điều trị và theo dõi (Murase và cs, 1999; Vilos và cs, 2015).
Theo vị trí, hiện nay, hệ thống phân loại UXCTC của Hiệp hội Sản Phụ khoa Quốc tế FIGO năm 2011 được sử dụng phổ biến nhất (Munro và cs, 2011). Phân loại được mô tả chi tiết theo hình bên dưới.
Các UXCTC L0, L1, L2 thường gây triệu chứng xuất huyết tử cung bất thường, có thể là nguyên nhân của vô sinh và sẩy thai. Nhóm này cần được điều trị bằng phương pháp nội soi buồng tử cung (Lefebvre và cs, 2003).
UXCTC L3 cũng có thể gây triệu chứng xuất huyết tử cung bất thường hoặc không. Điều trị nhóm này thường ưu tiên dùng thuốc để làm giảm kích thước khối u trước khi mang thai (Lefebvre và cs, 2003).
Các UXCTC L4-8 thường không gây xuất huyết tử cung bất thường. U xơ nhóm này cần điều trị khi kích thước to hoặc u chèn ép gây thận ứ nước hoặc bí tiểu hoặc táo bón. Có thể cân nhắc điều trị nội khoa hoặc phẫu thuật bóc u đối với phụ nữ còn nguyện vọng mang thai.

TRIỆU CHỨNG LÂM SÀNG CỦA U XƠ CƠ TỬ CUNG
UXCTC thường nhỏ và không có triệu chứng nên thường được phát hiện tình cờ thông qua thăm khám, siêu âm phụ khoa. Tuy nhiên, nhiều phụ nữ có UXCTC cũng gặp nhiều vấn đề làm ảnh hưởng cuộc sống như xuất huyết tử cung bất thường, đau bụng hay vô sinh. Những triệu chứng của UXCTC thường liên quan đến số lượng, kích thước và vị trí của khối UXCTC.
TRIỆU CHỨNG CƠ NĂNG
Những triệu chứng của UXCTC gồm rong kinh, cường kinh, bụng to, cảm giác trằn nặng vùng hạ vị, đau, tiểu khó, táo bón (Stewart và cs, 2015).
Trong số các triệu chứng bất thường do UXCTC gây ra thì xuất huyết tử cung bất thường là triệu chứng phổ biến nhất chiếm 26 - 29%, các triệu chứng khác chiếm tỷ lệ ít hơn.
Ra kinh nhiều hoặc kéo dài là triệu chứng xuất huyết tử cung bất thường điển hình nhất trong UXCTC và là triệu chứng thường gặp nhất do UXCTC gây ra (Fraser và cs, 2007). Tình trạng của xuất huyết tử cung bất thường phụ thuộc nhiều nhất vào vị trí khối u, sau đó là đến kích thước khối u:
- UXCTC dưới niêm mạc nhô vào trong lòng tử cung, dù nhỏ (như L0, L1, L2 theo phân loại FIGO 2011), thường liên quan với tình trạng chảy máu kinh nhiều. (Buttram và cs, 1981; Wamsteker và cs, 1993; Wegienka và cs, 2003; Munro và cs, 2011)
- UXCTC trong cơ tử cung cũng có thể gây ra tình trạng chảy máu kinh nhiều hoặc kéo dài nhưng UXCTC dưới thanh mạc thường không được xem là nguyên nhân chính gây ra tình trạng này.
- UXCTC ở cổ tử cung nếu nằm gần kênh cổ tử cung cũng có thể gây ra tình trạng xuất huyết tử cung bất thường. UXCTC ở cổ tử cung thường gây giao hợp đau.
Triệu chứng do chèn ép thay đổi nhiều, phụ thuộc vào kích thước, hình dạng và vị trí các khối UXCTC. Những triệu chứng này bao gồm cảm giác khó chịu hay đau vùng chậu, thận ứ nước nếu chèn ép niệu quản, bí tiểu hoặc đi tiểu khó nếu chèn ép bàng quang hay cổ bàng quang, táo bón nếu chèn ép trực tràng, chèn ép tĩnh mạch.
- Cảm giác khó chịu, đau vùng chậu - Triệu chứng trằn nặng, đau vùng chậu âm ỉ thường gặp ở phụ nữ bị UXCTC to. Tuy nhiên, triệu chứng này ít xuất hiện hơn xuất huyết tử cung bất thường.
- Đau bụng kinh được ghi nhận ở nhiều phụ nữ có UXCTC. Thường tình trạng đau bụng kinh này thường xuất hiện kèm hiện tượng chảy máu kinh nhiều, có máu đông.
- Đau khi giao hợp hiện còn là một triệu chứng chưa rõ có mối liên quan với UXCTC hay không. Tuy nhiên, những trường hợp có UXCTC nằm ở thành trước, ở cổ tử cung, hoặc ở vùng đáy có thể có cảm giác đau sâu khi giao hợp. (Ferrero và cs, 2006)
Triệu chứng đau lưng cũng có thể xuất hiện trong UXCTC, cần loại trừ các nhóm bệnh lý khác có thể gây ra triệu chứng này.
Trong một nghiên cứu đoàn hệ nhỏ cho thấy trong 14% trường hợp phụ nữ có UXCTC xuất hiện tình trạng thận ứ nước, thường ở bên phải, có thể do UXCTC nằm trong dây chằng rộng, chèn ép phải niệu quản phải. Kích thước UXCTC lớn nhất trung bình khoảng 6 cm và kích thước cả tử cung khoảng thai 18 tuần thường có sự liên quan với tình trạng thận ứ nước (Fletcher và cs, 2013).
- Chèn ép tĩnh mạch - UXCTC rất lớn có thể chèn ép tĩnh mạch chủ và làm tăng nguy cơ tắc mạch do huyết khối. Nghiên cứu đã chứng minh nguy cơ thuyên tắc tĩnh mạch do huyết khối do UXCTC to cao hơn nguy cơ sau phẫu thuật (Fletcher và cs, 2009).
- UXCTC thoái hóa hoặc xoắn (thường là UXCTC L7) cũng có thể gây ra triệu chứng đau bụng cấp tính. Đau bụng vùng chậu do UXCTC thoái hóa thường có thể xuất hiện kèm triệu chứng sốt nhẹ, tử cung đau khi sờ chạm, tăng bạch cầu, hoặc dấu cảm ứng phúc mạc. Đặc biệt, UXCTC trong thai kỳ thường to nhanh, mạch máu nuôi tăng trưởng theo không kịp đưa đến hoại tử vô trùng, đau rất nhiều và kéo dài. Tình trạng đau bụng do UXCTC thoái hóa thường giới hạn trong vài ngày đến vài tuần và đáp ứng với thuốc giảm đau NSAIDS.
- Chẩn đoán UXCTC thoái hóa thường dựa theo sự tồn tại của UXCTC cùng các triệu chứng điển hình. Khi siêu âm, triệu chứng đau khi quét đầu dò trực tiếp vùng UXCTC là triệu chứng giúp định hướng chẩn đoán. Trong trường hợp không rõ chẩn đoán, chụp MRI vùng chậu có thể được sử dụng với gadolinium giúp việc chẩn đoán có thể rõ hơn thông qua dấu hiệu vùng UXCTC thoái hóa không tăng độ tương phản khi sử dụng gadolinium (Laughlin và cs, 2011). Trong trường hợp đau bụng cấp tính nghi ngờ do UXCTC thoái hóa và có chỉ định phẫu thuật thì cần loại trừ cẩn thận các bệnh lý khác có thể gây tình trạng đau vùng chậu cấp như lạc nội mạc tử cung, cơn đau quặn thận, hay các bệnh lý ít gặp như lao vùng chậu. (Mollica và cs, 1996; Moore và cs, 2008)
TRIỆU CHỨNG THỰC THỂ: KHÁM TỔNG QUÁT VÀ KHÁM PHỤ KHOA
Sốt: hiếm gặp, thường chỉ gặp trong trường hợp UXCTC thoái hóa.
Thiếu máu: xuất hiện khi tình trạng xuất huyết tử cung nặng và/hoặc kéo dài, có thể gây ảnh hưởng sinh hiệu (mạch nhanh, huyết áp tuột) nhưng hiếm, thường gặp hơn là tình trạng da xanh, niêm nhợt. Có thể sử dụng xét nghiệm tổng phân tích máu toàn bộ để đánh giá chính xác hơn mức độ thiếu máu.
Khám mỏ vịt: có thể thấy khối UXCTC tại cổ ngoài cổ tử cung hoặc thấy UXCTC dưới niêm nằm nhô ra ngoài cổ tử cung, thường được chẩn đoán phân biệt với polyp nội mạc tử cung bằng độ chắc của khối u và giải phẫu bệnh lý.
Khám: nên khám kỹ để đánh giá kích thước, vị trí, độ di động của khối UXCTC, khi khám nên kết hợp khám tay trong âm đạo và tay ngoài thành bụng.
- Kích thước của tử cung có UXCTC khi thăm khám thường được ước tính tương đương với kích thước một tử cung khi mang thai sống.
- Một tử cung to, di động với đường viền không đều, cảm giác nhiều khối nhỏ lổn nhổn trên bề mặt là một tử cung đa nhân xơ.
- Tử cung to nhưng ít di động hoặc không di động, chúng ta nên nghĩ tới tình trạng viêm nhiễm hoặc kết hợp với lạc nội mạc tử cung.
TRIỆU CHỨNG CÁC BIẾN CHỨNG
Vô sinh là tình trạng có thể gặp phải thường liên quan với khối UXCTC làm biến dạng lòng tử cung như UXCTC dưới niêm mạc hoặc UXCTC trong cơ tử cung có 1 phần nhô vào buồng tử cung. Những cấu trúc này dù nhỏ, cũng có thể là nguyên nhân làm cản trở quá trình thụ thai cũng như tăng nguy cơ sẩy thai, sẩy thai liên tiếp (Pritts và cs, 2009). (Xin xem phần “UXCTC và hiếm muộn”)
Biến chứng sản khoa: UXCTC cũng đã được chứng minh là làm tăng các biến chứng sản khoa như nhau bong non, thai chậm tăng trưởng trong tử cung, ngôi thai bất thường và sinh non (Qidwai và cs, 2006). (Xin xem phần “UXCTC trong thai kỳ”)
Thoái hóa ác tính: rất hiếm gặp. Nên nghĩ tới tình trạng UXCTC thoái hóa ác tính khi khối u to nhanh, nhất là trên phụ nữ tuổi mãn kinh. Siêu âm có thể thấy tình trạng xuất huyết hoặc hoại tử. (Xin xem phần “Biến chứng của UXCTC”)
CHẨN ĐOÁN XÁC ĐỊNH
Chẩn đoán dựa trên triệu chứng lâm sàng
Hầu hết trường hợp UXCTC đều không biểu hiện triệu chứng và được chẩn đoán tình cờ khi khám phụ khoa và siêu âm vùng chậu (Divakar, 2008). Tuy nhiên cũng có những trường hợp UXCTC gây triệu chứng rầm rộ trên lâm sàng như xuất huyết tử cung bất thường, đau vùng chậu, thiếu máu... (Stewart và cs. 2015).
Chẩn đoán UXCTC trên khám lâm sàng dựa trên các dấu hiệu thường gặp bao gồm (Corazon và cs, 2017): (1) tử cung to, phát triển chậm (2) xuất huyết tử cung bất thường (rối loạn kinh nguyệt, ra kinh nhiều hoặc kéo dài), (3) đau, căng tức vùng chậu do thoái hóa hay do chèn ép các cơ quan xung quanh gây đi tiểu khó, bí tiểu, táo bón, thận ứ nước, (4) sẩy thai liên tiếp.
Chẩn đoán dựa trên hình ảnh
Siêu âm ngả âm đạo: là kỹ thuật hình ảnh đầu tay trong chẩn đoán UXCTC. Đặc điểm của UXCTC điển hình trên siêu âm bao gồm: khối u giới hạn rõ, hình cầu, có thể có dấu calcium hóa, phân bố mạch máu viền quanh tổn thương trên siêu âm doppler (Levy và cs, 2013).
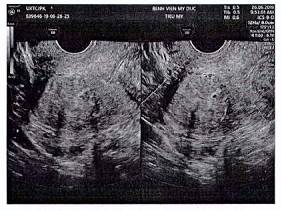
Hình 1. UXCTC qua siêu âm ngả âm đạo. Nguồn: Bệnh viện Mỹ Đức.
- Siêu âm ngả bụng: giúp đánh giá tổng quát vùng chậu, đếm số lượng khối u, quan sát các khối u lớn. Ngoài ra, siêu âm ngả bụng còn có thể giúp đánh giá biến chứng chèn ép niệu quản, bàng quang, trực tràng.
Siêu âm doppler: đánh giá phân bố mạch máu trong UXCTC, chẩn đoán phân biệt dạng phân bố xuyên tổn thương trong bệnh tuyến-cơ tử cung (adenomyosis). Ngoài ra, siêu âm doppler đánh giá chỉ số đập (PI) và chỉ số kháng trở (RI) động mạch cũng giúp ích trong chẩn đoán phân biệt UXCTC và bệnh tuyến-cơ tử cung.
- Siêu âm bơm nước buồng tử cung: thường chỉ định trong chẩn đoán UXCTC dưới niêm mạc (L 0-2 theo phân loại của FIGO).
- Trong trường hợp UXCTC không điển hình, không thể chẩn đoán xác định hoặc cần chẩn đoán phân biệt với bệnh tuyến-cơ tử cung có thể sử dụng cộng hưởng từ (MRI). Phần lớn những trường hợp không thể phân biệt UXCTC và bệnh tuyến-cơ tử cung trên siêu âm là dạng kết hợp cả hai bệnh lý (Podasca và cs, 2016). MRI còn có ưu điểm là giúp đánh giá tổng quát các cơ quan vùng chậu, phát hiện bệnh lý đi kèm hoặc biến chứng.
CHẨN ĐOÁN PHÂN BIỆT
Cần chấn đoán UXCTC và các bệnh lý sau:
- Tử cung to do có thai.
- Polyp nội mạc tử cung (trường hợp UXCTC dưới niêm mạc).
- Khối u buồng trứng (trường hợp UXCTC dưới thanh mạc có cuống).
- Leiomyosarcoma: sarcoma tử cung được chẩn đoán xác định dựa trên kết quả giải phẫu bệnh. Chẩn đoán lâm sàng sarcoma tử cung thật sự là một thách thức, bởi sự biệt hóa đa dạng của sarcoma, dấu hiệu lâm sàng nghèo nàn, không đặc hiệu, cần đặc biệt lưu ý trường hợp UXCTC đột ngột tăng nhanh kích thước hoặc mới xuất hiện trên phụ nữ tuổi mãn kinh. Đặc điểm của sarcoma tử cung trên siêu âm thường là khối đặc với phản âm không đồng nhất; kèm tăng sinh mạch máu mức độ trung bình trở lên (Ludovisi và cs, 2019).
Về chẩn đoán hình ảnh, cần chẩn đoán phân biệt UXCTC và bệnh tuyến-cơ tử cung:
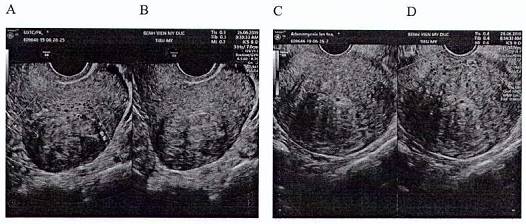
Hình 2. Chẩn đoán phân biệt UXCTC và bệnh tuyến-cơ tử cung (adenomyosis) trên siêu âm. Nguồn: Bệnh viện Mỹ Đức
A: phân bố mạch máu quanh UXCTC trên siêu âm doppler
B: UXCTC trên siêu âm thang xám ngả âm đạo
C: bệnh tuyến-cơ tử cung (adenomyosis) trên siêu âm thang xám ngả âm đạo
D: phân bố mạch đâm xuyên qua tổn thuơng (mạch luới) bệnh tuyến-cơ tử cung (adenomyosis) trên siêu âm doppler
| Đặc điểm | UXCTC điển hình | Bệnh tuyến-cơ tử cung (Adenomyosis) |
| Đường bờ thanh mạc tử cung | Phân thùy hoặc bờ đều | Tử cung hình cầu, tăng kích thước |
| Giới hạn tổn thương | Giới hạn rõ | Giới hạn không rõ |
| Sự đồng nhất của thành tử cung | Thành tử cung không đồng nhất trong vùng tổn thương giới hạn rõ | Thành trước - sau cơ tử cung không đồng nhất |
| Đường bờ tổn thương | Giới hạn rõ, trơn láng | Bờ không rõ, không đồng nhất |
| Hình dạng | Tròn, oval, phân thùy | Không có hình dạng nhất định |
| Viền tổn thương | Phản âm kém hoặc dày | Không có viền tổn thương |
| Bóng (lưng) | Bóng lưng ở bờ hoặc bên trong tổn thương (thường có hình rẻ quạt) | Không có bóng lưng ở bờ tổn thương, bóng lưng hình rẻ quạt |
| Độ hồi âm | Đồng nhất: có thể đồng âm, giảm âm hoặc tăng âm Không đồng nhất: phản âm hỗn hợp | Không đồng nhất: phản âm hỗn hợp Nhiều nang, nhiều vùng tăng âm, nhiều đường phản âm sọc dưới NMTC |
| Phân bố mạch máu | Quanh tổn thương | Mạch đâm xuyên qua tổn thương (mạch lưới) |
| Vùng nối |
|
|
| Dày vùng nối, tính đồng nhất | Không dày, đều hoặc không quan sát thấy | Dày vùng nối, không đều hoặc giới hạn không rõ |
| Vùng nối gián đoạn | Mất liên tục hoặc giãn ở vùng có UXCTC L1-3 theo FIGO | Vùng nối mất liên tục (ngay cả khi không quan sát thấy tổn thương khu trú) |
Nguồn: Van Den Bosch và cs, 2019.
Hầu hết phụ nữ có UXCTC nhỏ không có triệu chứng. UXCTC to, gây chèn ép, gây xuất huyết tử cung bất thường làm cho phụ nữ lo lắng và đến khám phụ khoa.
XUẤT HUYẾT TỬ CUNG BẤT THƯỜNG
Xuất huyết tử cung bất thường là biến chứng thường gặp nhất, do UXCTC nằm trong buồng tử cung hay nhô ra làm biến dạng buồng tử cung (L0, L1, L2). Xuất huyết tử cung bất thường là cường kinh (30%, Lumsden MA và cs, 1998), rong kinh và xuất huyết giữa chu kỳ kinh. Cơ chế xuất huyết tử cung bất thường do UXCTC vẫn chưa được hiểu rõ, giải thích được chấp nhận nhiều nhất là tăng diện tích bề mặt niêm mạc, bất thường mạch máu tử cung kết hợp với sự thay đổi hệ thống cầm máu tại nội mạc tử cung (Miura và cs, 2006).
Mức độ xuất huyết phụ thuộc vào vị trí hơn là kích thước khối u. UXCTC dưới niêm mạc (L0, L1, L2) dù nhỏ nhưng vẫn có thể gây cường kinh.
UXCTC dưới niêm mạc có thể giải quyết bằng phẫu thuật nội soi buồng tử cung (L0, L1, L2) hay điều trị nội khoa (L2, L3) bằng thuốc điều hòa thụ thể progesterone có chọn lọc; thuốc ngừa thai; GnRH đồng vận; LNG-IUS (vòng Mirena) sau khi đã cắt bỏ UXCTC L0 và L1; tranexamic acid.
CHÈN ÉP
UXCTC có thể to lên và chèn ép các cơ quan lân cận trong vùng chậu. Chèn ép niệu quản gây thận ứ nước, chèn ép bàng quang gây rối loạn đi tiểu hoặc chèn ép trực tràng gây nên táo bón. Các triệu chứng liên quan đến tiểu tiện nên được thăm khám và loại trừ các nguyên nhân khác trước khi kết luận các triệu chứng này liên quan đến UXCTC. (Lumsden và cs, 1998). Một số ít trường hợp khối UXCTC to chèn ép tĩnh mạch vùng chậu, dẫn đến sự ứ máu tại vùng chậu và dẫn đến thuyên tắc mạch. UXCTC gặp ở độ tuổi tiền mãn kinh có nguy cơ liên quan đến thuyên tắc huyết khối tĩnh mạch sâu và thuyên tắc phổi (Tanaka và cs, 2002).
ĐAU
Đau do UXCTC ít gặp và thường liên quan đến thoái hóa. Đa cũng có thể do UXCTC có cuống xoắn và có thể kết hợp với bệnh tuyến-cơ tử cung (adenomyosis) và/hoặc lạc nội mạc tử cung. Đau do UXCTC không đáp ứng với điều trị nội khoa cũng là một trong những chỉ định của điều trị ngoại khoa (Carranza và cs, 2015)
THOÁI HÓA
Thoái hóa là biến chứng cũng thường gặp của UXCTC. Thoái hóa được phân chia thành nhiều dạng khác nhau như thoái hóa kính, thoái hóa nang, hoại sinh vô khuẩn hoặc hóa vôi.
- Thoái hóa kính là loại thoái hóa thường gặp nhất, chiếm 60%.
- Thoái hóa nang gặp khoảng 4% và thường xảy ra sau khi có thoái hóa kính.
- Hoại sinh vô khuẩn thường gặp trong khi mang thai, khoảng 8% UXCTC trong thai kỳ, khoảng 3% cho các UXCTC nói chung (Kawakami và cs, 1994).
Thoái hóa ác tính (sarcomatous degeneration) hiếm xảy ra, tỷ lệ khoảng 0,2% cho tất cả các loại UXCTC. Cần đặc biệt chú ý đến các khối UXCTC phát triển nhanh hoặc những khối u mới xuất hiện khi đã mãn kinh. Triệu chứng của thoái hóa ác tính có thể là đau và xuất huyết tử cung bất thường (Yanai H và cs, 2010). Khi phẫu thuật bóc nhân xơ hoặc cắt tử cung, nếu khối u to, mặt cắt màu vàng hoặc nâu, mềm, có đốm xuất huyết hay hoại tử thì nghi ngờ thoái hóa ác tính. Chẩn đoán được xác định bằng giải phẫu bệnh lý.
HIẾM MUỘN
Ảnh hưởng của UXCTC lên khả năng sinh sản luôn là vấn đề được quan tâm nhưng chưa được hiểu biết rõ ràng. UXCTC đơn thuần không phải là nguyên nhân tuyệt đối gây hiếm muộn, nhiều bệnh nhân có UXCTC vẫn có thai mà không cần can thiệp. UXCTC dưới niêm làm giảm khả năng có thai, tăng nguy cơ sẩy thai, UXCTC dưới niêm (L0, L1, L2) phải được xử trí bằng phẫu thuật nội soi buồng tử cung. Trong khi đó, UXCTC trong cơ có thể không có ảnh hưởng rõ ràng, tuy nhiên nếu gây biến dạng lòng tử cung thì có thể ảnh hưởng đến khả năng thụ thai cũng như tăng nguy cơ sẩy thai, sẩy thai liên tiếp (Carranza và cs, 2015) (Xin xem phần UXCTC và hiếm muộn).
CÁC BIẾN CHỨNG LIÊN QUAN THAI KỲ
Tần suất phát hiện UXCTC trong thai kỳ phụ thuộc vào các nghiên cứu siêu âm, chủng tộc và độ tuổi (Laughlin và cs, 2009).
Hầu hết các nghiên cứu siêu âm cho thấy UXCTC có thể to lên, nhỏ đi hoặc giữ kích thước như trước khi có thai (Laughlin và cs, 2010; De Vivo và cs, 2011).
Một vài nghiên cứu hồi cứu cho thấy ảnh hưởng của UXCTC và kết cục thai kỳ. Phân tích gộp vào năm 2008 cho thấy có tăng nguy cơ ngôi bất thường, mổ lấy thai và sinh non (Klatsky và cs, 2008). Vào năm 2010, một nghiên cứu bao gồm 72.000 phụ nữ cho thấy tăng nguy cơ nhau tiền đạo, nhau bong non, vỡ ối sớm, sinh non < 34 tuần và thai lưu. Tuy nhiên khác biệt này < 2% và không có ý nghĩa thống kê. Điều này cho thấy UXCTC (đặc biệt các khối UXCTC lớn) và thai kỳ nên được theo dõi chặt chẽ để có kết cục sản và nhi khoa tốt (Stout và cs, 2010) (Xin xem phần UXCTC và thai kỳ).
TIẾP CẬN VÀ XỬ TRÍ CÁC TRƯỜNG HỢP U XƠ CƠ TỬ CUNG CHƯA CÓ CHỈ ĐỊNH CAN THIỆP NỘI - NGOẠI KHOA
UXCTC là loại khối u vùng chậu thường gặp nhất ở phụ nữ trong độ tuổi sinh sản. Hiện nay, đồng thuận của các Hiệp hội Sản Phụ khoa thế giới (Divakar, 2008; Lefebvre và cs, 2003; Myers và cs, 2002; Pérez-López và cs, 2014) cho rằng các trường hợp UXCTC không có triệu chứng và người bệnh không nhu cầu mang thai thì không cần điều trị. Do đó, chỉ định điều trị nội khoa và ngoại khoa chỉ đặt ra khi UXCTC có biến chứng gây nên những triệu chứng làm ảnh hưởng đến chất lượng cuộc sống và khả năng sinh sản của phụ nữ.
Tuy không cần phải điều trị, các trường hợp UXCTC không có chỉ định can thiệp nội khoa hay ngoại khoa vẫn cần được tiếp cận, theo dõi để dự phòng các biến chứng có thể xảy ra (Singh và cs, 2015).
Để tiếp cận và theo dõi các trường hợp này, có thể phân thành 2 đối tượng:
UXCTC ở phụ nữ trong lứa tuổi sinh sản
- Theo dõi sự phát triển kích thước của khối u bằng các số đo của siêu âm mỗi 6 tháng - 1 năm tùy vị trí, kích thước của khối u.
- Theo dõi sự xuất hiện các triệu chứng liên quan đến các biến chứng; khai thác bệnh sử, thăm khám mỗi 6 tháng - 1 năm
UXCTC ở phụ nữ mãn kinh
- Vì UXCTC có khuynh hướng giảm kích thước một cách đáng kể, thậm chí biến mất ở phụ nữ mãn kinh, vì vậy ở đối tượng này thì thái độ thận trọng theo dõi là một chọn lựa tối ưu hơn là một biện pháp can thiệp khác (Bulun, 2013). Theo dõi sự phát triển về kích thước, tính chất của khối u qua khảo sát siêu âm mỗi 3-6 tháng. Chú ý khả năng hóa ác khi khối u to nhanh, hình ảnh hoại tử trong lòng khối u.
- Đối với những phụ nữ mãn kinh có điều trị nội tiết thay thế, thì cần được cảnh báo rằng UXCTC có thể sẽ không giảm kích thước và có thể xuất hiện một số triệu chứng liên quan của UXCTC (Ryan và cs, 2005). Nếu có xuất huyết âm đạo, cần theo dõi sát để xác định khả năng ác tính. Cần đo bề dày niêm mạc tử cung ở mỗi lần siêu âm và nạo sinh thiết tầng nếu nội mạc tử cung dày.
ĐIỀU TRỊ NỘI KHOA U XƠ CƠ TỬ CUNG
Hiện nay, các Hiệp hội Sản Phụ Khoa đều đồng thuận rằng việc Điều trị UXCTC chỉ được đặt ra khi UXCTC có biến chứng gây nên những triệu chứng làm ảnh hưởng đến chất lượng cuộc sống và khả năng sinh sản của phụ nữ (Mas và cs, 2017; Breech và cs, 2003).
Việc điều trị UXCTC nên được cá thể hóa dựa trên tuổi, triệu chứng, kích thước UXCTC, nhu cầu mang thai và các tác dụng phụ có thể có của từng phương pháp.
Trước đây, các trường hợp UXCTC có biến chứng thường được chỉ định phẫu thuật. Tuy nhiên, điều trị nội khoa có nhiều tiến bộ và xu hướng điều trị bảo tồn tăng lên do yêu cầu của bản thân người phụ nữ và do có những bằng chứng cho thấy phụ nữ cắt tử cung, chừa 1 hoặc 2 buồng trứng, có nguy cơ mãn kinh sớm hơn 2-3 năm so với nhóm chứng (Moorman và cs, 2011).
Nhiều nhóm thuốc được nghiên cứu và bước đầu mang lại kết quả khả quan tạo thêm nhiều lựa chọn phù hợp cho từng bệnh nhân và giúp bảo tồn khả năng sinh sản.
Điều trị nội khoa có thể được áp dụng cho các trường hợp:
- UXCTC gây rong kinh rong huyết nhưng chưa ảnh hưởng nghiêm trọng đến thể trạng của bệnh nhân như gầy sút, thiếu máu nặng, chất lượng cuộc sống suy giảm trầm trọng.
- UXCTC không gây chèn ép lòng tử cung, vô sinh hoặc sẩy thai liên tiếp.
- UXCTC không gây chèn ép nặng niệu quản, thận ứ nước, suy thận mãn sau thận do tắc nghẽn.
- Để giảm kích thước khối u và tử cung, cải thiện tình trạng thiếu máu của bệnh nhân trước khi mổ.
TRANEXAMIC ACID
Tranexamic acid là một chất chống ly giải fibrin. Tranexamic acid được chứng minh làm giảm lượng máu kinh kể cả khi có UXCTC (Telner và cs, 2007). Khuyến cáo:
- Có bằng chứng ủng hộ sử dụng tranexamic acid trên bệnh nhân cường kinh và kiểm soát chảy máu trong phẫu thuật. (Khan và cs, 2014; Laughlin và cs, 2011; Wellington và cs, 2003)
- Điều trị kết hợp thuốc ngừa thai và tranexamic không được khuyến cáo. (Peitsidis và cs, 2014)
- Tranexamic acid không được khuyến cáo trên bệnh nhân có bệnh lý đông máu bẩm sinh hoặc có tiền căn huyết khối. Cách sử dụng:
o Đường uống: viên Transamin 250 mg hoặc 500 mg, 1viên x 3 lần mỗi ngày đến khi ngưng xuất huyết. Liều tối đa: 750 mg - 2.000 mg/24 giờ.
o Hoặc đường tiêm (ống thuốc có hàm lượng 250 mg hoặc 500 mg/5mL) : 250 - 500 mg/ngày tiêm bắp hay tĩnh mạch, dùng 1- 2 lần/ngày trước khi mổ hoặc nếu xuất huyết trong hay sau phẫu thuật 500 - 1.000 mg/lần tiêm tĩnh mạch hoặc 500 - 2.500 mg pha trong 500 mL dung dịch glucose 5% hay dung dịch có chất điện giải, truyền nhỏ giọt tĩnh mạch 24 giờ.
o Cẩn thận trên bệnh nhân đang điều trị huyết khối tĩnh mạch, suy thận hay quá mẫn với các thành phần của thuốc.
o Lưu ý tác dụng phụ có thể gặp bao gồm thống kinh, nôn ói, buồn nôn dù không thường xuyên xuất hiện.
THUỐC VIÊN TRÁNH THAI NỘI TIẾT KẾT HỢP (TVTTNTKH)
Khuyến cáo:
- Có bằng chứng ủng hộ sử dụng TVTTNTKH để điều trị triệu chứng xuất huyết tử cung nặng liên quan tới UXCTC, sau khi đã điều trị đợt xuất huyết cấp. (Vilos và cs, 2015)
- Chống chỉ định trên bệnh nhân có nguy cơ thuyên tắc tĩnh mạch, béo phì, tăng huyết áp và hút thuốc. (Practice Committee of the American Society for Reproductive Medicine, 2017)
Nguy cơ có thể gặp gồm ung thư vú, nhồi máu cơ tim, đột quỵ được xem là thấp dựa trên các chứng cứ hiện có (Kiley và cs, 2007). Ngoài ra, thuốc còn có các tác dụng phụ khác như đau đầu, buồn nôn, căng ngực.
PROGESTINS-DỤNG CỤ TỬ CUNG CHỨA LEVONORGESTREL (LEVONORGESTREL INTRAUTERINE SYSTEM - LNG-IUS)
Khuyến cáo:
LNG-IUS được chỉ định điều trị triệu chứng cường kinh và có thể là biện pháp điều trị thay thế để tránh nguy cơ phẫu thuật trong trường hợp cường kinh là triệu chứng chính của bệnh nhân.
- LNG-IUS có thể cải thiện nồng độ haemoglobin.
- LNG-IUS không được khuyến cáo cho những bệnh nhân xuất huyết âm đạo bất thường chưa xác định nguyên nhân.
- Bệnh nhân cần được điều trị ổn định qua đợt xuất huyết cấp, được nội soi buồng tử cung cắt các khối UXCTC L0, L1, L2, và điều trị các bệnh lây truyền qua đường tình dục (nếu có) trước khi đặt vòng LNG-IUS.
LNG-IUS làm giảm đáng kể lượng máu mất bằng cách giảm phân bào nội mạc tử cung, tăng cường chết tế bào theo chương trình (Maruo và cs, 2001).
LNG-IUS làm giảm 80% lượng máu kinh trong 4 tháng đầu tiên, có thể gây vô kinh trong vòng 2 năm. Haemoglobin tăng 7,8% trong 4 tháng đầu điều trị (Dhamangaonkar và cs, 2015). LNG-IUS cải thiện chất lượng sống, tăng mức độ hài lòng của bệnh nhân và tiếp tục duy trì quá trình điều trị, tránh bớt chỉ định phẫu thuật (Qiu và cs, 2014).
Tỷ lệ rơi vòng tuy thấp nhưng có thể xảy ra, đặc biệt ở những trường hợp có UXCTC to dưới niêm hoặc trong cơ (Khan và cs, 2014).
Các thuốc chứa progestins khác cũng có thể làm giảm chảy máu như que cấy chưa etonogestrel (Implanon).
GnRH ĐỒNG VẬN
(GONADOTROPIN RELEASING HORMONE AGONIST)
Khuyến cáo:
- GnRH đồng vận được sử dụng điều trị UXCTC có triệu chứng, có thể làm giảm kích thước khối u xơ và tử cung. Có thể sử dụng trước phẫu thuật 1-3 tháng để giảm lượng máu mất và mổ dễ hơn.
- GnRH đồng vận được khuyến cáo sử dụng trong trường hợp UXCTC có triệu chứng nhằm cải thiện nồng độ huyết sắc tố trước phẫu thuật. (Lethaby và cs, 2000)
- Ngưng GnRH đồng vận trong khoảng 2 tuần trước khi phẫu thuật.
- Không nên sử dụng GnRH đồng vận kéo dài trên 6 tháng, trừ khi có kết hợp thêm các điều trị bổ sung nhằm cân bằng những rối loạn do nội tiết tố sinh dục. Có bằng chứng cho thấy GnRH đồng vận gây giảm mật độ xương không hồi phục dù đã bổ sung estrogen trong quá trình điều trị. (Palomba và cs, 1999; Palomba và cs, 2002)
- GnRH đồng vận gây nên những triệu chứng của mãn kinh như bốc hỏa, viêm teo âm đạo và giảm mật độ xương do đó chỉ nên chỉ định ngắn hạn (dưới 6 tháng) trước khi phẫu thuật nhằm làm giảm kích thước u xơ và cải thiện tình trạng thiếu máu cho bệnh nhân.
Lưu ý, UXCTC có thể tái phát rất nhanh đồng thời kéo theo các triệu chứng liên quan sau khi ngưng điều trị GnRH đồng vận (Letterie và cs, 1989).
THUỐC ĐIỀU HÒA CHỌN LỌC THỤ THỂ PROGESTERONE
(SELECTIVE PROGESTERONE RECEPTOR MODULATORS-SPRMS)
Mifepristone
Khuyến cáo:
- Mifepristone được khuyến cáo chỉ định trong trường hợp UXCTC có xuất huyết tử cung bất thường, trằn nặng hạ vị, thiếu máu và thống kinh (Gurusamy và cs, 2016; Islam và cs, 2013; Khan và cs, 2014; Shen và cs, 2013; Singh và cs, 2015; Tristan và cs, 2012).
- Mifepristone chống chỉ định sử dụng trong thai kỳ và bệnh nhân đã Điều trị steroids trong 3 tháng trước đó. (Bagaria và cs, 2009; Tristan và cs, 2012)
Lưu ý:
- Khoảng 63% bệnh nhân được ghi nhận dày niêm mạc tử cung khi điều trị với mifepristone (Bagaria và cs, 2009).
- Những thay đổi trên nội mạc tử cung được gọi là “thay đổi nội mạc tử cung liên quan đến điều hòa thụ thể progesterone-PAEC”, có thể thoái triển khi ngưng liệu trình điều trị. Sự thay đổi này không phải tăng sinh nội mạc tử cung hay ung thư nội mạc tử cung (Chabbert-Buffet và cs, 2014).
- Cần lưu ý, mifepristone không được đăng ký chính thức để điều trị UXCTC (off-label).
Thuốc điều hòa chọn lọc thụ thể Progesterone (SPRMs)
Ulipristal acetate (UPA)
Khuyến cáo:
- UPA hiện được khuyến cáo là lựa chọn đầu tay trong điều trị nội khoa UXCTC.
- UPA được khuyến cáo điều trị làm giảm triệu chứng cường kinh và trằn nặng hạ vị do có tác dụng làm giảm lượng máu kinh (liều 5mg có thể làm giảm lượng máu kinh trên 91% bệnh nhân và 50% bệnh nhân sẽ ngưng xuất huyết trong vòng 10 ngày đầu điều trị (Donnez và cs, 2012)) và giảm kích thước khối u khoảng 25% kích thước sau 13 tuần (Donnez và cs, 2012; Talaulikar và cs, 2012).
- UPA có thể được chỉ định trước phẫu thuật để làm nhỏ kích thước khối u và tử cung, cải thiện tình trạng thiếu máu của bệnh nhân.
- Không cần thiết sử dụng đồng thời thuốc ngừa thai nội tiết và progestogens với UPA (Talaulikar và cs, 2014).
- SPRMs không ảnh hưởng trên tế bào cơ tử cung bình thường và không ức chế hoàn toàn hoạt động trục nội tiết nên không gây ra tình trạng giống mãn kinh (Chabbert-Buffet và cs, 2014). SPRMs gây chết tế bào theo chương trình (apoptosis) của các sợi cơ trong u, giảm chất nền khối u. Do đó khối UXCTC và các triệu chứng ít tái phát sau khi ngưng điều trị.
- Ulipristal acetate (UPA) là thuốc được sử dụng rộng rãi và cho nhiều kết quả khả quan nhất trong nhóm SPRMs hiện nay (Farris và cs, 2019).
- UPA có được sửa dụng nhằm (Odejinmi và cs, 2017):
• Cải thiện khả năng có thai ở phụ nữ hiếm muộn.
• Cải thiện triệu chứng gây ra bởi UXCTC cho phụ nữ gần tuổi mãn kinh.
• Tránh phẫu thuật cho bệnh nhân mang UXCTC có triệu chứng, do một số UXCTC sẽ giảm kích thước khi được điều trị với UPA. Từ đó cải thiện khả năng đậu thai.
• Tránh phẫu thuật cho bệnh nhân không muốn phẫu thuật.
• Kiểm soát triệu chứng ở người phụ nữ không đủ điều kiện phẫu thuật.
• Ngăn ngừa tái phát UXCTC ở phụ nữ đã được phẫu thuật bóc u xơ.
- Liều dùng: UPA 5 mg 1 viên/ngày trong 3 tháng. Nếu muốn dùng lặp lại phải ngưng 2 tháng rồi cho đợt thứ nhì 3 tháng. Có thể dùng tối đa 8 đợt.
- Chống chỉ định của UPA bao gồm có thai, xuất huyết âm đạo bất thường chưa rõ nguyên nhân và bệnh lý ác tính (Talaulikar và cs, 2014).
- Các tác dụng phụ thường gặp của UPA được ghi nhận gồm đau đầu, căng ngực, đau bụng, tuy nhiên các triệu chứng này cũng rất ít gặp (Donnez và cs, 2012).
- Nội mạc tử cung dày liên quan với UPA được ghi nhận, có thể do dày nang tuyến, ít liên quan đến tăng sinh nội mạc tử cung (Talaulikar và cs, 2012). Điều trị UPA thời gian dài cần theo dõi độ dày nội mạc tử cung qua siêu âm, đặc biệt ở thời điểm giữa các đợt điều trị.
- Tính an toàn của UPA đã được Ủy Ban Châu Âu về Dược Phẩm (European Medicines Agency - EMA) yêu cầu xem xét lại từ tháng 11 năm 2017 và đến tháng 05 năm 2018 đã kết luận và cho phép tiếp tục sử dựng UPA, với các lý lẽ như sau:
• Trên 1.800 bệnh nhân sử dụng UPA 2,5 mg hoặc 5 mg mỗi ngày x 3 tháng mỗi đợt x 1 - 8 đợt: không thấy có dấu hiệu UPA gây độc cho gan.
• Không có bệnh nhân nào uống 5 mg UPA mỗi ngày trong 1 hoặc nhiều đợt 3 tháng có men gan ALT hay AST tăng gấp 3 lần mức độ cao bình thường và không có bệnh nhân nào tổn thương gan do thuốc theo tiêu chuẩn quốc tế (Hy’s Law).
- Có một số ca báo cáo về tổn thương gan xảy ra sau khi UPA được lưu hành trên thị trường (8/765.000 ca đang sử dụng UPA - tỷ lệ # 1/100.000).
- UPA không nằm trong nhóm thuốc gây tổn thương gan (drugs-induced liver injuries - DILI).
- Trong thời điểm hiện tại, trên thị trường không có một loại thuốc nào ngoài UPA đã được chứng minh có hiệu quả điều trị u xơ cơ tử cung có biến chứng nặng hoặc trung bình, được cấp phép điều trị.
- Tổn thương gan có thể được loại trừ khi sử dụng UPA bằng cách xét nghiệm chức năng gan như sau:
• Trước khi bắt đầu điều trị: xét nghiệm chức năng gan, nếu AST (aspartate aminotransferase) hoặc ALT (alanine transaminase) > 2 lần giá trị bình thường, không nên chỉ định UPA.
• Trong 2 đợt điều trị đầu, xét nghiệm AST, ALT mỗi tháng.
• Những đợt điều trị tiếp theo: xét nghiệm AST, ALT trước khi bắt đầu đợt điều trị hoặc khi lâm sàng có triệu chứng liên quan.
• Cuối mỗi đợt điều trị: xét nghiệm AST, ALT sau 2-4 tuần kết thúc đợt.
• Ngưng ngay UPA nếu men gan tăng gấp 3 lần giới hạn trên và chuyển bệnh nhân khám chuyên khoa gan mật.
(Donnez và cs, 2018)
Điều trị nội khoa UXCTC bằng UPA là một biện pháp:
- Có thể sử dụng trước phẫu thuật làm nhỏ khối u và tử cung, cải thiện tình trạng thiếu máu.
- Có thể sử dụng lâu dài.
- Có thể thay thế phẫu thuật, nhất là cho phụ nữ sắp mãn kinh hoặc mong muốn có con, đáp ứng nguyện vọng giữ tử cung một cách an toàn cho hầu hết bệnh nhân.
ĐIỀU TRỊ NGOẠI KHOA U XƠ CƠ TỬ CUNG
Trong thời gian gần đây, điều trị nội khoa UXCTC được phát triển nhiều vì có nhiều thuốc mới điều trị hiệu quả. Một số trường hợp vẫn cần điều trị ngoại khoa như:
- UXCTC to, gây cảm giác khó chịu nhiều cho bệnh nhân lớn tuổi, không mong có thêm con.
- UXCTC gây biến chứng nặng như xuất huyết tử cung bất thường nặng, sẩy thai liên tiếp.
- Điều trị nội khoa thất bại (ít gặp).
CHUẨN BỊ TRƯỚC MỔ
1. Làm giảm kích thước khối u trước phẫu thuật (mức độ chứng cứ: mạnh)
GnRH đồng vận: Theo một phân tích gộp của Cochrane 2001 gồm 26 thử nghiệm lâm sàng cho thấy sử dụng GnRH đồng vận trong 3-4 tháng trước phẫu thuật làm giảm kích thước tử cung và kích thước khối UXCTC nên giảm thời gian phẫu thuật, giảm lượng máu mất và thời gian nằm viện.
Nên tiến hành phẫu thuật sau khi ngừng GnRH đồng vận trong vòng tối đa 2 tuần.
SPRMs (selective progesterone receptor modulators): Một thử nghiệm lâm sàng bao gồm những người bệnh UXCTC có triệu chứng được sử dụng UPA 5 mg/ngày (n=96) hoặc 10 mg/ngày (n=98) trong 13 tuần so với nhóm giả dược (n=48) cho thấy, kết quả kiểm soát được tình trạng chảy máu nặng 91-92% so với nhóm chứng là 19% đồng thời giảm kích thước và khối lượng UXCTC có ý nghĩa thống kê (Donnez và cs, 2012).
2. Loại trừ các tổn thương ung thư nội mạc tử cung hay cổ tử cung trước phẫu thuật
Tất cả những trường hợp có xuất huyết tử cung bất thường cần được loại trừ ung thư trước khi tiến hành phẫu thuật bằng cách thực hiện các thủ thuật nạo sinh thiết từng phần, soi cổ tử cung, phết tế bào cổ tử cung, bấm sinh thiết cổ tử cung nếu có chỉ định.
3. Cần khảo sát kỹ trước phẫu thuật:
- Yếu tố người bệnh: mức độ trầm trọng của xuất huyết (thiếu máu hay ảnh hưởng đến sinh hoạt), triệu chứng liên quan (đau vùng chậu, vô sinh), các bệnh lý nội khoa mắc phải, nguy cơ tiềm ẩn huyết khối, vị trí, kích thước và số lượng UXCTC, tuổi, PARA, mong muốn có thai. (Stewart và cs, 2017; Templeman và cs, 2009)
- Yếu tố phẫu thuật viên: quá trình đào tạo, kỹ năng và kinh nghiệm.
- Yếu tố cơ sở y tế: trang thiết bị y tế - kỹ thuật sẵn có, dự trữ máu và các thành phần của máu, chất lượng của đội ngũ hỗ trợ.
4. Giải thích và cung cấp đầy đủ thông tin cho người bệnh về điều trị nội khoa và điều trị ngoại khoa, điều trị ngắn hạn và điều trị dài hạn, Người bệnh cần ký cam kết bản đồng thuận điều trị.
5. Đặt sonde JJ đối với các UXCTC to, UXCTC có gây biến chứng chèn ép niệu quản, thận ứ nước.
Tất cả bệnh nhân có UXCTC to gây biến chứng chèn ép niệu quản, thận ứ nước trên siêu âm nên được chụp hệ niệu cản quang (Urographie intra veineuse-UIV) nhằm xác định mức độ tắc nghẽn. CT scan hoặc MRI cũng có thể là chọn lựa nếu cần khảo sát kỹ hơn về hệ niệu, bể thận và nếu điều kiện cơ sở y tế có sẵn.
Những bệnh nhân có tắc nghẽn trên UIV mức độ nhiều cần được đặt sonde JJ trước mổ nhằm giúp phẫu thuật viên (PTV) có thể định vị được vị trí niệu quản một cách thuận lợi trong cuộc mổ. Trong một số trường hợp như khi UXCTC to, hình ảnh thận ứ nước trên siêu âm và không thực hiện được UIV vì nhiều lý do, có thể cân nhắc đặt sonde JJ thường quy trước phẫu thuật.
Điều này rất có ích vì giúp PTV hạn chế được biến chứng tổn thương niệu quản khi bóc những UXCTC nằm ở vị trí khó, gần niệu quản. Ngoài ra nếu có xảy ra biến chứng tổn thương niệu quản trong lúc mổ, PTV có thể dễ dàng phát hiện sớm và hội chẩn bác sĩ chuyên khoa ngoại niệu kịp thời để xử trí.
CÁC PHƯƠNG PHÁP ĐIỀU TRỊ NGOẠI KHOA
A. BÓC U XƠ CƠ TỬ CUNG
Bóc UXCTC là một lựa chọn với trường hợp UXCTC có biến chứng nhưng mong muốn bảo tồn tử cung để mang thai. Bằng chứng cho thầy bóc UXCTC làm tăng tỷ tệ có thai phụ nữ < 35 tuổi có hiếm muộn, tỷ lệ sẩy thai giảm có ý nghĩa thống kê (p < 0,001)(Machupalli và cs, 2013; Li và cs, 1999).
Chỉ định:
- Có UXCTC nhưng người bệnh muốn giữ tử cung để bảo tồn chức năng mang thai (người bệnh còn mong muốn có thai).
- Bệnh nhân trẻ có xuất huyết tử cung nặng gây thiếu máu (Milton và cs, 2019), có UXCTC làm biến dạng buồng tử cung (L0, L1, L2),
- Bệnh nhân trẻ có UXCTC gây đau vùng chậu. (Milton và cs, 2019)
• Đau vùng chậu cấp
• Đau mạn tính vùng chậu hoặc thắt lưng hoặc bị đè nặng vùng chậu
- UXCTC gây hiếm muộn hoặc sẩy thai liên tiếp (Philippines Society for Reproductive Medicine, 2017).
- Bệnh nhân không muốn cắt tử cung.
Tư vấn nguy cơ:
- Có thể cắt tử cung trong quá trình phẫu thuật bóc UXCTC, do tổn thương quá nhiều, phức tạp.
- Khoảng 15% tái phát sau bóc UXCTC, 10% cắt tử cung sau 5-10 năm.
- Nguy cơ vỡ tử cung trong thai kỳ sau phẫu thuật bóc UXCTC đặc biệt là những trường hợp bóc nhiều nhân xơ.
Lựa chọn ngả thực hiện bóc u xơ: Tùy thuộc vào số lượng của khối u, kích thước, vị trí, mức độ dính và kinh nghiệm của phẫu thuật viên mà chọn ngả thực hiện bóc u xơ. Kiểm soát và xử trí tình trạng chảy máu trong quá trình bóc u xơ là ưu tiên hàng đầu để đạt kết quả tốt nhất sau phẫu thuật. (Kovac và cs, 2002).
1. Phẫu thuật nội soi buồng tử cung cắt UXCTC
Chỉ định: Hiệp hội Phẫu Thuật Nội Soi Phụ khoa Hoa Kỳ (American Association of Gynecologic Laparoscopists, 2012) khuyến nghị rằng phẫu thuật nội soi buồng tử cung cắt u xơ là lựa chọn đầu tay cho các trường hợp UXCTC dưới niêm L0, L1, L2 có biến chứng gây xuất huyết nặng, vô sinh, sẩy thai liên tiếp, và kích thước khối u < 5 cm.
Một nghiên cứu tại Hoa Kỳ gồm 1422 bệnh nhân ghi nhận nội soi buồng tử cung cắt u xơ L0, L1, L2 đạt kết quả cao trong việc điều trị xuất huyết tử cung bất thường. Tuy nhiên, tỷ lệ tái phát từ 14,5 - 30% sau 3 - 4 năm. Một nghiên cứu tiến cứu khác cũng tại Hoa Kỳ trong 3 năm cho kết quả khả quan khi 94,1% người bệnh đã kiểm soát được xuất huyết tử cung bất thường. Tương tự theo tác giả Piecak và Milart, 2017, phẫu thuật cắt bỏ UXCTC dưới niêm mạc giúp cải thiện tình trạng mang thai.
Phẫu thuật viên có kinh nghiệm sẽ thực hiện được việc cắt UXCTC dưới niêm (L0, L1, L2) có kích thước 4 - 5 cm qua nội soi buồng tử cung. Cắt UXCTC dưới niêm L2 có nhiều khả năng thực hiện phẫu thuật 2 thì so với L0, L1 vì nguy cơ hấp thụ dịch cao và thủng tử cung trong phẫu thuật. Cần thận trọng khi u xơ dưới niêm cách lớp thanh mạc tử cung dưới 5 mm (Puri K và cs, 2014).
Tai biến:
- Chảy máu: Trong phẫu thuật nội soi cắt đốt u xơ L0, L1, L2, tỷ lệ chảy máu khoảng 0,1 - 6,0%, sử dụng bóng sonde Foley bơm 30 ml nước muối sinh lý có hiệu quả cầm máu (Piecak và Milart, 2017)
- Tổn thương tử cung: nguy cơ chít hẹp cổ tử cung, thủng tử cung thường trong xẩy ra trong thì nong cổ tử cung, thủng tử cung trong thì cắt đốt có thể gây tổn thương ruột, bàng quang và các mạch máu lân cận (Piecak và Milart, 2017)
- Dính buồng tử cung: Là biến chứng thường gặp trong phẫu thuật nội soi buồng tử cung cắt đốt UXCTC L0, L1, L2. Tỷ lệ dính buồng tử cung sau phẫu thuật 35-45% được báo cáo nếu sử dụng năng lượng đơn cực nhưng nếu sử dụng năng lượng lưỡng cực thì tỷ lệ này giảm xuống còn 7,5% (Roy và cs, 2017). Hiện nay tại Việt Nam, một số bệnh viện đã sử dụng bộ đốt lưỡng cực trong nội soi phụ khoa.
Một số phương pháp chống dính buồng tử cung sau phẫu thuật, được cho hiệu quả thấp như đặt dụng cụ tử cung, liệu pháp hormone, trong khi các phương pháp có hiệu quả chống dính buồng tử cung tốt hơn như sử dụng bóng của ống thông Foley, gel hyaluronic. Khuyến cáo nên sử dụng phương pháp chống dính trong khoảng 6-8 tuần sau phẫu thuật (Piecak và Milart, 2017).
- Nếu cuộc mổ khó, kéo dài, cần bơm nhiều dịch vào buồng tử cung, có thể gây ra tăng tái hấp thụ dịch dẫn đến quá tải tuần hoàn, phù phổi cấp, phù não cấp. Nếu sử dụng dung dịch glycine mà truyền quá nhiều sẽ gây mất cân bằng điện giải (hạ natri máu, hạ protein máu và hematocrit thấp) gây buồn nôn, nôn, nhức đầu và lú lẫn (Piecak và Milart, 2017).
2. Mổ hở thành bụng bóc UXCTC
Chỉ định:
- Nhiều nhân xơ, to, trong cơ tử cung ở vị trí L2 đến L7.
- UXCTC có biến chứng nặng, không điều trị được bằng nội khoa.
- Bệnh nhân muốn bảo tồn tử cung hoặc đang mong con.
Trong quá trình phẫu thuật, cần giảm lượng máu mất bằng cách tiêm vasopressin hoặc các chất khác (xem phần các thuốc làm giảm chảy máu trong bóc UXCTC).
Tỷ lệ vỡ tử cung, mổ lấy thai thấp hơn so với phẫu thuật nội soi ổ bụng bóc u xơ.
Có thể bóc nhân xơ ngả bụng bằng đường rạch nhỏ < 8 cm nếu các khối u không quá to.
Phẫu thuật bóc UXCTC ngả bụng bằng đường rạch nhỏ là một lựa chọn nhằm giảm sự xâm lấn trên người bệnh có UXCTC lớn và nhiều khối.
Đường rạch da < 8 cm, cho phép phẫu thuật viên có thể sờ nắn các khối u xơ nằm trong cơ tử cung và quá trình khâu phục hồi các lớp cơ của tử cung theo 3 lớp tiêu chuẩn dễ dàng hơn.
Tai biến trong trong phẫu thuật thường là mất máu nhiều nên cần dự trù máu cùng nhóm.
Tai biến sau phẫu thuật
- Chảy máu trong vết khâu sau bóc nhân xơ nếu không khâu phục hồi cơ tử cung kỹ.
- Nhiễm trùng, nhất là khi có tụ máu nơi khâu phục hồi cơ tử cung.
- Vỡ tử cung trong lần mang thai sau, chiếm tỉ lệ 0 - 4%.
- Dò bàng quang-âm đạo-trực tràng, tổn thương niệu quản.
3. Phẫu thuật nội soi ổ bụng bóc nhân xơ (mức độ chứng cứ: mạnh)
Chỉ định:
- UXCTC dưới thanh mạc và trong cơ có biến chứng.
- Kích thước nhỏ hơn 10cm.
Tai biến trong phẫu thuật
- Chảy máu nhiều, thời gian phẫu thuật kéo dài.
- Đối với các nhân xơ to sau khi được bóc bằng nội soi, không thể lấy khối u ra khỏi ổ bụng qua đường rạch nội soi rất nhỏ, nhiều phẫu thuật viên đã sử dụng máy bào lấy mô. Tuy nhiên, sử dụng máy bào lấy mô UXCTC có nhiều điểm không thuận lợi như thời gian gây mê kéo dài, khả năng khối u đã hóa ác tính (sarcoma). Bào khối u có thể làm rơi vãi các tế bào ung thư trong ổ bụng gây di căn cho bệnh nhân (Wong và cs, 2018) tổng kết 33723 trường hợp UXCTC ở Trung Quốc được bóc qua nội soi ổ bụng, có sử dụng máy bào điện. Trong số này có 62 ca u đã hóa ác tính (0,18%) do giải phẫu bệnh lý xác nhận. Do đó, nếu sử dụng máy bào thì phải đặt khối u vào trong bao.
- Tổn thương ruột - bàng quang - các mạch máu lớn do đâm Trocar là biến chứng do lỗi kỹ thuật của phẫu thuật viên và thường ít khi gặp (Piecak và Milart, 2017).
- Thuyên tắc khí là một biến chứng hết sức nguy hiểm. Phẫu thuật viên và bác sĩ gây mê phải theo dõi sát và phát hiện sớm thuyên tắc khí nếu có xảy ra để điều trị kịp thời (Piecak và Milart, 2017).
Tai biến sau phẫu thuật
- Chảy máu sau mổ.
- Nhiễm trùng: viêm nội mạc tử cung trong thời gian hậu phẫu chiếm tỷ lệ 1-5%, nhiễm trùng cơ tử cung, nhiễm trùng vùng chậu dẫn đến cắt tử cung. Kháng sinh dự phòng có thể có hiệu quả để giảm thiểu tỷ lệ nhiễm trùng sau mổ.
- Vỡ tử cung trong thai kỳ lần sau: dao động từ 0 - 10%.
Theo dõi sau bóc nhân xơ
- Tái khám định kỳ:
• 1 tháng sau mổ.
• Mỗi 6 - 12 tháng tái khám 1 lần.
- Theo dõi có thai tự nhiên không? Nếu chưa có thai sau mổ 6-12 tháng, cân nhắc tư vấn cho bệnh nhân phương pháp TTTON sau khi khám lâm sàng và kiểm tra buồng tử cung.
- Mổ lấy thai chủ động sau bóc nhân xơ.
4. Phẫu thuật bóc nhân xơ cơ tử cung ngả âm đạo (mức độ chứng cứ: yếu)
Phẫu thuật bóc u xơ cơ tử cung ngả âm đạo, không rạch da là một phẫu thuật khó, chỉ nên được thực hiện đối với UXCTC nhỏ, nằm ở vị trí thuận lợi (cùng đồ sau). Phẫu thuật này đòi hỏi phẫu thuật viên phải có kỹ năng cao và nhiều kinh nghiệm.
B. CẮT TỬ CUNG DO U XƠ CƠ TỬ CUNG
Phẫu thuật cắt tử cung và hai ống dẫn trứng là phương pháp điều trị tận gốc UXCTC có biến chứng. Cắt tử cung hiện nay là phẫu thuật thường gặp, chỉ đứng sau mổ lấy thai tại các bệnh viện chuyên ngành Sản Phụ khoa (Blandon và cs, 2007).
Chỉ định
- Nghi ngờ UXCTC thoái hóa ác tính.
- Đa nhân xơ cơ TC, không còn mô lành, không thể bóc được.
- Trong khi bóc UXCTC mà không kiểm soát được tình trạng chảy máu.
- Phụ nữ lớn tuổi và đủ con.
- Có bệnh lý kèm theo như bệnh tuyến-cơ tử cung hoặc bệnh lý cổ tử cung.
Nếu cuộc mổ khó khăn, có thể cắt tử cung bán phần và hai ống dẫn trứng.
- Nên cắt 2 buồng trứng nếu bệnh nhân trên 50 tuổi. Tuy nhiên, cần sự đồng thuận của bệnh nhân bằng văn bản.
Tư vấn
- Các nguy cơ và tai biến của phẫu thuật cắt tử cung như tổn thương đường tiết niệu, ruột nếu dính nhiều.
- Phẫu thuật cắt tử cung có thể gây ra mãn kinh sớm khoảng 2-3 năm.
- Cắt tử cung có thể làm thay đổi cấu trúc sàn chậu (mất nút trung tâm đáy chậu tự nhiên nên có thể gia tăng tỷ lệ sa tạng chậu sau mổ, thường bắt đầu 5 năm sau mổ. Giảm Libido, rối loạn chức năng tâm lý (có thể trầm cảm) (Blandon và cs, 2007; Ewalds-Kvist và cs, 2005).
- Các thủ thuật thay thế phẫu thuật: lợi ích và nguy cơ.
1. Phẫu thuật cắt tử cung qua mổ hở ngả bụng
Chỉ định: khi UXCTC quá lớn, lan tỏa, nhiều nhân, hoặc các trường hợp chống chỉ định phẫu thuật cắt tử cung ngả âm đạo hoặc nội soi ổ bụng.
2. Phẫu thuật nội soi ổ bụng cắt tử cung
Chỉ định: thực hiện trên tử cung có kích thước < 14 tuần và không dính.
Là lựa chọn tốt hơn so với phẫu thuật hở cắt tử cung ngả bụng do chất lượng sống tốt hơn và giảm biến chứng hậu phẫu. Tuy nhiên, để thực hiện loại phẫu thuật này, cần phải đánh giá cẩn thận kích thước tử cung, cũng như kinh nghiệm, kỹ năng của phẫu thuật viên và trang thiết bị nội soi của bệnh viện để có chỉ định phù hợp. Có thể thực hiện trên người bệnh chưa từng có thai, chưa sanh ngả âm đạo hoặc đã có phẫu thuật ngả bụng trước đó, nếu không dính nhiều vùng chậu, Phục hồi nhu động ruột sớm trong thời gian hậu phẫu.
Tai biến trong phẫu thuật:
- Thuyên tắc khí.
- Tổn thương ruột, bàng quang, mạch máu lớn do lỗi đâm trocar.
- Tổn thương niệu quản.
Tai biến sau phẫu thuật:
- Nhiễm trùng.
- Dò âm đạo-trực tràng, bàng quang-âm dạo, niệu quản-âm đạo.
3. Phẫu thuật cắt tử cung ngả âm đạo
Đây là phương pháp ít xâm lấn và chi phí rẻ nhất. Tuy nhiên, tương tự như phẫu thuật bóc UXCTC ngả âm đạo, đây là một phẫu thuật khó thực hiện, nhiều nguy cơ biến chứng như chảy máu nhiều, sa tạng chậu, tổn thương niệu quản. Phẫu thuật này đòi hỏi phẫu thuật viên phải có kỹ năng và nhiều kinh nghiệm. Cần theo dõi sát tình trạng bệnh nhân sau mổ ở cơ sở y tế có đủ trang thiết bị kỹ thuật theo dõi để phát hiện sớm các biến chứng về niệu khoa (bí tiểu, tổn thương niệu quản), chảy máu sau mổ. Có thể cắt tử cung có UXCTC ngả âm đạo với sự trợ giúp của nội soi ổ bụng.
Hiện nay, đã có phẫu thuật nội soi cắt tử cung được áp dụng rộng rãi và hiệu quả, do đó bác sĩ lựa chọn cắt tử cung ngả âm đạo cần cân nhắc kỹ nguy cơ và biến chứng có thể xảy ra.
GIẢM MẤT MÁU TRONG BÓC UXCTC
Vasopressin: Là một loại thuốc được ưa chuộng trong phẫu thuật phụ khoa. Sử dụng 30 - 40 ml dung dịch vasopressin truyền trong mổ được chứng minh là có hiệu quả giảm lượng máu mất (p=0,0001) và nhu cầu truyền máu trong phẫu thuật bóc UXCTC, mặc dù không có sự khác biệt có ý nghĩa về việc làm giảm thời gian phẫu thuật và biến chứng hậu phẫu (Kongnyuy và cs, 2011; Ginsburg và cs, 1993; Fletcher và cs, 1996; Zhao và cs, 2011).
Misoprostol: Đặt trực tràng 400 μg trước phẫu thuật cắt tử cung ngả bụng 1 giờ làm giảm lượng máu mất và thời gian phẫu thuật so với nhóm chứng (574 ± 194,8 ml vs 874 ± 171,5 ml), thêm nửa lượng Hemoglobin giảm trong thời gian hậu phẫu thấp hơn so với nhóm chứng (Abdel-Hafeez và cs, 2015).
Oxytocin: tăng sự co hồi cơ tử cung dẫn đến giảm dòng máu tới tử cung làm giảm tình trạng chảy máu trong quá trình phẫu thuật. Sử dụng oxytocin phối hợp với misoprostol (một trong những yếu tố gây co cơ tử cung) trong phẫu thuật cắt tử cung ngả âm đạo có hỗ trợ của nội soi ổ bụng được cho là có hiệu quả giảm lượng máu mất, thời gian phẫu thuật ngắn hơn và giảm thời gian nằm viện.
Liều sử dụng 30 đơn vị pha trong 500 ml dung dịch Natri Chlorua 0,9% truyền tĩnh mạch cho thấy giảm thể tích máu mất so với nhóm chứng có ý nghĩa thống kê. Nhu cầu cần truyền máu thấp hơn ở nhóm truyền Oxytocin có ý nghĩa thống kê, tỷ lệ truyền máu ở nhóm có truyền Oxytocin là 7,5% và nhóm không truyền Oxytocin là 25% (P < 0,001).
Antifibrinolytics: Tranexamic acid đã cho thấy hiệu quả trong việc cầm máu và giảm tỷ lệ truyền máu trong phẫu thuật, sự khác biệt có ý nghĩa thống kê (p < 0,001). Với liều 1g tiêm/truyền tĩnh mạch làm giảm lượng máu mất trong phẫu thuật cắt tử cung (p = 0,004), giảm lượng máu mất > 500 ml (p = 0,003) và giảm tỷ lệ phải phẫu thuật lại do biến chứng xuất huyết nội (p = 0,034) (Topsoee và cs, 2016).
CÁC THỦ THUẬT THAY THẾ PHẪU THUẬT
THUYÊN TẮC ĐỘNG MẠCH TỬ CUNG
(UTERINE ARTERY EMBOLISATION - UAE)
Thuyên tắc động mạch tử cung (nút mạch tử cung) là thủ thuật ít xâm lấn trong điều trị UXCTC, giúp bảo tồn tử cung và bệnh nhân nhanh chóng hồi phục. Phương pháp điều trị thực hiện bằng cách tiêm các hạt nhỏ vào mạch máu đến tử cung, mục đích chặn việc cung cấp máu cho u xơ để giảm triệu chứng và giảm kích thước của UXCTC.
Có bằng chứng cho thấy thuyên tắc động mạch tử cung có hiệu quả giảm triệu chứng ngắn và trung hạn một cách đáng kể:
- Giảm 43% khối lượng u xơ sau 2 tháng và 59% sau 6 tháng (Burn và cs, 2000).
- Giảm triệu chứng 80% trong số 1387 bệnh nhân trong khoảng thời gian 24 tháng.
- Cải thiện đáng kể cuộc sống trong vòng 3 năm theo dõi (p < 0,001) (Linden, 2012).
UAE có hiệu quả trong điều trị hội chứng chèn ép và cường kinh tuy nhiên thiếu hiệu quả trong điều trị UXCTC dưới niêm và xuất huyết tử cung bất thường (Laughlin và Stewart, 2011; Telner và Jakubovicz, 2007).
Chống chỉ định: Mong con, khối u nghi ngờ ác tính, mãn kinh, nhân xơ cơ tử cung có cuống, nhân xơ cơ tử cung dưới niêm mạc (Smeets và cs, 2010).
Các biến chứng được ghi nhận bao gồm: Nhồi máu tử cung, tổn thương bàng quang và âm hộ, tổn thương buồng trứng, hội chứng sau tắc mạch (Post-embolization syndrome), đau, tăng tiết dịch âm đạo, mãn kinh sớm (Linden, 2012).
Sau 5 năm điều trị tỉ lệ tái phát là 10 - 20% (cao hơn UXCTC dưới niêm) và cần được điều trị lại hoặc phẫu thuật (Memtsa và Homer, 2012). Tuy UAE tốn ít phí thực hiện hơn so với phẫu thuật nhưng sau đó cần theo dõi sát hơn, cân nhiều khảo sát hình ảnh, và thời gian theo dõi sau thủ thuật dài hơn (The REST Investigators, 2007).
Bệnh nhân cần được tư vấn về nguy cơ thất bại điều trị, nguy cơ tái phát và cần can thiệp bổ sung. Phương pháp UAE không phải là lựa chọn đầu tay cho các phụ nữ đang mong con.
TIÊU HỦY UXCTC BẰNG NHIỆT
MRI - Guided Focused Ultrasound (MRgFUS) hay High-Intensity Focused Ultrasound (HIFU) là phương pháp tập trung các chùm siêu âm năng lượng cao vào một mô đích, biến thành nhiệt năng.
Nếu nhiệt độ tại mô mục tiêu lớn hơn 55°C thì sẽ làm biến đổi protein mô đích khiến chết tế bào và hoại tử (Hindley và cs, 2004). Các mô xung quanh có thể bị ảnh hưởng ấm lên nhưng không bị hoại tử do nhiệt.
Chỉ định:
- Bệnh nhân có UXCTC mong muốn bảo tồn tử cung.
- Bệnh nhân không muốn phẫu thuật bóc nhân xơ cổ điển.
Chống chỉ định: Mang thai, đường kính u xơ lớn hơn 10cm, Hct < 25%, cân nặng trên 113 kg, bệnh lý tim mạch (Hindley và cs, 2004; LeBlang và cs, 2010), sẹo mổ cũ trên đường đi của tia siêu âm, u xơ cơ tử cung vị trí khó tiếp cận, bệnh nhân có chống chỉ định với MRI có cản quang hay siêu âm có cản quang.
Nhược điểm: Khó xác định chính xác được mục tiêu đích (Tempany và cs, 2003), khó đánh giá hiệu quả nhiệt lên cơ quan đích do hạn chế của siêu âm trong đánh giá hiệu quả nhiệt
Bệnh nhân nhanh chóng hồi phục sau 24 đến 48 giờ (LeBlang và cs, 2010). Hiệu quả giảm kích thước khối u xơ cơ tử cung phụ thuộc vào thể tích tưới máu sau khi điều trị bằng tiêu hủy UXCTC bằng nhiệt. Theo Zhang, thì có thể giảm kích thước khối u hơn 90,1%, giảm rõ rệt triệu chứng kinh nguyệt (Zhang và cs, 2010).
Yêu cầu: Hướng của siêu âm từ thành bụng trước đến u xơ cơ tử cung không đi qua bàng quang và ruột, khoảng cách từ thanh mạc đến u xơ đích lớn hơn 15 mm(LeBlang và cs, 2010). Các bệnh nhân có dụng cụ tử cung phải được lấy ra trước thủ thuật (Ren và cs, 2007; Wang và cs, 2012).
Tác dụng phụ: Vết bỏng da nhỏ, rát da, mụn nước thành bụng trước (Tempany và cs, 2003; Wang và cs, 2012). Bệnh nhân cần được tư vấn trước về thiếu dữ liệu an toàn về khả năng có thai và mang thai sau điều trị MRgFUS, nguy cơ vỡ tử cung khi mang thai, nguy cơ tái phát.
TIÊU HỦY UXCTC BẰNG SÓNG CAO TẦN (Radiofrequency Myolysis)
Là phương pháp mới trong điều trị UXCTC. UXCTC thường được điều trị thu nhỏ kích thước trước thủ thuật bằng GnRH đồng vận (Goldfarb, 2008). Hiện nay tại Việt Nam, thủ thuật đã được bước đầu triển khai tại bệnh viện Từ Dũ.
CHUẨN BỊ BỆNH NHÂN TRƯỚC PHẪU THUẬT
CHUẨN BỊ TRƯỚC MỔ
Hỏi kỹ bệnh sử và tiền căn bệnh nhân và gia đình dị ứng thuốc (tê, mê) hay thức ăn, thuốc đang dùng, có ngưng thở khi ngủ không, nghiện rượu hay thuốc, bệnh: phổi, tim, gan, thận, tuyến giáp, đái tháo đường cao huyết áp... (Hilditch và cs, 2008)
Tư vấn các nguy cơ của phẫu thuật cắt tử cung, bóc UXCTC (nội soi, mở bụng) và nội soi cắt nhân xơ TC dưới niêm mạc, nguy cơ tái phát khi bóc và nguy cơ vỡ tử cung khi có thai (xem điều trị phẫu thuật UXCTC).
Ký cam kết phẫu thuật
1. Xét nghiệm thường quy: (O'Neill và cs, 2016)
- Công thức máu, nhóm máu, Hemoglobin/Hct. Thời gian prothrombin (PT), thời gian activated partial thromboplastin (aPTT).
- Xét nghiệm HbsAg, giang mai và HIV (sau khi tư vấn và bệnh nhân đồng ý).
- Đường huyết.
- Chức năng gan.
- Chức năng thận creatinine/ huyết thanh
- Bệnh nhân trong tuổi sinh đẻ nên được thử β-hCG. (O'Neill và cs, 2016)
- Tổng phân tích nước tiểu.
- X quang phổi.
- Điện giải đồ: không cần xét nghiệm thường quy trừ khi bệnh nhân có tiền căn bất thường.
- ECG không cần xét nghiệm thường quy ở bệnh nhân không có triệu chứng hay bệnh lý tim mạch (ACC/AHA)
- Phết tế bào cổ tử cung (PAP) hoặc soi cổ tử cung nếu chưa có kết quả PAP.
2. Chẩn đoán hình ảnh: Siêu âm để xác định số lượng kích thước và vị trí của UXCTC.
Siêu âm bụng để xác định thận có ứ nước không.
Siêu âm bơm nước buồng tử cung nếu nhân xơ L0, L1, L2.
MRI giúp tránh bỏ sót khi bóc nhân xơ cơ tử cung, phân biệt với bệnh tuyến- cơ tử cung (adenomyosis) và sarcoma tử cung, giúp phân biệt L0-3.
3. Nạo sinh thiết: bệnh nhân xuất huyết tử cung bất thường có nguy cơ tăng sinh nội mạc tử cung hay ung thư nên được nạo sinh thiết và có GPB trước phẫu thuật.
4. Điều trị trước phẫu thuật:
GnRH đồng vận làm giảm kích thước khối u giúp phẫu thuật nội soi tránh mở bụng. Giảm mất máu (xem điều trị nội khoa). Ulipristal acetat (UPA) có thể được sử dụng để giảm thể tích khối u và tử cung, cải thiện tình trạng thiếu máu của bệnh nhân (xem điều trị nội khoa).
Dự phòng thuyên tắc mạch hoặc thuyên tắc phổi nếu cuộc mổ kéo dài hơn 30 phút ở bệnh nhân có nguy cơ trung bình hay cao. (thrombophilia, ung thư, đặt catheter TM trung tâm, có thai, dùng thuốc viên ngừa thai hay nội tiết thay thế, dùng tamoxifen, suy tim, bệnh tim bẩm sinh, hội chứng antiphospholipid, béo phì, suy gan, thận, bệnh viêm ruột, > 65 tuổi...). Quyết định dùng hay không dựa vào lợi ích và nguy cơ chảy máu khi phẫu thuật (Gould và cs, 2012).
Thiếu máu do thiếu sắt: nên điều chỉnh thiếu máu trước phẫu thuật bằng truyền sắt, không nên truyền máu trước mổ.
5. Chuẩn bị đại tràng: không cần thiết trừ trường hợp có nguy cơ tổn thương ruột khi phẫu thuật (Fanning và Valea, 2011).
6. Tháo bỏ hết tất cả nữ trang hay khuyên đeo ở mũi, lưỡi, miệng. Nếu nội soi buồng tử cung nên lấy DCTC trước mổ. Bệnh nhân nên tắm đêm hôm trước phẫu thuật, tốt nhất bằng dung dịch chlohexidine gluconate (“Top CDC Recommendations to Prevent Healthcare-Associated Infections”).
TRONG PHÒNG MỔ
Kháng sinh dự phòng: cefazolin, cefoxitin hay cefotetan 2 gr tiêm TM trước phẫu thuật 60 phút. Có thể dùng kháng sinh thay thế ampicillin - subactam 2gr TM hay Clindamycin 900 mg TM hay Vancomycin 2 gTM (American College of Obstetricians and Gynecologists practice bulletin no. 104, 2009).
Bác sĩ phẫu thuật viên: nên khám vùng chậu trước khi phẫu thuật.
Đặt sonde JJ trong các trường hợp có chỉ định (xem bài xử trí ngoại khoa UXCTC)
Chuẩn bị vùng phẫu thuật: (American College of Obstetricians and Gynecologists practice bulletin no. 195, 2018, Pellegrini và cs, 2017) ngăn nhiễm trùng vị trí phẫu thuật bằng chlohexidine gluconate 4% với 70% isopropyl alcohol tốt hơn là povidone-iodine và iodone - alcohol (Darouiche và cs, 2010). Chuẩn bị âm đạo: bằng povidone-iodine nếu dị ứng sẽ dùng chlorhexidine gluconate 4% (Chlor sẽ không hiệu quả khi ra huyết âm đạo).
Ngay trước khi phẫu thuật:
- Thực hiện kiểm tra tên tuổi bệnh nhân trước mổ.
- Đánh dấu vị trí phẫu thuật (phải bảo đảm vẫn còn nhìn thấy sau khi sát trùng và trải săng mổ.
- Time-out ngay trước khi phẫu thuật để xác định đúng bệnh nhân, phương pháp phẫu thuật, vị trí phẫu thuật, dự kiến thời gian và các phương pháp ngăn ngừa biến chứng. (The Joint Commission on Accreditation of Healthcare Organizations protocol for surgical time-out, 2017)
(Time-out = kỹ thuật viên dụng cụ phòng mổ đọc tên, năm sinh, siêu âm, chỉ định mổ, cách mổ cho cả đội phẫu thuật viên, gây mê hồi sức và bệnh nhân cùng nghe).
UXCTC là loại khối u thường gặp nhất, xuất hiện ở 20 - 40% phụ nữ trong độ tuổi sinh sản và ở 5 - 10% phụ nữ hiếm muộn (Cook và cs, 2010). Ảnh hưởng của UXCTC lên khả năng sinh sản luôn là vấn đề được quan tâm nhưng chưa được hiểu biết rõ ràng. UXCTC đơn thuần không phải là nguyên nhân tuyệt đối gây hiếm muộn, nhiều bệnh nhân có UXCTC vẫn có thai mà không cần can thiệp. Tuy nhiên, một số dạng UXCTC có liên quan đến tình trạng hiếm muộn như dưới niêm mạc hay trong cơ tử cung mà có gây biến dạng lòng tử cung làm giảm tỷ lệ thai, tỷ lệ trẻ sinh sống, tăng nguy cơ sẩy thai diễn tiến và sinh non. UXCTC dưới thanh mạc không làm ảnh hưởng tới khả năng sinh sản (Pritts và cs, 2009; Sunkara và cs, 2010).
XỬ TRÍ UXCTC Ở BỆNH NHÂN HIẾM MUỘN
1. Khảo sát toàn diện các yếu tố liên quan đến hiếm muộn trước khi quyết định can thiệp UXCTC.
2. Bệnh nhân có UXCTC có triệu chứng lâm sàng: can thiệp UXCTC nên gần với thời điểm mong muốn có thai (>6-12 tháng) để giảm khả năng tái phát của UXCTC.
3. Siêu âm đánh giá kỹ UXCTC về vị trí, kích thước và số lượng.
4. Quyết định can thiệp tùy theo vị trí, kích thước của UXCTC và xem xét quá trình điều trị hiếm muộn của bệnh nhân
- UXCTC dưới niêm mạc (FIGO L0, L1, L2) gây biến dạng lòng tử cung làm giảm khả năng có thai.
• UXCTC (FIGO L0, L1, L2): nội soi buồng tử cung bóc UXCTC dưới niêm trước khi điều trị hỗ trợ sinh sản.
• UXCTC (FIGO L2), nếu kích thước UXCTC > 3 cm: nội soi ổ bụng để bóc UXCTC.
• Cần tư vấn cho bệnh nhân các nguy cơ liên quan đến tổn thương lòng tử cung, dính lòng tử cung trước tiến hành phẫu thuật. Nguy cơ dính lòng tử cung sau nội soi buồng tử cung khoảng 7,5% (Valle và cs, 1988).
- UXCTC trong cơ tử cung (FIGO L3-5)
• Kích thước UXCTC > 4 cm hay UXCTC < 4 cm nhưng thất bại chuyển phôi nhiều chu kỳ thụ tinh ống nghiệm mặc dù phôi tốt hay kết cục thai kỳ xấu (sẩy thai, sinh non): Bóc UXCTC (nội soi hay mổ mở) (Oliveira và cs, 2004; Kolankaya và cs, 2006).
- UXCTC có kích thước to, vị trí cản trở quá trình chọc hút để điều trị thụ tinh ống nghiệm có thể được xem xét bóc trước khi điều trị. Nếu vị trí không gây cản trở việc chọc hút trứng và bệnh nhân trên 35 tuổi, cân nhắc kích thích buồng trứng, tạo phôi, trữ phôi toàn bộ rồi bóc nhân xơ và chờ 1 năm sau chuyển phôi.
- Các biện pháp điều trị thay thế:
• Áp dụng cho các trường hợp:
o UXCTC (FIGO L3-5) kích thước < 4 cm ở bệnh nhân thất bại nhiều chu kỳ thụ tinh ống nghiệm nhiều chu kỳ và bệnh nhân không muốn mổ bóc UXCTC.
o UXCTC có liên quan kết cục thai kỳ xấu.
o Phẫu thuật UXCTC tiên lượng thành công kém như đa UXCTC, nguy cơ tổn thương lòng tử cung, dính buồng tử cung.
• Điều trị thay thế:
o Nội khoa: Ulispristal Acetate (UPA). UPA là một chất điều hòa thụ thể progesterone có chọn lọc. Trong các nghiên cứu giai đoạn 3 để phát triển UPA, có 21 bệnh nhân đang trong thời gian thử nghiệm, mong con; 15 trong số này đã có thai 18 lần (15/21 = 71%). Trong số đó, 12 người đã sinh 13 cháu, khỏe mạnh, bình thường còn 6 lần có thai kia đã bị sẩy thai (Luyckx và cs, 2014).
Kỹ thuật MRgFUS (kỹ thuật điều trị UXCTC bằng năng lượng sóng siêu âm tần số cao) cũng có thể được áp dụng với các trường hợp có UXCTC nhỏ. Tuy nhiên, các bằng chứng tới hiện tại trong y văn chưa ủng hộ việc sử dụng thường quy MRgFUS trong điều trị UXCTC ở phụ nữ mong muốn duy trì hoặc cải thiện khả năng sinh sản.
KẾT LUẬN
UXCTC đơn thuần không là nguyên nhân tuyệt đối gây hiếm muộn. Một số dạng UXCTC có liên quan đến tình trạng hiếm muộn. Xử trí UXCTC ở bệnh nhân hiếm muộn cần xem xét toàn diện các nguyên nhân gây hiếm muộn và quyết định can thiệp UXCTC dựa vào tuổi bệnh nhân, vị trí, kích thước, số lượng nhân xơ và quá trình điều trị hiếm muộn của bệnh nhân.
MỞ ĐẦU
Tỉ lệ mới mắc UXCTC trong thai kỳ ước tính dao động từ 2,7% ở những thai phụ phát hiện trên siêu âm tam cá nguyệt hai, 12,5% trên những thai phụ điều trị thụ tinh trong ống nghiệm và có thể lên đến 25% ở những thai phụ xin trứng (Lee và cs, 2010).
Tỉ lệ mới mắc của UXCTC tăng theo tuổi nên tỉ lệ thai phụ có UXCTC cũng tăng theo tuổi và tiền sử thai sản. Hiện tại chưa có dữ liệu về tỉ lệ hiện mắc UXCTC trong thai kỳ ở các vùng trên thế giới. Nhưng tỉ lệ đó được nhận thấy là tùy thuộc vào độ tuổi, thời điểm siêu âm và chủng tộc.
ẢNH HƯỞNG CỦA THAI KỲ LÊN UXCTC
UXCTC thường tăng kích thước từ tam cá nguyệt một đến hai, nhưng có xu hướng nhỏ đi đáng kể từ tam cá nguyệt ba đến lúc sinh.
Sự tăng trưởng của UXCTC phụ thuộc vào các hormones steroids. Estrogen là hormone chính trong thai kỳ làm tăng kích thước của UXCTC do UX có nhiều thụ thể nội tiết hơn với estrogen. Tuy nhiên gần đây, có bằng chứng cho thấy sự phát triển của UXCTC cũng có lệ thuộc vào progesterone, trong đó thụ thể PR-B có tác dụng làm tăng kích thước UXCTC, thụ thể PR-A không làm thay đổi kích thước UXCTC. Đa số các nghiên cứu cho thấy UXCTC vẫn không thay đổi kích thước khi có thai (Aharoni và cs, 1988; Lev-Toaff và cs, 1987; Muram và cs, 1980; Neiger và cs, 2006; Rosati và cs, 1992; Strobelt và cs, 1994; Winer- Muram và cs, 1983). Thậm chí, UXCTC có hiện tượng nhỏ đi tự nhiên trên 80% phụ nữ trong 6 tháng đầu hậu sản (Laughlin và cs, 2011). Những nghiên cứu gần đây cũng cho thấy kích thước UXCTC ổn định trong thai kỳ (tăng giảm < 10% thể tích) trong 50 - 60% trường hợp, tăng lên trong 22 - 32% và giảm đi ở 8 - 27% thai phụ (Aharoni và cs, 1988; Lev-Toaff và cs, 1987; Rosati và cs, 1992).
Sự giảm kích thước UXCTC trong thai kỳ có liên quan đến sự thiếu máu nuôi ở lớp nội mạc và cơ tử cung khi gần sinh. Sự thiếu máu nuôi này vẫn tiếp tục hiện diện trong giai đoạn hậu sản, bao gồm cả sự tái cấu trúc của hệ thống mạch máu tử cung (Aharoni và cs, 1988; Ciavattini và cs, 2016; Lev-Toaff và cs, 1987; Rosati và cs, 1992).
ẢNH HƯỞNG CỦA UXCTC LÊN THAI KỲ
Sẩy thai
Trong tam cá nguyệt một, biến chứng thường gặp nhất là sẩy thai, số lượng cũng như vị trí UXCTC là yếu tố tiên lượng trong sẩy thai. Các UXCTC ở vị trí L0, L1, L2 theo phân loại FIGO thì có nguy cơ gây sẩy thai cao hơn so với các vị trí khác. Sự hiện diện nhiều UXCTC trong cơ (L4-5) có thể không gây sẩy thai. Trong tam cá nguyệt hai, hầu hết các nghiên cứu không cho thấy biến cố bất lợi sản khoa nào đáng chú ý (Benson và cs, 2001).
Sinh non
Một trong những nguyên nhân gây ra các kết cục bất lợi cho sơ sinh trên thai phụ có UXCTC chính là sinh non. Một nghiên cứu đoàn hệ hồi cứu cho thấy tỉ lệ sinh non cao hơn ở những thai phụ có UXCTC, đặc biệt là nhóm có UXCTC > 3 cm (19,2% vs 12,7%, p < 0.001) (Lai và cs, 2012). Thời điểm sinh trung bình ở các sản phụ không có UXCTC, có UXCTC ≤ 5 cm và có UXCTC > 5 cm lần lượt là 38,6, 38,4 và 36,5 tuần, khác biệt này có ý nghĩa thống kê (Shavell và cs, 2012). Bên cạnh đó, sản phụ có UXCTC dưới niêm < 3 cm có nguy cơ sinh non tăng thêm 7% (OR 1,5; KTC 95%, 1,3-1,7) (Klatsky và cs, 2008). Ngoài ra, phụ nữ có nhiều UXCTC khi mang thai cũng có nguy cơ sinh non cao hơn.
Ngôi bất thường
Ngôi thai bất thường cũng khá thường gặp trong UXCTC. Những UXCTC to dưới niêm làm biến dạng lòng tử cung hoặc u xơ nằm ở đoạn dưới có mối liên hệ đến tình trạng ngôi bất thường (OR 2,9; KTC 95% 2,6-3,2) (Klatsky và cs, 2008). Một nghiên cứu trên 72000 thai kỳ đơn thai từ năm 1990 đến 2007 cho thấy tỉ lệ thai ngôi mông tăng lên đáng kể ở nhóm thai kỳ có UXCTC (OR 1,5; KTC 95% 1,3-1,9) (Stout và cs, 2010). Một vài nghiên cứu khác cho thấy các yếu tố như đa UXCTC, UXCTC nằm sau bánh nhau hoặc đoạn dưới tử cung, UXCTC to > 10 cm làm tăng tỉ lệ ngôi thai bất thường (Lev-Toaff và cs, 1987; Qidwai và cs, 2006; Rice và cs, 1989; Worthen và Gonzalez, 1984).
Thai chậm tăng trưởng
UXCTC ảnh hưởng rất ít và gần như không ảnh hưởng đến sự tăng trưởng của thai (OR 1,4; KTC 95% 1,1-1,7) (Exacoustòs và Rosati, 1993; Lev-Toaff và cs, 1987; Rice và cs, 1989; Shavell và cs, 2012). Tuy nhiên những UXCTC to với thể tích > 200 ml có thể liên quan đến cân nặng trẻ sơ sinh nhỏ so với tuổi thai (< bách phân vị 10 của tuổi thai lúc sinh) (Rosati và cs, 1992). UXCTC nằm tại vị trí bánh nhau cũng có liên quan đến thai chậm tăng trưởng do làm giảm tuần hoàn tử cung nhau thai.
Ối vỡ non
Đa số nghiên cứu không ghi nhận sự liên quan giữa UXCTC và ối vỡ non.
Nhiều nghiên cứu cho thấy UXCTC làm tăng nguy cơ nhau bong non, đặc biệt là những UXCTC nằm tại vị trí sau bánh nhau.
TRIỆU CHỨNG UXCTC TRONG THAI KỲ
Đa số các UXCTC không có triệu chứng trong thai kỳ. Một số trường hợp có thể gặp triệu chứng đau do UXCTC thoái hóa, đi kèm sốt, buồn nôn, nôn, bạch cầu tăng (Katz và cs, 1989). Tần suất đau có mối liên hệ với kích thước và thường gặp ở những thai phụ có UXCTC > 5 cm (Exacoustòs và Rosati, 1993; Rice và cs, 1989). Đau thường xuất hiện ở cuối tam cá nguyệt một và đầu tam cá nguyệt hai, lúc UXCTC ở kích thước lớn nhất và có nguy cơ hoại tử nhất, Hoại tử vô trùng UXCTC không do thoái hóa trong thai kỳ thường rất đau, điều trị để giữ thai đến đủ tháng rất khó. Đau trên thai phụ có UXCTC còn được lý giải là do sự thuyên tắc một phần các mạch máu nuôi u xơ khi tử cung phát triển to dần trong thai kỳ (Parker, 2007).
ĐIỀU TRỊ VÀ THEO DÕI
Phụ nữ mang thai có UXCTC gây ra triệu chứng đau có thể cần phải nhập viện để được Điều trị phù hợp.
Điều trị hỗ trợ và giảm đau acetaminophen là can thiệp ban đầu. Những thuốc giảm đau opioid với liều chuẩn hoặc giảm đau non-steroids kéo dài trong 48 giờ có thể được dùng nếu như các biện pháp giảm đau khác không hiệu quả. Giảm đau với ibuprofen (indomethacin) chỉ nên được sử dụng đối với những thai nhỏ hơn 32 tuần do nguy cơ có thể làm đóng ống động mạch sớm, làm tăng áp phổi sơ sinh, đa ối, và thậm chí là rối loạn chức năng tiểu cầu cho thai (Dildy và cs, 1992).
Mổ lấy thai (MLT) trên thai phụ có UXCTC chỉ nên thực hiện khi có chỉ định sản khoa (UXCTC tiền đạo) hoặc chỉ định liên quan đến thai (ngôi bất thường, CD ngưng tiến triển, thai suy cấp).
Không nên phẫu thuật bóc UXCTC trong MLT một cách thường quy. Cần đánh giá kỹ nguy cơ - lợi ích cũng như cân nhắc kỹ năng và kinh nghiệm của phẫu thuật viên, lượng máu dự trù, số lượng, vị trí và kích thước của UXCTC.
Không có sự liên quan giữa phẫu thuật bóc UXCTC trong MLT với những kết cục bất lợi lâu dài.
Những UXCTC nằm ở thành trước đoạn dưới tử cung có tiên lượng mổ lấy thai khó hơn u xơ nằm ở các vị trí khác. UXCTC nằm thấp đoạn dưới có khả năng gây bế sản dịch sau mổ dẫn đến biến chứng viêm nội mạc tử cung nếu không được xử trí kịp thời. Do đó có thể cân nhắc bóc nhân xơ khi mổ lấy thai. Hậu sản hay hậu phẫu mổ lấy thai ở những bệnh nhân có UXCTC đoạn dưới, cần đánh giá sản dịch mỗi ngày về lượng, tính chất (màu, mùi) và khám âm đạo, cổ tử cung, đánh giá sinh hiệu để phát hiện kịp thời dấu hiệu bế sản dịch. Nếu có hiện tượng bế sản dịch, cần nong cổ tử cung để xử trí.
Bóc UXCTC ở vị trí thành trước đoạn dưới tử cung, UXCTC có cuống, dưới thanh mạc (L5-6-7) trong cuộc MLT không liên quan đến các yếu tố bất lợi quanh phẫu thuật và được xem là an toàn.
Ở những bệnh nhân đã từng bóc UXCTC đoạn dưới tử cung trong lúc MLT, có thể cho thử sinh ngả âm đạo ở những lần mang thai kế, nhưng phải theo dõi rất sát.
NHỮNG ĐIỀU CẦN GHI NHỚ VỀ XỬ TRÍ U XƠ CƠ TỬ CUNG
UXCTC là khối u vùng chậu lành tính thường gặp nhất ở phụ nữ.
Yếu tố nguy cơ gồm: chủng tộc da đen, tuổi, tình trạng tiền mãn kinh, cao huyết áp, bệnh sử gia đình, thời gian kể từ lần sinh trước dài (hơn 5 năm), phụ gia thực phẩm và sữa đậu nành. Yếu tố giảm nguy cơ gồm hút thuốc lá, chỉ số khối cơ thể thấp, đa sản, dùng thuốc viên ngừa thai hay DMPA.
Bệnh lý UXCTC không được hiểu rõ tuy nhiên nội tiết steroids đóng vai trò then chốt. Trong đó thụ thể progesterone đóng vai trò quyết định trong sự phát triển của UXCTC.
Đa số không có triệu chứng lâm sàng.
Phân loại UXCTC theo FIGO góp phần giải thích triệu chứng mà khối u gây ra cũng như ảnh hưởng đến phương pháp và kết quả điều trị. U xơ dưới niêm mạc thường được phân loại theo STEP-w.
Cần chẩn đoán phân biệt với bệnh tuyến-cơ tử cung (adenomyosis) và sarcoma cơ trơn tử cung (leiomyosarcoma), xuất huyết tử cung bất thường và khối u vùng chậu như u buồng trứng.
Biến chứng thường gặp của UXCTC là xuất huyết tử cung bất thường, thoái hóa, đau và chèn ép. Biến chứng hiếm gặp gồm thuyên tắc mạch, suy thận, xuất huyết trong phúc mạc, huyết khối tĩnh mạch mạc treo ruột và thoái hóa mủ. Thoái hóa ác rất hiếm.
Siêu âm là phương pháp đầu tay giúp chẩn đoán UXCTC và phân biệt với bệnh tuyến-cơ tử cung (adenomyosis). MRI là phương pháp chẩn đoán hình ảnh chính xác nhất cho phát hiện, vị trí và phân loại khối u. CT giá trị thấp do không phân định được u với niêm mạc hay cơ tử cung. Siêu âm bơm nước lòng tử cung được đề nghị cho u xơ dưới niêm mạc. Siêu âm 3 D và nội soi buồng tử cung giá trị giới hạn trong chẩn đoán. Siêu âm màu không giúp phân biệt u lành hay ác.
ĐIỀU TRỊ
Phụ nữ không có triệu chứng: cần theo dõi cẩn thận sự phát triển của u
Nên theo dõi định kỳ mỗi năm trừ trường hợp UXCTC gây thận ứ nước mức độ trung bình hay nặng, hoặc u xơ dưới niêm mạc và muốn có thai.
Phụ nữ mãn kinh: phần lớn sau mãn kinh khối u sẽ thoái triển, tuy nhiên phụ nữ béo phì và dùng nội tiết thay thế u xơ sẽ không nhỏ đi.
Nên loại trừ sarcoma ở phụ nữ mãn kinh khi có u vùng chậu lớn nhanh hay mới xuất hiện. Tần suất sarcoma là 1-2% ở phụ nữ mãn kinh nếu u to nhanh, hay mới xuất hiện, ra huyết âm đạo bất thường hay đau vùng chậu.
Điều trị nội khoa UXCTC
Điều trị giảm chảy máu nhiều và giảm kích thước khối u
Gồm kháng viêm non-steroids, thuốc viên ngừa thai kết hợp, Letrozole, Carbegoline, Progesterone và chất điều hòa chọn lọc thụ thể estrogen: qua các nghiên cứu RCT cho mức độ chứng cứ thấp.
RCT cho thấy LNG-IUS giảm mất máu và giảm kích thước khối u so với thuốc viên ngừa thai kết hợp tuy nhiên mẫu nhỏ (n=58).
Dùng GnRH đồng vận trước phẫu thuật là có hiệu quả hơn so với progesterone uống và LNG-IUS trong cường kinh nặng và giảm kích thước UXCTC. Hầu hết các UXCTC sẽ phát triển trở lại ngay khi ngưng GnRH. Nếu điều trị GnRH kéo dài hơn 6 tháng sẽ gây thiếu hụt estrogen và progesterone.
Chất điều hòa chọn lọc thụ thể progesterone (SPRM): hiệu quả điều trị giảm xuất huyết nặng và giảm kích thước khối UXCTC. So với GnRH, điều trị với SPRM ít tác dụng phụ hơn và cho hiệu quả kéo dài hơn. SPRM gây biến đổi nội mạc tử cung nhưng sẽ hồi phục hoàn toàn sau điều trị.
Điều trị phẫu thuật UXCTC có triệu chứng
Điều trị phẫu thuật UXCTC cần phải được tư vấn đầy đủ và ký cam kết, lựa chọn phương pháp phẫu thuật dựa trên nhu cầu sức khỏe của bệnh nhân. Trong bối cảnh có nhiều tiến bộ trong điều trị nội khoa và mối quan ngại về tăng nguy cơ mãn kinh sớm 2-3 năm trên phụ nữ cắt tử cung chừa 1-2 buồng trứng, chỉ định phẫu thuật cần được cân nhắc thực hiện trên từng đối tượng cụ thể.
Các phẫu thuật gồm bóc nhân xơ cơ tử cung (nội soi, mở bụng) cắt tử cung (nội soi, mở bụng), nội soi buồng tử cung cắt nhân xơ. Lựa chọn loại phẫu thuật tùy thuộc vào: triệu chứng, vị trí kích thước số lượng nhân xơ, tuổi, số con và mong muốn có thai trong tương lai, tùy thuộc vào phẫu thuật viên và trang thiết bị của bệnh viện.
Bóc u xơ cơ tử cung
Ở người muốn bảo tồn tử cung chỉ định bóc UXCTC cho trường hợp u xơ có biến chứng gây chảy máu nặng, đau, chèn ép, vô sinh và sẩy thai tái phát. Phụ nữ nên được tham vấn về nguy cơ cắt tử cung trong lúc phẫu thuật. Khoảng 15% u xơ sẽ tái phát và khoảng 10% u xơ tái phát phải mổ lại cắt tử cung 5- 10 năm sau khi phẫu thuật.
Mở bụng nên thực hiện đối với những u xơ lớn. Có thể mở bụng với đường rạch da nhỏ cho những u xơ lớn hay đa u xơ. Nội soi bóc nhân xơ nên thực hiện ở những khối u xơ dưới thanh mạc hay trong cơ. Có thể kết hợp nội soi bóc nhân xơ và mở bụng nhỏ trong những ca UXCTC lớn và nhiều nhân. Robot trợ giúp nội soi bóc nhân xơ cho đến nay không thấy có lợi so với chỉ nội soi.
Nội soi buồng tử cung là chọn lựa đầu tiên cho bóc nhân xơ trong buồng tử cung.
Bóc nhân xơ qua ngả âm đạo có thể thực hiện ở những nhân xơ nằm ở cùng đồ sau.
Nguy cơ vỡ tử cung ở thai phụ có tiền căn mổ bóc UXCTC. Nguy cơ 0-4% nếu mở bụng 0-10% nếu nội soi bóc u. Tránh đốt nhiều và khâu nhiều lớp khi bóc nhân xơ để giảm nguy cơ vỡ tử cung khi có thai. Hiện nay máy bào không nên sử dụng khi bóc nhân xơ nội soi do nguy cơ làm rơi vãi tế bào ung thư, ổ bụng bệnh nhân không được biết là ung thư tử cung. Nên lấy u trong bao.
Cắt tử cung
Cắt tử cung là điều trị triệt để cho những trường hợp UCTC có biến chứng. Chỉ định: UXCTC không có triệu chứng nhưng to ở phụ nữ mãn kinh không dùng nội tiết thay thế. UXCTC gây xuất huyết mà điều trị nội khoa thất bại, UXCTC có triệu chứng nặng, đủ con, mong muốn được điều trị triệt để.
Điều trị thay thế phẫu thuật
Thuyên tắc động mạch tử cung (Nút mạch tử cung - UAE) có thể cân nhắc thay cho phẫu thuật ở phụ nữ UXCTC có biến chứng nhưng không còn muốn duy trì khả năng sinh sản. Tuy nhiên hiệu quả của phương pháp này không cao.
UAE chống chỉ định ở UXCTC có cuống, dưới niêm mạc, kích thước u quá lớn, có tiền căn thắt động mạch hạ vị và chưa có con. Sau UAE có 14,4% cần phải can thiệp thêm như mổ cắt tử cung, bóc nhân xơ.
Cho đến nay bằng chứng yếu về hiệu quả của siêu âm tần số cao dưới hướng dẫn của MRI trong điều trị UXCTC.
UXCTC dưới niêm
GnRH và SPRM hiệu quả giảm chảy máu ở phụ nữ trong tuổi sinh sản có nhân xơ dưới niêm (bằng chứng mạnh).
Leuprolide và SPRM trước phẫu thuật nội soi cho hiệu quả cải thiện kết cuộc phẫu thuật, nhưng hiện nay chưa có bằng chứng dùng thường quy trước nội soi buồng tử cung cắt nhân xơ dưới niêm mạc.
Nội soi buồng tử cung hiệu quả trong cắt UXCTC dưới niêm, cân nhắc nội soi bụng hay mở bụng trong trường hợp phức tạp UXCTC kích thước > 4cm). Nội soi buồng tử cung cắt nhân xơ sẽ làm tăng tỷ lệ có thai ở phụ nữ vô sinh.
Các phương pháp làm chín muồi cổ tử cung như laminaria, prostaglandin E1 làm giảm thời gian phẫu thuật nội soi buồng tử cung.
Chuẩn bị phẫu thuật
Trước phẫu thuật các GnRH và SPRM làm cải thiện kết cuộc phẫu thuật, chất ức chế aromatase, thảo dược không có bằng chứng có lợi, Danazol có hại (chứng cứ mạnh).
Trong phẫu thuật: tiêm vasopressin giảm chảy máu khi bóc u (bằng chứng mạnh). Bằng chứng yếu khi tiêm bupivacain kết hợp epinephrine, tranexamic acid, dinoprostone, buột quanh cổ tử cung hay quanh cổ tử cung và dây chằng rộng để giảm chảy máu khi bóc nhân xơ. Oxytocine, kẹp động mạch tử cung tạm thời không có hiệu quả giảm mất máu.
Tránh dính: không có hiệu quả.
UXCTC và hiếm muộn
UXCTC ảnh hưởng xấu lên khả năng sinh sản do yếu tố cơ học và sinh học. Nên nội soi buồng tử cung cắt nhân xơ dưới niêm để làm tăng tỷ lệ có thai. Chưa đủ bằng chứng bóc u xơ kích thước lớn trong cơ sẽ tăng tỷ lệ có thai. Nếu bệnh nhân làm thụ tinh trong ống nghiệm thất bại nên cân nhắc bóc UXCTC. UXCTC dưới thanh mạc không ảnh hưởng đến vô sinh. UXCTC dưới niêm và gây biến dạng lòng tử cung gây sẩy thai liên tiếp và thất bại làm tổ nhiều lần nên được phẫu thuật.
UXCTC và thai
Tần suất khoảng 2,7%. Thường to lên trong tam cá nguyệt 1 và 2 của thai kỳ, thoái triển ở tam cá nguyệt 3 hay hậu sản.
UXCTC có thể gây sinh non, ối vỡ non, nhau tiền đạo, nhau bong non, thai chậm phát triển trong tử cung, thai chết, băng huyết sau sinh, ngôi bất thường, chuyển dạ kéo dài.
Không nên bóc nhân xơ thường quy khi mổ lấy thai ở thai phụ có nhân xơ cơ tử cung, cân nhắc giữa lợi ích và nguy cơ, khả năng mất máu, trình độ và kinh nghiệm của phẫu thuật viên, vị trí kích thước của u xơ và lựa chọn của bệnh nhân.
TÓM TẮT HƯỚNG DẪN THỰC HÀNH LÂM SÀNG XỬ TRÍ U XƠ CƠ TỬ CUNG (UXCTC)
- Chủ yếu là u lành tính của tử cung, tỷ lệ thoái hóa ác tính rất thấp (# 0,16 - 0,28%).
- Tiến triển thường chậm, lặng lẽ, qua nhiều năm, không triệu chứng; nếu u to nhanh, nhất là ở tuổi quanh mãn kinh hoặc sau mãn kinh, (khoảng từ 40 đến 60), cần nghĩ ngay đến thoái hóa ác tính.
- U phụ thuộc vào hormones sinh dục, estrogens, progesterone, và testosterone.
- U có thể gây ra nhiều biến chứng nặng, thường gặp nhất do vị trí các khối u, là xuất huyết tử cung bất thường (XHTCBT) và các triệu chứng do chèn ép các cơ quan lân cận. UXCTC có thể có ảnh hưởng đến thai kỳ, hiếm muộn, sẩy thai và sẩy thai liên tiếp.
- FIGO (Hiệp hội Sản Phụ Khoa Quốc tế) đưa ra bảng phân loại mới, năm 2011, đã được đồng thuận sử dụng trên toàn cầu, dựa trên vị trí và số lượng khối u.
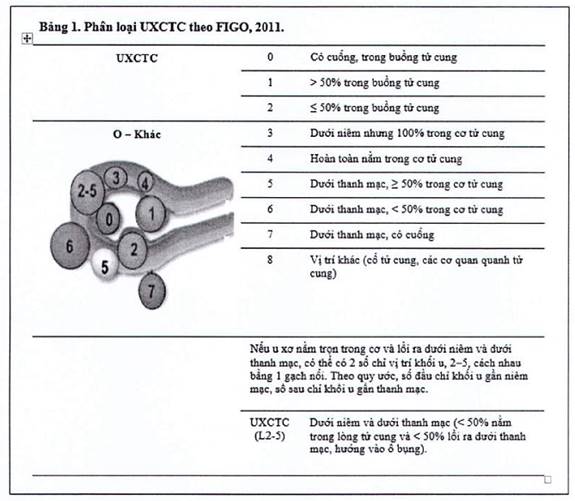
- Chẩn đoán dựa vào triệu chứng lâm sàng và siêu âm đầu dò âm đạo, siêu âm ngả bụng, siêu âm có bơm nước, siêu âm Doppler. Đôi khi, để chẩn đoán phân biệt, cần có cộng hưởng từ (MRI).
- Điều trị:
• Xu hướng hiện nay là giảm bớt chỉ định phẫu thuật cắt tử cung, kể cả bóc nhân xơ vì đã có nhiều loại thuốc giúp điều trị nội khoa rất hiệu quả.
• Nếu u không có triệu chứng: không điều trị mà chỉ cần theo dõi các triệu chứng XHTCBT và triệu chứng chèn ép. Đối với phụ nữ tuổi mãn kinh cần theo dõi tiến triển sang ác tính, nhất là khi u to nhanh. Hướng dẫn bệnh nhân khám phụ khoa định kỳ 6 - 12 tháng một lần, mỗi lần gặp, nên hỏi và đánh giá kỹ các triệu chứng lâm sàng, siêu âm theo dõi sự phát triển của khối u.
• Nếu u có triệu chứng XHTCBT nặng hoặc chèn ép nặng, nhất là ở người đã lớn tuổi, có đủ con, nên cân nhắc chỉ định phẫu thuật sau khi tư vấn kỹ về các thuận lợi và nguy cơ của từng biện pháp điều trị và để bệnh nhân tự lựa chọn, có cam kết bằng văn bản. Nếu có UXCTC loại L0, L1, L2: điều trị nội khoa để chấm dứt xuất huyết, tiến hành nội soi buồng tử cung, cắt các khối u. Nếu bệnh nhân chưa cần có thai ngay, có thể đặt dụng cụ tử cung có chứa progestin (levonorgestrel) để ngăn chặn dính buồng tử cung và tái phát triệu chứng.
• Nếu các triệu chứng không nặng: có thể điều trị nội khoa ngay, kể cả các trường hợp đa nhân xơ hay nhân xơ to, loại L3.
CÁC THUỐC CÓ THỂ SỬ DỤNG TRONG ĐIỀU TRỊ NỘI KHOA UXCTC
1. Tranexamic acid chống ly giải fibrin. Có thể sử dụng:
- Đường uống: viên Transamin 250 mg hoặc 500 mg, 1viên x 3 lần mỗi ngày đến khi ngưng xuất huyết. Liều tối đa: 750 mg- 2000 mg/24giờ.
- Hoặc đường tiêm (ống thuốc có hàm lượng 250 mg hoặc 500 mg/5mL): 250 - 500 mg/ngày tiêm bắp hay tĩnh mạch, dùng 1 - 2 lần/ngày trước khi mổ hoặc nếu xuất huyết trong hay sau phẫu thuật 500 -1000 mg/lần tiêm tĩnh mạch hoặc 500 - 2500 mg pha trong 500 mL dung dịch glucose 5% hay dung dịch có chất điện giải, truyền nhỏ giọt tĩnh mạch 24 giờ.
- Cẩn thận trên bệnh nhân đang Điều trị huyết khối tĩnh mạch, suy thận hay quá mẫn với thuốc.
2. Thuốc viên nội tiết kết hợp tránh thai (TVNTKHTT) có thể sử dụng nhưng hiệu quả thường chậm.
3. Các loại Progestins, uống hay đặt trong dụng cụ tử cung (LNG-IUS - vòng Mirena), hiện nay ít sử dụng vì sợi cơ của UXCTC có nhiều thụ thể progesterone cũng như estrogens nên có thể làm u to lên. Vòng Mirena có thể được sử dụng sau khi điều trị ngưng XHTCBT.
4. GnRH đồng vận ức chế tuyến yên chế tiết FSH và LH sau tiêm khoảng 7 - 10 ngày (do tác dụng flare-up ngay sau tiêm). Do ức chế nội tiết nên giảm các hormones steroids ở buồng trứng, khối UXCTC giảm thể tích, giảm xuất huyết tử cung. Khi ngưng thuốc, khối u to trở lại cùng với các triệu chứng. Liều sử dụng: Zoladex 3,6 mg hoặc Dipherelin 3,75 mg mỗi ống, tiêm dưới da hoặc tiêm bắp, 4 tuần một lần. Có thể tiêm tối đa 6 lần vì các tác dụng phụ gây triệu chứng giống mãn kinh và làm giảm mật độ xương. Có thể sử dụng GnRH đồng vận 3 tháng, ngưng khoảng 2 tuần trước mổ.
5. Thuốc điều hòa thụ thể progesterone có chọn lọc (SPRMs):
- Mifepristone: (sử đụng off-label để điều trị UXCTC), chủ yếu gắn vào thụ thể PR-A nên có thể làm giảm thể tích khối u và tử cung khoảng 50% sau 3 tháng và cũng làm ngưng XHTCBT. Liều sử dụng: có thể 5-10 mg, uống mỗi ngày một viên đến khi ngưng xuất huyết. Mifepristone có thể gây dày NMTC, nhưng không phải là tăng sản hay ung thư. Cần theo dõi độ dày NMTC trong khi uống. Do cơ chế tác dụng là ức chế nội tiết nên khi ngưng sử dụng, có tái phát.
- Ulipristal acetate (UPA): Cơ chế tác dụng là làm tăng chết tế bào theo lập trình (apoptosis) và làm giảm mô nền trong khối u nên ít tái phát sau khi ngưng thuốc. UPA không có tác dụng trên sợi cơ bình thường của khối u, không ức chế trục hạ đồi-tuyến yên-buồng trứng nên không gây triệu chứng mãn kinh như GnRH đồng vận. Uống UPA 5 mg, một viên mỗi ngày có thể làm ngưng XHTCBT trên 91% bệnh nhân và làm ngưng xuất huyết sau 10 ngày điều trị trên 50% bệnh nhân, kích thước khối u giảm 25% sau 13 tuần.
Cách sử dụng UPA:
• Khám và xét nghiệm toàn diện, chú ý chức năng gan trước khi cho sử dụng UPA. Nếu AST và/hoặc ALT tăng gấp 2 lần giá trị cao bình thường, không cho sử dụng.
• Uống UPA 5 mg, mỗi ngày 1 viên x 3 tháng một đợt. Trong khi điều trị, xét nghiệm chức năng gan mỗi tháng một lần, nếu AST và/hoặc ALT tăng gấp 2 lần, ngưng sử dụng. Sau 13 tuần, ngưng sử dụng và xét nghiệm lại chức năng gan khoảng 2 -3 tuần sau.
• Nếu chức năng gan vẫn bình thường, cho uống tiếp đợt 2 sau khi nghỉ thuốc 2 tháng, liều lượng và theo dõi như trên.
• Nếu cần thiết, có thể ho uống đến 4-8 đợt, hai đợt cách nhau 2 tháng.
• Những đợt sau, chỉ xét nghiệm trước và sau mỗi đợt điều trị.
Tác dụng phụ UPA: nhức đầu, đau bụng, căng ngực, làm dày NMTC nhưng không phải tăng sản hay ung thư. Có thể liên quan đến tổn thương gan nhưng chưa đủ chứng cứ, tỷ lệ 8/765000 bệnh nhân đã và đang sử dụng. Sau điều trị, bệnh nhân có thể có thai tự nhiên hay hỗ trợ. UPA có thể giảm chỉ định phẫu thuật cắt tử cung trước điều trị UPA.
Điều trị nội khoa UXCTC bằng UPA là một biện pháp:
• Có thể sử dụng trước phẫu thuật làm nhỏ khối u và tử cung, cải thiện tình trạng thiếu máu.
• Có thể sử dụng lâu dài.
• Có thể thay thế phẫu thuật, nhất là cho phụ nữ sắp mãn kinh hoặc mong muốn có con, đáp ứng nguyện vọng giữ tử cung một cách an toàn cho hầu hết bệnh nhân.
TRỊ NGOẠI KHOA UXCTC
Một số trường hợp có thể vẫn cần chỉ định trị ngoại khoa: phẫu thuật bóc nhân xơ tử cung hoặc cắt tử cung:
1. Bóc nhân xơ tử cung: đối với những phụ nữ
- Có UXCTC có biến chứng nhưng vẫn muốn giữ TC mà điều trị nội khoa không thành công hoặc tiên lượng khó thành công vì u to, nhiều nhân, muốn được điều trị nhanh để mang thai.
- Có UXCTC gây hiếm muộn hoặc sẩy thai liên tiếp, thường là khối u nằm trong buồng TC hoặc dưới niêm mạc TC (L0, L1, L2).
- Bệnh nhân trẻ, có UXCTC gây XHTCBT nặng, thiếu máu và/hoặc làm biến dạng buồng TC, hoặc gây đau vùng chậu không thể chịu đựng thêm.
2. Cắt tử cung và hai ống dẫn trứng: đối với những phụ nữ
- Có UXCTC nghi ngờ thoái hóa ác tính.
- Có quá nhiều nhân xơ, dự kiến còn rất ít hoặc không còn mô lành sau khi bóc hết nhân xơ.
- Trong khi bóc nhân xơ mà không kiểm soát được chảy máu.
- Phụ nữ lớn tuổi đã có đủ con.
- Có bệnh lý kèm theo như lạc NMTC nặng, hoặc có bệnh lý cổ TC.
- Nếu khi mổ cắt TC quá khó vì TC dính nhiều với ruột và các cơ quan lân cận, có thể cắt TC bán phần và 2 ống dẫn trứng.
- Đối với bệnh nhân trên 50 tuổi, cần giải thích, cung cấp thông tin, và thảo luận trước với bệnh nhân về việc nên cắt 2 buồng trứng, khi bệnh nhân và gia đình có quyết định đồng ý hay không đồng ý, nên đề nghị nêu rõ trong tờ cam kết đồng thuận.
Cần tư vấn kỹ:
- Có thể cắt TC qua mổ hở thành bụng hay qua nội soi, đường âm đạo hay ngả bụng.
- Các nguy cơ và tai biến của từng phương pháp.
- Cung cấp thông tin đầy đủ như, cắt TC, dù có để lại 2 buồng trứng, vẫn có thể làm cho phụ nữ mãn kinh sớm 2-3 năm...
- Cắt 2 ống dẫn trứng kèm với cắt TC là để giảm tỷ lệ ung thư buồng trứng.
- Cắt TC làm thay đổi cấu trúc sàn chậu, có thể làm gia tăng tỷ lệ sa tạng chậu sau mổ.
- Nếu bệnh nhân và gia đình không hiểu rõ ảnh hưởng của việc cắt TC, có thể đưa đến rối loạn chức năng tâm lý, giảm libido, ảnh hưởng hạnh phúc gia đình sau này.
3. Chọn phương pháp phẫu thuật để bóc nhân xơ hay cắt TC: có thể bằng mổ bụng hở hay nội soi, ngả bụng hay đường âm đạo, tùy theo các điều kiện có phẫu thuật viên được đào tạo đúng mức và nhiều kinh nghiệm, có trang bị máy nội soi và dụng cụ đầy đủ, cơ sở có khả năng cấp cứu tốt, có đủ cơ số máu và các thành phần của máu. Phải cân nhắc thận trọng trong tư vấn cho bệnh nhân, giải thích và thông tin đầy đủ về thuận lợi cũng như nguy cơ, tai biến có thể có, để bệnh nhân cùng bác sĩ chọn cách xử trí thích hợp nhất.
Tuy bệnh nhân có tham gia vào quyết định chọn phương pháp phẫu thuật, nhưng chúng ta cần nhớ, bác sĩ phẫu thuật viên và gây mê hồi sức vẫn là người chịu trách nhiệm chính khi có tai biến xảy ra.
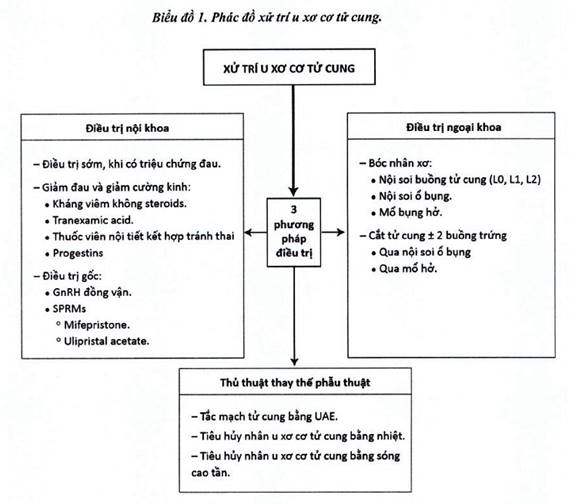
Biểu đồ 2. U xơ cơ tử cung đã chẩn đoán xác định, có siêu âm, có triệu chứng.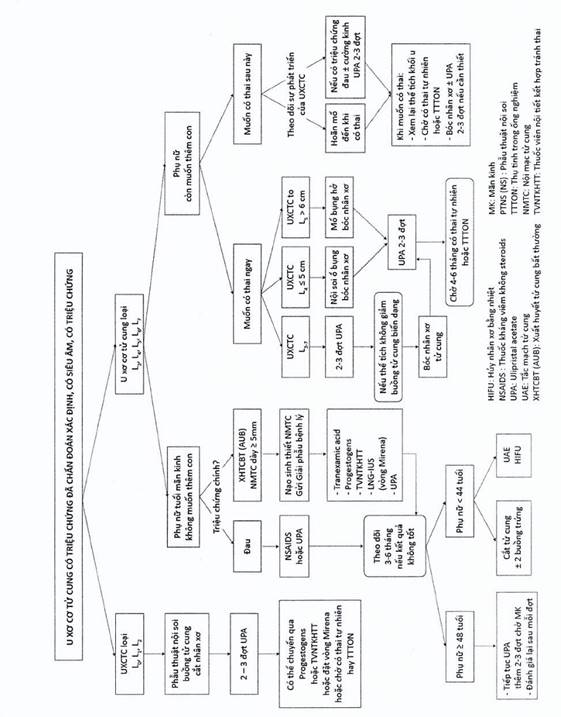
Abdel-Hafeez, M., Elnaggar, A., Ali, M., Ismail, A. M., & Yacoub,M. (2015). Rectal misoprostol for myomectomy: A randomised placebo-controlled study. The Australian & New Zealand Journal of Obstetrics & Gynaecology, 55(4), 363-368. https://doi.org/10.1111/ajo.12359
Aharoni, A., Reiter, A., Golan, D., Paltiely, Y., & Sharf, M. (1988). Patterns of growth of uterine leiomyomas during pregnancy. A prospective longitudinal study. British Journal of Obstetrics and Gynaecology, 95(5), 510-513. https://doi.org/10.1111/j.1471-0528.1988.tb12807.x
Alizadeh, Z., Faramarzi, S., Saidijam, M., Alizamir, T., Esna-Ashari, F., Shabab. N., & Farimani Sanoee, M. (2013). Effect of intramural myomectomy on endometrial HOXA10 and HOXA11 mRNA expression at the time of implantation window. Iranian Journal of Reproductive Medicine. 11(12), 983-988.
American Association of Gynecologic Laparoscopists (AAGL): Advancing Minimally Invasive Gynecology Worldwide. (2012). AAGL practice report: Practice guidelines for the diagnosis and management of submucous leiomyomas. Journal of Minimally Invasive Gynecology, 19(2), 152-171. https://doi.Org/10.1016/j.jmig.2011.09.005
American Association of Gynecologic Laparoscopists (AAGL): Advancing Minimally Invasive Gynecology Worldwide. (2014). AAGL practice report: Morcellation during uterine tissue extraction. Journal of Minimally Invasive Gynecology, 21(4), 517-530. https://doi.org/l0.l0l6/j.jmig.20l4.05.0l0
American College of Obstetricians and Gynecologists (ACOG) Committee opinion no. 557 (2013): Management of acute abnormal uterine bleeding in nonpregnant reproductive-aged women. Obstet Gynecol, 121(4), 891-896. https://doi.org/10.1097/01.AOG.0000428646.67925.9a
American College of Obstetricians and Gynecologists (ACOG) Committee on Practice Bulletins-Gynecology. (2001). ACOG practice bulletin No. 16. Surgical alternatives to hysterectomy in the management of leiomyomas. May 2000 (replaces educational bulletin number 192, May 1994). International Journal of Gynaecology and obstetrics: The Official Organ of the International Federation of Gynaecology and Obstetrics, 73(3), 285-293.
American College of Obstetricians and Gynecologists (ACOG) Committee Opinion No 701. (2017). Obstetrics & Gynecology, 129(6), el55-el59. https://doi.org/10.l097/aog.0000000000002112
American College of Obstetricians and Gynecologists (ACOG) Practice Bulletin No. 96: Alternatives to Hysterectomy in the Management of Leiomyomas. (2008). Obstetrics & Gynecology, 112(2), 387-400. https://doi.org/10.1097/AOG.0b013e318183fbab
American College of Obstetricians and Gynecologists (ACOG) Committee on Practice Bulletins Gynecology. (2009). ACOG practice bulletin No. 104: Antibiotic prophylaxis for gynecologic procedures. Obstetrics and Gynecology, 113(5), 1180-1189. https://doi.org/10.1097/AOG.0b0l3e3181a6d0ll.
American College of Obstetricians and Gynecologists (ACOG) Practice Bulletin No. 128. (2012). Obstetrics & Gynecology, 120(1), 197-206. https://doi.org/10.1097/aog.0b013e318262e320
American College of Obstetricians and Gynecologists (ACOG) Practice Bulletin No. 195: Prevention of Infection After Gynecologic Procedures. (2018). Obstetrics and Gynecology, 131(6), e172-e189. https://doi.org/10.1097/AOG.0000000000002670
ASEAN clincal practise guidelines on managing symptomatic uterine fibroids.
Bagaria, M., Suneja, A., Vaid, N. B., Guleria, K., & Mishra, K. (2009). Low-dose mifepristone in treatment of uterine leiomyoma: A randomised double-blind placebo-controlled clinical trial. Aust N Z J Obstet Gynaecol, 49(1), 77-83. https://doi.org/10.1111/j.1479-828X.2008.00931.x
Ben-Nagi, J., Miell, J., Mavrelos, D., Naftalin, J., Lee, C., & Jurkovic, D. (2010). Endometrial implantation factors in women with submucous uterine fibroids. Reproductive BioMedicine Online, 21(5), 610-615. https://doi.org/10.1016/j.rbmo.2010.06.039
Benson, C. B., Chow, J. S., Chang-Lee, W., Hill, J. A., & Doubilet, P. M. (2001). Outcome of pregnancies in women with uterine leiomyomas identified by sonography in the first trimester. Journal of Clinical Ultrasound: JCU, 29(5), 261-264. https://doi.org/10.1002/jcu.1031
Bhave Chittawar, P., Franik, S., Pouwer, A. W., & Farquhar, C. (2014). Minimally invasive surgical techniques versus open myomectomy for uterine fibroids. The Cochrane Database of Systematic Reviews, (10), CD004638. https://doi.org/10.1002/14651858.CD004638.pub3
Blandon, R. E., Bharucha, A. E., Melton, L. J., Schleck, C. D., Babalola, E.O., Zinsmeister, A. R., & Gebhart, J. B. (2007). Incidence of pelvic floor repair after hysterectomy: A population-based cohort study. American Journal of Obstetrics and Gynecology, 197(6), 664.e1-7. https://doi.org/10.1016/j.ajog.2007.08.064
Borah, B. J., Laughlin-Tommaso, S. K., Myers, E. R., Yao, X., & Stewart, E. A. (2016). Association Between Patient Characteristics and Treatment Procedure Among Patients With Uterine Leiomyomas. Obstetrics a Gynecology, 127(1), 67-77. https://doi.org/10.1097/aog.0000000000001160
Breech LL Rook JA. (2003). Leiomyomata uteri and myomectomy. In Te linde's operative gynecology. In Rock JA, Jones III HW, eds (9th ed.). Philadelphia: PA: JB Lippincott Co.
Bulun, S. E. (2013). Uterine Fibroids. New England Journal of Medicine, 369(14), 1344-1355. https://doi.org/10.1056/nejmra1209993
Burr, P. R., McCall, J. M., Chinn, R. J., Vashisht, A., Smith, J. R., & Healy, J. C. (2000). Uterine Fibroleiomyoma: MR Imaging Appearances before and after Embolization of uterine Arteries. Radiology, 214(3), 729-734. https://doi.org/10.1148/radiology.214.3.r00fe07729
Buttram, V. C., & Reiter, R. C. (1981). Uterine leiomyomata: Etiology, symptomatology, and management. Fertility and Sterility, 36(4), 433-445. https://doi.org/l0.1016/s0015-0282(16)45789-4
Cao, M., Qian, L., Zhang, X., Suo, X., Lu, Q., Zhao, H., ... Suo, S. (2017). Monitoring Leiomyoma Response tp Uterine Artery Embolization Using Diffusion and Perfusion Indices from Diffusion-Weighted Imaging. BioMed Research International, 2017. https://doi.org/10.1155/2017/3805073
Carranza-Mamane, B., Havelock, J., Hemmings, R., Reproductive Endocrinology And Infertility Committee, & Special Contributor. (2015). The management of uterine fibroids in women with otherwise unexplained infertility. Journal of Obstetrics and Gynaecology Canada. 37(3), 277-285. https://doi.org/10.1016/S1701-2163(15)30318-2
Centers for Disease Control and Prevention. “Top CDC Recommendations to Prevent Healthcare-Associated Infections”. Retrieved from https://www.cdc.gov/HAI/pdfs/hai/top-cdc-recs-factsheet.pdf.
Chabbert-Buffet, N., Esber, N., & Bouchard, P. (2014). Fibroid growth and medical options for treatment. Fertil Steril, 102(3), 630-639. https://doi.org/10.1016/j.fertnstert.2014.07.1238
Chiaffarino, F., Parazzini, F., Vecchia, C., Marsico, S., Surace, M., & Ricci, E. (1999). Use of oral contraceptives and uterine fibroids: Results from a case-control study. BJOG: An International Journal of Obstetrics and Gynaecology, 106(8), 857- 860. https://doi.org/10.1111/j.1471-0528.1999.tb08409.x
Ciavattini, A., Delli Carpini, G., Clemente, N., Moriconi, L., Gentili, C., & Di Giuseppe, J. (2016). Growth trend of small uterine fibroids and human chorionic gonadotropin serum levels in early pregnancy: An observational study. Fertility and Sterility, 105(5), 1255-1260. https://doi.org/10.1016/j.fertnstert.2016.01.032
Cook, H., Ezzati, M., Segars, J. H., & McCarthy, K. (2010). The impact of uterine leiomyomas on reproductive outcomes. Minerva Ginecologica, 62(3), 225-236.
Darouiche, R. O., Wall, M. J., Itani, K. M. F., Otterson, M. F., Webb, A. L., Carrick, M. M., ... Berger, D. H. (2010). Chlorhexldine-Alcohol versus Povidone-Iodine for Surgical-Site Antisepsis. New England Journal of Medicine, 362(1), 18-26. https://doi.org/10.1056/NEJMoa0810988
Day Baird, D., Dunson, D. B, Hill, M. C., Cousins, D., & Schectman, J. M. (2003). High cumulative incidence of uterine leiomyoma in black and white women: Ultrasound evidence. American Journal of Obstetrics and Gynecology, 188(1), 100-107. https://doi.org/10.1067/mob.2003.99
De Vivo, A., Mancuso, A., Giacobbe, A., Maggio Savasta, L., De Dominici, R., Dugo, N., ... Vaiarelli, A. (2011). Uterine myomas during pregnancy: A longitudinal sonographic study. Ultrasound in Obstetrics & Gynecology, 37(3), 361-365. https://doi.org/10.1002/uog.8826
DeWaay, D. (2002). Natural history of uterine polyps and leiomyomata. Obstetrics & Gynecology, 100(1), 3-7. https://doi.org/10.1016/s0029-7844(02)02007-0
Dhamangaonkar, P. C., Anuradha, K., & Saxena, A. (2015). Levonorgestrel intrauterine system (Mirena): An emerging tool for conservative treatment of abnormal uterine bleeding. J Midlife Health, 6(1), 26-30. https://doi.org/10.4103/0976-7800.153615
Dildy, G. A., Moise, K. J., Smith, L. G., Kirshon, B., & Carpenter, R. J. (1992). Indomethacin for the treatment of symptomatic leiomyoma uteri during pregnancy. American Journal of Perinatology, 9(3), 185-189. https://doi.org/10.1055/s-2007-999317
Divakar, H. (2008). Asymptomatic uterine fibroids. Best Practice & Research. Clinical Obstetrics & Gynaecology, 22(4), 643-654. https://doi.org/l0.1016/j.bpobgyn.2008.01.007
Donnez, J., Tatarchuk, T. F., Bouchard, P., Puscasiu, L., Zakharenko, N. F., Ivanova,T., ... Group, P. I. S. (2012). Ulipristal acetate versus placebo for fibroid treatment before surgery. N Engl J Med, 366(5), 409-420. https://doi.org/10.1056/NEJMoa1103182
Donnez, Jacques, Arriagada, P., Marciniak, M., & Larrey, D. (2018). Liver safety parameters of ulipristal acetate for the treatment of uterine fibroids: A comprehensive review of the clinical development program. Expert Opinion on Drug Safety, 17(12), 1225-1232. https://doi.org/10.1080/14740338.20l8.l550070
Ewalds-Kvist, S. B. M., Hirvonen, T., Kvist, M., Lertola, K., & Niemelă, P. (2005). Depression, anxiety, hostility and hysterectomy. Journal of Psychosomatic Obstetrics & Gynecology, 26(3), 193-204. https://dol.org/10.1080/01443610400023163
Exacoustòs, C., & Rosati, P. (1993). Ultrasound diagnosis of uterine myomas and complications in pregnancy. Obstetrics and Gynecology, 82(1), 97-101.
Faivre, E., Surroca, M. M., Deffieux, X., Pages, F., Gervaise, A., & Fernandez, H. (2010). Vaginal Myomectomy; Literature Review. Journal of Minimally Invasive Gynecology, 17(2), 154-160. https://doi.org/10.1016/j.jmig.2009.12.007
Fanning, J., & Valea, F. A. (2011). Perioperative bowel management for gynecologic surgery. American Journal of Obstetrics and Gynecology, 205(4), 309-314. https://doi.org/10.1016/j.ajog.2011.05.010
Farris, M., Bastianelli, C., Rosato, E., Brosens, I., & Benagiano, G. (2019). Uterine fibroids: An update on current and emerging medical treatment options. Ther Clin Risk Manag, 15,157-178. https://doi.org/10.2l47/TCRM.S147318
Ferrero, S., Abbamonte, L., Giordano, M., Parisi, M., Ragni, N., & Remorgida, V. (2006). Uterine myomas, dyspareunia, and sexual function. Fertility and Sterility, 86(5), 1504-1510. https://doi.org/10.1016/j.fertnstert.2006.04.025
Fleisher Lee A., Fleischmann Kirsten E., Auerbach Andrew D., Barnason Susan A., Beckman Joshua A., Bozkurt Biykem, ... Wijeysundera Duminda N. (2014). ACC/AHA Guideline on Perioperative Cardiovascular Evaluation and Management of Patients Undergoing Noncardiac Surgery: Executive Summary. Circulation, 130(24), 2215-2245. https://dol.org/10.1161/CIR.0000000000000105
Fletcher, H., Frederick, J., Hardie, M., & Simeon, D. (1996). A randomized comparison of vasopressin and tourniquet as hemostatic agents during myomectomy. Obstetrics and Gynecology, 87(6), 1014-1018.
Fletcher, H. M., Wharfe, G., Williams, N. P., Gordon-Strachan, G., & Johnson, P. (2013). Renal impairment as a complication of uterine fibroids: A retrospective hospital-based study. Journal of Obstetrics and Gynaecology, 33(4), 394-398. https://doi.org/10.3109/01443615.2012.753421
Fletcher, H., Wharfe, G., Williams, N. P., Gordon-Strachan, G., Pedican, M., & Brooks, A. (2009). Venous thromboembolism as a complication of uterine fibroids: A retrospective descriptive study. Journal of Obstetrics and Gynaecology, 29(8), 732-736. https://doi.org/10.3109/01443610903165545
Fraser, I. S., Critchley, H. O. D., Munro, M. G., & Broder, M. (2007). A process designed to lead to international agreement on terminologies and definitions used to describe abnormalities of menstrual bleeding*. Fertility and Sterility, 87(3), 466-476. https://doi.org/10.1016/j.fertnstert.2007.01.023
Ginsburg, E. S., Benson, C. B,, Garfield, J. M., Gleason, R. E., & Friedman, A. J. (1993). The effect of operative technique and uterine site on blood loss during myomectomy: A prospective randomized study. Fertility and sterility, 60(6), 956-962.
Glasser, M. H. (2005). Minilaparotomy myomectomy: A minimally invasive alternative for the large fibroid uterus. Journal of Minimally Invasive Gynecology, 12(3), 275-283, https://doi.org/10.1016/j.jmig.2005.03.009
Goldfarb, H. A. (2008). Myolysis Revisited. JSLS : Journal of the Society of Laparoendoscopic Surgeons, 12(4), 426-430.
Gould, M. K., Garcia, D. A., Wren, S. M., Karanicolas, P, J., Arcelus, J. I., Heit, J. A., & Samama, C. M. (2012). Prevention of VTE in nonorthopedic surgical patients: Antithrombotic Therapy and Prevention of Thrombosis, 9th ed: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines. Chest, 141(2 Suppl), e227S-e277S. https://doi.org/10.1378/chest.11-2297
Gurusamy, K. S., Vaughan, J., Fraser, I. S., Best, L M., & Richards, T. (2016). Medical Therapies for Uterine Fibroidsâ “A Systematic Review and Network Meta-Analysis of Randomised Controlled Trials. PLoS One, 11(2), e0149631. https://doi.org/10.1371/journal.pone.0149631
Milton, S. H., Chelmow, D., Talavera, F., Rivlin, M. E. (2019). Gynecologic Myomectomy: Background, History of the Procedure, Problem. Retrieved from https://emedicine.medscape.com/article/267677-overview
Heavy menstrual bleeding: Assessment and management | Guidance | NICE. (n.d.). Retrieved August 2, 2019, from https://www.nice.org.uk/guidance/ng88
Hilditch, W. G., Asbury. A J., Jack, E., & McGrane, S. (2003). Validation of a pre-anaesthetic screening questionnaire. Anaesthesia, 58(9), 874-877. https://doi.org/10.1046/j.l365-2044.2003.03335.x
Hindley, J., Gedroyc, W. M., Regan, L., Stewart, E., Tempany, C., Hynnen, K., ... Jolesz, F. (2004). MRI Guidance of Focused Ultrasound Therapy of Uterine Fibroids:Early Results. American Journal of Roentgenology, 183(6), 1713-1719. https://doi.org/10.2214/ajr.l83.6.0l831713
Hodge, J. C., & Morton, C. C. (2007). Genetic heterogeneity among uterine leiomyomata: Insights into malignant progression, Human Molecular Genetics, 16(R1), R7-R13. https://doi.org/10.1093/hmg/ddm043
Islam, M. S., Protic, O., Giannubilo, S. R., Toti, P., Tranquilli, A. L., Petraglia, F., ... Ciarmela, P. (2013). Uterine leiomyoma: Available medical treatments and new possible therapeutic options. J Clin Endocrinol Metab, 98(3), 921-934. https://doi.org/10.1210/jc.2012-3237
Kawakam, S., Togashi, K., Konishi, I., Kimura, I., Fukuoka, M., Mori, T., & Konishi, J. (1994). Red Degeneration of Uterine Leiomyoma. Journal of Computer Assisted Tomography, 18(6), 925-928. https://doi.org/10.1097/00004728-199411000-00014
Khan, A. T., Shehmar, M., & Gupta, J. K. (2014). Uterine fibroids: Current perspectives. Int J Womens Health, 6, 95-114. https://doi.org/10.2147/IJWH.S51083
Kido, A., Ascher, S. M., Hahn, W., Kishimoto, K., Kashitani, N., Jha, R. C., ... Spies, J. B. (2014). 3 T MRI uterine peristalsis: Comparison of symptomatic fibroid patients versus controls. Clinical Radiology, 69(5), 468-472. https://doi.org/10-1016/j.crad-2013.12.002
Kiley, J., & Hammond, C. (2007). Combined oral contraceptives: A comprehensive review. Clin Obstet Gynecol, 50(4), 868-877. https://doi.org/10.1097/GRF.0b013e318159c06a
Kitaya, K., & Yasuo, T. (2010). Leukocyte density and composition in human cycling endometrium with uterine fibroids. Human Immunology, 71(2), 158-163. https://doi.org/10.1016/j.humimm.2009.11.014
Klatsky, P. C., Tran, N. D., Caughey, A. B., & Fujimoto, V. Y. (2008). Fibroids and reproductive outcomes: A systematic literature review from conception to delivery. American Journal of Obstetrics and Gynecology, 198(4), 357-366. https://doi.org/10.1016/j.ajog.2007.12.039
Kolankaya, A., & Arici, A. (2006). Myomas and Assisted Reproductive Technologies: When and How to Act? Obstetrics and Gynecology Clinics of North America, 33(1), 145-152. https://doi.org/10.1016/j.ogc.2005.12.008
Kongnyuy, E. J., & Wiysonge, C. S. (2011). Interventions to reduce haemorrhage during myomectomy for fibroids. The Cochrane Database of Systematic Reviews, (11), CD005355. https://doi.org/10.1002/14651858.CD005355.pub4
Kovac, S. R., Barhan, S., Lister, M., Tucker, L., Bishop, M., & Das, A. (2002). Guidelines for the selection of the route of hysterectomy: Application in a resident clinic population. American Journal of Obstetrics and Gynecology, 187(6) 1521-1527. https://doi.org/10.1067/mob.2002.129165
Lai, J., Caughey, A. B., Qidwai, G. I., & Jacoby, A. F. (2012). Neonatal outcomes in women with sonographically identified uterine leiomyomata. The Journal of Maternal-Fetal & Neonatal Medicine: The Official Journal of the European Association of Perinatal Medicine, the Federation of Asia and Oceania Perinatal Societies, the International Society of Perinatal Obstetricians, 25(6), 710-713. https://doi.org/10.3109/14767058.2011.572205
Laughlin. S. K., Baird, D. D., Savitz, D. A., Herring, A. H., & Hartmann, K. E. (2009) Prevalence of Uterine Leiomyomas in the First Trimester of Pregnancy. Obstetrics & Gynecology, 113(3), 630-635. https://doi.org/10-1097/aog.0b013e318197bbaf
Laughlin, S. K., Hartmann, K., & Baird, D. D. (2011). Postpartum factors and natural fibroid regression. American Journal of Obstetrics and Gynecology, 204(6), 496.e1-6. https://doi.org/10.1016/j.ajog.2011.02.018
Laughlin, S. K., Herring, A. H., Savitz, D. A., Olshan, A. F., Fielding, J. R., Hartmann, K. E., & Baird, D. D. (2010). Pregnancy-related fibroid reduction. Fertility and Sterility, 94(6), 2421-2423. https://doi.org/10.1016/j.fertnstert.2010.03.035
Laughlin, S. K., & Stewart, E. A. (2011). Uterine leiomyomas: Individualizing the approach to a heterogeneous condition, Obstetrics and Gynecology, 117(2 Pt 1), 396-403. https://doi.org/10.1097/AOG.0b013e31820780e3
LeBlang, S. D., Hoctor, K., & Steinberg, F. L. (2010). Leiomyoma Shrinkage After MRI-Guided Focused Ultrasound Treatment: Report of 80 Patients. American Journal of Roentgenology, 194(1), 274-280. https://doi.org/l0.2214/ajr.09.2842
Lee, H. J., Norwitz, E. R., & Shaw, J. (2010). Contemporary Management of Fibroids in Pregnancy Reviews in Obstetrics and Gynecology, 3(1), 20-27.
Lefebvre, G., Vilos, G., Allaire, C., Jeffrey, J., Arneja, J., Birch, C., … Clinical Practice Gynaecology Committee, Society for Obstetricians and Gynaecologists of Canada. (2003). The management of uterine leiomyomas. Journal of obstetrics and Gynaecology Canada: JOGC = Journal d'obstetrique et Gynecologie Du Canada: JOGC, 25(5), 396-418; quiz 419-422.
Lethaby, A., Vollenhoven, B., & Sowter, M. (2000). Pre-operative GnRH analogue therapy before hysterectomy or myomectomy for uterine fibroids. Cochrane Database Syst Rev, (2), CD000547 https://doi.org/10.1002/14651858.CD000547
Letterie, G. S., Coddington, C. C., Winkel, C. A., Shawker, T. H., Loriaux, D. L., & Collins, R. L. (1989). Efficacy of a gonadotropin-releasing hormone agonist in the treatment of uterine leiomyomata: Long-term follow-up. Fertil Steril, 51(6), 951-956. (2498132).
Lev-Toaff, A. S., Coleman, B. G., Arger, P. H., Mintz, M. C., Arenson, R. L., & Toaff, M. E. (1987). Leiomyomas in pregnancy. Sonographic study. Radiology, 164(2), 375-380. https://doi.org/10.1148/radiology.164.2.3299488
Levy, G., Dehaene, A., Laurent, N., Lernout, M., Collinet, P., Lucot, J.-P., … Poncelet, E. (2013). An update on adenomyosis. Diagnostic and Interventional Imaging, 94(1), 3-25. https://doi.org/10.1016/j.diii.2012.10.012
Li, T. C., Mortimer, R., & Cooke, I. D. (1999). Myomectomy: A retrospective study to examine reproductive performance before and after surgery. Human Reproduction (Oxford, England), 14(7), 1735-1740. https://doi.org/10.1093/humrep/14.7.1735
Linden, B. (2012). NICE guidance on off-pump coronary artery bypass graftingNational Institute for Health and Clinical Excellence (2011a) Off Pump Coronary Artery Bypass Grafting, (Interventional Procedures Guidance 377]. Www.nice.Org.uk/guidance/IPG377 (accessed 16 December 2011). British Journal of Cardiac Nursing, 7(1), 8-9. https://doi.org/10.l2968/bjca.2012.7.1.8
Ludovisi, M., Moro, F., Pasciuto, T., Di Noi, S., Giunchi, S., Savelli. L., … Testa, A. C. (2019), Imaging of gynecological disease: Clinical and ultrasound characteristics of uterine sarcomas. Ultrasound in Obstetrics & Gynecology: The official Journal of the International Society of Ultrasound in Obstetrics and Gynecology. https://doi.org/10.1002/uog.20270
Lumbiganon, P., Rugpao, S., Phandhu-fung, S., Laopaiboon, M., Vudhikamraksa, N., & Werawatakul, Y. (1996). Protective effect of depot-medroxyprogesterone acetate on surgically treated uterine leiomyomas: A multicentre case-control study. BJOG: An International Journal of obstetrics and Gynaecology, 103(9), 909-914. https://doi.org/10.1111/j.l471-0528.1996. tb09911.x
Lumsden, M. A., & Wallace, E. M. (1998). 2 Clinical presentation of uterine fibroids. Baillière’s Clinical Obstetrics and Gynaecology, 12(2), 177-195. https://doi.org/10.1016/s0950-3552(98)80060-6
Lurie, S., Plper, I., Woliovitch, I., & Glezerman, M. (2005). Age-related prevalence of sonographicaly confirmed uterine myomas. Journal of Obstetrics and Gynaecology, 25(1), 42-44. https://doi.org/10.1080/01443610400024583
Luyckx, M., Squifflet, J.-L., Jadoul, P., Votino, R., Dolmans, M.-M., & Donnez, J. (2014). First series of 18 pregnancies after ulipristal acetate treatment for uterine fibroids. Fertility and sterility, 102(5), 1404-1409. https://doi.org/10.1016/j.fertnstert.2014.07.1253
Machupalli, S., Norkus, E. P., Mukherjee, T, K., & Reilly, K. D. (2013). Abdominal Myomectomy Increases Fertility Outcome. Gynecology & Obstetrics 3(2), 1-4. doi: 10.4172/2161-0932.1000144
Maruo, T., Laoag-Fernandez, J. B., Pakarinen, P., Murakoshi, H., Spitz, I. M., & Johansson, E. (2001). Effects of the levonorgestrel-releasing Intrauterine system on proliferation and apoptosis in the endometrium. Hum Reprod, 16(10), 2103-2108. https://doi.org/10.1093/humrep/16.10.2103
Mas, A., Tarazona, M., Dasi Carrasco, J., Estate, G., Cristóbal, I., & Monleón, J. (2017). Updated approaches for management of uterine fibroids. International Journal of Women’s Health, 9, 607-617. https://doi.org/10.2147/IJWH.S138982
Matsutaki, S., Canis, M., Darcha, C., Pouly, J.-L., & Mage, G. (2009). HOXA-10 expression in the mid-secretory endometrium of infertile patients with either endometriosis, uterine fibromas or unexplained infertility. Human Reproduction, 24(12), 3180-3187. https://doi.org/10.1093/humrep/dep306
Mehine, M., Kaasinen, E., Mãkinen, N., Katainen, R., Kãmpjãrvi, K., Pitkãnen, E., … Aaltonen, L. A. (2013). Characterization of Uterine Leiomyomas by Whole-Genome Sequencing. New England Journal of Medicine, 369(1), 43-53. https://doi.org/10.1056/nejmoa1302736
Memtsa, M., & Homer, H. (2012). Complications Associated with Uterine Artery Embolisation for Fibroids, Obstetrics and Gynecology International, 2012, 1-5. https://doi.org/10.1155/2012/290542
Miura, S., Khan, K. N., Kitajima, M., Hiraki, K., Moriyama, S., Masuzaki, H., … Ishimaru, T. (2006). Differential infiltration of macrophages and prostaglandin production by different uterine leiomyomas. Human Reproduction, 21(10), 2545-2554, https://doi.org/10.l093/humrep/del205
Mollica, G., Pittini, L., Minganti, E., Perri, G., & Pansini, F. (1996). Elective uterine myomectomy in pregnant women. Clinical and Experimental Obstetrics & Gynecology, 23(3), 168-172.
Moore, A. R., Rogers, F. M., Dietrick, D., & Smith, S. (2008). Extrapulmonary Tuberculosis in Pregnancy Masquerading as a Degenerating Leiomyoma. Obstetrics & Gynecology, 111(2, Part 2), 550-552. https://doi.org/10.1097/0l.aog.0000285482.21168.a7
Moorman, P. G., Myers, E. R., Schildkraut, J. M., Iversen, E, S., Wang, F., & Warren, N. (2011). Effect of Hysterectomy With Ovarian Preservation on Ovarian Function. Obstetrics and Gynecology, 118(6), 1271-1279. https://doi.org/10.1097/AOG.0b013e318236fdl2
Munro, M. G., Critchley, H. O. D., Broder, M. S., & Fraser, I. S. (2011), FIGO classification system (PALM-COEIN) for causes of abnormal uterine bleeding in nongravid women of reproductive age. International Journal of Gynecology & Obstetrics, 113(1), 3-13. https://doi.org/10.1016/j.ijgo.2010.11.011
Munro, M. G., Critchley, H. O. D., & Fraser, I. S. (2011). The FIGO classification of causes of abnormal uterine bleeding in the reproductive years. Fertility and Sterility, 95(7), 2204-2208.e3. https://doi.org/10.1016/j.fertnstert.2011.03.079
Muram, D., Gillieson, M., & Walters, J. H. (1980). Myomas of the uterus in pregnancy: Ultrasonographic follow-up. American Journal of Obstetrics and Gynecology, 138(1), 16-19. https://dol.org/10.1016/0002-9378(80)90005-8
Murase, E., Siegelman. E. S., Outwater, E. K., Perez-Jaffe, L. A., & Tureck, R. W. (1999). Uterine Leiomyomas: Histopathologic Features, MR Imaging Findings, Differential Diagnosis, and Treatment. RadioGraphics, 19(5), 1179-1197. https://doi.org/10.1148/radiographics.19.5.g99se131179
Myers, E. R., Barber, M. D., Gustilo-Ashby, T., Couchman, G., Matchar, D. B., & McCrory, D. C. (2002). Management of uterine leiomyomata: What do we really know? Obstetrics and Gynecology, 100(1), 8-17.
Neiger, R., Sonek, J. D., Croom, C. S., & Ventolini, G. (2006). Pregnancy-related changes in the size of uterine leiomyomas. The Journal of Reproductive Medicine, 51(9), 671-674.
Odejinmi, F., Oliver, R., & Mallick, R. (2017). Is ulipristal acetate the new drug of choice for the medical management of uterine fibroids? Res ipsa loquitur? Women’s Health (London, England), 13(3), 98-105. https://doi.org/10.1177/1745505717740218
Oliveira, F. G., Abdelmassih, V. G., Diamond, M. P., Dozortsev, D., Melo, N. R., & Abdelmassih, R. (2004). Impact of subserosal and intramural uterine fibroids that do not distort the endometrial cavity on the outcome of in vitro fertilizalion-intracytoplasmic sperm injection. Fertility and sterility, 81(3), 582-587. https://doi.org/10.1016/j.fertnstert.2003.08.034
O’Neill, F., Carter, E., Pink, N., & Smith, I. (2016). Routine preoperative tests for elective surgery: Summary of updated NICE guidance. BMJ, i3292. https://doi.org/10-1136/bmj.i3292
Palomba, S., Affinito, P., Di Carlo, C., Bifulco, G., & Nappi, C. (1999). Long-term administration of tibolone plus gonadotropin-releasing hormone agonist for the treatment of uterine leiomyomas: Effectiveness and effects on vasomotor symptoms, bone mass, and lipid profiles. Fertil Steril, 72(5), 889-895. (10560995).
Palomba, S., Orio, F., Jr., Morelli, M., Russo, T., Pellicano, M., Nappi, C., ... Zullo, F. (2002). Raloxifene administration in women treated with gonadotropin-releasing hormone agonist for uterine leiomyomas: Effects on bone metabolism. J Clin Endocrinol Metab, 87(10), 4476-4481. https://doi.org/10.1210/jc.2O02-020780
Parker, W. H. (2007). Etiology, symptomatology, and diagnosis of uterine myomas. Fertility and Sterility, 87(4), 725-736. https://doi.org/10.1016/j.fertnstert.2007.01.093
Pavone, D., Clemenza, S., Sorbi, F., Fambrini, M., & Petraglia, F. (2018). Epidemiology and Risk Factors of Uterine Fibroids. Best Practice & Research Clinical Obstetrics & Gynaecology, 46, 3-11. https://doi.org/10.1016/j.bpobgyn.2017.09.004
Payson, M., Leppert, P., & Segars, J. (2006). Epidemiology of myomas. Obstetrics and Gynecology Clinics of North America, 33(1), 1-11. https://doi.org/10.1016/j.ogc.2005.12.004
Peitsidis, P., & Koukoulomati, A. (2014). Tranexamic acid for the management of uterine fibroid tumors: A systematic review of the current evidence. World J Clin Cases, 2(12), 893-898. https://doi.org/10.12998/wjcc.v2.i12.893
Pellegrini, J. E., Toledo, P., Soper, D. E., Bradford, W. C., Cruz, D. A., Levy, B. S., St & Lemieux, L. A. (2017). Consensus Bundle on Prevention of Surgical Site Infections After Major Gynecologic Surgery. Obstetrics & Gynecology, 129(1), 50-61. https://doi.org/10.1097/aog.000000000000175l
Pérez-López, F. R., Ornat, L., Ceausu, I., Depypere, H., Erel, C.T., Lambrinoudaki, I., … EMAS. (2014). EMAS position statement: Management of uterine fibroids. Maturitas, 79(1), 106-116. https://doi.org/10.1016/j.maturitas.20l4.06.002
Philippines Society for reproductive medicine. Clinical Practice Guideline for Uterine Leiomyomas. (2017). Piecak, K., & Milart, P. (2017). Hysteroscopic myomectomy. Menopausal Review, 16(4), 126-128. https://doi.org/10.5114/pm.2017.72757
Podasca, C., Banciu, S., Moga, M. A., Mironescu, A., Dracea, L. L., Ples, L., & Barabas, B. (2016). Preoperative diagnosis of adenomyosis, leiomyoma and intricate situations. https://doi.org/10.18643/gieu.2016.126
Practice Committee of the American Society for Reproductive Medicine (2017). Combined hormonal contraception and the risk of venous thromboembolism: A guideline. Fertility and Sterility, 107(1), 43-51. https://doi.org/10.1016/j.fertnstert.2016.09.027
Pritts, E. A., Parker, W. H., & Olive, D. L. (2009). Fibroids and infertility: An updated systematic review of the evidence. Fertility and Sterility, 91(4), 1215-1223. https://doi.org/10.1016/j.fertnstert.2008.01.051
Puri, K., Famuyide, A. O., Erwin, P. J., Stewart, E. A., & Laughlin-Tommaso, S. K. (2014). Submucosal fibroids and the relation to heavy menstrual bleeding and anemia. American Journal of Obstetrics and Gynecology, 210(1), 38.e1-38.e7. https://doi.org/10.1016/j.ajog.2013.09.038
Qidwai, G. I., Caughey, A. B., & Jacoby, A. F. (2006). Obstetric outcomes in women with sonographically identified uterine leiomyomata. Obstetrics and Gynecology, 107(2 Pt 1), 376-382. https://doi.org/10.1097/01.AOG.0000196806.25897.7c
Qiu, J., Cheng, J., Wang, Q., & Hua, J. (2014). Levonorgestrel-releasing intrauterine system versus medical therapy for menorrhagia: A systematic review and meta-analysis. Med Sci Monit, 20, 1700-1713. https://doi.org/10.12659/MSM.892126
Rackow, B. W., & Taylor, H. S. (2010). Submucosal uterine leiomyomas have a global effect on molecular determinants of endometrial receptivity. Fertility and Sterility, 93(6), 2027-2034. https://doi.org/10.1016/j.fertnstert.2008.03.029
Ren, X.-L., Zhou, X.-D., Zhang, J., He, G.-B., Han, Z.-H., Zheng, M.-J., … Wang, L. (2007). Extracorporeal Ablation of Uterine Fibroids With High-Intensity Focused Ultrasound. Journal of Ultrasound in Medicine, 26(2), 201-212. https://doi.org/10.7863/jum.2007.26.2.201
Rice, J. P., Kay, H. H., & Mahony, B. S. (1989). The clinical significance of uterine leiomyomas in pregnancy. American Journal of Obstetrics and Gynecology, 160(5 Pt 1), 1212-1216. https://doi.org/10.1016/0002-9378(89)90194-4
Richards, P. (1998). The ultrastructure of fibromyomatous myometrium and its relationship to infertility. Human Reproduction Update, 4(5), 520-525. https://doi.org/10.l093/humupd/4.5.520
Robboy, S. J., Bentley, R. C., Butnor, K., & Anderson, M. C. (2000). Pathology and Pathophysiology of Uterine Smooth-Muscle Tumors. Environmental Health Perspectives, 108(s5), 779-784. https://doi.org/10.1289/ehp.00108s5779
Rosati, P., Exacoustòs, C., & Mancuso, S. (1992). Longitudinal evaluation of uterine myoma growth during pregnancy. A sonographic study. Journal of Ultrasound in Medicine: Official Journal of the American Institute of Ultrasound in Medicine, 11(10), 511-515.
Ross, R. K., Pike, M. C., Vessey, M. P., Bull, D., Yeates, D., & Casagrande, J. T. (1986). Risk factors for uterine fibroids: Reduced risk associated with oral contraceptives. Br Med J (Clin Res Ed), 293(6543), 359-362. https://doi.org/10.1136/bmj.293.6543.359
Roy, K. K., Metta, S., Kansal, Y., Kumar, S., Singhal, & Vanamail, P. (2017). A Prospective Randomized Study Comparing Unipolar Versus Bipolar Hysteroscopic Myomectomy in infertile Women. Journal of Human Reproductive Sciences, 10(3), 185-193. https://doi.org/10.4103/jhrs.JHRS_134_16
Ryan, G. L., Syrop, C. H., & Van Voorhis, B. J. (2005). Role, Epidemiology, and Natural History of Benign Uterine Mass Lesions. Clinical Obstetrics and Gynecology, 48(2), 312-324. https://doi.org/10.1097/01.grf.0000159538.27221.8c
Sciarra J, Dilts PV Jr. (1986). Gynecology and obstetrics. Philadelphia: PA: JB Lippincott.
Selo-Ojeme, D., Lawal, O., Shah, J., Mandal, R., Pathak, S., Selo-Ojeme, U., & Samuel, D. (2008). The incidence of uterine leiomyoma and other pelvic ultrasonographic findings in 2,034 consecutive women in a north London hospital. Journal of Obstetrics and Gynaecology, 28(4), 421-423. https://doi.org/10.1080/01443610802l49863
Shavell, V. I., Thakur, M., Sawant, A., Kruger, M. L., Jones, T. B., Singh, M., … Diamond, M. P. (2012). Adverse obstetric outcomes associated with sonographically identified large uterine fibroids. Fertility and Sterility, 97(1), 107-110. https://doi.org/10.1016/j.fertnstert.2011.10.009
Shen, Q., Hua, Y., Jiang, W., Zhang, W., Chen, M., & Zhu, X. (2013). Effects of mifepristone on uterine leiomyoma in premenopausal women: A meta-analysis. Fertil Steril, 100(6), 1722-6 e1-10. https://doi.org/10.1016/j.fertnstert.2013.08.039
Shen, Y., Xu, Q., Xu, J., Ren, M. L., & Cai, Y. L. (2013). Environmental exposure and risk of uterine leiomyoma: An epidemiologic survey. European Review for Medical and Pharmacological Sciences, 17(23), 3249-3256,
Singh, S. S., & Belland, L. (2015). Contemporary management of uterine fibroids: Focus on emerging medical treatments. Curr Med Res Opin, 31(1), 1-12, https://doi.org/10.1185/03007995.2014.982246
Smeets, A. J., Nijenhuis, R. J., van Rooij, W. J., Weimar, E. A. M., Boekkooi, P. F., Lampmann, L. E. H., … Lohle, P. N. M. (2010). Uterine Artery Embolization in Patients with a Large Fibroid Burden: Long-Term Clinical and MR Follow-Up. CardioVascular and Interventional Radiology, 33(5), 943-948. https://doi.org/10.1007/s00270-009-9793-2
Stephenson, J. (2014). FDA Warns Against Procedure Used in Removing Fibroids. JAMA, 311(19), 1956. https://doi.org/10.1001/jama. 2014.5182
Stewart, E. A. (2015). Uterine Fibroids. New England Journal of Medicine, 372(17), 1646-1655. https://doi.org/10.1056/nejmcp1411029
Stewart, E., Cookson, C., Gandolfo, R., & Schulze-Rath, R. (2017). Epidemiology of uterine fibroids: A systematic review. BJOG: An International Journal of Obstetrics & Gynaecology, 124(10), 1501-1512. https://doi.org/10-1111/1471-0528.14640
Stout, M. J., Odibo, A. O., Graseck, A. S., Macones, G. A., Crane, J. P., & Cahill, A. G. (2010). Leiomyomas at routine second-trimester ultrasound examination and adverse obstetric outcomes. Obstetrics and Gynecology, 116(5), 1056-1063. https://doi.org/10.1097/AOG.0b013e3181f7496d
Strobelt, N., Ghidini, A., Cavallone, M., Pensabene, I., Ceruti, P., & Vergani, P. (1994). Natural history of uterine leiomyomas in pregnancy. Journal of Ultrasound in Medicine: Official Journal of the American Institute of Ultrasound in Medicine, 13(5), 399-401.
Styer, A. K., & Rueda, B. R. (2016). The Epidemiology and Genetics of Uterine Leiomyoma. Best Practice & Research Clinical Obstetrics & Gynaecology, 34, 3-12. https://doi.org/10.1016/j.bpobgyn.2015.11.018
Sunkara, S. K., Khairy, M., El-Toukhy, T., Khalaf, Y., & Coomarasamy, A. (2009). The effect of intramural fibroids without uterine cavity involvement on the outcome of IVF treatment: A systematic review and meta-analysis. Human Reproduction, 25(2), 418-429. https://doi.org/10.1093/humrep/dep396
Takeda, T., Sakata, M., Isobe, A., Miyake, A., Nishimoto, F., Ota, Y., ... Kimura, T. (2008). Relationship between Metabolic Syndrome and Uterine Leiomyomas: A Case-Control Study. Gynecologic and Obstetric Investigation, 66(1), 14-17. https://doi.org/10.1159/000114250
Talaulikar, V. S., & Manyonda, I. (2014). Ulipristal acetate for use in moderate to severe symptoms of uterine fibroids. Womens Health (Lond), 10(6), 565-570. https://doi.org/10.2217/whe.14.60
Talaulikar, V. S., & Manyonda, I. T. (2012). Ulipristal acetate: A novel option for the medical management of symptomatic uterine fibroids. Adv Ther, 29(8), 655-663. https://doi.org/10.1007/sl2325-012-0042-8
Tanaka, H., Umekawa, T., Kikukawa, T., Nakamura, M., & Toyoda, N. (2002). Venous thromboembolic diseases associated with uterine myomas diagnosed before hysterectomy: A report of two cases. Journal of Obstetrics and Gynaecology Research, 28(6), 300-303. https://doi.org/10.1046/j.1341-8076.2002.00059.x
Telner, D. E., & Jakubovicz, D. (2007). Approach to diagnosis and management of abnormal uterine bleeding. Can Fam Physician, 53(1), 58-64. (17872610).
Tempany, C. M. C., Stewart, E. A., McDannold, N., Quads, B. J., Jolesz, F. A., & Hynynen, K.(2003). MR Imaging-guided Focused Ultrasound Surgery of Uterine Leiomyomas: A Feasibility Study. Radiology, 226(3), 897-905. https://doi.org/10.1148/radiol.2271020395
Templeman, C., Marshall, S. F., Clarke, C. A., DeLellis Henderson, K., Largent, J., Neuhausen, S., … Bernstein, L. (2009). Risk factors for surgically removed fibroids In a large cohort of teachers. Fertility and Sterility, 92(4), 1436-1446. https://doi.org/10.1016/j.fertnstert.2008.08.074
Terry, K. L., De Vivo, I., Hankinson, S. E., & Missmer, S. A. (2010). Reproductive characteristic and risk of uterine leiomyomata. Fertility and Sterility, 94(7), 2703-2707. https://doi.org/10.1016/j.fertnstert.2010.04.065
The Joint Commission on Accreditation of Healthcare Organizations. Time-outs and their role in improving safety and quality in surgery. (2017, June 1). Retrieved August 4, 2019, from The Bulletin website: http://bulletin.facs.org/2017/06/time-outs-and-their-role-in-improving-safety-and-quality-in-surgery/
The REST Investigators. Uterine-Artery Embolization versus Surgery for Symptomatic Uterine Fibroids. (2007). New England Journal of Medicine, 356(4), 360-370. https://doi.org/10.1056/nejmoa062003
Tocci, A., Greco, E., & Ubaldi, F. M. (2008). Adenomyosis and ‘endometrial- subendometrial myometrium unit disruption disease’ are two different entities. Reproductive BioMedicine Online, 17(2), 281-291. https://doi.org/l0.1016/s1472-6483(10)60207-6
Topsoee, M. F., Bergholt, T., Ravn, P., Schouenborg, L., Moeller, C., Ottesen, B., & Settnes, A. (2016). Anti-hemorrhagic effect of prophylactic tranexamic acid in benign hysterectomy-a double-blinded randomized placebo-controlled trial. American Journal of Obstetrics & Gynecology, 215(1), 72.e1-72.e8. doi: 10.1016/j.ajog.2016.01.184
Tristan, M., Orozco, L. J., Steed, A., Ramirez-Morera, A., & Stone, P. (2012). Mifepristone for uterine fibroids. Cochrane Database Syst Rev, (8), CD007687. https://doi.org/10.1002/14651858.CD007687.pub2
Valle, R. F., & Sciarra, J. J. (1988). Intrauterine adhesions: Hysteroscopic diagnosis, classification, treatment, and reproductive outcome. American Journal of Obstetrics and Gynecology, 158(6), 1459-1470. https://doi.org/10.1016/0002-9373(88)90382-1
Van den Bosch, T., de Bruijn, A. M., de Leeuw, R. A., Dueholm, M., Exacoustos, C, Valentin, L., ... Huirne, J. A. F. (2019). Sonographic classification and reporting system for diagnosing adenomyosis. Ultrasound in Obstetrics & Gynecology, 53(5), 576-582. bttps://doi.org/10.1002/uog.l9096
Vilos, G. A., Allaire, C., Laberge, P. Y., Leyland, N., & Special, C. (2015). The management of uterine leiomyomas. J Obstet Gynaecol Can, 37(2), 157-178. https//doi.org/l0.1016/S1701-2163(15)30338-8
Wamsteker, K., Emanuel, M. H., & de Kruif, J. H, (1993). Transcervical hysteroscopic resection of submucous fibroids for abnormal uterine bleeding: Results regarding the degree of intramural extension. Obstetrics and Gynecology, 82(5), 736-740.
Wang, W., Wang, Y., Wang, T., Wang, J., Wang, L., & Tang, J. (2012). Safety and efficacy of US-guided high-intensity focused ultrasound for treatment of submucosal fibroids. European Radiology, 22(11), 2553-2558. https://doi.org/10.1007/s00330-012-2517-z
Wegienka, G., Baird, D. D., Hertz-Picciotto, Harlow, S. D., Steege, J. F., Hill, M. C.(... Hartmann, K. E. (2003). Self-Reported Heavy Bleeding Associated With Uterine Leiomyomata. Obstetrics & Gynecology, 101(3), 431-437. https://doi.org/10.1097/00006250-200303000-00005
Wellington, K., & Wagstaff, A. J. (2003). Tranexamic acid: A review of its use in the management of menorrhagia. Drugs, 63(13), 1417-1433. https://doi.org/10.2155/00003495-200363130-00008
Winer-Muram, H. T., Muram, D., Gillieson, M. S., Ivey, B. J., & Muggah, H. F. (19S3). Uterine myomas in pregnancy. Canadian Medical Association Journal, 128(8), 949-950.
Wise, L. A. (2004). Reproductive Factors, Hormonal Contraception, and Risk of uterine Leiomyomata in African-American Women; A Prospective study. American Journal of Epidemiology, 159(2), 113-123. https://doi.org/10.1093/aje/kwh0l6
Wise, L. A., & Laughlin-Tommaso, S. K. (2016). Epidemiology of Uterine Fibroids. Clinical Obstetrics and Gynecology, 59(1), 2- 24. https://doi.org/10.1097/grf.0000000000000164
Wong, M., De Wilde, R. L., & Isaacson, K. (2018). Reducing the spread of occult uterine sarcoma at the time of minimally invasive gynecologic surgery. Archives of Gynecology and Obstetrics, 297(2), 285-293. https://doi.org/10.1007/s00404-017-4575-6
Worthen, N. J., & Gonzalez, F. (1984), Septate uterus; Sonographic diagnosis and obstetric complications. Obstetrics and Gynecology, 64(3 Suppl), 34S-3SS.
Yanai, H., Wani, Y., Notohara, K., Takada, S., & Yoshino, T. (2010). Uterine leiomyosarcoma arising in leiomyoma: Clinicopathological study of four cases and literature review. Pathology International, 60(7), 506-509. https://doi.org/10.1111/j.1440-1827.2010.02549.x
Yoshino, O., Nishii, O., Osuga, Y., Asada, H., Okuda, S., Orisaka, M., … Hayashi, T. (2012). Myomectomy Decreases Abnormal Uterine Peristalsis and Increases Pregnancy Rate. Journal of Minimally Invasive Gynecology, 19(1), 63-67. https://doi.org/10.1016/j.jmig.2011.09.010
Zhang, L., Chen, W.-Z., Liu, Y.-J., Hu, X., Zhou, K., Chen, L., … Wang, Z.-B. (2010). Feasibility of magnetic resonance imaging-guided high intensity focused ultrasound therapy for ablating uterine fibroids in patients with bowel lies anterior to uterus. European Journal of Radiology, 73(2), 396-403. https://doi.org/10.1016/j.ejrad.2008.11.002
Zhao, F., Jiao, Y., Guo, Z., Hou, R., & Wang, M. (2011). Evaluation of loop ligation of larger myoma pseudocapsule combined with vasopressin on laparoscopic myomectomy. Fertility and sterility, 95(2), 762-766. https://doi.org/10.1016/j.fertnstert.2010.08.059
BAN THƯ KÝ BIÊN SOẠN
BS CKII. Bùi Đỗ Hiếu
BS CKI. Vương Tú Như
BSCKII. Hồ Cao Cường
BS CKI. Châu Ngọc Minh
BS CKI. Bùi Quang Trung
BS CKI. Lê Văn Khánh
ThS. BS. Hê Thanh Nhã Yến
BS CKI. Triệu Thị Thanh Tuyền
BS CKI. Lê Tiểu My
BS CKI. Vũ Nhật Khang
BS. Hồ Ngọc Anh Vũ
BS. Nguyễn Minh Nhật
BS. Lê Văn Thành
BAN THƯ KÝ HÀNH CHÁNH
Nguyễn Thạch Thảo Nguyên
Vũ Thị Hà
Trần Hữu Yến Ngọc
- 1Thông tư 03/2012/TT-BYT hướng dẫn về thử thuốc trên lâm sàng do Bộ Y tế ban hành
- 2Quyết định 3942/QÐ-BYT năm 2014 tài liệu chuyên môn “Hướng dẫn chẩn đoán và điều trị các bệnh về dị ứng - miễn dịch lâm sàng” do Bộ trưởng Bộ Y tế ban hành
- 3Quyết định 1539/QĐ-BYT năm 2017 về tài liệu chuyên môn “Hướng dẫn thực hành kỹ thuật vi sinh lâm sàng" do Bộ trưởng Bộ Y tế ban hành
- 1Quyết định 2013/QĐ-TTg năm 2011 phê duyệt Chiến lược Dân số và Sức khỏe sinh sản Việt Nam giai đoạn 2011 - 2020 do Thủ tướng Chính phủ ban hành
- 2Thông tư 03/2012/TT-BYT hướng dẫn về thử thuốc trên lâm sàng do Bộ Y tế ban hành
- 3Quyết định 3942/QÐ-BYT năm 2014 tài liệu chuyên môn “Hướng dẫn chẩn đoán và điều trị các bệnh về dị ứng - miễn dịch lâm sàng” do Bộ trưởng Bộ Y tế ban hành
- 4Nghị định 75/2017/NĐ-CP quy định chức năng, nhiệm vụ, quyền hạn và cơ cấu tổ chức của Bộ Y tế
- 5Quyết định 1539/QĐ-BYT năm 2017 về tài liệu chuyên môn “Hướng dẫn thực hành kỹ thuật vi sinh lâm sàng" do Bộ trưởng Bộ Y tế ban hành
Quyết định 3780/QĐ-BYT năm 2019 phê duyệt tài liệu "Hướng dẫn lâm sàng xử trí u xơ cơ tử cung" do Bộ trưởng Bộ Y tế ban hành
- Số hiệu: 3780/QĐ-BYT
- Loại văn bản: Quyết định
- Ngày ban hành: 26/08/2019
- Nơi ban hành: Bộ Y tế
- Người ký: Nguyễn Viết Tiến
- Ngày công báo: Đang cập nhật
- Số công báo: Đang cập nhật
- Ngày hiệu lực: 26/08/2019
- Tình trạng hiệu lực: Kiểm tra