Để sử dụng toàn bộ tiện ích nâng cao của Hệ Thống Pháp Luật vui lòng lựa chọn và đăng ký gói cước.
| BỘ Y TẾ
| CỘNG HÒA XÃ HỘI CHỦ NGHĨA VIỆT NAM |
| Số: 293/QĐ-QLD | Hà Nội, ngày 07 tháng 05 năm 2024 |
CỤC TRƯỞNG CỤC QUẢN LÝ DƯỢC
Căn cứ Nghị định số 95/2022/NĐ-CP ngày 15/11/2022 của Chính phủ quy định chức năng, nhiệm vụ, quyền hạn và cơ cấu tổ chức của Bộ Y tế;
Căn cứ Quyết định số 1969/QĐ-BYT ngày 26/4/2023 của Bộ trưởng Bộ Y tế quy định chức năng, nhiệm vụ, quyền hạn và cơ cấu tổ chức của Cục Quản lý Dược thuộc Bộ Y tế;
Căn cứ Quyết định số 388/QĐ-QLD ngày 29/5/2023 của Cục trưởng Cục Quản lý Dược về việc ban hành Quy định chức năng, nhiệm vụ, quyền hạn của Văn phòng và các phòng thuộc Cục Quản lý Dược;
Căn cứ yêu cầu thực tế công tác quản lý của Cục Quản lý Dược;
Theo đề nghị của Chánh Văn phòng Cục.
QUYẾT ĐỊNH:
Điều 1. Ban hành kèm theo Quyết định này Quy trình thao tác chuẩn trong Hệ thống quản lý chất lượng theo tiêu chuẩn ISO 9001:2015 áp dụng vào hoạt động quản lý nhà nước tại Cục Quản lý Dược, cụ thể:
Quy trình cấp phép nhập khẩu: tá dược, vỏ nang, bao bì tiếp xúc trực tiếp với thuốc, chất chuẩn; dược chất, bán thành phẩm thuốc, bán thành phẩm dược liệu để làm mẫu kiểm nghiệm, nghiên cứu thuốc; dược chất, bán thành phẩm thuốc, bán thành phẩm dược liệu để sản xuất thuốc xuất khẩu (Mã số QT.KD.02.05 thay thế quy trình mã số QT.KD.02.04).
Điều 3. Các Ông/bà: Lãnh đạo Cục, Lãnh đạo Ban QMS, Chánh Văn phòng, Trưởng các phòng thuộc Cục Quản lý Dược chịu trách nhiệm thi hành Quyết định này./.
|
| CỤC TRƯỞNG |
MÃ SỐ: QT.KD.02.05
| Trách nhiệm | Người viết | Người kiểm tra | Người phê duyệt |
| Họ và tên | Đào Thanh Tùng | Phan Công Chiến Trưởng phòng | Vũ Tuấn Cường Cục trưởng |
| Chữ ký |
|
|
|
|
CỤC QUẢN LÝ DƯỢC | QUY TRÌNH CẤP PHÉP NHẬP KHẨU: TÁ DƯỢC, VỎ NANG, BAO BÌ TIẾP XÚC TRỰC TIẾP VỚI THUỐC, CHẤT CHUẨN; DƯỢC CHẤT, BÁN THÀNH PHẨM THUỐC, BÁN THÀNH PHẨM DƯỢC LIỆU ĐỂ LÀM MẪU KIỂM NGHIỆM, NGHIÊN CỨU THUỐC; DƯỢC CHẤT, BÁN THÀNH PHẨM THUỐC, BÁN THÀNH PHẨM DƯỢC LIỆU ĐỂ SẢN XUẤT THUỐC XUẤT KHẨU | Mã số: QT.KD.02.05 Ngày ban hành: 07/5/2024 Lần ban hành: 05 Tổng số trang: 08
|
| 1. Người/bộ phận có liên quan phải nghiên cứu và thực hiện đúng các nội dung của quy định này. 2. Quy trình có hiệu lực kể từ ngày ký ban hành 3. Mỗi đơn vị chỉ được phân phối 01 bản. Khi các đơn vị có nhu cầu phân phối thêm tài liệu phải đề nghị với Ban QMS. File mềm được cung cấp trên mạng nội bộ để chia sẻ thông tin. | ||
NƠI NHẬN (ghi rõ nơi nhận rồi đánh dấu X ở bên cạnh)
| X | Lãnh đạo Cục | X | Phòng Đăng ký thuốc |
| X | Ban QMS | X | Phòng Quản lý chất lượng thuốc |
| X | Văn phòng Cục | X | Phòng Quản lý giá thuốc |
| X | Phòng Pháp chế - Hội nhập | □ | Phòng Quản lý mỹ phẩm |
| X | Phòng Quản lý kinh doanh dược | X | Trung tâm đào tạo và hỗ trợ doanh nghiệp dược & mỹ phẩm |
| X | Văn phòng NRA | □ |
|
BẢNG THEO DÕI TÌNH TRẠNG SỬA ĐỔI
| STT | Ngày sửa đổi | Vị trí sửa đổi | Nội dung sửa đổi | Ghi chú |
|
|
| Mục 3 | Cập nhật các văn bản QPPL mới |
|
|
|
| Mục 7 | Cập nhật các quy định tại Nghị định số 54/2017/NĐ-CP, 155/2018/NĐ-CP |
|
Quy trình này nhằm quy định thống nhất trình tự cấp phép nhập khẩu: Tá dược, vỏ nang, bao bì tiếp xúc trực tiếp với thuốc, chất chuẩn; dược chất, bán thành phẩm thuốc, bán thành phẩm dược liệu để làm mẫu kiểm nghiệm, nghiên cứu thuốc; dược chất, bán thành phẩm thuốc, bán thành phẩm dược liệu để sản xuất thuốc xuất khẩu theo quy định tại Điều 82, Điều 86 và Điều 84 Nghị định số 54/2017/NĐ-CP ngày 08/5/2017 của Chính phủ (sửa đổi bởi Nghị định số 155/2018/NĐ-CP ngày 12/11/2018 của Chính phủ và Nghị định số 88/2023/NĐ-CP ngày 11/12/2023 của Chính phủ).
- Tất cả các đối tượng tham gia trong quá trình tiếp nhận và giải quyết hồ sơ đề nghị cấp phép nhập khẩu: Tá dược, vỏ nang, bao bì tiếp xúc trực tiếp với thuốc, chất chuẩn; Dược chất, bán thành phẩm thuốc, bán thành phẩm dược liệu để làm mẫu kiểm nghiệm, nghiên cứu thuốc; Dược chất, bán thành phẩm thuốc, bán thành phẩm dược liệu để sản xuất thuốc xuất khẩu.
- Hồ sơ đề nghị Cấp phép nhập khẩu: Tá dược, vỏ nang, bao bì tiếp xúc trực tiếp với thuốc, chất chuẩn; dược chất, bán thành phẩm thuốc, bán thành phẩm dược liệu để làm mẫu kiểm nghiệm, nghiên cứu thuốc; dược chất, bán thành phẩm thuốc, bán thành phẩm dược liệu để sản xuất thuốc xuất khẩu theo quy định tại Điều 82, Điều 86 và Điều 84 Nghị định số 54/2017/NĐ-CP ngày 08/5/2017 của Chính phủ (sửa đổi bởi Nghị định số 155/2018/NĐ-CP ngày 12/11/2018 của Chính phủ và Nghị định số 88/2023/NĐ-CP ngày 11/12/2023 của Chính phủ), bao gồm: hồ sơ nhập khẩu nộp lần đầu và hồ sơ bổ sung (cơ sở nhập khẩu nộp bổ sung theo yêu cầu của cơ quan cấp phép).
- Luật Dược số 105/2016/QH13 ngày 06/4/2016.
- Nghị định số 54/2017/NĐ-CP ngày 08/5/2017 của Chính phủ quy định chi tiết một số điều và biện pháp thi hành Luật dược.
- Nghị định số 155/2018/NĐ-CP ngày 12/11/2018 của Chính phủ sửa đổi, bổ sung một số quy định liên quan đến điều kiện đầu tư kinh doanh thuộc phạm vi quản lý nhà nước của Bộ Y tế.
- Nghị định số 88/2023/NĐ-CP ngày 11/12/2023 của Chính phủ sửa đổi, bổ sung một số điều của Nghị định số 54/2017/NĐ-CP ngày 08/5/2017 của Chính phủ quy định chi tiết một số điều và biện pháp thi hành Luật Dược và Nghị định số 155/2018/NĐ-CP ngày 12/11/2018 của Chính phủ sửa đổi, bổ sung một số quy định liên quan đến điều kiện đầu tư kinh doanh thuộc phạm vi quản lý nhà nước của Bộ Y tế.
- Thông tư số 06/2017/TT-BYT ngày 03/5/2017 của Bộ Y tế ban hành Danh mục thuốc độc và nguyên liệu độc làm thuốc.
- Thông tư số 20/2017/TT-BYT ngày 10/5/2017 của Bộ Y tế quy định chi tiết một số điều của Luật dược và Nghị định số 54/2017/NĐ-CP ngày 08/5/2017 của Chính phủ về thuốc và nguyên liệu làm thuốc phải kiểm soát đặc biệt.
- Quyết định 1969/QĐ-BYT ngày 26/04/2023 quy định chức năng, nhiệm vụ, quyền hạn và cơ cấu tổ chức của Cục Quản lý Dược thuộc Bộ Y tế.
- Các văn bản quy phạm pháp luật khác có liên quan.
- Lãnh đạo phòng Quản lý kinh doanh dược có trách nhiệm giám sát để bảo đảm những quy định trong Quy trình này được thực hiện và tuân thủ.
- Lãnh đạo phòng QLKDD, cán bộ liên quan của Phòng QLKDD và Bộ phận một cửa, Bộ phận văn thư của Văn phòng Cục có trách nhiệm thực hiện và tuân thủ những quy định tại Quy trình này.
- Lãnh đạo các phòng, đơn vị có trách nhiệm phối hợp, kiểm tra và bảo đảm những quy định tại Quy trình này được thực hiện và tuân thủ.
- Lãnh đạo Cục có trách nhiệm kiểm tra và bảo đảm những quy định trong quy trình này được thực hiện.
- Phòng Đăng ký thuốc, Phòng Quản lý Chất lượng thuốc, Phòng Quản lý giá thuốc có trách nhiệm chia sẻ dữ liệu cập nhật liên tục để đảm bảo căn cứ pháp lý trong việc giải quyết hồ sơ đề nghị nhập khẩu thuốc theo Quy trình này, liên quan đến các nội dung cụ thể:
+ Cơ sở nhập khẩu, cơ sở sản xuất thuốc, nguyên liệu làm thuốc có/không thuộc trường hợp Cục Quản lý Dược có Quyết định về việc tiếp nhận hồ sơ đề nghị nhập khẩu thuốc, nguyên liệu làm thuốc, ngừng cấp phép nhập khẩu hoặc ngừng nhập khẩu thuốc, nguyên liệu làm thuốc đề nghị nhập khẩu.
+ Nguyên liệu làm thuốc đề nghị nhập khẩu có/không thuộc trường hợp Cục Quản lý Dược có Quyết định về việc thu hồi Giấy đăng ký lưu hành, ngừng lưu hành hay khuyến cáo không dùng/tạm dừng sử dụng.
- QT: Quy trình
- QLKDD : Quản lý kinh doanh Dược
- Cán bộ thụ lý: là chuyên viên hoặc chuyên gia của Phòng QLKDD được phân công xem xét hồ sơ.
- TP: Trưởng phòng Quản lý Kinh doanh Dược.
- LĐC: Lãnh đạo Cục.
- Lãnh đạo Cục: Lãnh đạo Cục được phân công phụ trách.
Quá trình tiếp nhận, xem xét và phê duyệt hồ sơ đề nghị cấp phép nhập khẩu: Tá dược, vỏ nang, bao bì tiếp xúc trực tiếp với thuốc, chất chuẩn; dược chất, bán thành phẩm thuốc, bán thành phẩm dược liệu để làm mẫu kiểm nghiệm, nghiên cứu thuốc; dược chất, bán thành phẩm thuốc, bán thành phẩm dược liệu để sản xuất thuốc xuất khẩu được thực hiện trực tuyến thông qua hệ thống phần mềm dịch vụ công trực tuyến của Cục Quản lý dược đã kết nối hải quan một cửa quốc gia. Trường hợp quy trình thực hiện có thay đổi hoặc gặp sự cố, người thực hiện phải báo cáo tìm cách xử lý, nêu rõ lý do để có được sự đồng ý của người phê duyệt quy trình này trước khi thực hiện.
Địa chỉ Cổng thông tin một cửa quốc gia (khai báo thông tin, tiếp nhận hồ sơ của doanh nghiệp): https://vnsw.gov.vn
Địa chỉ truy cập phần mềm tác nghiệp của cán bộ, công chức Cục Quản lý Dược: https://dichvucong.dav.gov.vn
Mỗi cá nhân tham gia vào quy trình được cấp một tài khoản để thực hiện công việc tác nghiệp và có trách nhiệm giữ gìn mật khẩu để đảm bảo tính bảo mật của hệ thống. Văn phòng Cục là đầu mối quản lý việc cấp tài khoản công tác.
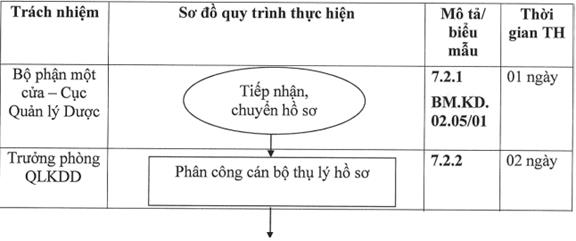
7.2.1. Tiếp nhận hồ sơ:
Thời gian tối đa để thực hiện bước này là 01 ngày.
Cán bộ Bộ phận Một cửa - Cục Quản lý Dược đăng nhập vào tài khoản văn thư, kiểm tra tính đầy đủ của hồ sơ chuyển đến từ cổng thông tin một cửa quốc gia theo Biểu mẫu BM.KD.02.05/01, tiếp nhận và chuyển hồ sơ vào tài khoản tác nghiệp của Trưởng phòng Quản lý kinh doanh dược.
7.2.2. Lãnh đạo Phòng phân công đơn hàng đến cán bộ thụ lý:
Thời gian tối đa để thực hiện bước này là 02 ngày.
Trưởng phòng QLKDD (hoặc người được ủy quyền) phân công hồ sơ đến cán bộ thụ lý.
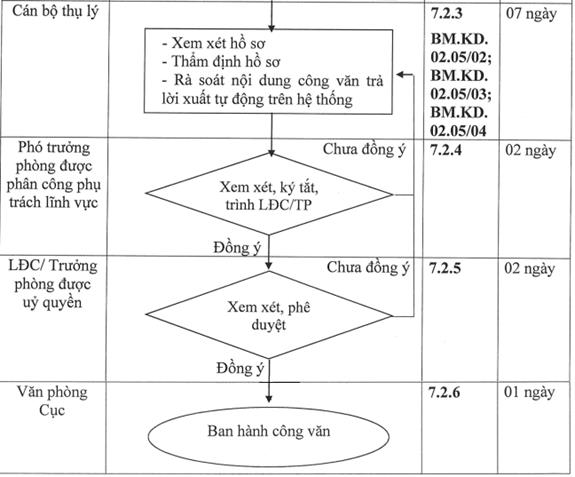
7.2.3. Cán bộ thụ lý xem xét, thẩm định hồ sơ
Thời gian tối đa để thực hiện bước này là 07 ngày.
Cán bộ thụ lý thực hiện rà soát hồ sơ để ghi ý kiến đánh giá tại Tóm tắt đơn hàng nhập khẩu theo một trong các Biểu mẫu: Biểu mẫu BM.KD.02.05/02, Biểu mẫu BM.KD.02.05/03, Biểu mẫu BM.KD.02.05/04.
Sau đó, Cán bộ thụ lý dự thảo công văn trả lời theo một trong các Biểu mẫu BM.KD.02.05/05, Biểu mẫu BM.KD.02.05/06, Biểu mẫu BM.KD.02.05/07, Biểu mẫu BM.KD.02.05/08, Biểu mẫu BM.KD.02.05/09 tương ứng và phải phù hợp với ý kiến đánh giá tại Biên bản thẩm định.
(Đối với các tài liệu không bắt buộc phải có trong hồ sơ theo quy định tại Nghị định 54/2017/NĐ-CP, Nghị định số 155/2018/NĐ-CP, Nghị định số 88/2023/NĐ-CP và không liên quan đến các nội dung giải trình của cơ sở về số lượng thuốc đề nghị nhập khẩu nhưng cơ sở nhập khẩu có nộp kèm trong hồ sơ thì không cần xem xét).
Cuối cùng, cán bộ thụ lý ấn vào nút “Chuyển hồ sơ” để trình LĐP và chuyển sang bước 7.2.4.
7.2.4. Phó Trưởng phòng được phân công phụ trách lĩnh vực xem xét, duyệt hồ sơ
Thời gian tối đa để thực hiện bước này là 02 ngày.
Trên cơ sở kết quả thẩm định của cán bộ thụ lý, Phó Trưởng phòng được phân công phụ trách lĩnh vực di chuyển vào mục “Duyệt hồ sơ” để xem xét, cho ý kiến:
Nếu nhất trí với ý kiến của các cán bộ thụ lý thì lựa chọn “Trình Lãnh đạo Cục/ Trưởng phòng trong trường hợp được ủy quyền” và ấn vào nút “Chuyển hồ sơ” để trình hồ sơ.
Nếu chưa nhất trí với ý kiến của các cán bộ thụ lý hoặc cần làm rõ thêm bất kỳ nội dung nào thì lựa chọn “Chuyển lại cán bộ thụ lý” đồng thời ghi rõ nội dung cần làm rõ, giải trình vào ô “Ý kiến của Lãnh đạo phòng” và ấn vào nút “Chuyển hồ sơ” để yêu cầu cán bộ thụ lý xem xét lại. Trong trường hợp này quy trình quay trở lại bước 7.2.3.
7.2.5. Lãnh đạo Cục/ Trưởng phòng trong trường hợp được ủy quyền xem xét, phê duyệt:
Thời gian tối đa để thực hiện bước này là 02 ngày.
Lãnh đạo Cục/ Trưởng phòng trong trường hợp được ủy quyền xem xét biên bản:
Trường hợp Lãnh đạo Cục/ Trưởng phòng trong trường hợp được ủy quyền đồng ý với ý kiến đề xuất của Phó Trưởng phòng tại biên bản: Lãnh đạo Cục/ Trưởng phòng trong trường hợp được ủy quyền thực hiện ký điện tử trên Công văn, Đơn hàng, lựa chọn “Chuyển Văn thư Cục” và ấn vào nút “Chuyền hồ sơ” để chuyển tới bộ phận Văn thư Cục.
Trường hợp Lãnh đạo Cục/ Trưởng phòng trong trường hợp được ủy quyền không đồng ý với ý kiến đề xuất của Phó Trưởng phòng được phân công phụ trách lĩnh vực tại biên bản hoặc yêu cầu giải trình thêm thì lựa chọn “Trả lại” đồng thời ghi ý kiến chỉ đạo vào ô “Ý kiến của Lãnh đạo Cục” và ấn vào nút “Chuyển hồ sơ” để quay lại bước 7.2.4.
7.2.6. Ban hành công văn:
Thời gian tối đa cho thực hiện bước này là 01 ngày.
Văn phòng Cục nhận công văn, đơn hàng điện tử (đã ký), thực hiện thao tác đóng dấu điện tử và ấn vào nút “Trả hồ sơ” để chuyển cho doanh nghiệp.
Trong trường hợp Cục Quản lý Dược có công văn trả lời yêu cầu cơ sở bổ sung hồ sơ: Khi nhận hồ sơ bổ sung, quy trình được thực hiện lại như mục từ 7.2.1 đến 7.2.6.
Thời hạn bổ sung hồ sơ: trong vòng 06 tháng kể từ ngày có công văn thông báo.
Sau 12 tháng kể từ ngày nộp hồ sơ lần đầu mà hồ sơ bổ sung không đáp ứng yêu cầu thì thông báo cho Doanh nghiệp hồ sơ đã nộp không còn giá trị.
Hồ sơ sau khi hoàn thành được lưu trữ trong hệ thống phần mềm dịch vụ công trực tuyến của Cục Quản lý Dược.
10. BIỂU MẪU:
- BM.KD.02.05/01: Danh mục thành phần hồ sơ.
- BM.KD.02.05/02: Tóm tắt đơn hàng nhập khẩu dược chất, bán thành phẩm thuốc, bán thành phẩm dược liệu để làm mẫu kiểm nghiệm, nghiên cứu thuốc theo Điều 82 Nghị định 54/2017/NĐ-CP.
- BM.KD.02.05/03: Tóm tắt đơn hàng nhập khẩu tá dược, vỏ nang, bao bì tiếp xúc trực tiếp với thuốc, chất chuẩn theo Điều 86 Nghị định 54/2017/NĐ-CP.
- BM.KD.02.05/03: Tóm tắt đơn hàng nhập khẩu dược chất, bán thành phẩm thuốc, dược liệu, bán thành phẩm dược liệu để sản xuất thuốc xuất khẩu theo Điều 84 Nghị định 54/2017/NĐ-CP.
- BM.KD.02.05/05: Mẫu công văn không đồng ý.
- BM.KD.02.05/06: Mẫu công văn đồng ý cấp phép nhập khẩu dược chất, bán thành phẩm thuốc, bán thành phẩm dược liệu để làm mẫu kiểm nghiệm, nghiên cứu thuốc theo Điều 82 Nghị định 54/2017/NĐ-CP.
- BM.KD.02.05/07: Mẫu công văn đồng ý cấp phép nhập khẩu bao bì tiếp xúc trực tiếp với thuốc/ chất chuẩn theo Điều 86 Nghị định 54/2017/NĐ-CP.
- BM.KD.02.05/08: Mẫu công văn đồng ý cấp phép nhập khẩu tá dược/ vỏ nang theo Điều 86 Nghị định 54/2017/NĐ-CP.
- BM.KD.02.05/09: Mẫu công văn đồng ý cấp phép nhập khẩu dược chất, bán thành phẩm thuốc, bán thành phẩm dược liệu để sản xuất thuốc xuất khẩu theo Điều 84 Nghị định 54/2017/NĐ-CP.
| STT | Thành phần hồ sơ |
| 1 | 01 Đơn hàng: - Mẫu số 36 Phụ lục III Nghị định 155/2018/NĐ-CP: Dược chất/ bán thành phẩm thuốc. - Mẫu số 41 Phụ lục III Nghị định 155/2018/NĐ-CP: Bán thành phẩm dược liệu. - Mẫu số 43 Phụ lục III Nghị định 155/2018/NĐ-CP: Tá dược/ vỏ nang/ bao bì tiếp xúc trực tiếp với thuốc/ chất chuẩn. |
| 2 | Văn bản giải trình của cơ sở đề nghị nhập khẩu (Áp với hồ sơ Điều 82 Nghị định 54/2017/NĐ-CP) |
Mã Hồ sơ: Số đơn hàng:
Ngày tiếp nhận: Ngày đơn hàng:
Cơ sở nhập khẩu:
| STT | Tên dược chất, bán thành phẩm thuốc, bán thành phẩm dược liệu | Công ty nhập khẩu đáp ứng điều kiện kinh doanh | Sử dụng trong kiểm nghiệm, nghiên cứu tại các cơ sở sản xuất hoặc cơ sở kiểm nghiệm, nghiên cứu | Đề xuất (số lượng) | ||||
| Văn bản giải trình mục đích và số lượng sử dụng dược chất, bán thành phẩm thuốc, bán thành phẩm dược liệu | Đề xuất cấp | Không đề xuất | Lý do | |||||
| Đạt | Không đạt | Đạt | Không đạt |
|
|
| ||
|
|
|
|
|
|
|
|
|
|
| ...., ngày tháng năm | ...., ngày tháng năm |
TÓM TẮT ĐƠN HÀNG NHẬP KHẨU TÁ DƯỢC/VỎ NANG/BAO BÌ TIẾP XÚC TRỰC TIẾP VỚI THUỐC/ CHẤT CHUẨN
Mã hồ sơ: Số đơn hàng:
Ngày tiếp nhận: Ngày đơn hàng:
Cơ sở nhập khẩu:
| STT | Tên tá dược, vỏ nang, bao bì tiếp xúc trực tiếp với thuốc, chất chuẩn | Tiêu chuẩn chất lượng/phương pháp kiểm nghiệm | Công ty nhập khẩu đáp ứng điều kiện kinh doanh | Đề xuất | |||
| Đạt | Không đạt | Đề xuất cấp | Không đề xuất | Lý do | |||
|
|
|
|
|
|
|
|
|
| ...., ngày tháng năm | ...., ngày tháng năm |
TÓM TẮT ĐƠN HÀNG NHẬP KHẨU DƯỢC CHẤT/BÁN THÀNH PHẨM THUỐC/ BÁN THÀNH PHẨM DƯỢC LIỆU
Mã HS: ………………… Số ĐH:....
Ngày tiếp nhận: …………………. Ngày ĐH:…………….
Công ty nhập khẩu: ……………........
| STT | Tên dược chất | Công ty nhập khẩu đáp ứng điều kiện kinh doanh | Tiêu chuẩn chất lượng/Phương pháp kiểm nghiệm | Văn bản giải trình cụ thể về KHSD đối với NL đề nghị NK | Đề xuất (Số lượng) | |||||
|
|
| Đạt | Không đạt | Đạt | Không đạt | Đạt | Không đạt | Đề xuất cấp | Không đề xuất | Lý do |
|
|
|
|
|
|
|
|
|
|
|
|
| Hà Nội, ngày tháng năm | Hà Nội, ngày tháng năm |
| BỘ Y TẾ | CỘNG HÒA XÃ HỘI CHỦ NGHĨA VIỆT NAM |
| Số: /QLD-KD | Hà Nội, ngày tháng năm |
Kính gửi: Công ty ...
(Địa chỉ: ...)
Cục Quản lý Dược - Bộ Y tế nhận được Đơn hàng nhập khẩu số ……… đề ngày ……. của Cơ sở về việc nhập khẩu ....
Căn cứ Nghị định số 54/2017/NĐ-CP ngày 08/05/2017 của Chính phủ quy định chi tiết một số điều và biện pháp thi hành Luật dược,
Căn cứ theo Nghị định số 155/2018/NĐ-CP ngày 12/11/2018 của Chính phủ sửa đổi, bổ sung một số quy định liên quan đến điều kiện đầu tư kinh doanh thuộc phạm vi quản lý nhà nước của Bộ Y tế,
Căn cứ Nghị định số 88/2023/NĐ-CP ngày 11/12/2023 của Chính phủ sửa đổi, bổ sung một số điều của Nghị định số 54/2017/NĐ-CP ngày 08/5/2017 của Chính phủ quy định chi tiết một số điều và biện pháp thi hành Luật Dược và Nghị định số 155/2018/NĐ-CP ngày 12/11/2018 của Chính phủ sửa đổi, bổ sung một số quy định liên quan đến điều kiện đầu tư kinh doanh thuộc phạm vi quản lý nhà nước của Bộ Y tế,
Cục Quản lý Dược - Bộ Y tế có ý kiến như sau:
Chưa đồng ý/Không đồng ý Đơn hàng nhập khẩu số ……. đề ngày ………… của Cơ sở.
Lý do:
Đề nghị Cơ sở sửa đổi, bổ sung hồ sơ theo quy định[1].
Cục Quản lý Dược - Bộ Y tế thông báo để Cơ sở biết và thực hiện theo quy định./
|
| LÃNH ĐẠO CỤC |
| BỘ Y TẾ | CỘNG HÒA XÃ HỘI CHỦ NGHĨA VIỆT NAM |
| Số: /QLD-KD | Hà Nội, ngày tháng năm |
Kính gửi:
Địa chỉ: ……............…………………………………..
Cục Quản lý Dược nhận được Đơn hàng nhập khẩu số ………… đề ngày …………. của Cơ sở về việc nhập khẩu nguyên liệu là dược chất/ bán thành phẩm thuốc/ bán thành phẩm dược liệu để làm mẫu kiểm nghiệm, nghiên cứu thuốc.
Căn cứ Nghị định số 54/2017/NĐ-CP ngày 08/05/2017 của Chính phủ quy định chi tiết một số điều và biện pháp thi hành Luật dược,
Căn cứ Nghị định số 155/2018/NĐ-CP ngày 12/11/2018 của Chính phủ sửa đổi, bổ sung một số quy định liên quan đến điều kiện đầu tư kinh doanh thuộc phạm vi quản lý nhà nước của Bộ Y tế,
Căn cứ Nghị định số 88/2023/NĐ-CP ngày 11/12/2023 của Chính phủ sửa đổi, bổ sung một số điều của Nghị định số 54/2017/NĐ-CP ngày 08/5/2017 của Chính phủ quy định chi tiết một số điều và biện pháp thi hành Luật Dược và Nghị định số 155/2018/NĐ-CP ngày 12/11/2018 của Chính phủ sửa đổi, bổ sung một số quy định liên quan đến điều kiện đầu tư kinh doanh thuộc phạm vi quản lý nhà nước của Bộ Y tế,
Cục Quản lý Dược có ý kiến như sau:
Đồng ý đề cơ sở nhập khẩu 01 khoản tại Đơn hàng nhập khẩu số ………… đề ngày …………. của Cơ sở. Đơn hàng nhập khẩu gồm các trang, 01 khoản có đóng dấu xác nhận của Cục Quản lý Dược.
Cơ sở phải thực hiện theo đúng các quy định hiện hành về xuất nhập khẩu thuốc và các quy định về dược có liên quan.
Cơ sở chỉ được sử dụng số nguyên liệu làm thuốc nhập khẩu trên để kiểm nghiệm, nghiên cứu, không sử dụng vào mục đích khác, không được lưu thông trên thị trường.
Đơn hàng có giá trị 02 năm kể từ ngày ban hành công văn này.
Cục Quản lý Dược thông báo để Cơ sở biết và thực hiện./.
|
| CỤC TRƯỞNG |
| BỘ Y TẾ | CỘNG HÒA XÃ HỘI CHỦ NGHĨA VIỆT NAM |
| Số: /QLD-KD | Hà Nội, ngày tháng năm 2019 |
Kính gửi:
Địa chỉ: ………………………….
Cục Quản lý Dược nhận được Đơn hàng nhập khẩu số ………… đề ngày ………. của Cơ sở về việc nhập bao bì tiếp xúc trực tiếp với thuốc/ chất chuẩn.
Căn cứ Nghị định số 54/2017/NĐ-CP ngày 08/05/2017 của Chính phủ quy định chi tiết một số điều và biện pháp thi hành Luật dược,
Căn cứ Nghị định số 155/2018/NĐ-CP ngày 12/11/2018 của Chính phủ sửa đổi, bổ sung một số quy định liên quan đến điều kiện đầu tư kinh doanh thuộc phạm vi quản lý nhà nước của Bộ Y tế,
Căn cứ Nghị định số 88/2023/NĐ-CP ngày 11/12/2023 của Chính phủ sửa đổi, bổ sung một số điều của Nghị định số 54/2017/NĐ-CP ngày 08/5/2017 của Chính phủ quy định chi tiết một số điều và biện pháp thi hành Luật Dược và Nghị định số 155/2018/NĐ-CP ngày 12/11/2018 của Chính phủ sửa đổi, bổ sung một số quy định liên quan đến điều kiện đầu tư kinh doanh thuộc phạm vi quản lý nhà nước của Bộ Y tế,
Cục Quản lý Dược có ý kiến như sau:
Đồng ý đề cơ sở nhập khẩu 01 khoản tại Đơn hàng nhập khẩu số ……… đề ngày ……… của Cơ sở. Đơn hàng nhập khẩu gồm các trang, 01 khoản có đóng dấu xác nhận của Cục Quản lý Dược.
Cơ sở phải thực hiện theo đúng các quy định hiện hành về xuất nhập khẩu thuốc và các quy định về dược có liên quan.
Đơn hàng có giá trị 02 năm kể từ ngày ban hành công văn này.
Cục Quản lý Dược thông báo để Cơ sở biết và thực hiện./.
|
| CỤC TRƯỞNG |
| BỘ Y TẾ | CỘNG HÒA XÃ HỘI CHỦ NGHĨA VIỆT NAM |
| Số: /QLD-KD | Hà Nội, ngày tháng năm |
Kính gửi:
Địa chỉ: …………………………….
Cục Quản lý Dược nhận được Đơn hàng nhập khẩu số ………….đề ngày …………của Cơ sở về việc nhập khẩu tá dược/ vỏ nang để kiểm nghiệm, nghiên cứu/ sản xuất thuốc xuất khẩu.
Căn cứ Nghị định số 54/2017/NĐ-CP ngày 08/05/2017 của Chính phủ quy định chi tiết một số điều và biện pháp thi hành Luật dược,
Căn cứ Nghị định số 155/2018/NĐ-CP ngày 12/11/2018 của Chính phủ sửa đổi, bổ sung một số quy định liên quan đến điều kiện đầu tư kinh doanh thuộc phạm vi quản lý nhà nước của Bộ Y tế,
Căn cứ Nghị định số 88/2023/NĐ-CP ngày 11/12/2023 của Chính phủ sửa đổi, bổ sung một số điều của Nghị định số 54/2017/NĐ-CP ngày 08/5/2017 của Chính phủ quy định chi tiết một số điều và biện pháp thi hành Luật Dược và Nghị định số 155/2018/NĐ-CP ngày 12/11/2018 của Chính phủ sửa đổi, bổ sung một số quy định liên quan đến điều kiện đầu tư kinh doanh thuộc phạm vi quản lý nhà nước của Bộ Y tế,
Cục Quản lý Dược có ý kiến như sau:
Đồng ý đề cơ sở nhập khẩu 01 khoản tại Đơn hàng nhập khẩu số ……….đề ngày ……….. của Cơ sở. Đơn hàng nhập khẩu gồm các trang, 01 khoản có đóng dấu xác nhận của Cục Quản lý Dược.
Cơ sở phải thực hiện theo đúng các quy định hiện hành về xuất nhập khẩu thuốc và các quy định về dược có liên quan.
Đơn hàng có giá trị 02 năm kể từ ngày ban hành công văn này.
Cục Quản lý Dược thông báo để Cơ sở biết và thực hiện./.
|
| CỤC TRƯỞNG |
| BỘ Y TẾ | CỘNG HÒA XÃ HỘI CHỦ NGHĨA VIỆT NAM |
| Số: /QLD-KD | Hà Nội, ngày tháng năm |
Kính gửi: ……………………..
(Địa chỉ: ………………………. )
Cục Quản lý Dược - Bộ Y tế nhận được Đơn hàng số …………. đề ngày ………….. của Công ty về việc nhập khẩu nguyên liệu làm thuốc là để sản xuất thuốc xuất khẩu.
Căn cứ Nghị định số 54/2017/NĐ-CP ngày 08/05/2017 của Chính phủ quy định chi tiết một số điều và biện pháp thi hành Luật dược,
Căn cứ Nghị định số 155/2018/NĐ-CP ngày 12/11/2018 của Chính phủ sửa đổi, bổ sung một số quy định liên quan đến điều kiện đầu tư kinh doanh thuộc phạm vi quản lý nhà nước của Bộ Y tế,
Căn cứ Nghị định số 88/2023/NĐ-CP ngày 11/12/2023 của Chính phủ sửa đổi, bổ sung một số điều của Nghị định số 54/2017/NĐ-CP ngày 08/5/2017 của Chính phủ quy định chi tiết một số điều và biện pháp thi hành Luật Dược và Nghị định số 155/2018/NĐ-CP ngày 12/11/2018 của Chính phủ sửa đổi, bổ sung một số quy định liên quan đến điều kiện đầu tư kinh doanh thuộc phạm vi quản lý nhà nước của Bộ Y tế,
Cục Quản lý Dược - Bộ Y tế có ý kiến như sau:
Chấp thuận đơn hàng nhập khẩu số .... đề ngày .... gồm ... trang, có .... khoản, có đóng dấu xác nhận của Cục Quản lý Dược - Bộ Y tế.
Công ty chỉ được sử dụng nguyên liệu nhập khẩu trên để sản xuất thuốc xuất khẩu, không sử dụng vào mục đích khác. Thuốc thành phẩm sản xuất không được lưu hành tại Việt Nam
Công ty phải thực hiện theo đúng các quy định hiện hành về xuất nhập khẩu thuốc, nguyên liệu làm thuốc và các quy định về Dược có liên quan.
Đơn hàng có giá trị 02 năm kể từ ngày ký.
Cục Quản lý Dược - Bộ Y tế thông báo để Công ty biết và thực hiện./.
|
| CỤC TRƯỞNG |
- 1Quyết định 178/QĐ-QLD năm 2024 về Quy trình thao tác chuẩn trong Hệ thống quản lý chất lượng theo tiêu chuẩn ISO 9001:2015 áp dụng vào hoạt động quản lý Nhà nước tại Cục Quản lý Dược
- 2Quyết định 205/QĐ-QLD năm 2024 về Quy trình thao tác chuẩn trong hệ thống quản lý chất lượng theo tiêu chuẩn ISO 9001:2015 áp dụng vào hoạt động quản lý nhà nước tại Cục Quản lý Dược
- 3Quyết định 223/QĐ-QLD năm 2024 ban hành, bãi bỏ Quy trình thao tác chuẩn trong Hệ thống quản lý chất lượng theo tiêu chuẩn ISO 9001:2015 áp dụng vào hoạt động quản lý nhà nước tại Cục Quản lý Dược
- 4Quyết định 344/QĐ-QLD năm 2024 về Quy trình thao tác chuẩn trong hệ thống quản lý chất lượng theo tiêu chuẩn ISO 9001:2015 áp dụng vào hoạt động quản lý nhà nước tại Cục Quản lý Dược
- 1Luật Dược 2016
- 2Nghị định 54/2017/NĐ-CP hướng dẫn Luật dược do Chính phủ ban hành
- 3Thông tư 06/2017/TT-BYT Danh mục thuốc độc và nguyên liệu độc làm thuốc do Bộ trưởng Bộ Y tế ban hành
- 4Thông tư 20/2017/TT-BYT về hướng dẫn Luật dược và Nghị định 54/2017/NĐ-CP về thuốc và nguyên liệu làm thuốc phải kiểm soát đặc biệt do Bộ trưởng Bộ Y tế ban hành
- 5Nghị định 155/2018/NĐ-CP sửa đổi quy định liên quan đến điều kiện đầu tư kinh doanh thuộc phạm vi quản lý nhà nước của Bộ Y tế
- 6Nghị định 95/2022/NĐ-CP quy định chức năng, nhiệm vụ, quyền hạn và cơ cấu tổ chức của Bộ Y tế
- 7Quyết định 1969/QĐ-BYT năm 2023 quy định chức năng, nhiệm vụ, quyền hạn và cơ cấu tổ chức của Cục Quản lý Dược thuộc Bộ Y tế
- 8Nghị định 88/2023/NĐ-CP sửa đổi Nghị định 54/2017/NĐ-CP hướng dẫn Luật Dược và Nghị định 155/2018/NĐ-CP sửa đổi quy định liên quan đến điều kiện đầu tư kinh doanh thuộc phạm vi quản lý Nhà nước của Bộ Y tế
- 9Quyết định 178/QĐ-QLD năm 2024 về Quy trình thao tác chuẩn trong Hệ thống quản lý chất lượng theo tiêu chuẩn ISO 9001:2015 áp dụng vào hoạt động quản lý Nhà nước tại Cục Quản lý Dược
- 10Quyết định 205/QĐ-QLD năm 2024 về Quy trình thao tác chuẩn trong hệ thống quản lý chất lượng theo tiêu chuẩn ISO 9001:2015 áp dụng vào hoạt động quản lý nhà nước tại Cục Quản lý Dược
- 11Quyết định 223/QĐ-QLD năm 2024 ban hành, bãi bỏ Quy trình thao tác chuẩn trong Hệ thống quản lý chất lượng theo tiêu chuẩn ISO 9001:2015 áp dụng vào hoạt động quản lý nhà nước tại Cục Quản lý Dược
- 12Quyết định 344/QĐ-QLD năm 2024 về Quy trình thao tác chuẩn trong hệ thống quản lý chất lượng theo tiêu chuẩn ISO 9001:2015 áp dụng vào hoạt động quản lý nhà nước tại Cục Quản lý Dược
Quyết định 293/QĐ-QLD năm 2024 về Quy trình thao tác chuẩn trong Hệ thống quản lý chất lượng theo tiêu chuẩn ISO 9001:2015 áp dụng vào hoạt động quản lý nhà nước tại Cục Quản lý Dược
- Số hiệu: 293/QĐ-QLD
- Loại văn bản: Quyết định
- Ngày ban hành: 07/05/2024
- Nơi ban hành: Cục Quản lý dược
- Người ký: Vũ Tuấn Cường
- Ngày công báo: Đang cập nhật
- Số công báo: Đang cập nhật
- Ngày hiệu lực: 07/05/2024
- Tình trạng hiệu lực: Kiểm tra


