Để sử dụng toàn bộ tiện ích nâng cao của Hệ Thống Pháp Luật vui lòng lựa chọn và đăng ký gói cước.
| BỘ Y TẾ | CỘNG HÒA XÃ HỘI CHỦ NGHĨA VIỆT NAM |
| Số: 26/QĐ-BYT | Hà Nội, ngày 03 tháng 01 năm 2013 |
VỀ VIỆC BAN HÀNH TÀI LIỆU “HƯỚNG DẪN QUY TRÌNH KỸ THUẬT CHUYÊN NGÀNH VI SINH Y HỌC”
BỘ TRƯỞNG BỘ Y TẾ
Căn cứ Luật khám bệnh, chữa bệnh năm 2009;
Căn cứ Nghị định số 63/2012/NĐ-CP ngày 31/8/2012 của Chính Phủ quy định chức năng, nhiệm vụ, quyền hạn và cơ cấu tổ chức của Bộ Y tế;
Xét Biên bản họp của Hội đồng nghiệm thu Hướng dẫn Quy trình kỹ thuật khám bệnh, chữa bệnh chuyên ngành Vi sinh Y học của Bộ Y tế;
Theo đề nghị của Cục trưởng Cục Quản lý Khám, chữa bệnh,
QUYẾT ĐỊNH:
Điều 1. Ban hành kèm theo Quyết định này tài liệu “Hướng dẫn quy trình kỹ thuật chuyên ngành Vi sinh Y học”, gồm 231 quy trình kỹ thuật.
Điều 2. Tài liệu “Hướng dẫn quy trình kỹ thuật chuyên ngành Vi sinh Y học” ban hành kèm theo Quyết định này được áp dụng tại các cơ sở khám bệnh, chữa bệnh.
Căn cứ vào tài liệu hướng dẫn này và điều kiện cụ thể của đơn vị, Giám đốc cơ sở khám bệnh, chữa bệnh xây dựng và ban hành tài liệu Hướng dẫn Quy trình kỹ thuật Vi sinh Y học phù hợp để thực hiện tại đơn vị.
Điều 4. Các ông, bà: Chánh Văn phòng Bộ, Chánh Thanh tra Bộ, Cục trưởng Cục Quản lý Khám, chữa bệnh, Cục trưởng và Vụ trưởng các Cục, Vụ thuộc Bộ Y tế, Giám đốc các bệnh viện, viện có giường bệnh trực thuộc Bộ Y tế, Giám đốc Sở Y tế các tỉnh, thành phố trực thuộc trung ương, Thủ trưởng Y tế các Bộ, Ngành và Thủ trưởng các đơn vị có liên quan chịu trách nhiệm thi hành Quyết định này./.
|
Nơi nhận: | KT. BỘ TRƯỞNG |
DANH SÁCH CÁC QUY TRÌNH KỸ THUẬT CHUYÊN NGÀNH VI SINH HỌC
(Ban hành kèm theo Quyết định số: 26/QĐ-BYT ngày 03 tháng 01 năm 2014 của Bộ trưởng Bộ Y tế)
| TT | TÊN QUY TRÌNH KỸ THUẬT |
| Danh mục xét nghiệm vi khuẩn | |
|
| A. Vi khuẩn chung |
| 1 | Vi khuẩn nhuộm soi |
| 2 | Vi khuẩn test nhanh |
| 3 | Vi khuẩn nuôi cấy và định danh phương pháp thông thường |
| 4 | Vi khuẩn nuôi cấy và định danh hệ thống tự động |
| 5 | Vi khuẩn nuôi cấy, định danh và kháng thuốc hệ thống tự động |
| 6 | Vi khuẩn kháng thuốc định tính |
| 7 | Vi khuẩn kháng thuốc hệ thống tự động |
| 8 | Vi khuẩn kháng thuốc định lượng (MIC) (cho 1 loại kháng sinh) |
| 9 | Vi khuẩn kháng sinh phối hợp |
| 10 | Vi khuẩn kỵ khí nuôi cấy và định danh |
| 11 | Vi khuẩn khẳng định |
| 12 | Vi khuẩn định danh PCR |
| 13 | Vi khuẩn định danh giải trình tự gene |
| 14 | Vi khuẩn kháng thuốc PCR |
| 15 | Vi khuẩn kháng thuốc giải trình tự gene |
| 16 | Vi hệ đường ruột |
|
| B. Mycobacteria |
| 17 | AFB trực tiếp nhuộm Ziehl-Neelsen |
| 18 | AFB trực tiếp nhuộm huỳnh quang |
| 19 | Mycobacterium tuberculosis nuôi cấy môi trường lỏng |
| 20 | Mycobacterium tuberculosis nuôi cấy môi trường đặc |
| 21 | Mycobacterium tuberculosis Mantoux |
| 22 | Mycobacterium tuberculosis kháng thuốc hàng 1 môi trường đặc |
| 23 | Mycobacterium tuberculosis kháng thuốc hàng 1 môi trường lỏng |
| 24 | Mycobacterium tuberculosis kháng thuốc hàng 2 môi trường đặc |
| 25 | Mycobacterium tuberculosis kháng thuốc hàng 2 môi trường lỏng |
| 26 | Mycobacterium tuberculosis kháng thuốc PZA môi trường lỏng |
| 27 | Mycobacterium tuberculosis pyrazinamidase |
| 28 | Mycobacterium tuberculosis định danh và kháng RMP Xpert |
| 29 | Mycobacterium tuberculosis đa kháng LPA |
| 30 | Mycobacterium tuberculosis siêu kháng LPA |
| 31 | Mycobacterium tuberculosis PCR hệ thống tự động |
| 32 | Mycobacterium tuberculosis Real-time PCR |
| 33 | Mycobacterium tuberculosis spoligotyping |
| 34 | Mycobacterium tuberculosis RFLP typing |
| 35 | NTM (Non tuberculosis mycobacteria) nuôi cấy môi trường lỏng |
| 36 | NTM (Non tuberculosis mycobacteria) nuôi cấy môi trường đặc |
| 37 | NTM (Non tuberculosis mycobacteria) định danh LPA |
| 38 | Mycobacterium leprae nhuộm soi |
| 39 | Mycobacterium leprae PCR |
| 40 | Mycobacterium leprae mảnh sinh thiết |
|
| C. Vibrio cholerae |
| 41 | Vibrio cholerae nhuộm soi |
| 42 | Vibrio cholerae nhuộm huỳnh quang |
| 43 | Vibrio cholerae nuôi cấy, định danh và kháng thuốc |
| 44 | Vibrio cholerae PCR |
| 45 | Vibrio cholerae giải trình tự gene |
|
| D. Neisseria gonorrhoeae |
| 46 | Neisseria gonorrhoeae nhuộm soi |
| 47 | Neisseria gonorrhoeae nuôi cấy, định danh và kháng thuốc |
| 48 | Neisseria gonorrhoeae PCR |
| 49 | Neisseria gonorrhoeae Real-time PCR |
|
| E. Neisseria meningitidis |
| 50 | Neisseria meningitidis nhuộm soi |
| 51 | Neisseria meningitidis nuôi cấy, định danh và kháng thuốc |
| 52 | Neisseria meningitidis PCR |
| 53 | Neisseria meningitidis Real-time PCR |
|
| F. Các vi khuẩn khác |
| 54 | Chlamydia test nhanh |
| 55 | Chlamydia nhuộm huỳnh quang |
| 56 | Chlamydia Ab miễn dịch bán tự động |
| 57 | Chlamydia PCR |
| 58 | Chlamydia Real-time PCR |
| 59 | Chlamydia Real-time PCR hệ thống tự động |
| 60 | Clostridium nuôi cấy, định danh |
| 61 | Clostridium difficile miễn dịch bán tự động |
| 62 | Clostridium difficile PCR |
| 63 | Leptospira test nhanh |
| 64 | Mycoplasma pneumoniae Real-time PCR |
| 65 | Mycoplasma hominis nuôi cấy, định danh và kháng thuốc |
| 66 | Rickettsia Ab miễn dịch bán tự động |
| 67 | Salmonella Widal |
| 68 | Streptococcus pyogenes ASO |
| 69 | Treponema pallidum soi tươi |
| 70 | Treponema pallidum nhuộm soi |
| 71 | Treponema pallidum RPR định tính và định lượng |
| 72 | Treponema pallidum TPHA định tính và định lượng |
| 73 | Ureaplasma urealyticum nuôi cấy, định danh và kháng thuốc |
| Danh mục xét nghiệm virus | |
|
| A. Virus chung |
| 74 | Virus test nhanh |
| 75 | Virus Ag miễn dịch bán tự động |
| 76 | Virus Ab miễn dịch bán tự động |
|
| B. Hepatitis virus |
| 77 | HBsAg test nhanh |
| 78 | HBsAg miễn dịch bán tự động |
| 79 | HBsAg miễn dịch tự động |
| 80 | HBsAg khẳng định |
| 81 | HBsAg định lượng |
| 82 | HBsAb miễn dịch bán tự động |
| 83 | HBsAb định lượng |
| 84 | HBc IgM miễn dịch bán tự động |
| 85 | HBc IgM miễn dịch tự động |
| 86 | HBc total miễn dịch bán tự động |
| 87 | HBc total miễn dịch tự động |
| 88 | HBeAg miễn dịch bán tự động |
| 89 | HBeAg miễn dịch tự động |
| 90 | HBeAb miễn dịch bán tự động |
| 91 | HBeAb miễn dịch tự động |
| 92 | HBV đo tải lượng Real-time PCR |
| 93 | HBV đo tải lượng hệ thống tự động |
| 94 | HBV genotype PCR |
| 95 | HBV genotype Real-time PCR |
| 96 | HBV genotype giải trình tự gene |
| 97 | HBV kháng thuốc Real-time PCR (cho 1 loại thuốc) |
| 98 | HBV kháng thuốc giải trình tự gene |
| 99 | HCV Ab miễn dịch bán tự động |
| 100 | HCV Ab miễn dịch tự động |
| 101 | HCV Ag/Ab miễn dịch bán tự động |
| 102 | HCV Core Ag miễn dịch tự động |
| 103 | HCV PCR |
| 104 | HCV đo tải lượng Real-time PCR |
| 105 | HCV đo tải lượng hệ thống tự động |
| 106 | HCV genotype Real-time PCR |
| 107 | HCV genotype giải trình tự gene |
| 108 | HAV IgM miễn dịch bán tự động |
| 109 | HAV IgM miễn dịch tự động |
| 110 | HAV total miễn dịch bán tự động |
| 111 | HAV total miễn dịch tự động |
| 112 | HDV Ag miễn dịch bán tự động |
| 113 | HDV IgM miễn dịch bán tự động |
| 114 | HDV Ab miễn dịch bán tự động |
| 115 | HEV IgM test nhanh |
| 116 | HEV IgM miễn dịch bán tự động |
|
| C. HIV |
| 117 | HIV Ab test nhanh |
| 118 | HIV Ag/Ab test nhanh |
| 119 | HIV Ab miễn dịch bán tự động |
| 120 | HIV Ag/Ab miễn dịch bán tự động |
| 121 | HIV Ag/Ab miễn dịch tự động |
| 122 | HIV khẳng định |
| 123 | HIV đo tải lượng Real-time PCR |
| 124 | HIV đo tải lượng hệ thống tự động |
| 125 | HIV genotype giải trình tự gene |
| 126 | HIV kháng thuốc giải trình tự gene |
|
| D. Dengue virus |
| 127 | Dengue virus NS1Ag test nhanh |
| 128 | Dengue virus NS1Ag/IgM/IgG test nhanh |
| 129 | Dengue virus IgM/IgG test nhanh |
| 130 | Dengue virus IgM miễn dịch bán tự động |
| 131 | Dengue virus IgG miễn dịch bán tự động |
| 132 | Dengue virus PCR |
| 133 | Dengue virus serotype PCR |
|
| E. Herpesviridae |
| 134 | CMV IgM miễn dịch bán tự động |
| 135 | CMV IgM miễn dịch tự động |
| 136 | CMV IgG miễn dịch bán tự động |
| 137 | CMV IgG miễn dịch tự động |
| 138 | CMV PCR |
| 139 | CMV Real-time PCR |
| 140 | CMV đo tải lượng hệ thống tự động |
| 141 | CMV Avidity |
| 142 | HSV 1+2 IgM miễn dịch bán tự động |
| 143 | HSV 1+2 IgG miễn dịch bán tự động |
| 144 | HSV Real-time PCR |
| 145 | VZV Real-time PCR |
| 146 | EBV-VCA IgM miễn dịch bán tự động |
| 147 | EBV-VCA IgG miễn dịch bán tự động |
| 148 | EBV EA-D IgG miễn dịch bán tự động |
| 149 | EBV EB-NA IgG miễn dịch bán tự động |
| 150 | EBV PCR |
| 151 | EBV Real-time PCR |
|
| E. Enterovirus |
| 152 | EV71 PCR |
| 153 | EV71 Real-time PCR |
| 154 | EV71 genotype giải trình tự gene |
| 155 | Enterovirus PCR |
| 156 | Enterovirus genotype giải trình tự gene |
|
| F. Các virus khác |
| 157 | Adenovirus Real-time PCR |
| 158 | BK/JC virus PCR |
| 159 | HPV PCR |
| 160 | HPV Real-time PCR |
| 161 | HPV genotype Real-time PCR |
| 162 | HPV genotype PCR hệ thống tự động |
| 163 | HPV genotype giải trình tự gene |
| 164 | Influenza virus A, B test nhanh |
| 165 | Influenza virus A, B Real-time PCR |
| 166 | Influenza virus A, B giải trình tự gene |
| 167 | JEV IgM miễn dịch bán tự động |
| 168 | Measles virus Ab miễn dịch bán tự động |
| 169 | Rotavirus test nhanh |
| 170 | RSV Ab miễn dịch bán tự động |
| 171 | RSV Real-time PCR |
| 172 | Rubella virus IgM miễn dịch bán tự động |
| 173 | Rubella virus IgM miễn dịch tự động |
| 174 | Rubella virus IgG miễn dịch bán tự động |
| 175 | Rubella virus IgG miễn dịch tự động |
| 176 | Rubella virus PCR |
| 177 | Rubella virus giải trình tự gene |
| Danh mục xét nghiệm KST | |
|
| A. Ký sinh trùng trong phân |
| 178 | Hồng cầu, bạch cầu trong phân soi tươi |
| 179 | Hồng cầu trong phân test nhanh |
| 180 | Đơn bào đường ruột soi tươi |
| 181 | Đơn bào đường ruột nhuộm soi |
| 182 | Trứng giun, sán soi tươi |
| 183 | Trứng giun soi tập trung |
| 184 | Strongyloides stercoralis (giun lươn) ấu trùng soi tươi |
|
| B. Ký sinh trùng trong máu |
| 185 | Angiostrogylus cantonensis (Giun tròn chuột) Ab miễn dịch bán tự động |
| 186 | Clonorchis/Opisthorchis (Sán lá gan nhỏ) Ab miễn dịch bán tự động |
| 187 | Cysticercus cellulosae (Sán lợn) Ab miễn dịch bán tự động |
| 188 | Entamoeba histolytica (Amip) Ab miễn dịch bán tự động |
| 189 | Fasciola (Sán lá gan lớn) Ab miễn dịch bán tự động |
| 190 | Filaria (Giun chỉ) ấu trùng trong máu nhuộm soi |
| 191 | Gnathostoma Ab miễn dịch bán tự động |
| 192 | Plasmodium (Ký sinh trùng sốt rét) nhuộm soi định tính |
| 193 | Plasmodium (Ký sinh trùng sốt rét) nhuộm soi định lượng |
| 194 | Plasmodium (Ký sinh trùng sốt rét) Ag test nhanh |
| 195 | Strongyloides stercoralis (Giun lươn) Ab miễn dịch bán tự động |
|
| Toxocara (Giun đũa chó, mèo) Ab miễn dịch bán tự động |
| 197 | Toxoplasma IgM miễn dịch tự động |
| 198 | Toxoplasma IgG miễn dịch tự động |
| 199 | Toxoplasma Avidity |
|
| C. Ký sinh trùng ngoài da |
| 200 | Demodex soi tươi |
| 201 | Demodex nhuộm soi |
| 202 | Phthirus pubis (Rận mu) soi tươi |
| 203 | Phthirus pubis (Rận mu) nhuộm soi |
| 204 | Sarcoptes scabies hominis(Ghẻ) soi tươi |
| 205 | Sarcoptes scabies hominis(Ghẻ) nhuộm soi |
|
| D. Ký sinh trùng trong các bệnh phẩm khác |
| 206 | Cysticercus cellulosae (Sán lợn) ấu trùng soi mảnh sinh thiết |
| 207 | Gnathostoma ấu trùng soi mảnh sinh thiết |
| 208 | Pneumocystis jirovecii nhuộm soi |
| 209 | Taenia (Sán dây) soi tươi định danh |
| 210 | Toxocara (Giun đũa chó, mèo) soi mảnh sinh thiết |
| 211 | Trichinella spiralis (Giun xoắn) soi mảnh sinh thiết |
| 212 | Trichomonas vaginalis soi tươi |
| 213 | Trichomonas vaginalis nhuộm soi |
| Danh mục xét nghiệm Vi nấm | |
| 214 | Vi nấm soi tươi |
| 215 | Vi nấm test nhanh |
| 216 | Vi nấm nhuộm soi |
| 217 | Vi nấm nuôi cấy và định danh phương pháp thông thường |
| 218 | Vi nấm nuôi cấy và định danh hệ thống tự động |
| 219 | Vi nấm nuôi cấy, định danh và kháng thuốc hệ thống tự động |
| 220 | Vi nấm khẳng định |
| 221 | Vi nấm kháng thuốc định lượng (MIC) (cho 1 loại kháng sinh) |
| 222 | Vi nấm PCR |
| 223 | Vi nấm giải trình tự gene |
| Danh mục xét nghiệm đánh giá nhiễm khuẩn bệnh viện | |
| 224 | Vi sinh vật cấy kiểm tra không khí |
| 225 | Vi sinh vật cấy kiểm tra bàn tay |
| 226 | Vi sinh vật cấy kiểm tra dụng cụ đã tiệt trùng |
| 227 | Vi sinh vật cấy kiểm tra bề mặt |
| 228 | Vi sinh vật cấy kiểm tra nước sinh hoạt |
| 229 | Vi sinh vật cấy kiểm tra nước thải |
| 230 | Vi khuẩn kháng thuốc - Phát hiện người mang |
| 231 | Vi khuẩn gây nhiễm trùng bệnh viện - Phá |
(Tổng số 231 quy trình kỹ thuật)
MỤC LỤC
XÉT NGHIỆM VI KHUẨN
1. Vi khuẩn nhuộm soi
2. Vi khuẩn test nhanh
3. Vi khuẩn nuôi cấy và định danh phương pháp thông thường
4. Vi khuẩn nuôi cấy, định danh hệ thống tự động
5. Vi khuẩn nuôi cấy, định danh và kháng thuốc hệ thống tự động
6. Vi khuẩn kháng thuốc định tính
7. Vi khuẩn kháng thuốc hệ thống tự động
8. Vi khuẩn kháng thuốc định lượng MIC (cho 1 loại kháng sinh)
9. Vi khuẩn kháng sinh phối hợp
10. Vi khuẩn kị khí nuôi cấy và định danh
11. Vi khuẩn khẳng định
13. Vi khuẩn định danh giải trình tự gene
14. Vi khuẩn kháng thuốc PCR
15. Vi khuẩn kháng thuốc giải trình tự gene
16. Vi hệ đường ruột
17. AFB trực tiếp nhuộm Ziehl-Neelsen
18. AFB trực tiếp nhuộm huỳnh quang
19. Mycobacterium tuberculosis nuôi cấy môi trường lỏng
20. Mycobacterium tuberculosis nuôi cấy môi trường đặc
21. Mycobacterium tuberculosis Mantoux
22. Mycobacterium tuberculosis kháng thuốc hàng 1 môi trường đặc
23. Mycobacterium tuberculosis kháng thuốc hàng 1 môi trường lỏng
24. Mycobacterium tuberculosis kháng thuốc hàng 2 môi trường đặc
25. Mycobacterium tuberculosis kháng thuốc hàng 2 môi trường lỏng
26. Mycobacterium tuberculosis kháng thuốc PZA môi trường lỏng
27. Mycobacterium tuberculosis pyrazinamidase
28. Mycobacterium tuberculosis định danh và kháng RMP XPERT
29. Mycobacterium tuberculosis đa kháng LPA
30. Mycobacterium tuberculosis siêu kháng LPA
31. Mycobacterium tuberculosis PCR hệ thống tự động
32. Mycobacterium tuberculosis Real-time PCR
33. Mycobacterium tuberculosis Spoligotyping
34. Mycobacterium tuberculosis RFLP typing
35. NTM (Non Tuberculosis Mycobacteria) nuôi cấy môi trường lỏng
36. NTM (Non Tuberculosis Mycobacteria) nuôi cấy môi trường đặc
37. NTM (Non Tuberculosis Mycobacteria) LPA
38. Mycobacterium leprae nhuộm soi
39. Mycobacterium leprae PCR
40. Mycobacterium leprae mảnh sinh thiết
41. Vibrio cholerae nhuộm soi
42. Vibrio cholerae nhuộm huỳnh quang
43. Vibrio cholerae nuôi cấy, định danh và kháng thuốc
44. Vibrio cholerae PCR
45. Vibrio cholerae giải trình tự gene
46. Neisseria gonorrhoeae nhuộm soi
47. Neisseria gonorrhoeae nuôi cấy, định danh và kháng thuốc
48. Neisseria gonorrhoeae PCR
49. Neisseria gonorrhoeae Real-time PCR
50. Neisseria meningitidis nhuộm soi
51. Neisseria meningitidis nuôi cấy, định danh và kháng thuốc
52. Neisseria menigititdis PCR
54. Chlamydia test nhanh
55. Chlamydia nhuộm huỳnh quang
56. Chlamydia Ab miễn dịch bán tự động
57. Chlamydia PCR
58. Chlamydia Real-time PCR
59. Chlamydia Real-time PCR hệ thống tự động
60. Clostridium nuôi cấy, định danh
61. Clostridium difficile miễn dịch bán tự động
62. Clostridium difficile PCR
63. Leptospira test nhanh
64. Mycoplasma pneumoniae Real-time PCR
65. Mycoplasma hominis nuôi cấy, định danh và kháng thuốc
66. Ricketsia Ab miễn dịch bán tự động
67. Salmonella Widal
68. Streptococcus pyogenes ASO
69. Treponema pallidum soi tươi
70. Treponema pallidum nhuộm soi
71. Treponema pallidum RPR định tính và định lượng
72. Treponema pallidum TPHA định tính và định lượng
73. Ureaplasma urealyticum nuôi cấy, định danh và kháng thuốc
XÉT NGHIỆM VIRUS
74. Virus test nhanh
75. Virus Ag miễn dịch tự động
76. Virus Ab miễn dịch tự động
77. HBsAg test nhanh
78. HBsAg miễn dịch bán tự động
79. HBsAg miễn dịch tự động
80. HBsAg khẳng định
81. HBsAg định lượng
82. HBsAb miễn dịch bán tự động
83. HBsAb định lượng
84. HBc IgM miễn dịch bán tự động
85. HBc IgM miễn dịch tự động
86. HBc total miễn dịch bán tự động
87. HBc total miễn dịch tự động
88. HBeAg miễn dịch bán tự động
89. HBeAg miễn dịch tự động
90. HBeAb miễn dịch bán tự động
91. HBeAb miễn dịch tự động
92. HBV đo tải lượng Real-time PCR
93. HBV đo tải lượng hệ thống tự động
94. HBV genotype PCR
95. HBV genotype Real-time PCR
96. HBV genotype giải trình tự gene
97. HBV kháng thuốc Real-time PCR (Cho 1 loại thuốc)
98. HBV kháng thuốc giải trình tự gene
99. HCV Ab miễn dịch bán tự động
100. HCV Ab miễn dịch tự động
101. HCV Ag/Ab miễn dịch bán tự động
102. HCV Core Ag miễn dịch tự động
103. HCV PCR
104. HCV đo tải lượng Real-time PCR
105. HCV đo tải lượng hệ thống tự động
106. HCV genotype Real-time PCR
107. HCV genotype giải trình tự gene
108. HAV IgM miễn dịch bán tự động
109. HAV IgM miễn dịch tự động
110. HAV total miễn dịch bán tự động
111. HAV total miễn dịch tự động
112. HDV Ag miễn dịch bán tự động
113. HDV IgM miễn dịch bán tự động
114. HDV Ab miễn dịch bán tự động
115. HEV IgM test nhanh
116. HEV IgM miễn dịch bán tự động
117. HIV Ab test nhanh
118. HIV Ag/Ab test nhanh
120. HIV Ag/Ab miễn dịch bán tự động
121. HIV Ag/Ab miễn dịch tự động
122. HIV khẳng định
123. HIV đo tải lượng Real-time PCR
124. HIV đo tải lượng hệ thống tự động
125. HIV genotype giải trình tự gene
128. Dengue virus NS1Ag/IgM/IgG test nhanh
129. Dengue virus IgM/IgG test nhanh
130. Dengue virus IgM miễn dịch bán tự động
131. Dengue virus IgG miễn dịch bán tự động
132. Dengue virus PCR
133. Dengue virus serotype PCR
134. CMV IgM miễn dịch bán tự động
135. CMV IgM miễn dịch tự động
136. CMV IgG miễn dịch bán tự động
137. CMV IgG miễn dịch tự động
138. CMV PCR
139. CMV Real-time PCR
140. CMV đo tải lượng hệ thống tự động
141. CMV Avidity
142. HSV 1 + 2 IgM miễn dịch bán tự động
143. HSV 1+ 2 IgG miễn dịch bán tự động
144. HSV Real-time PCR
145. VZV Real-time PCR
146. EBV-VCA IgM miễn dịch bán tự động
147. EBV-VCA IgG miễn dịch bán tự động
148. EBV EA-D IgG miễn dịch bán tự động
149. EBV EB-NA IgG miễn dịch bán tự động
150. EBV PCR
151. EBV Real-time PCR
152. EV71 PCR
155. Enterovirus PCR
156. Entrovirus genotype giải trình tự gene
157. Adenovirus Real-time PCR
158. BK/JC virus PCR
159. HPV PCR
160. HPV Real-time PCR
161. HPV Genotype Real-time PCR
162. HPV genotype PCR hệ thống tự động
163. HPV genotype giải trình tự gene
164. Influenza virus A, B test nhanh
165. Influenza virus A, B Real-time PCR
166. Influenza virus A, B giải trình tự gene
167. JEV IgM miễn dịch bán tự động
168. Measle virus Ab miễn dịch bán tự động
169. Rotavirus test nhanh
170. RSV Ab miễn dịch bán tự động
171. RSV Real-time PCR
172. Rubella virus IgM miễn dịch bán tự động
173. Rubella virus IgM miễn dịch tự động
174. Rubella virus IgG miễn dịch bán tự động
175. Rubella virus IgG miễn dịch tự động
176. Rubella virus PCR
177. Rubella virus giải trình tự gene
XÉT NGHIỆM KÝ SINH TRÙNG - VI NẤM
178. Hồng cầu, bạch cầu trong phân soi tươi
179. Hồng cầu trong phân test nhanh
180. Đơn bào đường ruột soi tươi
181. Đơn bào đường ruột nhuộm soi
182. Trứng giun, sán soi tươi
183. Trứng giun soi tập trung
184. Strongyloides stercoralis (Giun lươn) ấu trùng soi tươi
185. Angiostrongylus cantonensis (Giun tròn chuột) Ab miễn dịch bán tự động
186. Clonorchis/Opisthorchis (Sán lá gan nhỏ) Ab miễn dịch bán tự động
187. Cysticercus cellulosae (Sán lợn) Ab miễn dịch bán tự động
188. Entamoeba histolytica (Amip) Ab miễn dịch bán tự động
189. Fasciola (Sán lá gan lớn) Ab miễn dịch bán tự động
190. Filaria (Giun chỉ) ấu trùng trong máu nhuộm soi
191. Gnathostoma(Giun đầu gai) Ab Miễn dịch bán tự động
192. Plasmodium (Ký sinh trùng sốt rét) nhuộm soi định tính
193. Plasmodium (Ký sinh trùng sốt rét) nhuộm soi định lượng
194. Plasmodium (Ký sinh trùng sốt rét) Ag test nhanh
195. Strongyloides stercoralis (Giun lươn) Ab miễn dịch bán tự động
196. Toxocara (Giun đũa chó mèo) Ab miễn dịch bán tự động
197. Toxoplasma IgM miễn dịch tự động
198. Toxoplasma IgG miễn dịch tự động
199. Toxoplasma Avidity miễn dịch tự động
200. Demodex soi tươi
201. Demodex nhuộm soi
202. Phthirus pubis (Rận mu) soi tươi
203. Phthirus pubis (Rận mu) nhuộm soi
204. Sarcoptes scabies hominis (Ghẻ) soi tươi
205. Sarcoptes scabies hominis (Ghẻ) nhuộm soi
206. Cysticercus cellulosae (Sán lợn) ấu trùng soi mảnh sinh thiết
207. Gnathostoma ấu trùng soi mảnh sinh thiết
208. Taenia (Sán dây) soi tươi định danh
209. Toxocara (Giun đũa chó, mèo) soi mảnh sinh thiết
210. Trichinella spiralis (Giun xoắn) soi mảnh sinh thiết
211. Trichomonas vaginalis soi tươi
212. Trichomonas vaginalis nhuộm soi
213. Pneumocystis jirovecii nhuộm soi
214. Vi nấm soi tươi
215. Vi nấm test nhanh
216. Vi nấm nhuộm soi
217. Vi nấm nuôi cấy và định danh bằng phương pháp thông thường
218. Vi nấm nuôi cấy và định danh hệ thống tự động
219. Vi nấm nuôi cấy, định danh và kháng thuốc hệ thống tự động
220. Vi nấm khẳng định (tham chiếu)
221. Vi nấm kháng thuốc định lượng (MIC) (Cho 1 loại kháng sinh)
222. Vi nấm PCR
223. Vi nấm giải trình tự gene
XÉT NGHIỆM ĐÁNH GIÁ NHIỄM KHUẨN BỆNH VIỆN
224. Vi sinh vật cấy kiểm tra không khí
225. Vi sinh vật cấy kiểm tra bàn tay
226. Vi sinh vật cấy kiểm tra dụng cụ đã tiệt trùng
227. Vi sinh vật cấy kiểm tra bề mặt
228. Vi sinh vật cấy kiểm tra nước sinh hoạt
229. Vi sinh vật cấy kiểm tra nước thải
230. Vi khuẩn kháng thuốc - Phát hiện người mang
231. Vi khuẩn gây nhiễm trùng bệnh viện - Phát hiện nguồn nhiễm
CÁC TỪ VIẾT TẮT
| BCĐN: | Bạch cầu đa nhân |
| CLIA: | Chemiluminescence immunoassay |
| CLSI: | Clinical and laboratory standards institute |
| CO: | Cut off |
| DNA: | Deoxyribonucleic acid |
| ELISA: | Enzyme-linked immunosorbant assay |
| EQAS: | External quality assessment scheme HBV: Hepatitis B virus |
| HCV: | Hepatitis C virus |
| HIV: | Human immunodeficiency virus |
| HPC: | High positive control |
| HT: | Huyết thanh |
| I: | Intermediate |
| IU: | International unit |
| KKT: | Kháng kháng thể |
| KN-KT: | Kháng nguyên - Kháng thể |
| KST: | Ký sinh trùng |
| LPC: | Low positive control |
| NC: | Negative control |
| OD: | Optical density |
| PC: | Positive control |
| PCR: | Polymerase chain reaction |
| QC: | Quality control |
| R: | Resistant |
| RNA: | Ribonucleic acid |
| RT - PCR: | Reverse transcription polymerase chain reaction |
| S: | Susceptible |
| VD: | Ví dụ |
| VK: | Vi khuẩn |
| VSV: | Vi sinh vật |
1. Vi khuẩn nhuộm soi
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Nhận định sơ bộ hình ảnh vi khuẩn và các hình ảnh tế bào (nếu có) trực tiếp từ bệnh phẩm.
2. Nguyên lý
Đánh giá hình thể, kích thước, tính chất bắt màu, cách sắp xếp của vi khuẩn và các hình ảnh tế bào (nếu có) bằng kỹ thuật nhuộm và soi dưới kính hiển vi quang học.
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện: Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Máy ly tâm (cần cho một số loại bệnh phẩm)
- Tủ an toàn sinh học cấp 2
- Kính hiển vi quang học
- Dụng cụ sấy lam (nếu có)
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Lọ lấy bệnh phẩm | Lọ | 1,000 |
| 2 | Que cấy | Cái | 1,000 |
| 3 | Lam kính | Cái | 2,000 |
| 4 | Dầu soi kính | ml | 1,000 |
| 5 | Cồn 96 độ lau kính | ml | 1,000 |
| 6 | Nước muối sinh lý | ml | 5,000 |
| 7 | Thuốc nhuộm đỏ fuchsin | ml | 5,000 |
| 8 | Thuốc nhuộm tím gentian | ml | 5,000 |
| 9 | Cồn tẩy 95% | ml | 10,000 |
| 10 | Lugol | ml | 5,000 |
| 11 | Thuốc nhuộm xanh methylen | ml | 5,000 |
| 12 | Bông | Kg | 0,001 |
| 13 | Cồn 90 độ (vệ sinh dụng cụ) | ml | 10,000 |
| 14 | Đèn cồn | Cái | 0,0001 |
| 15 | Panh | Cái | 0,0001 |
| 16 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 17 | Hộp vận chuyển bệnh phẩm | Cái | 0,0001 |
| 18 | Mũ | Cái | 0,020 |
| 19 | Khẩu trang | Cái | 0,020 |
| 20 | Găng tay | Đôi | 3,000 |
| 21 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 22 | Quần áo bảo hộ | Bộ | 0,001 |
| 23 | Acid ngâm lam | ml | 10,000 |
| 24 | Ống nghiệm thủy tinh | Ống | 1,000 |
| 25 | Bút viết kính | Cái | 0,020 |
| 26 | Bút bi | Cái | 0,010 |
| 27 | Bật lửa | Cái | 0,010 |
| 28 | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 29 | Cồn sát trùng tay nhanh | ml | 1,000 |
| 30 | Dung dịch nước rửa tay | ml | 8,000 |
| 31 | Khăn lau tay | Cái | 0,030 |
| 32 | Giấy trả kết quả xét nghiệm | Tờ | 2,000 |
| 33 | QC (nếu thực hiện) * |
| 0,1 |
| 34 | EQAS (nếu thực hiện) * |
| 0,005 |
* Ghi chú:
- Chi phí nội kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình nội kiểm (QC) là 1/10 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lượng ≥ 10 mẫu cho 1 lần tiến hành kỹ thuật).
- Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/200 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 2 lần/1 năm).
3. Bệnh phẩm
Các loại bệnh phẩm được chỉ định xét nghiệm vi khuẩn.
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu phiếu yêu cầu.
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
- Nhỏ dung dịch tím gentian, phủ kín nơi dàn đồ phiến, duy trì 1 - 2 phút
- Đổ dung dịch tím gentian, rửa tiêu bản dưới vòi nước chảy nhẹ
- Nhỏ dung dịch lugol, để 30 giây
- Đổ dung dịch lugol, rửa nước
- Tẩy màu: nhỏ vài giọt cồn 95% lên tiêu bản, nghiêng đi nghiêng lại để cho cồn chảy từ cạnh nọ sang cạnh kia. Khi thấy màu tím trên lam kính vừa phai hết thì rửa nước ngay.
- Nhỏ dung dịch đỏ fuchsin, để 1 - 2 phút
- Rửa nước kỹ, để khô tiêu bản, soi kính hiển vi.
IV. NHẬN ĐỊNH KẾT QUẢ
Chỉ đọc kết quả khi QC đạt tiêu chuẩn.
1. Đánh giá hình ảnh vi khuẩn trên tiêu bản nhuộm Gram
- Soi dưới vật kính dầu (x100)
- Diễn giải và đọc kết quả:
Vi khuẩn Gram (+) bắt màu tím sẫm của gentian.
Vi khuẩn Gram (-) bắt màu đỏ của fuchsin.
2. Đánh giá hình ảnh tế bào trên tiêu bản nhuộm đơn (nếu có).
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
Gram dương giả: Tẩy cồn chưa đủ thời gian
Gram âm giả:
+ Tuổi của mẫu cấy vi khuẩn ảnh hưởng lên tính chất nhuộm Gram ở các mẫu cấy vi khuẩn để thời gian quá lâu.
+ Tẩy cồn quá lâu và tráng không kỹ.
Nhuộm lại tiêu bản khi nghi ngờ kết quả không chính xác.
2. Vi khuẩn test nhanh
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Xác định nhanh sự có mặt của vi khuẩn gây bệnh trong bệnh phẩm thông qua phát hiện sự có mặt của kháng nguyên vi khuẩn.
2. Nguyên lý
Phát hiện kháng nguyên vi khuẩn dựa trên phản ứng kết hợp đặc hiệu giữa kháng nguyên với kháng huyết thanh mẫu.
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện: Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1 . Trang thiết bị
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Bông | Kg | 0,001 |
| 2 | Dây garô | Cái | 0,001 |
| 3 | Cồn | ml | 1,000 |
| 4 | Bơm kim tiêm | Cái | 1,000 |
| 5 | Panh | Cái | 0,0001 |
| 6 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 7 | Hộp vận chuyển bệnh phẩm | Cái | 0,001 |
| 8 | Tube đựng bệnh phẩm | Cái | 1,000 |
| 9 | Sinh phẩm chẩn đoán | Test | 1,000 |
| 10 | Đầu côn 200 ul | Cái | 2,000 |
| 11 | Giấy thấm | Cuộn | 0,100 |
| 12 | Giấy xét nghiệm | Tờ | 2,000 |
| 13 | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 14 | Bút viết kính | Cái | 0,020 |
| 15 | Bút bi | Cái | 0,010 |
| 16 | Mũ | Cái | 0,020 |
| 17 | Khẩu trang | Cái | 0,020 |
| 18 | Găng tay | Đôi | 0,100 |
| 19 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 20 | Quần áo bảo hộ | Bộ | 0,005 |
| 21 | Dung dịch nước rửa tay | ml | 8,000 |
| 22 | Cồn sát trùng tay nhanh | ml | 1,000 |
| 23 | Dung dịch khử trùng | ml | 10,000 |
| 24 | Khăn lau tay | Cái | 0,010 |
| 25 | QC (nếu thực hiện) * |
| 0,1 |
| 26 | EQAS (nếu thực hiện) * |
| 0,005 |
Thực hiện xét nghiệm 05 mẫu bệnh phẩm/lần.
* Ghi chú:
- Chi phí nội kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình nội kiểm (QC) là 1/10 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lượng ≥ 10 mẫu cho 1 lần tiến hành kỹ thuật).
- Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/200 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 2 lần/1 năm).
3. Bệnh phẩm
Các loại bệnh phẩm chỉ định làm test nhanh.
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu phiếu yêu cầu
III. CÁC BƯỚC THỰC HIỆN
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
Theo đúng quy định của chuyên ngành Vi sinh (Xem Phụ lục 1).
2. Tiến hành kỹ thuật
Bộ sinh phẩm Slidex Meningite - Kit 5 (VD) phát hiện 5 căn nguyên vi khuẩn gây viêm màng não.
| Các bước thực hiện | Kỹ thuật |
| 1. | Đưa sinh phẩm ra ngoài nhiệt độ phòng Đánh số thứ tự các bệnh phẩm và số thứ tự trên tấm kính |
| 2. | Lắc nhẹ nhàng lọ chứa hạt latex, không được lắc quá mạnh |
| 3. | Dùng pipet nhỏ 1 giọt dịch não tủy của người bệnh vào ô tương ứng đã đánh số trên phiến kính. Nhỏ chứng dương và chứng âm |
| 4. | Lắc nhẹ nhàng lọ có chứa hạt latex và nhỏ một giọt vào cạnh giọt dịch não tủy của người bệnh |
| 5. | Trộn đều 2 loại với nhau bằng que trộn phủ đều bề mặt của mỗi ô. |
| 6. | Lắc đều cả phiến kính bằng tay hoặc dùng máy lắc 80-100 vòng trong 10 phút |
| 7. | Đọc kết quả |
IV. NHẬN ĐỊNH KẾT QUẢ
- Ô chứng dương: có nhiện tượng ngưng kết hạt latex
- Ô chứng âm: không có nhiện tượng ngưng kết, hỗn dịch nhìn thấy mịn, đồng nhất
- Ô không có hiện tượng ngưng kết, hỗn dịch nhìn thấy mịn, đồng nhất: Âm tính
- Ô có hiện tượng ngưng kết, hỗn dịch nhìn thấy thô, có hạt ngưng kết rõ trên nền đen.
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
Lượng bệnh phẩm đưa vào quá nhiều hoặc quá ít đều có thể ảnh hưởng đến kết quả.
Do vậy, phải tiến hành lấy thể tích bệnh phẩm đúng theo yêu cầu (Xem Phụ lục 6).
3. Vi khuẩn nuôi cấy và định danh phương pháp thông thường
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Phát hiện và định danh vi khuẩn gây bệnh bằng phương pháp nuôi cấy kinh điển.
2. Nguyên lý
Vi khuẩn được định danh dựa vào đặc điểm nuôi cấy, một số tính chất chuyển hóa, các đặc điểm về hình thái học và có thể kết hợp với tính chất kháng nguyên.
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện: Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
3. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1 .Trang thiết bị
- Tủ an toàn sinh học cấp 2
- Kính hiển vi quang học
- Tủ ấm thường
- Tủ ấm CO2
- Máy tính cài phần mềm đọc API (nếu có)
2.2 .Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Lọ lấy bệnh phẩm | Lọ | 1,000 |
| 2 | Que cấy | Cái | 1,000 |
| 3 | Lam kính | Cái | 2,000 |
| 4 | Dầu soi kính | ml | 1,000 |
| 5 | Cồn 96 độ lau kính | ml | 1,000 |
| 6 | Nước muối sinh lý | ml | 5,000 |
| 7 | Thuốc nhuộm đỏ fuchsin | ml | 5,000 |
| 8 | Thuốc nhuộm tím gentian | ml | 5,000 |
| 9 | Cồn tẩy 95 độ | ml | 10,000 |
| 10 | Lugol | ml | 5,000 |
| 11 | Thuốc nhuộm xanh methylen | ml | 5,000 |
| 12 | Môi trường nuôi cấy | Đĩa | 1,500 |
| 13 | Bộ sinh vật hóa học (bộ API …) | Test | 0,500 |
| 14 | Bông | Kg | 0,001 |
| 15 | Cồn 90 độ (vệ sinh dụng cụ) | ml | 10,000 |
| 16 | Đèn cồn | Cái | 0,0001 |
| 17 | Panh | Cái | 0,0001 |
| 18 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 19 | Hộp vận chuyển bệnh phẩm | Cái | 0,0001 |
| 20 | Mũ | Cái | 0,020 |
| 21 | Khẩu trang | Cái | 0,020 |
| 22 | Găng tay | Đôi | 3,000 |
| 23 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 24 | Quần áo bảo hộ | Bộ | 0,001 |
| 25 | Acid ngâm lam | ml | 10,000 |
| 26 | Ống nghiệm thủy tinh | Ống | 1,000 |
| 27 | Bút viết kính | Cái | 0,020 |
| 28 | Bút bi | Cái | 0,010 |
| 29 | Bật lửa | Cái | 0,010 |
| 30 | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 31 | Cồn sát trùng tay nhanh | ml | 1,000 |
| 32 | Dung dịch nước rửa tay | ml | 8,000 |
| 33 | Khăn lau tay | Cái | 0,030 |
| 34 | Giấy trả kết quả xét nghiệm | Tờ | 2,000 |
| 35 | QC (nếu thực hiện) * |
| 0,1 |
| 36 | EQAS (nếu thực hiện) * |
| 0,005 |
Môi trường nuôi cấy và hóa chất định danh vi khuẩn được tính trên tỉ lệ dương tính trung bình là 50 % cho các loại bệnh phẩm.
* Ghi chú:
- Chi phí nội kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình nội kiểm (QC) là 1/10 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lượng ≥ 10 mẫu cho 1 lần tiến hành kỹ thuật).
- Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/200 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 2 lần/1 năm).
3. Bệnh phẩm
Tất cả các loại bệnh phẩm được chỉ định nuôi cấy tìm vi khuẩn gây bệnh.
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu phiếu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
Theo đúng quy định của chuyên ngành Vi sinh (Xem Phụ lục 1).
2. Tiến hành kỹ thuật
- Nhuộm soi bệnh phẩm, đánh giá sơ bộ
- Nuôi cấy bệnh phẩm vào môi trường phân lập
- Ủ ấm qua đêm
- Bắt khuẩn lạc nghi ngờ
- Nhuộm soi, thử nghiệm các thử nghiệm sinh vật hóa học đơn giản và định danh bằng các bộ sinh vật hóa học (bộ API …)
IV. NHẬN ĐỊNH KẾT QUẢ
- Dương tính: Phân lập và định danh được vi khuẩn gây bệnh. Trả kết quả tên vi khuẩn đến mức độ chi và/hoặc loài.
- Âm tính: Không tìm thấy hoặc không phân lập được vi khuẩn gây bệnh.
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
Quy trình này chỉ áp dụng tìm vi khuẩn hiếu kỵ khí tùy tiện dễ nuôi cấy, không áp dụng cho các vi khuẩn kỵ khí bắt buộc. Kết quả âm tính không có nghĩa là không có vi khuẩn gây bệnh trong bệnh phẩm mà là không tìm thấy căn nguyên vi khuẩn gây bệnh có thể phân lập được bằng quy trình nuôi cấy này.
Nếu có yêu cầu tìm căn nguyên vi khuẩn hiếm gặp, phải ghi yêu cầu cụ thể.
Bệnh phẩm lấy, vận chuyển và bảo quản không đúng yêu cầu có thể đưa đến kết quả âm tính hoặc dương tính giả (Xem Phụ lục 6).
4. Vi khuẩn nuôi cấy, định danh hệ thống tự động
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Phát hiện vi khuẩn gây bệnh bằng phương pháp nuôi cấy, định danh trên hệ thống tự động.
2. Nguyên lý
Vi khuẩn được định danh bằng máy tự động dựa trên một số tính chất chuyển hóa kết hợp với các đặc điểm về hình thái học và tính chất bắt màu.
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Kính hiển vi quang học
- Tủ ấm thường
- Tủ ấm CO2
- Hệ thống định danh tự động
- Máy đo độ đục
- Lò hấp ướt
- Tủ an toàn sinh học cấp 2
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Lọ lấy bệnh phẩm | Lọ | 1,000 |
| 2 | Que cấy | Cái | 2,000 |
| 3 | Lam kính | Cái | 2,000 |
| 4 | Dầu soi kính | ml | 1,000 |
| 5 | Cồn 96 độ lau kính | ml | 1,000 |
| 6 | Nước muối sinh lý | ml | 5,000 |
| 7 | Thuốc nhuộm đỏ fuchsin | ml | 5,000 |
| 8 | Thuốc nhuộm tím gentian | ml | 5,000 |
| 9 | Cồn tẩy 95 độ | ml | 10,000 |
| 10 | Lugol | ml | 5,000 |
| 11 | Thuốc nhuộm xanh methylen | ml | 5,000 |
| 12 | Môi trường nuôi cấy | Đĩa | 1,500 |
| 13 | Panel định danh theo hệ thống máy tự động | Test | 0,500 |
| 14 | Bộ Panel chứng | Bộ | 0,0002 |
| 15 | Bơm kim tiêm | Cái | 1,000 |
| 16 | Bông | Kg | 0,001 |
| 17 | Cồn 90 độ (vệ sinh dụng cụ) | ml | 10,000 |
| 18 | Đèn cồn | Cái | 0,0001 |
| 19 | Panh | Cái | 0,0001 |
| 20 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 21 | Hộp vận chuyển bệnh phẩm | Cái | 0,0001 |
| 22 | Mũ | Cái | 0,020 |
| 23 | Khẩu trang | Cái | 0,020 |
| 24 | Găng tay | Đôi | 3,000 |
| 25 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 26 | Quần áo bảo hộ | Bộ | 0,001 |
| 27 | Acid ngâm lam | ml | 10,000 |
| 28 | Ống nghiệm thủy tinh | Ống | 1,000 |
| 29 | Bút viết kính | Cái | 0,020 |
| 30 | Bút bi | Cái | 0,010 |
| 31 | Bật lửa | Cái | 0,010 |
| 32 | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 33 | Cồn sát trùng tay nhanh | ml | 1,000 |
| 34 | Dung dịch nước rửa tay | ml | 8,000 |
| 35 | Khăn lau tay | Cái | 0,030 |
| 36 | Giấy trả kết quả xét nghiệm | Tờ | 2,000 |
| 37 | QC (nếu thực hiện) * |
| 0,1 |
| 38 | EQAS (nếu thực hiện) * |
| 0,005 |
Môi trường nuôi cấy được tính trên tỉ lệ dương là 50 % so với tổng số bệnh phẩm gửi xét nghiệm.
Bộ Panel sử dụng để kiểm chuẩn được tính trên 5000 Test/1 năm.
* Ghi chú:
- Chi phí nội kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình nội kiểm (QC) là 1/10 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lượng ≥ 10 mẫu cho 1 lần tiến hành kỹ thuật).
- Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/200 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 2 lần/1 năm).
3. Bệnh phẩm
Tất cả các loại bệnh phẩm được chỉ định nuôi cấy tìm vi khuẩn gây bệnh.
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu phiếu yêu cầu.
II. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
Theo đúng quy định của chuyên ngành Vi sinh (Xem phụ lục 1).
2. Tiến hành kỹ thuật
- Nhuộm soi bệnh phẩm, đánh giá sơ bộ
- Nuôi cấy bệnh phẩm vào môi trường phân lập
- Ủ ấm qua đêm
- Bắt khuẩn lạc nghi ngờ
- Nhuộm soi, thử nghiệm các tính chất sinh vật hóa học đơn giản và định danh bằng hệ thống tự động.
IV. NHẬN ĐỊNH KẾT QUẢ
- Dương tính: Phân lập và định danh được vi khuẩn gây bệnh. Trả kết quả tên vi khuẩn đến mức độ chi và/hoặc loài.
- Âm tính: Không tìm thấy hoặc không phân lập được vi khuẩn gây bệnh.
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
Quy trình này chỉ áp dụng tìm vi khuẩn hiếu kỵ khí tùy tiện dễ nuôi cấy, không áp dụng cho các vi khuẩn kỵ khí bắt buộc. Kết quả âm tính không có nghĩa là không có vi khuẩn gây bệnh trong bệnh phẩm mà là không tìm thấy căn nguyên vi khuẩn gây bệnh có thể phân lập được bằng quy trình nuôi cấy này.
Nếu có yêu cầu tìm căn nguyên vi khuẩn nào đó, phải ghi yêu cầu cụ thể.
Bệnh phẩm lấy, vận chuyển và bảo quản không đúng yêu cầu có thể đưa đến kết quả âm tính hoặc dương tính giả (Xem Phụ lục 6).
5. Vi khuẩn nuôi cấy, định danh và kháng thuốc hệ thống tự động
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Phát hiện vi khuẩn gây bệnh bằng phương pháp nuôi cấy, định danh và kháng thuốc trên hệ thống tự động.
2. Nguyên lý
Vi khuẩn được định danh bằng máy tự động dựa trên một số tính chất chuyển hóa kết hợp với các đặc điểm về hình thái học và tính chất bắt màu; và xác định mức độ nhạy cảm với kháng sinh bằng phương pháp kháng sinh pha loãng.
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Kính hiển vi quang học
- Tủ ấm thường
- Tủ ấm CO2
- Hệ thống định danh tự động
- Máy đo độ đục
- Lò hấp ướt
- Tủ an toàn sinh học cấp 2
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Lọ lấy bệnh phẩm | Lọ | 1,000 |
| 2 | Lam kính | Cái | 2,000 |
| 3 | Que cấy | Cái | 2,000 |
| 4 | Dầu soi kính | ml | 1,000 |
| 5 | Cồn 96 độ lau kính | ml | 1,000 |
| 6 | Nước muối sinh lý | ml | 5,000 |
| 7 | Thuốc nhuộm đỏ Fuchsin | ml | 5,000 |
| 8 | Thuốc nhuộm tím Gentian | ml | 5,000 |
| 9 | Cồn tẩy 95 độ | ml | 10,000 |
| 10 | Lugol | ml | 5,000 |
| 11 | Thuốc nhuộm xanh methylen | ml | 5,000 |
| 12 | Môi trường nuôi cấy | Đĩa | 1,500 |
| 13 | Panel định danh theo hệ thống máy tự động | Test | 1,000 |
| 14 | Bộ Panel chứng | Bộ | 0,0002 |
| 15 | Bơm kim tiêm | Cái | 1,000 |
| 16 | Bông | Kg | 0,001 |
| 17 | Cồn 90 độ (vệ sinh dụng cụ) | ml | 10,000 |
| 18 | Đèn cồn | Cái | 0,0001 |
| 19 | Panh | Cái | 0,0001 |
| 20 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 21 | Hộp vận chuyển bệnh phẩm | Cái | 0,0001 |
| 22 | Mũ | Cái | 0,020 |
| 23 | Khẩu trang | Cái | 0,020 |
| 24 | Găng tay | Đôi | 3,000 |
| 25 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 26 | Quần áo bảo hộ | Bộ | 0,001 |
| 27 | Acid ngâm lam | ml | 10,000 |
| 28 | Ống nghiệm thủy tinh | Ống | 1,000 |
| 29 | Bút viết kính | Cái | 0,020 |
| 30 | Bút bi | Cái | 0,010 |
| 31 | Bật lửa | Cái | 0,010 |
| 32 | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 33 | Cồn sát trùng tay nhanh | ml | 1,000 |
| 34 | Dung dịch nước rửa tay | ml | 8,000 |
| 35 | Khăn lau tay | Cái | 0,030 |
| 36 | Giấy trả kết quả xét nghiệm | Tờ | 2,000 |
| 37 | QC (nếu thực hiện) * |
| 0,1 |
| 38 | EQAS (nếu thực hiện) * |
| 0,005 |
Môi trường nuôi cấy được tính trên tỉ lệ dương là 50 % so với tổng số bệnh phẩm gửi xét nghiệm.
Bộ Panel sử dụng để kiểm chuẩn được tính trên 5000 Test/1 năm.
* Ghi chú:
- Chi phí nội kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình nội kiểm (QC) là 1/10 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lượng ≥ 10 mẫu cho 1 lần tiến hành kỹ thuật).
- Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/200 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 2 lần/1 năm).
3. Bệnh phẩm
Tất cả các loại bệnh phẩm được chỉ định nuôi cấy tìm vi khuẩn gây bệnh.
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu phiếu yêu cầu.
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
Theo đúng quy định của chuyên ngành Vi sinh (Xem phụ lục 1).
2. Tiến hành kỹ thuật
- Nhuộm soi bệnh phẩm, đánh giá sơ bộ
- Nuôi cấy bệnh phẩm vào môi trường phân lập
- Ủ ấm qua đêm
- Bắt khuẩn lạc nghi ngờ
- Nhuộm soi, thử nghiệm các tính chất sinh vật hóa học đơn giản và định danh bằng hệ thống tự động.
IV. NHẬN ĐỊNH KẾT QUẢ
- Dương tính: Phân lập và định danh được vi khuẩn gây bệnh. Trả kết quả tên vi khuẩn đến mức độ chi và/hoặc loài.
- Âm tính: Không tìm thấy hoặc không phân lập được vi khuẩn gây bệnh.
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
Quy trình này chỉ áp dụng tìm vi khuẩn hiếu kỵ khí tùy tiện dễ nuôi cấy, không áp dụng cho các vi khuẩn kỵ khí bắt buộc. Kết quả âm tính không có nghĩa là không có vi khuẩn gây bệnh trong bệnh phẩm mà là không tìm thấy căn nguyên vi khuẩn gây bệnh có thể phân lập được bằng quy trình nuôi cấy này.
Sử dụng sai panel định danh cho loại vi khuẩn cần xác định. Cần chọn lựa chính xác panel định danh cho từng loại vi khuẩn.
Nếu có yêu cầu tìm căn nguyên vi khuẩn nào đó, phải ghi yêu cầu cụ thể. Bệnh phẩm lấy, vận chuyển và bảo quản không đúng yêu cầu có thể đưa đến kết quả âm tính hoặc dương tính giả (Xem Phụ lục 6).
6. Vi khuẩn kháng thuốc định tính
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Xác định mức độ nhạy cảm với kháng sinh của các chủng vi khuẩn gây bệnh.
2. Nguyên lý
Mức độ nhạy cảm với kháng sinh của các chủng vi khuẩn thử nghiệm được đánh giá bằng phương pháp kháng sinh khuếch tán trong thạch. Sự phát triển của vi khuẩn sẽ bị ức chế khi kháng sinh đạt đến một nồng độ nhất định. Đường kính vùng ức chế tỷ lệ thuận với mức độ nhạy cảm được phiên giải ra các phân loại S (sensitive - nhạy cảm), I (intermediate - trung gian), hoặc R (resistant - đề kháng) khi so sánh với bảng chuẩn CSLI cập nhật hàng năm.
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1 . Trang thiết bị
- Tủ ấm
- Tủ an toàn sinh học cấp 2
- Máy lắc
- Ống độ đục chuẩn McFarland 0.5
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Khoanh giấy kháng sinh | Khoanh | 22,000 |
| 2 | Que cấy | Cái | 1,000 |
| 3 | Thạch Muller Hinton | Đĩa | 3,000 |
| 4 | Thạch máu | Đĩa | 1,000 |
| 5 | Giấy kháng sinh đồ | Tờ | 2,000 |
| 6 | Bông | Kg | 0,001 |
| 7 | Cồn 90 độ (vệ sinh dụng cụ) | ml | 10,000 |
| 8 | Panh | Cái | 0,0001 |
| 9 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 10 | Hộp vận chuyển bệnh phẩm | Cái | 0,0001 |
| 11 | Mũ | Cái | 0,050 |
| 12 | Khẩu trang | Cái | 0,050 |
| 13 | Găng tay | Đôi | 3,000 |
| 14 | Găng tay xử lý dụng cụ | Đôi | 0,030 |
| 15 | Quần áo bảo hộ | Bộ | 0,001 |
| 16 | Nước muối sinh lý | ml | 5,000 |
| 17 | Ống nghiệm thủy tinh | Ống | 1,000 |
| 18 | Tăm bông vô trùng | Cái | 1,000 |
| 19 | Bút viết kính | Cái | 0,020 |
| 20 | Bút bi | Cái | 0,010 |
| 21 | Bật lửa | Cái | 0,010 |
| 22 | Sổ lưu kết quả xét nghiệm | Quyển | 0,001 |
| 23 | Cồn sát trùng tay nhanh | ml | 1,000 |
| 24 | Dung dịch nước rửa tay | ml | 8,000 |
| 25 | Khăn lau tay | Cái | 0,050 |
| 26 | QC (nếu thực hiện) * |
| 0,1 |
| 27 | EQAS (nếu thực hiện) * |
| 0,005 |
* Ghi chú:
- Chi phí nội kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình nội kiểm (QC) là 1/10 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lượng ≥ 10 mẫu cho 1 lần tiến hành kỹ thuật).
- Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/200 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 2 lần/1 năm).
3. Bệnh phẩm
Chủng vi khuẩn được xác định là căn nguyên gây bệnh, thuần và mới.
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu phiếu yêu cầu.
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
Chủng vi khuẩn cần thử nghiệm đã được nuôi cấy thuần nhất trong điều kiện tối ưu và đang ở giai đoạn phát triển mạnh (nuôi cấy sau 16-24 giờ).
2. Tiến hành kỹ thuật
2.1. Pha huyền dịch vi khuẩn
Dùng que cấy lấy vi khuẩn từ 3-5 khuẩn lạc có hình thái giống nhau nghiền đều vào ống nước muối sinh lý 5 ml, lắc đều trên máy lắc để có huyền dịch đồng nhất. So sánh độ đục của huyền dịch vi khuẩn với độ đục của ống McFarland 0,5.
2.2 . Dàn đều canh khuẩn lên mặt đĩa thạch
Dùng tăm bông vô trùng nhúng vào ống huyền dịch vi khuẩn đã pha ở trên, ép nhẹ và xoay tròn tăm bông trên thành bên của ống huyền dịch vi khuẩn để loại bớt phần huyền dịch vi khuẩn đã thấm vào đầu tăm bông. Sau đó, ria đều que tăm bông trên toàn bộ mặt đĩa thạch Mueller-Hinton sao cho vi khuẩn được dàn đều lên trên toàn bộ bề mặt đĩa thạch
2.3. Đặt các khoanh giấy kháng sinh lên mặt thạch
Các khoanh giấy sau khi đặt cần được ấn xuống vừa phải để đảm bảo chúng được tiếp xúc hoàn toàn với mặt thạch. Trong vòng 15 phút sau khi đặt khoanh giấy kháng sinh, các đĩa thạch phải được lật úp để trong tủ ấm 35ºC.
2.4. Ủ đĩa thạch trong tủ ấm 16 - 24 giờ
IV. NHẬN ĐỊNH KẾT QUẢ
Chỉ đọc kết quả kháng sinh đồ chủng người bệnh khi kết quả QC đạt.
Đo đường kính vùng ức chế (bao gồm cả đường kính của khoanh giấy kháng sinh) tính theo mm.
Phiên giải đường kính vùng ức chế ra kết quả S, I, R theo hướng dẫn của CLSI cập nhật hàng năm.
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
Quy trình này chỉ áp dụng cho các chủng vi khuẩn hiếu kỵ khí tùy tiện dễ nuôi cấy, không áp dụng cho các vi khuẩn kỵ khí bắt buộc.
Sai sót có thể gặp khi:
- Lẫn hai hay nhiều chủng vi khuẩn
- Vi khuẩn mọc quá dày hoặc quá thưa.
Phải tiến hành làm lại khi thấy các hiện tượng như trên.
7. Vi khuẩn kháng thuốc hệ thống tự động
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Xác định mức độ nhạy cảm với kháng sinh của các chủng vi khuẩn gây bệnh.
2. Nguyên lý
Mức độ nhạy cảm với kháng sinh của các chủng vi khuẩn thử nghiệm được đánh giá dựa trên giá trị của nồng độ ức chế tối thiểu - MIC. Giá trị MIC sẽ được phiên giải ra phân loại S (sensitive - nhạy cảm), I (intermediate - trung gian), hoặc R (resistant - đề kháng) nhờ hệ thống tự động.
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện: Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1 . Trang thiết bị
- Máy định danh, kháng sinh đồ tự động (ví dụ Hệ thống Vitek 2 Compact)
- Tủ an toàn sinh học cấp 2
- Máy vi tính
- Máy in
2.2 . Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Thẻ kháng sinh đồ | Thẻ | 1,000 |
| 2 | Que cấy | Cái | 1,000 |
| 3 | Blood agar base 500G | ml | 75,000 |
| 4 | Dụng cụ lấy bệnh phẩm | Lọ | 1,000 |
| 5 | Mac Conkey agar | ml | 75,000 |
| 6 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 7 | Mũ | Cái | 0,030 |
| 8 | Khẩu trang | Cái | 0,030 |
| 9 | Găng tay | Đôi | 3,000 |
| 10 | Găng tay xử lý dụng cụ | Đôi | 0,030 |
| 11 | Quần áo bảo hộ | Cái | 0.0005 |
| 12 | ống nghiệm thủy tinh | ống | 1,000 |
| 13 | Dung dịch nước rửa tay | ml | 8,000 |
| 14 | Khăn lau tay | Cái | 0,030 |
| 15 | Giấy trả kết quả xét nghiệm | Tờ | 4,000 |
| 16 | Presept | Viên | 1,000 |
| 17 | QC (nếu thực hiện) * |
| 0,1 |
| 18 | EQAS (nếu thực hiện) * |
| 0,005 |
* Ghi chú:
- Chi phí nội kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình nội kiểm (QC) là 1/10 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lượng ≥ 10 mẫu cho 1 lần tiến hành kỹ thuật).
- Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/200 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 2 lần/1 năm).
3. Bệnh phẩm
Chủng vi khuẩn được xác định là căn nguyên gây bệnh, thuần và mới.
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu phiếu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
Chủng vi khuẩn cần thử nghiệm đã được nuôi cấy thuần nhất trong điều kiện tối ưu và đang ở giai đoạn phát triển mạnh (nuôi cấy sau 16-24 giờ).
2. Tiến hành kỹ thuật
- Chuẩn bị mẫu
- Nạp ống nghiệm và card test đúng loại vào cassette
- Nhập mẫu vào máy
- Khai báo thông tin
- Tạo thông tin bệnh nhân
- Xem kết quả của mẫu
IV. NHẬN ĐỊNH KẾT QUẢ
Chỉ đọc kết quả kháng sinh đồ chủng người bệnh khi kết quả QC đạt. Ghi nhận các kết quả S, I hay R cùng với giá trị MIC.
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
Quy trình này chỉ áp dụng cho các chủng vi khuẩn hiếu kỵ khí tùy tiện dễ nuôi cấy, không áp dụng cho các vi khuẩn kỵ khí bắt buộc.
Sai sót có thể gặp khi:
- Lẫn hai hay nhiều chủng vi khuẩn
- Chọn thẻ làm kháng sinh đồ không phù hợp với chủng vi khuẩn cần thử nghiệm
- Chủng vi khuẩn sau khi pha không được đưa vào máy trong vòng 30 phút
Phải tiến hành làm lại khi thấy các hiện tượng như trên.
8. Vi khuẩn kháng thuốc định lượng MIC (cho 1 loại kháng sinh)
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Xác định mức độ nhạy cảm và nồng độ ức chế tối thiểu của kháng sinh với chủng vi khuẩn gây bệnh.
2. Nguyên lý
Etest là thanh plastic kích thước 5 x 57 mm được phân bổ dải MIC theo g/mL và có mã code tên kháng sinh. Có 15 nồng độ kháng sinh được pha loãng bậc 2 gắn cố định ở một mặt của băng plastic. Khi băng Etest được đặt lên mặt thạch đã dàn vi khuẩn, kháng sinh ở có bậc nồng độ nhanh chóng khuếch tán trong thạch. Sau khi nuôi cấy qua đêm, sẽ xuất hiện vùng ức chế hình elip đối xứng qua thanh plastic. Giá trị MIC được xác định trực tiếp tại điểm cắt của hình elip với thanh Etest. Giá trị MIC sẽ được phiên giải ra phân loại S (sensitive - nhạy cảm), I (intermediate - trung gian), hoặc R (resistant - đề kháng) khi so sánh với bảng chuẩn CLSI cập nhật hàng năm.
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1 . Trang thiết bị
- Tủ ấm
- Tủ an toàn sinh học cấp 2
- Máy lắc
- Ống độ đục chuẩn McFarland 0.5
2.2 . Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Thanh giấy kháng sinh | Cái | 1,000 |
| 2 | Que cấy | Cái | 1,000 |
| 3 | Thạch Muller Hinton | Đĩa | 1,000 |
| 4 | Thạch máu | Đĩa | 1,000 |
| 5 | Giầy kháng sinh đồ | Tờ | 2,000 |
| 6 | Bông | Kg | 0,001 |
| 7 | Cồn 90 độ (vệ sinh dụng cụ) | ml | 10,000 |
| 8 | Panh | Cái | 0,0001 |
| 9 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 10 | Hộp vận chuyển bệnh phẩm | Cái | 0,0001 |
| 11 | Mũ | Cái | 0,050 |
| 12 | Khẩu trang | Cái | 0,050 |
| 13 | Găng tay | Đôi | 3,000 |
| 14 | Găng tay xử lý dụng cụ | Đôi | 0,030 |
| 15 | Quần áo bảo hộ | Bộ | 0,001 |
| 16 | Nước muối sinh lý | ml | 5,000 |
| 17 | Ống nghiệm thủy tinh | Ống | 1,000 |
| 18 | Tăm bông vô trùng | Cái | 1,000 |
| 19 | Bút viết kính | Cái | 0,020 |
| 20 | Bút bi | Cái | 0,010 |
| 21 | Bật lửa | Cái | 0,010 |
| 22 | Sổ lưu kết quả xét nghiệm | Quyển | 0,001 |
| 23 | Cồn sát trùng tay nhanh | ml | 1,000 |
| 24 | Dung dịch nước rửa tay | ml | 8,000 |
| 25 | Khăn lau tay | Cái | 0,050 |
| 26 | QC (nếu thực hiện) * |
| 0,1 |
| 27 | EQAS (nếu thực hiện) * |
| 0,005 |
* Ghi chú:
- Chi phí nội kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình nội kiểm (QC) là 1/10 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lượng ≥ 10 mẫu cho 1 lần tiến hành kỹ thuật).
- Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/200 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 2 lần/1 năm).
3 Bệnh phẩm
Chủng vi khuẩn được xác định là căn nguyên gây bệnh, thuần và mới.
4 Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu phiếu yêu cầu.
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
Chủng vi khuẩn cần thử nghiệm đã được nuôi cấy thuần nhất trong điều kiện tối ưu và đang ở giai đoạn phát triển mạnh (nuôi cấy sau 16-24 giờ).
2. Tiến hành kỹ thuật
2.1. Pha huyền dịch vi khuẩn
Dùng que cấy lấy vi khuẩn từ 3-5 khuẩn lạc có hình thái giống nhau nghiền đều vào ống nước muối sinh lý 5 ml, lắc đều trên máy lắc để có huyền dịch đồng nhất. So sánh độ đục của huyền dịch vi khuẩn với độ đục của ống McFarland 0,5.
2.2. Dàn đều canh khuẩn lên mặt đĩa thạch
Dùng tăm bông vô trùng nhúng vào ống huyền dịch vi khuẩn đã pha ở trên, ép nhẹ và xoay tròn tăm bông trên thành bên của ống huyền dịch vi khuẩn để loại bớt phần huyền dịch vi khuẩn đã thấm vào đầu tăm bông. Sau đó, ria đều que tăm bông trên toàn bộ mặt đĩa thạch Mueller-Hinton sao cho vi khuẩn được dàn đều lên trên toàn bộ bề mặt đĩa thạch
2.3. Đặt các khoanh giấy kháng sinh lên mặt thạch
Đặt thanh Etest lên mặt thạch sao cho mặt có ghi dải nồng độ hướng lên trên và phải đảm bảo toàn bộ bề mặt của thanh Etest được tiếp xúc hoàn toàn với mặt thạch. Khi đã đặt xong thanh Etest không được dịch chuyển thanh Etest khỏi vị trí.
2.4. Ủ đĩa thạch trong tủ ấm 16 - 24 giờ
IV. NHẬN ĐỊNH KẾT QUẢ
1. Chỉ đọc kết quả kháng sinh đồ chủng người bệnh khi kết quả QC đạt.
2. Đọc kết quả
Sau ủ ấm 16 - 24 h và khi thấy rõ vi khuẩn mọc, đọc giá trị MIC ở điểm cắt của hình elip với thanh E-test. Làm tròn giá trị MIC ở điểm giữa hai bậc pha loãng lên giá trị cao hơn một bậc trước khi phiên giải kết quả.
Phiên giải kết quả MIC ra giá trị S, I hoặc R theo tài liệu của CLSI cập nhật hàng năm.
Với các kháng sinh diệt khuẩn, phải đọc giá trị MIC tại điểm vi khuẩn bị ức chế hoàn toàn. Với các kháng sinh kìm khuẩn, phải đọc giá trị MIC tại điểm vi khuẩn bị ức chế 80%.
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
Quy trình này chỉ áp dụng cho các chủng vi khuẩn hiếu kỵ khí tùy tiện dễ nuôi cấy, không áp dụng cho các vi khuẩn kỵ khí bắt buộc.
Sai sót có thể gặp khi:
- Lẫn hai hay nhiều chủng vi khuẩn
- Vi khuẩn mọc quá dày hoặc quá thưa.
Phải tiến hành làm lại khi thấy các hiện tượng như trên.
9. Vi khuẩn kháng sinh phối hợp
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Tìm cặp kháng sinh phối hợp có tác dụng hiệp đồng trên chủng vi khuẩn gây bệnh.
2. Nguyên lý
Xác định tác dụng hiệp đồng, đối kháng hoặc không khác biệt (giá trị MIC) khi thử nghiệm phối hợp 2 kháng sinh khác nhau với vi khuẩn gây bệnh bằng thanh E-test dựa trên chỉ số FIC (Fractional Inhibitory Concentration).
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2. Phương tiện, hóa chất
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
2.1. Trang thiết bị
- Tủ ấm
- Tủ an toàn sinh học cấp 2
- Máy lắc
- Ống độ đục chuẩn McFarland 0.5
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Thanh giấy kháng sinh | Cái | 4,000 |
| 2 | Thạch Muller Hinton | Đĩa | 3,000 |
| 3 | Que cấy | Cái | 1,000 |
| 4 | Thạch máu | Đĩa | 2,000 |
| 5 | Giấy kháng sinh đồ | Tờ | 2,000 |
| 6 | Bông | Kg | 0,001 |
| 7 | Cồn 90 độ (vệ sinh dụng cụ) | ml | 10,000 |
| 8 | Panh | Cái | 0,0001 |
| 9 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 10 | Hộp vận chuyển bệnh phẩm | Cái | 0,0001 |
| 11 | Mũ | Cái | 0,050 |
| 12 | Khẩu trang | Cái | 0,050 |
| 13 | Găng tay | Đôi | 3,000 |
| 14 | Găng tay xử lý dụng cụ | Đôi | 0,030 |
| 15 | Quần áo bảo hộ bảo hộ | Bộ | 0,001 |
| 16 | Nước muối sinh lý | ml | 5,000 |
| 17 | Ống nghiệm thủy tinh | Ống | 1,000 |
| 18 | Tăm bông vô trùng | Cái | 1,000 |
| 19 | Bút viết kính | Cái | 0,020 |
| 20 | Bút bi | Cái | 0,010 |
| 21 | Bật lửa | Cái | 0,010 |
| 22 | Sổ lưu kết quả xét nghiệm | Quyển | 0,001 |
| 23 | Cồn sát trùng tay nhanh | ml | 1,000 |
| 24 | Dung dịch nước rửa tay | ml | 8,000 |
| 25 | Khăn lau tay | Cái | 0,050 |
| 26 | QC (nếu thực hiện) * |
| 0,1 |
| 27 | EQAS (nếu thực hiện) * |
| 0,005 |
* Ghi chú:
- Chi phí nội kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình nội kiểm (QC) là 1/10 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lượng ≥ 10 mẫu cho 1 lần tiến hành kỹ thuật).
- Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/200 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 2 lần/1 năm).
3. Bệnh phẩm
Chủng vi khuẩn được xác định là căn nguyên gây bệnh, thuần và mới.
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu phiếu yêu cầu.
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
- Pha huyền dịch vi khuẩn có độ đục tương ứng với độ đục McFarland 0.5
- Dàn đều canh khuẩn lên mặt 2 đĩa thạch Mueller-Hinton và cấy thuần trên 1 đĩa thạch máu
- Đặt 2 thanh E-test lên 2 đĩa thạch đã dàn đều vi khuẩn
- Ủ các đĩa thạch trong tủ ấm 16 - 18 giờ
- Đọc kết quả giá trị MIC của cả hai kháng sinh
- Pha huyền dịch vi khuẩn có độ đục tương ứng với độ đục McFarland 0.5 rồi dàn đều canh khuẩn lên mặt 1 đĩa thạch Mueller-Hinton và cấy thuần trên 1 đĩa thạch máu
- Đặt 2 thanh E-test vuông góc với nhau, giao nhau tại giá trị MIC của mỗi thanh đã đọc ở bước 5 lên đĩa thạch đã dàn đều vi khuẩn
- Ủ các đĩa thạch trong tủ ấm 16 - 18 giờ
- Đọc kết quả giá trị MIC của cả hai kháng sinh
IV. NHẬN ĐỊNH KẾT QUẢ
Chỉ đọc kết quả kháng sinh đồ chủng người bệnh khi kết quả QC đạt. Đọc kết quả:
- Tính chỉ số FIC (Fractional Inhibitory Concentration)
FIC của kháng sinh A = MIC của kháng sinh A trong thử nghiệm phối hợp/MIC của kháng sinh A thử nghiệm riêng
FIC của kháng sinh B = MIC của kháng sinh B trong thử nghiệm phối hợp/MIC của kháng sinh B thử nghiệm riêng
Chỉ số FIC = FIC của kháng sinh A/ FIC của kháng sinh B
- Phiên giải kết quả chỉ số FIC
o Hai kháng sinh có tác dụng hiệp đồng nếu chỉ số FIC ≤ 0.5
o Hai kháng sinh có tác dụng đối kháng nếu chỉ số FIC > 4
o Hai kháng sinh phối hợp không có tác dụng khác biệt nếu chỉ số FIC ≤ 4 và > 0.5
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
Quy trình này chỉ áp dụng cho các chủng vi khuẩn hiếu kỵ khí tùy tiện dễ nuôi cấy, không áp dụng cho các vi khuẩn kỵ khí bắt buộc.
Những trường hợp tác dụng đối kháng yếu có thể không phát hiện được vì vùng ức chế nằm dưới vùng bắt chéo của hai thanh E-test.
Sai sót có thể gặp khi:
- Lẫn hai hay nhiều chủng vi khuẩn
- Vi khuẩn mọc quá dày hoặc quá thưa.
- Phải tiến hành làm lại khi thấy các hiện tượng như trên.
10. Vi khuẩn kị khí nuôi cấy và định danh
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Phát hiện và định danh vi khuẩn kị khí gây bệnh bằng phương pháp nuôi cấy kinh điển.
2. Nguyên lý
Vi khuẩn được định danh dựa vào đặc điểm nuôi cấy, một số tính chất chuyển hóa, các đặc điểm về hình thái học và có thể kết hợp với tính chất kháng nguyên.
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện: Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ
hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Kính hiển vi quang học
- Tủ an toàn sinh học cấp 2
- Hệ thống máy nuôi cấy vi khuẩn kỵ khí
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Lọ lấy bệnh phẩm | Lọ | 1,000 |
| 2 | Lam kính | Cái | 2,000 |
| 3 | Que cấy | Cái | 2,000 |
| 4 | Dầu soi kính | ml | 1,000 |
| 5 | Cồn 96 độ lau kính | ml | 1,000 |
| 6 | Nước muối sinh lý | ml | 5,000 |
| 7 | Thuốc nhuộm đỏ fuchsin | ml | 5,000 |
| 8 | Thuốc nhuộm tím gentian | ml | 5,000 |
| 9 | Cồn tẩy 95 độ | ml | 10,000 |
| 10 | Lugol | ml | 5,000 |
| 11 | Thuốc nhuộm xanh methylen | ml | 5,000 |
| 12 | Môi trường nuôi cấy kỵ khí | chai | 1,000 |
| 13 | Môi trường thạch máu thường | Đĩa | 2,000 |
| 14 | Môi trường thạch máu kỵ khí | Đĩa | 2,000 |
| 15 | Bộ giá đường API | Test | 1,000 |
| 16 | Bình khí trộn (tính theo giờ) | Giờ | 168,000 |
| 17 | Bơm kim tiêm | Cái | 1,000 |
| 18 | Bông | Kg | 0,001 |
| 19 | Cồn 90 độ (vệ sinh dụng cụ) | ml | 10,000 |
| 20 | Đèn cồn | Cái | 0,0001 |
| 21 | Panh | Cái | 0,0001 |
| 22 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 23 | Hộp vận chuyển bệnh phẩm | Cái | 0,0001 |
| 24 | Mũ | Cái | 0,020 |
| 25 | Khẩu trang | Cái | 0,020 |
| 26 | Găng tay | Đôi | 3,000 |
| 27 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 28 | Quần áo bảo hộ bảo hộ | Bộ | 0,001 |
| 29 | Acid ngâm lam | ml | 10,000 |
| 30 | Ống nghiệm thủy tinh | Ống | 1,000 |
| 31 | Bút viết kính | Cái | 0,020 |
| 32 | Bút bi | Cái | 0,010 |
| 33 | Bật lửa | Cái | 0,010 |
| 34 | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 35 | Cồn sát trùng tay nhanh | ml | 1,000 |
| 36 | Dung dịch nước rửa tay | ml | 8,000 |
| 37 | Khăn lau tay | Cái | 0,030 |
| 38 | Giấy trả kết quả xét nghiệm | Tờ | 2,000 |
| 39 | QC (nếu thực hiện) * |
| 0,1 |
| 39 | EQAS (nếu thực hiện) * |
| 0,005 |
* Ghi chú:
- Chi phí nội kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình nội kiểm (QC) là 1/10 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lượng ≥ 10 mẫu cho 1 lần tiến hành kỹ thuật).
- Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/200 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 2 lần/1 năm).
3. Bệnh phẩm
Tất cả các loại bệnh phẩm được chỉ định nuôi cấy tìm vi khuẩn kỵ khí gây bệnh.
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu phiếu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
Theo đúng quy định của chuyên ngành Vi sinh (Xem Phụ lục 1).
2. Tiến hành kỹ thuật
- Nhuộm soi bệnh phẩm, đánh giá sơ bộ
- Nuôi cấy bệnh phẩm vào môi trường phân lập
- Ủ ấm qua đêm
- Bắt khuẩn lạc nghi ngờ
- Nhuộm soi, thử nghiệm các thử nghiệm sinh vật hóa học đơn giản và định danh bằng các bộ sinh vật hóa học chuyên dụng.
- Tất cả các bước tiến hành và ủ ấm đều được thực hiện bên trong hệ thống máy nuôi cấy vi khuẩn kỵ khí nhằm đảm bảo điều kiện môi trường kị khí.
IV. NHẬN ĐỊNH KẾT QUẢ
- Dương tính: Phân lập và định danh được vi khuẩn gây bệnh. Trả kết quả tên vi khuẩn đến mức độ chi và/hoặc loài.
- Âm tính: Không tìm thấy hoặc không phân lập được vi khuẩn gây bệnh.
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
Quy trình này chỉ áp dụng tìm vi khuẩn kỵ khí bắt buộc và kị khí tùy tiện. Kết quả âm tính không có nghĩa là không có vi khuẩn gây bệnh trong bệnh phẩm mà là không tìm thấy căn nguyên vi khuẩn gây bệnh có thể phân lập được bằng quy trình nuôi cấy này.
Tất cả các thao tác kỹ thuật phải diễn ra bên trong hệ thống máy tạo môi trường kị khí để đảm bảo điều kiện nuôi cấy thích hợp cho vi khuẩn kị khí mọc.
Khí trường sử dụng để nuôi cấy vi khuẩn phải đảm bảo đúng nồng độ.
Nếu có yêu cầu tìm căn nguyên vi khuẩn nào đó, phải ghi yêu cầu cụ thể.
11. Vi khuẩn khẳng định
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Phát hiện vi khuẩn gây bệnh bằng phương pháp nuôi cấy, định danh trên hệ thống tự động.
2. Nguyên lý
Vi khuẩn được định danh bằng máy tự động dựa trên một số tính chất chuyển hóa kết hợp với các đặc điểm về hình thái học và tính chất bắt màu.
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Kính hiển vi quang học
- Tủ ấm thường
- Tủ ấm CO2
- Hệ thống định danh tự động
- Máy đo độ đục
- Lò hấp ướt
- Tủ an toàn sinh học cấp 2
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Lọ lấy bệnh phẩm | Lọ | 1,000 |
| 2 | Lam kính | Cái | 2,000 |
| 3 | Que cấy | Cái | 1,000 |
| 4 | Dầu soi kính | ml | 1,000 |
| 5 | Cồn 96 độ lau kính | ml | 1,000 |
| 6 | Nước muối sinh lý | ml | 5,000 |
| 7 | Thuốc nhuộm đỏ Fuchsin | ml | 5,000 |
| 8 | Thuốc nhuộm tím Gentian | ml | 5,000 |
| 9 | Cồn tẩy 95 độ | ml | 10,000 |
| 10 | Lugol | ml | 5,000 |
| 11 | Thuốc nhuộm xanh methylen | ml | 5,000 |
| 12 | Môi trường nuôi cấy | Đĩa | 3,000 |
| 13 | Panel định danh theo hệ thống máy tự động | Test | 1,000 |
| 14 | Bộ Panel chứng | Bộ | 0,0002 |
| 15 | Bơm kim tiêm | Cái | 1,000 |
| 16 | Bông | Kg | 0,001 |
| 17 | Cồn 90 độ (vệ sinh dụng cụ) | ml | 10,000 |
| 18 | Đèn cồn | Cái | 0,0001 |
| 19 | Panh | Cái | 0,0001 |
| 20 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 21 | Hộp vận chuyển bệnh phẩm | Cái | 0,0001 |
| 22 | Mũ | Cái | 0,020 |
| 23 | Khẩu trang | Cái | 0,020 |
| 24 | Găng tay | Đôi | 3,000 |
| 25 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 26 | Quần áo bảo hộ | Bộ | 0,001 |
| 27 | Acid ngâm lam | ml | 10,000 |
| 28 | Ống nghiệm thủy tinh | Ống | 1,000 |
| 29 | Bút viết kính | Cái | 0,020 |
| 30 | Bút bi | Cái | 0,010 |
| 31 | Bật lửa | Cái | 0,010 |
| 32 | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 33 | Cồn sát trùng tay nhanh | ml | 1,000 |
| 34 | Dung dịch nước rửa tay | ml | 8,000 |
| 35 | Khăn lau tay | Cái | 0,030 |
| 36 | Giấy trả kết quả xét nghiệm | Tờ | 2,000 |
| 37 | QC (nếu thực hiện) * |
| 0,1 |
| 37 | EQAS (nếu thực hiện) * |
| 0,005 |
Bộ Panel sử dụng để kiểm chuẩn được tính trên 5000 Test/1 năm.
* Ghi chú:
- Chi phí nội kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình nội kiểm (QC) là 1/10 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lượng ≥ 10 mẫu cho 1 lần tiến hành kỹ thuật).
- Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/200 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 2 lần/1 năm).
3. Bệnh phẩm
Tất cả các loại bệnh phẩm được chỉ định nuôi cấy tìm vi khuẩn gây bệnh.
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu phiếu yêu cầu.
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
Theo đúng quy định của chuyên ngành Vi sinh (Xem phụ lục 1).
2. Tiến hành kỹ thuật
- Nhuộm soi bệnh phẩm, đánh giá sơ bộ
- Nuôi cấy bệnh phẩm vào môi trường phân lập
- Ủ ấm qua đêm
- Bắt khuẩn lạc nghi ngờ
- Nhuộm soi, thử nghiệm các tính chất sinh vật hóa học đơn giản và định danh bằng hệ thống tự động.
IV. NHẬN ĐỊNH KẾT QUẢ
- Dương tính: Phân lập và định danh được vi khuẩn gây bệnh. Trả kết quả tên vi khuẩn đến mức độ chi và/hoặc loài.
- Âm tính: Không tìm thấy hoặc không phân lập được vi khuẩn gây bệnh.
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
Quy trình này chỉ áp dụng tìm vi khuẩn hiếu kỵ khí tùy tiện dễ nuôi cấy, không áp dụng cho các vi khuẩn kỵ khí bắt buộc. Kết quả âm tính không có nghĩa là không có vi khuẩn gây bệnh trong bệnh phẩm mà là không tìm thấy căn nguyên vi khuẩn gây bệnh có thể phân lập được bằng quy trình nuôi cấy này.
Nếu có yêu cầu tìm căn nguyên vi khuẩn nào đó, phải ghi yêu cầu cụ thể. Bệnh phẩm lấy, vận chuyển và bảo quản không đúng yêu cầu có thể đưa đến kết quả âm tính hoặc dương tính giả (Xem Phụ lục 6).
12. Vi khuẩn định danh PCR
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Chẩn đoán nhanh vi khuẩn trực tiếp từ bệnh phẩm.
2. Nguyên lý
Xác định sự có mặt của gene đặc trưng cho vi khuẩn bằng kỹ thuật PCR.
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện: Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Tủ an toàn Sinh học cấp 2
- Máy PCR
- Máy điện di
- Máy đọc điện di
- Máy ly tâm 25000 x g
- Máy ủ nhiệt
- Máy vortex
- Máy ly tâm dùng cho tube 0,2 ml
- Micropipette
- Tủ âm sâu (-200C)
- Bộ lưu điện.
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
Định mức sinh phẩm và vật tư tiêu hao cho 2 mẫu/lần thực hiện (VD)
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Bông | kg | 0,001 |
| 2 | Cồn | ml | 1,000 |
| 3 | Bơm kim tiêm | Cái | 1,000 |
| 4 | Panh | Cái | 0,0001 |
| 5 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 6 | Hộp vận chuyển bệnh phẩm | Test | 0,001 |
| 7 | Tube đựng bệnh phẩm | Cái | 2,000 |
| 8 | Găng không có bột (DNase-RNase free) | Cái | 0,500 |
| 9 | Sinh phẩm chẩn đoán | Test | 1,000 |
| 10 | Khấu hao sinh phẩm cho kiểm tra lại | Test | 1,350 |
| 11 | Kit tách chiết DNA | Test | 2,350 |
| 12 | DNA marker | Bộ | 1,000 |
| 13 | Primer 1 | ml | 0,0001 |
| 14 | Primer 2 | ml | 0,0001 |
| 15 | Ependoff 1,7ml | Tube | 3,000 |
| 16 | Ependoff 0,2ml | Tube | 1,000 |
| 17 | Đầu côn 10 µl có lọc | Cái | 1,000 |
| 18 | Đầu côn 30 µl | Cái | 1,200 |
| 19 | Đầu côn 200 µl có lọc | Cái | 2,200 |
| 20 | Đầu côn 1 ml có lọc | Cái | 3,200 |
| 21 | Ethanol BDH | ml | 0,500 |
| 22 | Water-DEPC Treated | ml | 2,000 |
| 23 | Giấy thấm | Cuộn | 0,100 |
| 24 | Giấy xét nghiệm | Tờ | 2,000 |
| 25 | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 26 | Bút viết kính | Cái | 0,020 |
| 27 | Bút bi | Cái | 0,010 |
| 28 | Mũ | Cái | 0,020 |
| 29 | Khẩu trang | Cái | 0,020 |
| 30 | Găng tay | Đôi | 0,100 |
| 31 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 32 | Quần áo bảo hộ | Bộ | 0,005 |
| 33 | Dung dịch nước rửa tay | ml | 8,000 |
| 34 | Cồn sát trùng tay nhanh | ml | 1,000 |
| 35 | Dung dịch khử trùng | ml | 10,000 |
| 36 | Khăn lau tay | cái | 0,010 |
| 37 | QC (nếu thực hiện) * |
| 0,100 |
| 38 | EQAS (nếu thực hiện) * |
| 0,005 |
* Ghi chú:
- Chi phí nội kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình nội kiểm (QC) là 1/10 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lượng ≥ 10 mẫu cho 1 lần tiến hành kỹ thuật).
- Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/200 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 2 lần/1 năm).
3. Bệnh phẩm
Vi khuẩn thuần và bệnh phẩm phân lập
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu phiếu yêu cầu.
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
Theo đúng quy định của chuyên ngành Vi sinh (Xem phụ lục 3).
2. Tiến hành kỹ thuật
- Tách chiết DNA tổng số
- Thực hiện PCR
- Điện di kiểm tra sản phẩm
- Đánh giá và kết luận
IV. NHẬN ĐỊNH KẾT QUẢ
Sản phẩm PCR phải có một băng đặc hiệu duy nhất, rõ nét, không bị đứt gẫy và có kích thước tương ứng với đoạn gene đích cần khuếch đại.
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
Khi kết quả khi chứng âm và/hoặc chứng dương không hợp lý, cần phải kiểm tra lại quá trình tách chiết DNA tổng số, chất lượng primers và master mix, sau đó thực hiện lại xét nghiệm.
13. Vi khuẩn định danh giải trình tự gene
I. NGUYÊN LÝ
1. Mục đích
Định danh mọi căn nguyên vi khuẩn gây bệnh đến mức độ chi và hoặc loài.
2. Nguyên lý
Định danh chính xác các loại vi khuẩn dựa trên trình tự nucleotide đặc trưng của gene mã hóa cho 16S rRNA của vi khuẩn bằng kỹ thuật giải trình tự gene.
II. CHUẨN BỊ
1.Người thực hiện
- Người thực hiện: Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Tủ an toàn Sinh học cấp 2
- Máy PCR
- Máy đọc điện di
- Máy giải trình tự gen
- Máy ly tâm 25000 x g
- Máy ủ nhiệt
- Máy vortex
- Máy ly tâm dùng cho tube 0,2 ml
- Micropipette
- Bộ lưu điện
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
Định mức sinh phẩm và vật tư tiêu hao cho 3 mẫu/lần thực hiện (VD)
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Bông | kg | 0,001 |
| 2 | Cồn | ml | 1,000 |
| 3 | Bơm kim tiêm | Cái | 1,000 |
| 4 | Panh | Cái | 0,0001 |
| 5 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 6 | Hộp vận chuyển bệnh phẩm | Test | 0,001 |
| 7 | Tube đựng bệnh phẩm | Cái | 2,000 |
| 8 | Găng không có bột (DNase-RNase free) | Cái | 0,500 |
| 9 | Sinh phẩm chẩn đoán | Test | 1,000 |
| 10 | Khấu hao sinh phẩm cho kiểm tra lại | Test | 1,350 |
| 11 | Kit tách chiết DNA | Test | 2,350 |
| 12 | DNA marker | Bộ | 1,000 |
| 13 | Primer 1 (bộ primer đặc hiệu) | ml | 0,0001 |
| 14 | Primer 2 (bộ primer đặc hiệu) | ml | 0,0001 |
| 15 | Primer 3 (bộ primer đặc hiệu) | ml | 0,0001 |
| 16 | Primer 4 (bộ primer đặc hiệu) | ml | 0,0001 |
| 17 | Ống Eppendorf 1,5 ml | Tube | 3,000 |
| 18 | Ống Eppendorf 0,2 ml | Tube | 1,000 |
| 19 | Đầu côn 10 µl có lọc | Cái | 1,000 |
| 20 | Đầu côn 30 µl | Cái | 1,200 |
| 21 | Đầu côn 200 µl có lọc | Cái | 2,200 |
| 22 | Đầu côn 1 ml có lọc | Cái | 3,200 |
| 23 | Ethanol BDH | ml | 0,500 |
| 24 | Water-DEPC Treated | ml | 2,000 |
| 25 | Giấy thấm | Cuộn | 0,100 |
| 26 | Giấy xét nghiệm | Tờ | 2,000 |
| 27 | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 28 | Bút viết kính | Cái | 0,020 |
| 29 | Bút bi | Cái | 0,010 |
| 30 | Mũ | Cái | 0,020 |
| 31 | Khẩu trang | Cái | 0,020 |
| 32 | Găng tay | Đôi | 0,100 |
| 33 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 34 | Quần áo bảo hộ | Bộ | 0,005 |
| 35 | Dung dịch nước rửa tay | ml | 8,000 |
| 36 | Cồn sát trùng tay nhanh | ml | 1,000 |
| 37 | Dung dịch khử trùng | ml | 10,000 |
| 38 | Khăn lau tay | cái | 0,010 |
| 39 | QC (nếu thực hiện) * |
| 0,100 |
| 40 | EQAS (nếu thực hiện) * |
| 0,005 |
* Ghi chú:
- Chi phí nội kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình nội kiểm (QC) là 1/10 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lượng ≥ 10 mẫu cho 1 lần tiến hành kỹ thuật).
- Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/200 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 2 lần/1 năm).
3. Bệnh phẩm
Chủng vi khuẩn nuôi cấy thuần.
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu phiếu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
Theo đúng quy định của chuyên ngành Vi sinh (Xem phụ lục 3).
2. Tiến hành kỹ thuật
- Tách chiết DNA tổng số
- Thực hiện PCR gene 16S ARN ribosome
- Điện di kiểm tra sản phẩm
- Giải trình tự gene
- Kiểm tra độ tương đồng DNA
IV. NHẬN ĐỊNH KẾT QUẢ
Sản phẩm PCR phải có một băng đặc hiệu duy nhất, rõ nét và không bị đứt gẫy. Trình tự DNA của gene đích được so sánh với các trình tự của gene mã hóa cho 16S rRNA có trên “Genebank” để định danh căn nguyên vi khuẩn cần xác định. Trình tự nucleotide phải có độ tương đồng ≥ 97 % mới có thể kết luận được đến mức độ chi và/hoặc loài.
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
- Trong trường hợp không có sản phẩm PCR, cần phải kiểm tra lại quá trình tách chiết DNA tổng số, chất lượng primers và master mix, và thực hiện lại.
- Nếu trình tự DNA bị nhiễu cần phải kiểm tra lại độ đặc hiệu của sản phẩm PCR hoặc quá trình chạy PCR sequencing bị nhiễm chéo.
14. Vi khuẩn kháng thuốc PCR
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Phát hiện đặc tính kháng thuốc của vi khuẩn thông qua xác định sự có mặt của gene kháng thuốc ở vi khuẩn.
2. Nguyên lý
Sử dụng cặp mồi có trình tự đặc hiệu để xác định sự có mặt của gene kháng thuốc trong vi khuẩn gây bệnh bằng kỹ thuật PCR.
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện: Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Tủ an toàn Sinh học cấp 2
- Máy PCR
- Máy đọc điện di
- Máy ly tâm 25000 x g
- Máy ủ nhiệt
- Máy vortex
- Máy ly tâm dùng cho tube 0,2 ml
- Micropipette
- Bộ lưu điện.
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
Định mức sinh phẩm và vật tư tiêu hao cho 2 mẫu/lần thực hiện (VD)
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Bông | kg | 0,001 |
| 2 | Cồn | ml | 1,000 |
| 3 | Bơm kim tiêm | Cái | 1,000 |
| 4 | Panh | Cái | 0,0001 |
| 5 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 6 | Hộp vận chuyển bệnh phẩm | Test | 0,001 |
| 7 | Tube đựng bệnh phẩm | Cái | 2,000 |
| 8 | Găng không có bột (DNase-RNase free) | Cái | 0,500 |
| 9 | Sinh phẩm chẩn đoán | Test | 1,000 |
| 10 | Khấu hao sinh phẩm cho kiểm tra lại | Test | 1,350 |
| 11 | Kit tách chiết DNA | Test | 2,350 |
| 12 | DNA marker | Bộ | 1,000 |
| 13 | Primer 1 | ml | 0,0001 |
| 14 | Primer 2 | ml | 0,0001 |
| 15 | Ống Eppendorf 1,5 ml | Tube | 3,000 |
| 16 | Ống Eppendorf 0,2 ml | Tube | 1,000 |
| 17 | Đầu côn 10 µl có lọc | Cái | 1,000 |
| 18 | Đầu côn 30 µl | Cái | 1,200 |
| 19 | Đầu côn 200 µl có lọc | Cái | 2,200 |
| 20 | Đầu côn 1 ml có lọc | Cái | 3,200 |
| 21 | Ethanol BDH | ml | 0,500 |
| 22 | Water-DEPC Treated | ml | 2,000 |
| 23 | Giấy thấm | Cuộn | 0,100 |
| 24 | Giấy xét nghiệm | Tờ | 2,000 |
| 25 | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 26 | Bút viết kính | Cái | 0,020 |
| 27 | Bút bi | Cái | 0,010 |
| 28 | Mũ | Cái | 0,020 |
| 29 | Khẩu trang | Cái | 0,020 |
| 30 | Găng tay | Đôi | 0,100 |
| 31 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 32 | Quần áo bảo hộ | Bộ | 0,005 |
| 33 | Dung dịch nước rửa tay | ml | 8,000 |
| 34 | Cồn sát trùng tay nhanh | ml | 1,000 |
| 35 | Dung dịch khử trùng | ml | 10,000 |
| 36 | Khăn lau tay | cái | 0,010 |
| 37 | QC (nếu thực hiện) * |
| 0,100 |
| 38 | EQAS (nếu thực hiện) * |
| 0,005 |
* Ghi chú:
- Chi phí nội kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình nội kiểm (QC) là 1/10 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lượng ≥ 10 mẫu cho 1 lần tiến hành kỹ thuật).
- Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/200 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 2 lần/1 năm).
3. Bệnh phẩm
Bệnh phẩm hoặc chủng vi khuẩn cần xác định đặc tính kháng thuốc.
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu phiếu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
Theo đúng quy định của chuyên ngành Vi sinh (Xem phụ lục 3).
2. Tiến hành kỹ thuật
- Tách chiết DNA tổng số
- Thực hiện PCR
- Điện di kiểm tra sản phẩm
- Đánh giá và kết luận
IV. NHẬN ĐỊNH KẾT QUẢ
Sản phẩm PCR phải có một băng đặc hiệu duy nhất, rõ nét, không bị đứt gẫy và có kích thước tương ứng với đoạn gene đích cần khuếch đại.
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
Khi kết quả khi chứng âm và/hoặc chứng dương không hợp lý, cần phải kiểm tra lại quá trình tách chiết DNA tổng số, chất lượng primers và master mix, sau đó thực hiện lại xét nghiệm.
15. Vi khuẩn kháng thuốc giải trình tự gene
I. NGUYÊN LÝ
1. Mục đích
Phát hiện gene kháng thuốc có trong vi khuẩn gây bệnh.
2.Nguyên lý
Dựa trên trình tự nucleotide đặc trưng của gene mã hóa cho đặc tính kháng thuốc của vi khuẩn bằng kỹ thuật giải trình tự gene.
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện: Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Tủ an toàn Sinh học cấp 2
- Máy PCR
- Máy đọc điện di
- Máy giải trình tự gen
- Máy ly tâm 25000 x g
- Máy ủ nhiệt
- Máy vortex
- Máy ly tâm dùng cho tube 0,2 ml
- Micropipette
- Bộ lưu điện
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
Định mức sinh phẩm và vật tư tiêu hao cho 3 mẫu/lần thực hiện (VD)
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Bông | kg | 0,001 |
| 2 | Cồn | ml | 1,000 |
| 3 | Bơm kim tiêm | Cái | 1,000 |
| 4 | Panh | Cái | 0,0001 |
| 5 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 6 | Hộp vận chuyển bệnh phẩm | Test | 0,001 |
| 7 | Tube đựng bệnh phẩm | Cái | 2,000 |
| 8 | Găng không có bột (DNase-RNase free) | Cái | 0,500 |
| 9 | Sinh phẩm chẩn đoán | Test | 1,000 |
| 10 | Khấu hao sinh phẩm cho kiểm tra lại | Test | 1,350 |
| 11 | Kit tách chiết DNA | Test | 2,350 |
| 12 | DNA marker | Bộ | 1,000 |
| 13 | Primer 1 (bộ primer đặc hiệu) | ml | 0,0001 |
| 14 | Primer 2 (bộ primer đặc hiệu) | ml | 0,0001 |
| 15 | Primer 3 (bộ primer đặc hiệu) | ml | 0,0001 |
| 16 | Primer 4 (bộ primer đặc hiệu) | ml | 0,0001 |
| 17 | Ống Eppendorf 1,5 ml | Tube | 3,000 |
| 18 | Ống Eppendorf 0,2 ml | Tube | 1,000 |
| 19 | Đầu côn 10 µl có lọc | Cái | 1,000 |
| 20 | Đầu côn 30 µl | Cái | 1,200 |
| 21 | Đầu côn 200 µl có lọc | Cái | 2,200 |
| 22 | Đầu côn 1 ml có lọc | Cái | 3,200 |
| 23 | Ethanol BDH | ml | 0,500 |
| 24 | Water-DEPC Treated | ml | 2,000 |
| 25 | Giấy thấm | Cuộn | 0,100 |
| 26 | Giấy xét nghiệm | Tờ | 2,000 |
| 27 | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 28 | Bút viết kính | Cái | 0,020 |
| 29 | Bút bi | Cái | 0,010 |
| 30 | Mũ | Cái | 0,020 |
| 31 | Khẩu trang | Cái | 0,020 |
| 32 | Găng tay | Đôi | 0,100 |
| 33 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 34 | Quần áo bảo hộ | Bộ | 0,005 |
| 35 | Dung dịch nước rửa tay | ml | 8,000 |
| 36 | Cồn sát trùng tay nhanh | ml | 1,000 |
| 37 | Dung dịch khử trùng | ml | 10,000 |
| 38 | Khăn lau tay | cái | 0,010 |
| 39 | QC (nếu thực hiện) * |
| 0,100 |
| 40 | EQAS (nếu thực hiện) * |
| 0,005 |
* Ghi chú:
- Chi phí nội kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình nội kiểm (QC) là 1/10 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lượng ≥ 10 mẫu cho 1 lần tiến hành kỹ thuật).
- Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/200 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 2 lần/1 năm).
3. Bệnh phẩm
Bệnh phẩm hoặc chủng vi khuẩn cần tìm gene kháng thuốc.
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu phiếu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
Theo đúng quy định của chuyên ngành Vi sinh (Xem phụ lục 3).
2. Tiến hành kỹ thuật
- Tách chiết DNA tổng số
- Thực hiện PCR gene kháng thuốc
- Điện di kiểm tra sản phẩm
- Giải trình tự gene
- Kiểm tra sự thay đổi nucleotide của gene kháng thuốc và kết luận
IV. NHẬN ĐỊNH KẾT QUẢ
Sản phẩm PCR phải có một băng đặc hiệu duy nhất, rõ nét và không bị đứt gẫy. Trình tự DNA của gene đích được so sánh với các trình tự của gene của chủng hoang dại trên “Genebank” để xác định sự có mặt của các đột biến kháng thuốc.
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
- Trong trường hợp không có sản phẩm PCR, cần phải kiểm tra lại quá trình tách chiết DNA tổng số, chất lượng primers và master mix, và thực hiện lại.
- Nếu trình tự DNA bị nhiễu cần phải kiểm tra lại độ đặc hiệu của sản phẩm PCR hoặc quá trình chạy PCR sequencing bị nhiễm chéo.
16. Vi hệ đường ruột
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Đánh giá tỷ lệ các loại vi khuẩn có mặt trong phân.
2. Nguyên lý
Dựa vào quan sát hình thể và tính chất bắt màu khi nhuộm đơn và nhuộm Gram để đánh giá một cách tương đối tỷ lệ các loại vi khuẩn Gram âm, Gram dương có mặt trong phân.
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện: Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Kính hiển vi quang học
- Tủ an toàn sinh học cấp 2
- Dụng cụ sấy lam (nếu có)
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Lọ lấy bệnh phẩm | Lọ | 1,000 |
| 2 | Lam kính | Cái | 2,000 |
| 3 | Que cấy | Cái | 1,000 |
| 4 | Dầu soi kính | ml | 1,000 |
| 5 | Cồn 96 độ lau kính | ml | 1,000 |
| 6 | Nước muối sinh lý | ml | 5,000 |
| 7 | Thuốc nhuộm đỏ fuchsin | ml | 5,000 |
| 8 | Thuốc nhuộm tím gentian | ml | 5,000 |
| 9 | Cồn tẩy 95 độ | ml | 10,000 |
| 10 | Lugol | ml | 5,000 |
| 11 | Thuốc nhuộm xanh methylen | ml | 5,000 |
| 12 | Bông | Kg | 0,001 |
| 13 | Cồn 90 độ (vệ sinh dụng cụ) | ml | 10,000 |
| 14 | Đèn cồn | Cái | 0,0001 |
| 15 | Panh | Cái | 0,0001 |
| 16 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 17 | Hộp vận chuyển bệnh phẩm | Cái | 0,0001 |
| 18 | Mũ | Cái | 0,020 |
| 19 | Khẩu trang | Cái | 0,020 |
| 20 | Găng tay | Đôi | 3,000 |
| 21 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 22 | Quần áo bảo hộ | Bộ | 0,001 |
| 23 | Acid ngâm lam | ml | 10,000 |
| 24 | Ống nghiệm thủy tinh | Ống | 1,000 |
| 25 | Bút viết kính | Cái | 0,020 |
| 26 | Bút bi | Cái | 0,010 |
| 27 | Bật lửa | Cái | 0,010 |
| 28 | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 29 | Cồn sát trùng tay nhanh | ml | 1,000 |
| 30 | Dung dịch nước rửa tay | ml | 8,000 |
| 31 | Khăn lau tay | Cái | 0,030 |
| 32 | Giấy trả kết quả xét nghiệm | Tờ | 2,000 |
| 33 | QC (nếu thực hiện) * |
| 0,1 |
| 33 | EQAS (nếu thực hiện) * |
| 0,005 |
* Ghi chú:
- Chi phí nội kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình nội kiểm (QC) là 1/10 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lượng ≥ 10 mẫu cho 1 lần tiến hành kỹ thuật).
- Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/200 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 2 lần/1 năm).
3. Bệnh phẩm: Phân
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu phiếu yêu cầu.
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
Theo đúng quy định của chuyên ngành Vi sinh (Xem Phụ lục 1).
2. Tiến hành kỹ thuật
2.1. Chuẩn bị 2 tiêu bản
2.2. Nhuộm đơn bằng xanh methylene 1 tiêu bản
2.3. Nhuộm Gram 1 tiêu bản
- Nhỏ dung dịch tím gentian, phủ kín nơi dàn đồ phiến, duy trì 1 - 2 phút
- Đổ dung dịch tím gentian, rửa tiêu bản dưới vòi nước chảy nhẹ
- Nhỏ dung dịch lugol, để 30 giây
- Đổ dung dịch lugol, rửa nước
- Tẩy màu: nhỏ vài giọt cồn 95% lên tiêu bản, nghiêng đi nghiêng lại để cho cồn chảy từ cạnh nọ sang cạnh kia. Khi thấy màu tím trên lam kính vừa phai hết thì rửa nước ngay.
- Nhỏ dung dịch đỏ fuchsin, để 1 - 2 phút
- Rửa nước kỹ, để khô tiêu bản, soi kính hiển vi.
IV. NHẬN ĐỊNH KẾT QUẢ
Đánh giá hình ảnh tế bào trên tiêu bản nhuộm đơn. Đánh giá hình ảnh vi khuẩn trên tiêu bản nhuộm Gram
- Soi dưới vật kính dầu (100x)
- Diễn giải và đọc kết quả:
Vi khuẩn Gram (+) bắt màu tím sẫm gentian.
Vi khuẩn Gram (-) bắt màu đỏ fuchsin.
Vi hệ đường ruột bình thường khi có 70% trực khuẩn Gram âm và 30% liên cầu và các trực khuẩn Gram dương khác.
Loạn khuẩn khi tỷ lệ các loại vi khuẩn trên thay đổi và/hoặc xuất hiện bào tử nấm.
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
- Gram dương giả: Tẩy cồn chưa đủ thời gian.
- Gram âm giả:
+ Tuổi của mẫu cấy vi khuẩn ảnh hưởng lên tính chất nhuộm Gram. Ở các mẫu cấy cũ, tế bào Gram dương thường trở thành Gram âm.
+ Tẩy cồn quá lâu và tráng không kỹ.
17. AFB trực tiếp nhuộm Ziehl-Neelsen
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Phát hiện các trực khuẩn bền vững với acid (AFB - acid fast bacillus) thuộc chi Mycobacterium.
2. Nguyên lý
Do đặc tính kháng acid của AFB nên khi được nhuộm bằng phương pháp Ziehl-Neelsen và soi dưới kính hiển vi quang học, hình ảnh của AFB sẽ có màu đỏ, các vi khuẩn và các tế bào (nếu có) không có đặc tính kháng acid sẽ có màu xanh.
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện: Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Tủ an toàn sinh học cấp 2
- Kính hiển vi quang học
- Thiết bị sấy lam (nếu có)
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Dung dịch fuchsin 0,3% | ml | 5,000 |
| 2 | Dung dịch cồn tẩy HCL 3% | ml | 10,000 |
| 3 | Dung dịch xanh methylen 0,3% | ml | 5,000 |
| 4 | Cồn 96 độ (vệ sinh dụng cụ và ngâm lam) | ml | 20,000 |
| 5 | Dung dịch khử khuẩn ngâm que phết đờm | ml | 15,000 |
| 6 | Cồn sát trùng tay nhanh | ml | 2,000 |
| 7 | Dung dịch nước rửa tay | ml | 8,000 |
| 8 | Lọ/cốc/ tuýp lấy bệnh phẩm | Lọ | 1,200 |
| 9 | Que cấy | Cái | 1,000 |
| 10 | Lam kính | Cái | 1,500 |
| 11 | Que phết đờm | Cái | 1,500 |
| 12 | Dầu soi kính | ml | 1,000 |
| 13 | Giấy lau kính | Tờ | 2,000 |
| 14 | Bông | Kg | 0,001 |
| 15 | Đèn cồn | Cái | 0,0001 |
| 16 | Panh | Cái | 0,0001 |
| 17 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 18 | Hộp vận chuyển bệnh phẩm | Cái | 0,0001 |
| 19 | Hộp lưu tiêu bản | Cái | 0,0001 |
| 20 | Bô can (bình chứa) vật nhiễm | Cái | 0,0001 |
| 21 | Mũ | Cái | 0,020 |
| 22 | Khẩu trang | Cái | 0,020 |
| 23 | Găng tay | Đôi | 2,000 |
| 24 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 25 | Quần áo bảo hộ | Bộ | 0,001 |
| 26 | Khăn lau tay | Cái | 0,030 |
| 27 | Túi chứa rác thải lây nhiễm | Cái | 0,0001 |
| 28 | Khăn giấy vệ sinh các bàn làm việc | Tờ | 2,000 |
| 29 | Bút viết kính | Cái | 0,020 |
| 30 | Bút bi | Cái | 0,010 |
| 31 | Bật lửa | Cái | 0,010 |
| 32 | Sổ nhận bệnh phẩm | Tờ | 0,001 |
| 33 | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 34 | Sổ bàn giao kết quả xét nghiệm | Tờ | 0,001 |
| 35 | Giấy trả kết quả xét nghiệm | Tờ | 2,000 |
| 36 | Nhãn mã vạch | Cái | 3,000 |
| 37 | QC (nếu thực hiện) * |
| 0,1 |
| 38 | EQAS (nếu thực hiện) * |
| 0,005 |
* Ghi chú:
- Chi phí nội kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình nội kiểm (QC) là 1/10 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lượng ≥ 10 mẫu cho 1 lần tiến hành kỹ thuật).
- Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/200 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 2 lần/1 năm).
3. Bệnh phẩm
Đờm, dịch phế quản, phân, mủ, dịch não tủy, các loại dịch khác, …
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
Theo đúng quy định của chuyên ngành Vi sinh.
2. Tiến hành kỹ thuật
- Chuẩn bị tiêu bản đạt tiêu chuẩn của CTCLQG
- Cố định tiêu bản
- Nhỏ dung dịch fuchsin phủ kín nơi dàn đồ phiến, hơ nóng cho bốc hơi 3 lần (không được sôi)
- Rửa nước
- Tẩy màu bằng dung dịch cồn acid cho đến khi phai hết màu đỏ
- Rửa nước
- Nhỏ dung dịch xanh methylen phủ lên vùng dàn tiêu bản
- Đọc và đánh giá kết quả tiêu bản trên kính hiển vi quang học
IV. NHẬN ĐỊNH KẾT QUẢ
Quan sát AFB bằng vật kính dầu (x100) trên kính hiển vi quang học. AFB có hình ảnh trực khuẩn mảnh, hơi cong, bắt màu đỏ đứng riêng lẻ hay xếp đôi hoặc từng đám trên nền xanh. Đếm số lượng AFB và ghi kết quả như bảng sau:
| Số lượng AFB | Kết quả | Phân loại |
| Có > 10 AFB/ 1 vi trường (Soi ít nhất 20 vi trường) | Dương tính | 3 + |
| Có từ 1-10 AFB/ 1 vi trường (Soi ít nhất 50 vi trường) | Dương tính | 2 + |
| Có từ 10-99 AFB/ 100 vi trường | Dương tính | 1 + |
| Có từ 1-9 AFB/ 100 vi trường | Dương tính | Ghi số lượng cụ thể |
| Không AFB/ 100 vi trường | Âm tính | |
Lưu ý: 1 dòng tương đương 100 vi trường. Soi ít nhất 1 dòng (tiêu bản dương). Soi ít nhất 3 dòng (tiêu bản âm)
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
- Mỗi mẻ nhuộm không nên quá 12 tiêu bản, các tiêu bản để cách nhau ít nhất 1 cm.
- Tiêu bản vẫn còn màu hồng do tẩy chưa đủ thời gian.
- Tiêu bản có nhiều cặn fuchsin do chưa lọc hóa chất hoặc chai nhuộm không được súc rửa khi cho hóa chất mới.
- Tiêu bản nhìn không rõ vi trường có thể do để ngược tiêu bản, điều chỉnh kính hiển vi chưa đúng...
- AFB nhạt màu có thể do tẩy quá lâu hoặc nhuộm chưa đủ (thời gian, sức nóng).
- Nếu AFB tối màu có thể do nhuộm nền quá lâu.
- Tiêu bản có nhiều muội đen bám phía sau có thể do que đốt hết cồn.
18. AFB trực tiếp nhuộm huỳnh quang
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Phát hiện các trực khuẩn bền vững với acid (AFB - acid fast bacillus) thuộc chi Mycobacterium.
2. Nguyên lý
Với kỹ thuật nhuộm huỳnh quang, AFB được phát hiện bởi hình thể trực khuẩn mảnh phát quang trên nền tối khi soi dưới kính hiển vi huỳnh quang.
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Tủ an toàn sinh học cấp 2
- Kính hiển vi huỳnh quang đèn LED
- Thiết bị sấy lam (nếu có)
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | FAST Auramin O stain | ml | 1,300 |
| 2 | FAST Decolorizer | ml | 1,200 |
| 3 | Cồn 96 độ (vệ sinh dụng cụ và ngâm lam) | ml | 20,000 |
| 4 | Dung dịch khử khuẩn ngâm que phết đờm | ml | 15,000 |
| 5 | Cồn sát trùng tay nhanh | ml | 2,000 |
| 6 | Dung dịch nước rửa tay | ml | 8,000 |
| 7 | Lọ/cốc/ tuýp lấy bệnh phẩm | Lọ | 1,200 |
| 8 | Lam kính | Cái | 1,500 |
| 9 | Que phết đờm | Cái | 1,500 |
| 10 | Giấy lau kính | Tờ | 2,000 |
| 11 | Bông | Kg | 0,001 |
| 12 | Panh | Cái | 0,0001 |
| 13 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 14 | Hộp vận chuyển bệnh phẩm | Cái | 0,0001 |
| 15 | Hộp lưu tiêu bản | Cái | 0,0001 |
| 16 | Bô can (bình chứa) vật nhiễm | Cái | 0,0001 |
| 17 | Mũ | Cái | 0,020 |
| 18 | Khẩu trang | Cái | 0,020 |
| 19 | Găng tay | Đôi | 2,000 |
| 20 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 21 | Quần áo bảo hộ | Bộ | 0,001 |
| 22 | Khăn lau tay | Cái | 0,030 |
| 23 | Túi chứa rác thải lây nhiễm | Cái | 0,0001 |
| 24 | Khăn giấy vệ sinh các bàn làm việc | Tờ | 2,000 |
| 25 | Bút viết kính | Cái | 0,020 |
| 26 | Bút bi | Cái | 0,010 |
| 27 | Sổ nhận bệnh phẩm | Tờ | 0,001 |
| 28 | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 29 | Sổ bàn giao kết quả xét nghiệm | Tờ | 0,001 |
| 30 | Giấy trả kết quả xét nghiệm | Tờ | 2,000 |
| 31 | Nhãn mã vạch | Cái | 3,000 |
| 32 | QC (nếu thực hiện) * |
| 0,1 |
| 33 | EQAS (nếu thực hiện) * |
| 0,005 |
* Ghi chú:
- Chi phí nội kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình nội kiểm (QC) là 1/10 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lượng ≥ 10 mẫu cho 1 lần tiến hành kỹ thuật).
- Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/200 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 2 lần/1 năm).
3. Bệnh phẩm
Đờm, dịch phế quản, phân, mủ, dịch não tủy, các loại dịch khác, …
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
Theo đúng quy định của chuyên ngành Vi sinh (Xem Phụ lục 1).
2. Tiến hành kỹ thuật
- Chuẩn bị tiêu bản đạt tiêu chuẩn của CTCLQG
- Cố định tiêu bản
- Nhuộm màu bằng FAST Auramin O
- Tẩy và nhuộm nền bằng FAST Decolorizer
- Đọc và đánh giá kết quả trên kính hiển vi huỳnh quang đèn LED
IV. NHẬN ĐỊNH KẾT QUẢ
Quan sát AFB bằng vật kính 40 trên kính huỳnh quang đèn LED. AFB có hình ảnh trực khuẩn mảnh, hơi cong, đứng riêng lẻ, xếp đôi, song song hoặc từng đám. AFB bắt màu vàng sáng phát quang trên nền tối. Đếm số lượng AFB và ghi kết quả như bảng sau:
| Số lượng AFB | Kết quả | Mức độ |
| >50AFB/1 vi trường (Đọc ít nhất 8 vi trường) | Dương tính | 3 + |
| 5-50AFB/1 vi trường (Đọc ít nhất 20 vi trường) | Dương tính | 2+ |
| 20-199AFB/1 dòng (Đọc ít nhất 1 dòng) | Dương tính | 1 + |
| 1-19AFB /1 dòng | Dương tính | Ghi số lượng cụ thể |
| 0 AFB /ít nhất 1 dòng | Âm tính | |
Lưu ý: 1 dòng lam tương đương 40 vi trường.
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
- Mỗi mẻ nhuộm không nên quá 12 tiêu bản, các tiêu bản để cách nhau ít nhất 1 cm.
- AFB phát quang yếu có thể do tiêu bản sau khi nhuộm không đọc ngay, tiêu bản bị tiếp xúc nhiều với ánh sáng.
- AFB phát quang yếu có thể do chất lượng hóa chất không đạt do bảo quản chưa đúng, quá hạn.
19. Mycobacterium tuberculosis nuôi cấy môi trường lỏng
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Phát hiện Mycobacterium tuberculosis bằng kỹ thuật nuôi cấy môi trường lỏng.
2. Nguyên lý
Tube MGIT chứa môi trường lỏng Middlebrook 7H9 có oxy hòa tan và 1 hợp chất gồm: chất màu huỳnh quang, tris 4, 7-diphenyl-1, 10-phenonthroline ruthenium chloride pentahydrate được gắn vào lớp silicone ở đáy tube. Khi vi khuẩn phát triển oxy bị tiêu thụ, nồng độ oxy giảm, chất màu huỳnh quang thoát ức chế sẽ phát quang trong tube MGIT, có thể quan sát bằng tia UV. Cường độ phát quang tương ứng với mức độ tiêu thụ oxy, tương ứng nồng độ vi khuẩn phát triển trong tube môi trường. Máy tự động giám sát sự phát quang 60 phút một lần. Vi khuẩn mọc càng nhiều càng tăng độ phát quang.
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện: Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: Cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Tủ an toàn sinh học cấp 2
- Máy li tâm đủ tiêu chuẩn an toàn sinh học, đủ lực ly tâm (>= 3000 g).
- Máy lắc: vortex
- Tủ lạnh
- Cân điện tử: max 220 g, d = 0,1 mg
- Đồng hồ phút
- Kính hiển vi
- Nồi hấp
- Hệ thống máy BACTEC- MGIT 960 hoặc 320
- Pipet loại 100-1000 l.
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| I | Hoá chất |
|
|
| 1 | MGIT tuýp loại 7 ml | tuýp | 1,100 |
| 2 | MGIT supplement - PANTA | ml | 0,900 |
| 3 | KH2PO4 | gam | 0,250 |
| 4 | Na2HPO4 | gam | 0,250 |
| 5 | Cồn 70o | ml | 5,000 |
| 6 | Nước cất | ml | 60,000 |
| 7 | NaOH | gam | 0,020 |
| 8 | NaCitrat | gam | 0,015 |
| 9 | NALC | mg | 25,000 |
| 10 | Dầu soi | ml | 0,100 |
| 11 | Cồn 95o | ml | 4,500 |
| 12 | Cacbol fuchsin | gam | 0,030 |
| 13 | HCL | ml | 0,300 |
| 14 | Phenol | ml | 0,500 |
| 15 | Methylen | gam | 0,030 |
| 16 | Thanh định danh nhanh (SD, TBcID..) | test | 0,400 |
| 17 | Presept 2,5 | viên | 0,050 |
| 18 | Microshiel | ml | 1,000 |
| 19 | Lòng trắng trứng | ml | 0,010 |
| II | Vật tư tiêu hao |
|
|
| 20 | Lam kính | cái | 2,200 |
| 21 | Tuyp nắp xoáy vô trùng 50ml | cái | 1,100 |
| 22 | Pipette Paster nhựa vô trùng | cái | 3,000 |
| 23 | Chai thủy tinh trung tính 1000ml | cái | 0,001 |
| 24 | Que phết đờm | cái | 0,500 |
| 25 | Giấy lau kính hiển vi | tờ | 0,100 |
| 26 | Bông thấm nước | gam | 0,500 |
| 27 | Đầu côn nhựa loại 1ml | cái | 0,010 |
| 28 | Găng tay | đôi | 0,200 |
| 29 | Tuýp 18 x 24 mm | cái | 0,100 |
| 30 | Bô can | cái | 0,010 |
| 31 | Hộp đựng tiêu bản | cái | 0,001 |
| 32 | Túi nilon loại 2 loại chịu nhiệt hấp | cái | 0,050 |
| 33 | Túi rác vàng hủy vật liệu lây nhiễm | cái | 0,020 |
| 34 | Thùng rác có nắp | cái | 0,001 |
| 35 | Thùng vận chuyển vật liệu lây nhiễm | cái | 0,001 |
| 36 | Hộp đựng vật sắc nhọn | cái | 0,003 |
| 37 | Khay đựng bệnh phẩm | cái | 0,001 |
| 38 | Hộp vận chuyển bệnh phẩm | cái | 0,001 |
| 39 | Giá đựng tuýp | cái | 0,001 |
| 40 | Mũ | cái | 0,020 |
| 41 | Khẩu trang | cái | 0,020 |
| 42 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 43 | Quần áo bảo hộ | Bộ | 0,001 |
| 44 | Dung dịch tẩy rửa dụng cụ | ml | 10,000 |
| 45 | Bút chì đen HB | cái | 0,020 |
| 46 | Bút bi | cái | 0,010 |
| 47 | Bật lửa | cái | 0,010 |
| 48 | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 49 | Khăn lau tay | cái | 0,005 |
| 50 | Giấy trả kết quả xét nghiệm | Tờ | 2,000 |
| 51 | Nhãn mã vạch | cái | 4,000 |
| 52 | QC (nếu thực hiện) * |
| 0,1 |
| 53 | EQAS (nếu thực hiện) * |
| 0,005 |
* Ghi chú:
- Chi phí nội kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình nội kiểm (QC) là 1/10 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lượng ≥ 10 mẫu cho 1 lần tiến hành kỹ thuật).
- Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/200 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 2 lần/1 năm).
3. Bệnh phẩm
Đờm, dịch phế quản, phân, mủ, dịch não tủy, các loại dịch khác…
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
Theo đúng quy định của chuyên ngành Vi sinh (Xem Phụ lục 1 và Phụ lục 4).
2. Tiến hành kỹ thuật
2.1. Chuẩn bị môi trường hóa chất
2.2. Xử lý bệnh phẩm, nhuộm soi, nuôi cấy
2.3. Định danh: soi định danh và định danh nhanh bằng sắc kí miễn dịch
2.4. Xử lý vật liệu lây nhiễm
IV. NHẬN ĐỊNH KẾT QUẢ
1. Kết quả nhuộm soi tìm AFB (hướng dẫn của Chương trình chống lao Quốc gia)
| Số lượng AFB | Kết quả | Phân loại |
| Có > 10 AFB/ 1 vi trường (Soi ít nhất 20 vi trường) | Dương tính | AFB 3 (+) |
| Có từ 1-10 AFB/ 1 vi trường (Soi ít nhất 50 vi trường) | Dương tính | AFB 2 (+) |
| Có từ 10-99 AFB/ 100 vi trường | Dương tính | AFB 1 (+) |
| Có từ 1-9 AFB/ 100 vi trường | Dương tính | Ghi số lượng AFB/100 vi trường |
| Không AFB/ 100 vi trường | Âm tính | |
2. Kết quả cấy
- Kết quả cấy dương tính trung bình trong vòng 3 ngày đến 2 tuần: máy tự động đọc và báo kết quả dương tính bằng tín hiệu đèn đỏ và âm thanh, lấy tuýp cấy được máy báo dương ra khỏi máy để định danh.
- Kết quả cấy âm tính được máy báo bằng tín hiệu đèn xanh và âm thanh sau 6 tuần, lấy tuýp cấy được máy báo âm ra khỏi máy quan sát bằng mắt thường để phát hiện tube cấy dương (có cặn vụn) trước khi khẳng định cấy âm tránh bỏ sót các trường hợp cấy dương tính máy không phát hiện được do số lượng vi khuẩn mọc ít.
- Ngoài ra tube cấy máy báo âm tính có đầu vào nhuộm soi dương phải ly tâm lấy cặn nhuộm soi để kiểm tra kết quả.
3. Kết quả định danh
3.1. Soi định danh
Các tube cấy do máy báo dương hoặc quan sát bằng mắt thấy cặn vụn hút cặn làm tiêu bản nhuộm ZN soi định danh gặp các tình huống sau:
- AFB dạng cuộn thừng nghĩ đến M. tuberculosis (MTB)
- AFB hình thể vụn xếp thành đám nghĩ đến NTM
- AFB tạo dạng cuộn thừng lẫn AFB hình thể vụn: nghĩ đến mẫu cấy vừa có MTB vừa có NTM
- AFB dạng cuộn thừng lẫn vi khuẩn khác: mẫu cấy có MTB và ngoại nhiễm
- Không có AFB, có các vi khuẩn khác hoặc nấm mẫu cấy bị ngoại nhiễm
- Soi không thấy gì tiếp tục ủ ấm làm tiêu bản khác sau 3 ngày.
3.2. Định danh nhanh bằng sắc ký miễn dịch (SD, TBcID..)
Những tuýp cấy dương tiến hành soi AFB, định danh nhanh bằng sắc ký miễn dịch (SD, TBcID..) để khẳng định M. tuberculosis complex.
- M. tuberculosis complex có kết quả định danh MTB dương tính
- NTM có kết quả định danh MTB âm tính
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
Máu lẫn trong bệnh phẩm ảnh hưởng đến kết quả cấy, vì vậy các bệnh phẩm lẫn nhiều máu không nuôi cấy lỏng yêu cầu lấy bệnh phẩm khác. Trường hợp dịch lẫn ít máu (tuýp dịch phân thành 2 lớp: dịch trên máu dưới) gạn lấy phần dịch thêm nước cất để phá vỡ hồng cầu trước khi Xử lý.
Nhiễm chéo trong quá trình thao tác kỹ thuật: hạn chế nhiễm chéo bằng cách phân loại nguồn bệnh phẩm dịch, đờm, nghi MDR, người bệnh thường...để Xử lý thích hợp. Không cấy chuyển chủng không làm tiêu bản soi định danh cùng lúc Xử lý bệnh phẩm. Chia nhỏ hóa chất dung dịch đệm, thao tác nhẹ nhàng tránh tạo hạt mù, chắt dung dịch vào thành tuýp. Không mở đồng thời các tuýp mẫu Mỗi mẻ Xử lý 6 - 8 mẫu.
Tỷ lệ ngoại nhiễm cao: giảm ngoại nhiễm bằng cách: Xử lý mẫu càng sớm càng tốt. Mẫu bảo quản 2 - 8 0 C không quá 72 giờ, dịch dạ dày, nước tiểu Xử lý sớm trước 4 giờ kể từ khi lấy mẫu. Tuân thủ quy trình xử lý, nồng độ và thời gian tiếp xúc với hóa chất. Đảm bảo chất lượng môi trường, sinh phẩm, hóa chất, dụng cụ trong hạn và vô trùng.
Nhầm lẫn hành chính: Kiểm tra cẩn thận về hành chính từ khâu nhận bệnh phẩm, vào sổ, trả kết quả, tránh nhầm lẫn. Khi thao tác kỹ thuật xếp mẫu theo thứ tự, tuân thủ qui tắc để cách ô trống đầu tiên.
20. Mycobacterium tuberculosis nuôi cấy môi trường đặc
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Phát hiện Mycobacterium tuberculosis bằng kỹ thuật nuôi cấy môi trường đặc.
2. Nguyên lý
Xác định Mycobacterum tuberculosis có trong bệnh phẩm dựa vào hình ảnh khuẩn lạc mọc trên môi trường đặc, đặc điểm hình thể và các tính chất sinh vật hóa học của vi khuẩn nuôi cấy được.
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện: Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: Cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Tủ an toàn sinh học cấp 2
- Máy li tâm đủ tiêu chuẩn an toàn sinh học, đủ lực li tâm (>= 3000g).
- Máy lắc
- Tủ lạnh
- Cân
- Đồng hồ phút
- Kính hiển vi
- Nồi hấp
- Tủ ấm hoặc buồng ấm (35 - 38oC)
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm).
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| I | Hóa chất |
|
|
| 1 | KH2PO4 | gam | 0,300 |
| 2 | MgSO4 | gam | 0,0033 |
| 3 | MgCitrat | gam | 0,0084 |
| 4 | Asparagin | gam | 0,051 |
| 5 | Glyxerol | ml | 0,168 |
| 6 | Malachite | gam | 0,0026 |
| 7 | Na2HPO4 | gam | 0,250 |
| 8 | Trứng gà | quả | 1/3 |
| 9 | Cồn 70o | ml | 150,000 |
| 10 | Nước cất | ml | 65,000 |
| 11 | NaOH | gam | 0,020 |
| 12 | NaCitrat | gam | 0,015 |
| 13 | NALC | mg | 25,000 |
| 14 | Dầu soi | ml | 0,050 |
| 15 | Cồn 95o | ml | 4,500 |
| 16 | Cacbol fuchsin | gam | 0,015 |
| 17 | HCL | ml | 0,150 |
| 18 | Phenol | ml | 0,250 |
| 19 | Methylen | gam | 0,015 |
| 20 | Thanh định danh Niacin | test | 0,400 |
| 21 | Presept 2,5 | viên | 0,050 |
| 22 | Microshiel | ml | 1,000 |
| II | Vật tư tiêu hao |
|
|
| 23 | Tuyp nắp xoáy vô trùng 50ml | cái | 1,100 |
| 24 | Lam kính | cái | 1,200 |
| 25 | Pipette Paster nhựa vô trùng | cái | 2,000 |
| 26 | Que phết đờm | cái | 0,500 |
| 27 | Giấy lau kính hiển vi | tờ | 0,100 |
| 28 | Gạc lọc | mét | 0,030 |
| 29 | Bông thấm nước | gam | 0,500 |
| 30 | Bông mỡ | gam | 0,500 |
| 31 | Pipette nhựa 10ml | cái | 0,200 |
| 32 | Đầu côn nhựa loại 1ml | cái | 0,010 |
| 33 | Găng tay | đôi | 0,200 |
| 34 | Tuýp thủy tinh trung tính nút xoáy | cái | 0,300 |
| 35 | Tuýp 18 x 24 mm | cái | 0,100 |
| 36 | Bô can | cái | 0,010 |
| 37 | Bình cầu 2000ml | cái | 0,001 |
| 38 | ống đong 500 ml | cái | 0,001 |
| 39 | ống đong 50 ml | cái | 0,001 |
| 40 | Phễu thuỷ tinh 500ml | cái | 0,001 |
| 41 | Cốc mỏ 500ml | cái | 0,001 |
| 42 | Cốc có mỏ 200 ml | cái | 0,001 |
| 43 | Chai thủy tinh trung tính 1000ml | cái | 0,002 |
| 44 | Hộp đựng tiêu bản | cái | 0,001 |
| 45 | Túi nilon loại 2 lớp chịu nhiệt hấp | cái | 0,050 |
| 46 | Túi rác vàng hủy vật liệu lây nhiễm | cái | 0,020 |
| 47 | Thùng rác có nắp | cái | 0,001 |
| 48 | Thùng vận chuyển vật liệu lây nhiễm | cái | 0,001 |
| 49 | Hộp đựng vật sắc nhọn | cái | 0,003 |
| 50 | Khay đựng bệnh phẩm | cái | 0,001 |
| 51 | Hộp vận chuyển bệnh phẩm | cái | 0,001 |
| 52 | Giá đựng tuýp | cái | 0,001 |
| 53 | Khay đựng môi trường | cái | 0,001 |
| 54 | Mũ | cái | 0,020 |
| 55 | Khẩu trang | cái | 0,020 |
| 56 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 57 | Quần áo bảo hộ | Bộ | 0,001 |
| 58 | Dung dịch tẩy rửa dụng cụ | ml | 10,000 |
| 59 | Bút chì đen HB | cái | 0,020 |
| 60 | Bút bi | cái | 0,010 |
| 61 | Bật lửa | cái | 0,010 |
| 62 | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 63 | Khăn lau tay | cái | 0,005 |
| 64 | Giấy trả kết quả xét nghiệm | Tờ | 2,000 |
| 65 | Nhãn mã vạch | cái | 4,000 |
| 66 | QC (nếu thực hiện) * |
| 0,1 |
| 67 | EQAS (nếu thực hiện) * |
| 0,005 |
* Ghi chú:
- Chi phí nội kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình nội kiểm (QC) là 1/10 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lượng ≥ 10 mẫu cho 1 lần tiến hành kỹ thuật).
- Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/200 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 2 lần/1 năm).
3. Bệnh phẩm
Đờm, dịch phế quản, phân, mủ, dịch não tủy, các loại dịch khác…
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
Theo đúng quy định của chuyên ngành Vi sinh (Xem Phụ lục 1 và Phụ lục 6)
2. Tiến hành kỹ thuật
2.1. Chuẩn bị môi trường hóa chất
2.2. Xử lý bệnh phẩm, nhuộm soi, nuôi cấy
Xử lý mẫu càng sớm càng tốt. Mẫu bảo quản 2 - 8 oC không quá 72 giờ. Dịch dạ dày, nước tiểu xử lý sớm trước 4 giờ kể từ khi lấy mẫu.
2.3. Định danh
2.4. Xử lý vật liệu lây nhiễm
IV. NHẬN ĐỊNH KẾT QUẢ
1. Kết quả nhuộm soi
AFB có hình ảnh trực khuẩn mảnh, hơi cong, bắt màu đỏ đứng riêng lẻ hay xếp đôi hoặc từng đám trên nền xanh. Đếm số lượng AFB và ghi kết quả như bảng sau:
| Số lượng AFB | Kết quả | Phân loại |
| Có > 10 AFB/ 1 vi trường (Soi ít nhất 20 vi trường) | Dương tính | AFB 3 (+) |
| Có từ 1-10 AFB/ 1 vi trường | Dương tính | AFB 2 (+) |
| (Soi ít nhất 50 vi trường) |
|
|
| Có từ 10-99 AFB/ 100 vi trường | Dương tính | AFB 1 (+) |
| Có từ 1-9 AFB/ 100 vi trường | Dương tính | Ghi số lượng AFB/100 vi trường |
| Không AFB/ 100 vi trường | Âm tính | |
2. Kết quả cấy
- Kiểm tra nhiễm trùng: sau 24 - 48 giờ
- Kiểm tra sau 72 giờ: mặt môi trường khô, xoáy nắp tuýp tránh bay hơi làm khô môi trường
- Đọc kết quả cấy hàng tuần đến 8 tuần.
- Khuẩn lạc M. tuberculosis điển hình dạng R khô, xù xì giống súp lơ, màu trắng ngà, mọc chậm sau 7 ngày.
Quy định đánh giá kết quả
| Đọc kết quả cấy | Nhận định kết quả cấy |
| Không thấy khuẩn lạc | Âm tính |
| 1 - 19 khuẩn lạc | Dương tính: số khuẩn lạc |
| 20 - 100 khuẩn lạc (mọc 1/3 bề mặt môi trường) | Dương tính: 1 + |
| 100 - 200 khuẩn lạc (mọc ½ bề mặt môi trường) | Dương tính: 2 + |
| 200 - 500 khuẩn lạc (mọc 2/3 bề mặt môi trường) | Dương tính: 3 + |
| > 500 khuẩn lạc (phủ kín toàn bộ bề mặt môi trường) | Dương tính: 4 + |
| Nhiễm vi khuẩn hoặc nấm | Ngoại nhiễm |
3. Kết quả định danh
- M. tuberculosis có kết quả Niacin dương tính
- NTM (non tuberculosis mycobacteria) Niacin âm tính
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
- Tỉ lệ soi âm cấy dương thấp: có thể do khử tạp quá mạnh (nồng độ hóa chất, thời gian tiếp xúc) làm chết vi khuẩn lao.
- Tỉ lệ ngoại nhiễm cao: có thể tăng thể tích hoặc nồng độ hóa chất, không kéo dài thời gian khử nhiễm.
- Nhiễm chéo có thể xảy ra, đề phòng nhiễm chéo: mỗi mẻ chỉ Xử lý 6-8 bệnh phẩm không mở đồng thời các tuýp mẫu. Chia nhỏ lượng dung dịch khử nhiễm và dung dịch đệm, không chắt trực tiếp dung dịch khử nhiễm hay dung dịch đệm vào bệnh phẩm.
21. Mycobacterium tuberculosis Mantoux
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Phát hiện nhiễm Mycobacterium tuberculosis.
2. Nguyên lý
Phản ứng Mantoux bản chất là phản ứng quá mẫn muộn với tuberculin. Tiêm trong da 0.1 ml Tuberculin PPD (protein tinh khiết chiết tách từ vi khuẩn lao) cho người được chỉ định, nếu bị nhiễm lao sẽ có phản ứng dị ứng quá mẫn muộn (sau khi tiêm 72 giờ) tại nơi tiêm. Đọc kết quả phản ứng bằng cách xác định và đo đường kính cục sần hoặc vết phồng rộp.
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện: Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: Cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| I | Hóa chất |
|
|
| 1 | Tuberculin Tùy hãng sản xuất, có loại dung dịch, có loại đông khô và dung môi. | ml | 0,150 |
| 2 | Cồn 70 | ml | 0,300 |
| 3 | Microshiel | ml | 1,000 |
| II | Vật tư tiêu hao |
|
|
| 4 | Bơm tiêm loại 1ml | cái | 1,100 |
| 5 | Kim tiêm cỡ 25 - 26 | cái | 1,100 |
| 6 | Bông thấm nước | gr | 0,050 |
| 7 | Hộp inox đựng bông cồn | cái | 0,001 |
| 8 | Khay inox | cái | 0,001 |
| 9 | Kéo | cái | 0,001 |
| 10 | Panh | cái | 0,001 |
| 11 | Túi rác vàng hủy vật liệu lây nhiễm | cái | 0,020 |
| 12 | Thùng rác có nắp | cái | 0,001 |
| 13 | Hộp đựng vật sắc nhọn | cái | 0,003 |
| 14 | Thước nhựa trong, mềm có chia vạch mm | cái | 0,001 |
| 15 | Mũ | cái | 0,020 |
| 16 | Khẩu trang | cái | 0,020 |
| 17 | Găng tay | Đôi | 0,020 |
| 18 | Quần áo bảo hộ | Bộ | 0,001 |
| 19 | Bút bi | cái | 0,010 |
| 20 | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 21 | Khăn lau tay | cái | 0,005 |
| 22 | Giấy trả kết quả xét nghiệm | Tờ | 2,000 |
3. Bệnh phẩm
Người được chỉ định xét nghiệm
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Chuẩn bị sinh phẩm
2. Tiến hành kỹ thuật
3. Dặn dò, hẹn người bệnh đến đọc kết quả
4. Đọc kết quả
5. Xử lý vật liệu lây nhiễm
IV. NHẬN ĐỊNH KẾT QUẢ
1. Đọc kết quả
Quan sát cục sần, hiện tượng phồng, rộp, đo đường kính cục sần, tính ra mm.
3. Diễn giải kết quả
Biện luận kết quả phụ thuộc vào loại tuberculin và hướng dẫn của nhà sản xuất. Ví dụ Tuberculin RT23 SSI chuẩn quốc tế do viện Statens Serum của Đan Mạch sản xuất: Liều tiêm 02 đơn vị (2TU/ 0,1ml = 0,04 microgam tuberculin PPD)
| Đường kính cục sần | ||
| Âm tính: 0-5mm | Dương tính: 6-14mm | Dương tính mạnh: ≥ 15 mm |
Kết quả dương tính thể hiện đáp ứng miễn dịch theo một trong các tình huống sau:
- Nhiễm Mycobacterium tuberculosis complex.
- Nhiễm NTM.
- Tiền sử tiêm BCG (thường sau 4-8 tuần).
Phản ứng dương tính mạnh thường do nhiễm Mycobacterium tuberculosis complex.
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
1. Phản ứng âm tính giả: Là phản ứng âm tính trong khi người thử phản ứng có mắc bệnh lao: Thể lao tiến triển nặng (lao kê, lao màng não...) phản ứng bị ức chế hoặc
- Tiêm không đúng kỹ thuật, tuberculin bảo quản không đúng qui định về nhiệt độ và thời gian.
- Trong vòng một tháng sau khi người bệnh tiêm vắc xin có chứa virus sống (sởi, quai bị, rubella)
- Người bệnh bị các bệnh nhiễm virus (rubella, cúm,...)
- Người bệnh bị bệnh có suy giảm miễn dịch: Hodgkin, sarcoidosis, HIV
- Người bệnh rối loạn chuyển hoá nặng: Suy thận mãn, suy kiệt thiếu protein, bỏng nặng…
- Người bệnh già hoặc bệnh nhi dưới 6 tuần tuổi.
2. Phản ứng dương tính giả: Là phản ứng dương tính trong khi người được thử phản ứng không bị nhiễm lao (M. tuberculosis): Phản ứng chéo với các NTM.
3. Hiệu ứng không mong muốn
- Dị ứng có thể xảy ra với cá nhân mẫn cảm với thành phần thuốc thử.
Chống chỉ định với người bệnh có tiền sử dị ứng với các thành phần thuốc thử tuberculin. Mặc dù rất hiếm, song cần phải có thuốc cấp cứu trong khi thử Mantoux
- Những cá nhân quá nhạy cảm loét, hoại tử tạo thành sẹo tại chỗ tiêm
- Có thể gặp đau đầu, sốt, nổi hạch nách.
- Có thể xảy ra sưng tấy, đau, ngứa, khó chịu ngay sau khi tiêm
22. Mycobacterium tuberculosis kháng thuốc hàng 1 môi trường đặc
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Xác định mức độ đề kháng của Mycobacterium tuberculosis với các kháng thuốc hàng 1 trên môi trường đặc.
2. Nguyên lý
Huyền dịch M. tuberculosis được pha loãng bậc hai và cấy vào môi trường không thuốc và môi trường có thuốc lao theo nồng độ xác định. Tính tỉ lệ phần trăm giữa số lượng khuẩn lạc mọc trên môi trường có thuốc và môi trường không có thuốc. Xác định sự kháng của M. tuberculosis với từng loại thuốc bằng cách so tỉ lệ trên với ngưỡng kháng: Nếu trên hoặc bằng ngưỡng là vi khuẩn lao kháng thuốc; dưới ngưỡng là vi khuẩn lao nhạy cảm.
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện: Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: Cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Tủ an toàn sinh học cấp 2
- Máy lắc
- Tủ lạnh
- Cân
- Đồng hồ phút.
- Nồi hấp
- Tủ ấm hoặc buồng ấm (35 - 380C)
- Pipet tự động loại 20-100 l
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| I | Hoá chất |
|
|
| 1 | KH2PO4 | gam | 0,100 |
| 2 | MgSO4 | gam | 0,010 |
| 3 | MgCitrat | gam | 0,025 |
| 4 | Asparagin | gam | 0,150 |
| 5 | Glyxerol | ml | 0,500 |
| 6 | Malachite | gam | 0,020 |
| 7 | Trứng gà | quả | 1,000 |
| 8 | Cồn 70o | ml | 70,000 |
| 9 | Nước cất | ml | 65,000 |
| 10 | INH | g | 0,0005 |
| 11 | RIF | g | 0,0005 |
| 12 | SM | g | 0,0006 |
| 13 | EMB | g | 0,0005 |
| 14 | PNB | g | 0,0025 |
| 15 | Dimethylformamide | ml | 0,010 |
| 16 | Propylenglycol | ml | 0,100 |
| 17 | Presept | viên | 0,050 |
| 18 | Microshiel | ml | 1,000 |
| 19 | Mcfarland số 1 | ống | 0,001 |
| 20 | Chủng chuẩn quốc tế H37 Rv | ống | 0,001 |
| II | Vật tư tiêu hao |
|
|
| 21 | Tuýp nhựa vô trùng loại 15 ml | cái | 2,500 |
| 22 | Đầu côn nhựa loại 0,1ml | cái | 2,000 |
| 23 | Tuýp thủy tinh trung tính nút xoáy | cái | 0,300 |
| 24 | Bông thấm nước | gam | 0,500 |
| 25 | Bi thủy tinh 3 mm | viên | 5,000 |
| 26 | Bô can | cái | 0,010 |
| 27 | Găng tay | đôi | 0,200 |
| 28 | Túi nilon loại 2 lớp chịu nhiệt hấp | cái | 0,050 |
| 29 | Túi rác vàng hủy vật liệu lây nhiễm | cái | 0,020 |
| 30 | Thùng rác có nắp | cái | 0,001 |
| 31 | Thùng vận chuyển vật liệu lây nhiễm | cái | 0,001 |
| 32 | Gạc lọc | mét | 0,030 |
| 33 | Bông thấm nước | gam | 0,500 |
| 34 | Pipette nhựa 10ml | cái | 0,200 |
| 35 | Đầu côn nhựa loại 1ml | cái | 0,010 |
| 36 | Găng tay | đôi | 0,200 |
| 37 | Tuýp thủy tinh trung tính nút xoáy | cái | 2,000 |
| 38 | Bình cầu 2000ml | cái | 0,001 |
| 39 | ống đong 500 ml | cái | 0,001 |
| 40 | ống đong 50 ml | cái | 0,001 |
| 41 | Phễu thuỷ tinh 500ml | cái | 0,001 |
| 42 | Cốc mỏ 500ml | cái | 0,001 |
| 43 | Cốc có mỏ 200 ml | cái | 0,001 |
| 44 | Chai thủy tinh trung tính 1000ml | cái | 0,003 |
| 45 | Giấy nháp | tờ | 0,010 |
| 46 | Giá đựng tuýp | cái | 0,001 |
| 47 | Khay đựng môi trường | cái | 0,001 |
| 48 | Mũ | cái | 0,020 |
| 49 | Khẩu trang N95 | cái | 0,020 |
| 50 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 51 | Quần áo bảo hộ | Bộ | 0,001 |
| 52 | Dung dịch tẩy rửa dụng cụ | ml | 10,000 |
| 53 | Bút bi | cái | 0,010 |
| 54 | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 55 | Khăn lau tay | cái | 0,005 |
| 56 | Giấy trả kết quả xét nghiệm | Tờ | 2,000 |
| 57 | Nhãn mã vạch | cái | 10,000 |
| 58 | QC (nếu thực hiện) * |
| 0,1 |
| 59 | EQAS (nếu thực hiện) * |
| 0,005 |
* Ghi chú:
- Chi phí nội kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình nội kiểm (QC) là 1/10 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lượng ≥ 10 mẫu cho 1 lần tiến hành kỹ thuật).
- Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/200 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 2 lần/1 năm).
3. Bệnh phẩm
Chủng đã định danh vi khuẩn lao.
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu yêu cầu.
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Chuẩn bị môi trường dụng cụ
2. Tiến hành kỹ thuật
3. Xử lý vật liệu lây nhiễm
IV. NHẬN ĐỊNH KẾT QUẢ
- Kiểm tra ngoại nhiễm: sau 24 - 48 giờ
- Kiểm tra sau 72 giờ: mặt môi trường khô, xoáy nắp tuýp tránh bay hơi làm khô môi trường
- Theo dõi trong vòng 6 tuần
- Đọc kết quả KSĐ 2 lần sau 4 tuần và sau 6 tuần
- Đánh giá kết quả như kỹ thuật cấy
| Đọc kết quả cấy | Nhận định kết quả cấy |
| Không thấy khuẩn lạc | Âm tính |
| 1 - 19 khuẩn lạc | Dương tính: số khuẩn lạc |
| 20 - 100 khuẩn lạc (ước tính khuẩn lạc mọc 1/3 bề mặt môi trường) | Dương tính: 1 + |
| 100 - 200 khuẩn lạc (ước tính khuẩn lạc mọc ½ bề mặt môi trường) | Dương tính: 2 + |
| 200 - 500 khuẩn lạc (ước tính khuẩn lạc mọc 2/3 bề mặt môi trường) | Dương tính: 3 + |
| > 500 khuẩn lạc (ước tính khuẩn lạc phủ kín toàn bộ bề mặt môi trường) | Dương tính: 4 + |
| Nhiễm vi khuẩn hoặc nấm | Ngoại nhiễm |
So sánh kết quả vi khuẩn lao mọc giữa ống chứng và ống có thuốc, so với ngưỡng kháng < 1% là nhạy cảm, >=1% là kháng thuốc.
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
Khi làm KSĐ, chọn các ống môi trường đều nhau, sản xuất cùng lô cho 1 chủng
- Xếp dụng cụ, để trống vị trí đầu khi thao tác có ô trống tránh nhầm lẫn.
- Gặt chủng hạn chế lẫn môi trường
- Bảo quản chủng ở nhiệt độ 2- 8oC qua đêm nghiền tan dễ dàng hơn
- Lau pipet bằng bông cồn 70o sau khi cấy mỗi chủng
- Kiểm tra lượng huyền dịch đủ 0,1 ml mỗi lần hút
- Thường xuyên theo dõi ủ ấm, phát hiện loại bỏ ngoại nhiễm, làm lại kịp thời.
- Vi khuẩn mọc trên ống LJ - PNB, kiểm tra lại kết quả định danh. Làm lại kháng sinh đồ sớm nhất có thể trong các trường hợp sau:
- Vi khuẩn không mọc trên tuýp chứng
- Số lượng khuẩn lạc trên tuýp chứng ở nồng độ 10-2 < 200 khuẩn lạc (mức độ < 2+), tuýp chứng ở nồng độ 10-4 không mọc.
- Tỷ lệ kháng xấp xỉ ngưỡng kháng.
- Ngoại nhiễm
23. Mycobacterium tuberculosis kháng thuốc hàng 1 môi trường lỏng
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Xác định mức độ kháng thuốc của M. tuberculosis với các thuốc hàng 1 bằng kỹ thuật nuôi cấy môi trường lỏng.
2. Nguyên lý
Hệ thống Bactec MGIT 960 được dùng làm thử nghiệm kháng sinh đồ thuốc lao hàng 1. Hệ thống tự động so sánh lượng vi khuẩn mọc ở tuýp chứa thuốc với tuýp chứng không chứa thuốc, phân tích kết quả và trả lời kết quả nhạy hoặc kháng.
- Chủng vi khuẩn lao được pha theo tỷ lệ qui định, cấy vào môi trường lỏng MGIT có và không có thuốc chống lao, nhập vào máy BACTEC.
- Hệ thống máy BACTEC - MGIT giám sát liên tục sự phát quang của tuýp cấy dựa vào đơn vị sinh trưởng (GU).
- Kết quả KSĐ được báo cáo trong 4-13 ngày khi tuýp chứng đạt 400 GU dựa trên so sánh định lượng sự phát triển của M. tuberculosis trong tuýp chứng và các tuýp có thuốc:
+ Tuýp có thuốc GU < 100 là nhạy cảm
+ Tuýp có thuốc GU > = 100 là kháng thuốc
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện: Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ
hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: Cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Tủ an toàn sinh học loại cấp 2
- Máy lắc vortex
- Tủ lạnh
- Đồng hồ phút.
- Nồi hấp
- Hệ thống máy BACTEC- MGIT 960 hoặc 320
- Pipet loại 20-100 ml và 100-1000 ml.
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| I | Hóa chất |
|
|
| 1 | MGIT tuýp loại 7 ml | tuýp | 5,500 |
| 2 | MGIT supplement - PANTA | ml | 5,000 |
| 3 | SIRE KIT (gồm 4 loại thuốc S, I, R, E tính số ml riêng mỗi loại) | ml | 0,140 |
| 4 | Cồn 70o | ml | 5,000 |
| 5 | Nước cất | ml | 10,000 |
| 6 | Presept 2,5 | viên | 0,050 |
| 7 | Microshiel | ml | 1,000 |
| 8 | Mcfarland 1 | ống | 0,001 |
| 9 | Mcfarland 0.5 | ống | 0,001 |
| II | Vật tư tiêu hao |
|
|
| 10 | Tuyp vô trùng 15ml | cái | 2,000 |
| 11 | Pipette Paster nhựa vô trùng | cái | 3,000 |
| 12 | Chai thủy tinh trung tính 1000ml | cái | 0,001 |
| 13 | Đầu côn nhựa loại 1ml | cái | 2,000 |
| 14 | Đầu côn nhựa loại 0,1 ml | cái | 5,000 |
| 15 | Găng tay | đôi | 1,000 |
| 16 | Bô can | cái | 0,010 |
| 17 | Túi nilon loại 2 lớp chịu nhiệt hấp | cái | 0,050 |
| 18 | Túi rác vàng hủy vật liệu lây nhiễm | cái | 0,020 |
| 19 | Thùng rác có nắp | cái | 0,001 |
| 20 | Thùng vận chuyển vật liệu lây nhiễm | cái | 0,001 |
| 21 | Khay đựng bệnh phẩm | cái | 0,001 |
| 22 | Giá đựng tuýp | cái | 0,001 |
| 23 | Giỏ AST 5 lỗ | cái | 0,001 |
| 24 | Mũ | cái | 0,020 |
| 25 | Khẩu trang | cái | 0,020 |
| 26 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 27 | Quần áo bảo hộ | Bộ | 0,001 |
| 28 | Dung dịch tẩy rửa dụng cụ | ml | 10,000 |
| 29 | Bút bi | cái | 0,010 |
| 30 | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 31 | Khăn lau tay | cái | 0,005 |
| 32 | Giấy trả kết quả xét nghiệm | Tờ | 2,000 |
| 33 | Nhãn mã vạch | cái | 5,000 |
| 34 | QC (nếu thực hiện) * |
| 0,1 |
| 35 | EQAS (nếu thực hiện) * |
| 0,005 |
* Ghi chú:
- Chi phí nội kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình nội kiểm (QC) là 1/10 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lượng ≥ 10 mẫu cho 1 lần tiến hành kỹ thuật).
- Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/200 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 2 lần/1 năm).
3. Bệnh phẩm
- Tuýp cấy MGIT dương đã định danh là MTB
- Hoặc chủng MTB trên LJ
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Chuẩn bị môi trường dụng cụ
2. Tiến hành kỹ thuật
3. Xử lý vật liệu lây nhiễm
IV. NHẬN ĐỊNH KẾT QUẢ
Máy tự động đọc kết quả. Khi có tín hiệu máy báo, lấy bộ AST ra khỏi máy, quét mã vạch, in kết quả KSĐ
- Kết quả KSĐ: Nhạy (S), kháng (R), và không kết luận được (X).
- Kết quả KSĐ được máy báo tại thời điểm tuýp chứng (GC) đủ 400 đơn vị sinh trưởng (GU - growth unit) trong vòng 4-13 ngày. Ngưỡng kháng thuốc là 100. Kết quả nhạy khi tuýp có thuốc có GU <100, kết quả kháng khi tuýp có thuốc có GU > = 100. Kết quả không kết luận được (X) có thể do:
+ GU > 400 thời gian máy báo < 4 ngày, có thể do pha huyền dịch vi khuẩn đặc hoặc chủng nhiễm trùng.
+ Một số chủng kháng thuốc đặc hiệu mọc chậm hoặc huyền dịch vi khuẩn loãng.
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
- Máy không được bảo trì và hiệu chuẩn, phải bảo trì và hiệu chuẩn hệ thống BACTEC MGIT theo định kỳ 6 - 12 tháng, thay ống chuẩn theo lịch.
- Chất lượng môi trường MGIT, SIRE, supplement không đạt: kiểm tra chất lượng trước khi sử dụng, hủy khi sinh phẩm không đạt.
- Máy báo lỗi E 400 và E 200 phải kiểm tra toàn bộ quá trình thực hiện kĩ thuật: có thể do chủng nhiễm, vi khuẩn tạo thành cụm trong huyền dịch, pha huyền dịch đặc hoặc loãng.
- Nhầm lẫn hành chính: Kiểm tra cẩn thận về hành chính từ khâu nhận chủng, vào sổ, trả kết quả, tránh nhầm lẫn. Khi thao tác kỹ thuật xếp chủng theo thứ tự, tuân thủ qui tắc để cách ô trống đầu tiên.
24. Mycobacterium tuberculosis kháng thuốc hàng 2 môi trường đặc
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Xác định mức độ kháng thuốc của Mycobacterium tuberculosis với các thuốc kháng lao hàng 2 bằng kỹ thuật nuôi cấy môi trường đặc.
2. Nguyên lý
Huyền dịch vi khuẩn được pha loãng bậc hai và cấy vào môi trường không thuốc và môi trường có thuốc lao theo nồng độ xác định. Tính tỉ lệ phần trăm giữa số lượng khuẩn lạc mọc trên môi trường có thuốc và môi trường không có thuốc. Xác định sự kháng của vi khuẩn lao với từng loại thuốc bằng cách so tỉ lệ trên với ngưỡng kháng: Nếu trên hoặc bằng ngưỡng là vi khuẩn kháng thuốc; dưới ngưỡng là vi khuẩn nhạy cảm.
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: Cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Tủ an toàn sinh học cấp 2
- Máy lắc
- Tủ lạnh
- Cân
- Đồng hồ phút.
- Nồi hấp
- Tủ ấm hoặc buồng ấm (35 - 38oC)
- Pipet tự động loại 20-100 ml
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| I | Hóa chất |
|
|
| 1 | KH2PO4 | gam | 0,100 |
| 2 | MgSO4 | gam | 0,010 |
| 3 | MgCitrat | gam | 0,025 |
| 4 | Asparagin | gam | 0,150 |
| 5 | Glyxerol | ml | 0,500 |
| 6 | Malachite | gam | 0,020 |
| 7 | Trứng gà | quả | 1,000 |
| 8 | Cồn 70o | ml | 70,000 |
| 9 | Nước cất | ml | 65,000 |
| 10 | OF | g | 0,0005 |
| 11 | AM | g | 0,0005 |
| 12 | KM | g | 0,0006 |
| 13 | CAP | g | 0,0006 |
| 14 | PNB | g | 0,0025 |
| 15 | Propylenglycol | ml | 0,100 |
| 16 | Presept | viên | 0,050 |
| 17 | Microshiel | ml | 1,000 |
| 18 | McFarland số 1 | ống | 0,001 |
| 19 | Chủng chuẩn quốc tế H37 Rv | ống | 0,001 |
| II | Vật tư tiêu hao |
|
|
| 20 | Tuýp nhựa vô trùng loại 15 ml | cỏi | 2,500 |
| 21 | Đầu côn nhựa loại 0,1ml | cái | 2,000 |
| 22 | Tuýp thủy tinh trung tính nút xoáy | cái | 0,300 |
| 23 | Bông thấm nước | gam | 0,500 |
| 24 | Bi thủy tinh 3 mm | viên | 5,000 |
| 25 | Bô can | cái | 0,010 |
| 26 | Găng tay | đôi | 0,200 |
| 27 | Túi nilon loại 2 lớp chịu nhiệt hấp | cái | 0,050 |
| 28 | Túi rác vàng hủy vật liệu lây nhiễm | cái | 0,020 |
| 29 | Thùng rác có nắp | cái | 0,001 |
| 30 | Thùng vận chuyển vật liệu lây nhiễm | cái | 0,001 |
| 31 | Gạc lọc | mét | 0,030 |
| 32 | Bông thấm nước | gam | 0,500 |
| 33 | Pipette nhựa 10ml | cái | 0,200 |
| 34 | Đầu côn nhựa loại 1ml | cái | 0,010 |
| 35 | Găng tay | đôi | 0,200 |
| 36 | Tuýp thủy tinh trung tính nút xoáy | cái | 2,000 |
| 37 | Bình cầu 2000ml | cái | 0,001 |
| 38 | ống đong 500 ml | cái | 0,001 |
| 39 | ống đong 50 ml | cái | 0,001 |
| 40 | Phễu thuỷ tinh 500ml | cái | 0,001 |
| 41 | Cốc mỏ 500ml | cái | 0,001 |
| 42 | Cốc có mỏ 200 ml | cái | 0,001 |
| 43 | Chai thủy tinh trung tính 1000ml | cái | 0,003 |
| 44 | Giấy nháp | tờ | 0,010 |
| 45 | Giá đựng tuýp | cái | 0,001 |
| 46 | Khay đựng môi trường | cái | 0,001 |
| 47 | Mũ | cái | 0,020 |
| 48 | Khẩu trang N95 | cái | 0,020 |
| 49 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 50 | Quần áo bảo hộ | Bộ | 0,001 |
| 51 | Dung dịch tẩy rửa dụng cụ | ml | 10,000 |
| 52 | Bút bi | cái | 0,010 |
| 53 | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 54 | Khăn lau tay | cái | 0,005 |
| 55 | Giấy trả kết quả xét nghiệm | Tờ | 2,000 |
| 56 | Nhãn mã vạch | cái | 10,000 |
| 57 | QC (nếu thực hiện) * |
| 0,1 |
| 58 | EQAS (nếu thực hiện) * |
| 0,005 |
* Ghi chú:
- Chi phí nội kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình nội kiểm (QC) là 1/10 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lượng ≥ 10 mẫu cho 1 lần tiến hành kỹ thuật).
- Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/200 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 2 lần/1 năm).
3. Bệnh phẩm
Chủng đã định danh vi khuẩn lao.
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu yêu cầu.
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Chuẩn bị môi trường dụng cụ
2. Tiến hành kỹ thuật
3. Xử lý vật liệu lây nhiễm
IV. NHẬN ĐỊNH KẾT QUẢ
- Kiểm tra ngoại nhiễm: sau 24 - 48 giờ
- Kiểm tra sau 72 giờ: mặt môi trường khô, xoáy nắp tuýp tránh bay hơi làm khô môi trường
- Theo dõi trong vòng 6 tuần
- Đọc kết quả KSĐ 2 lần sau 4 tuần và sau 6 tuần
- Đánh giá kết quả như kỹ thuật cấy
| Đọc kết quả cấy | Nhận định kết quả cấy |
| Không thấy khuẩn lạc | Âm tính |
| 1 - 19 khuẩn lạc | Dương tính: số khuẩn lạc |
| 20 - 100 khuẩn lạc (ước tính khuẩn lạc mọc 1/3 bề mặt môi trường) | Dương tính: 1 + |
| 100 - 200 khuẩn lạc (ước tính khuẩn lạc mọc ½ bề mặt môi trường) | Dương tính: 2 + |
| 200 - 500 khuẩn lạc (ước tính khuẩn lạc mọc 2/3 bề mặt môi trường) | Dương tính: 3 + |
| > 500 khuẩn lạc (ước tính khuẩn lạc phủ kín toàn bộ bề mặt môi trường) | Dương tính: 4 + |
| Nhiễm vi khuẩn hoặc nấm | Ngoại nhiễm |
So sánh kết quả vi khuẩn mọc giữa ống chứng và ống có thuốc, so với ngưỡng kháng < 1% là nhạy cảm, >=1% là kháng thuốc.
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
Khi làm KSĐ, chọn các ống môi trường đều nhau, sản suất cùng lô cho 1 chủng
- Xếp dụng cụ để trống vị trí đầu khi thao tác có ô trống tránh nhầm lẫn.
- Gặt chủng hạn chế lẫn môi trường
- Bảo quản chủng ở nhiệt độ 2 - 8 oC qua đêm nghiền tan dễ dàng hơn
- Lau pipette bằng bông cồn 70o sau khi cấy mỗi chủng
- Kiểm tra lượng huyền dịch đủ 0,1 ml mỗi lần hút
- Thường xuyên theo dõi quá trình ủ ấm, phát hiện loại bỏ ngoại nhiễm, làm lại kịp thời.
- Vi khuẩn mọc trên ống LJ - PNB, kiểm tra lại kết quả định danh. Làm lại kháng sinh đồ sớm nhất có thể trong các trường hợp sau:
- Vi khuẩn không mọc trên tuýp chứng
- Số lượng khuẩn lạc trên tuýp chứng ở nồng độ 10-2 < 200 khuẩn lạc (mức độ < 2+), tuýp chứng ở nồng độ 10 -4 không mọc.
- Tỷ lệ kháng xấp xỉ ngưỡng kháng.
- Ngoại nhiễm
25. Mycobacterium tuberculosis kháng thuốc hàng 2 môi trường lỏng
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Xác định mức độ đề kháng của M. tuberculosis với các thuốc hàng 2 bằng kỹ thuật nuôi cấy môi trường lỏng.
2. Nguyên lý
Hệ thống Bactec MGIT 960 được dùng làm thử nghiệm kháng sinh đồ thuốc lao hàng hai. Hệ thống tự động so sánh lượng vi khuẩn mọc ở tuýp chứa thuốc với tuýp chứng không chứa thuốc,phân tích kết quả và trả lời kết quả nhạy hoặc kháng.
- Chủng vi khuẩn lao được pha theo tỷ lệ qui định, cấy vào môi trường lỏng MGIT có và không có thuốc chống lao, nhập vào máy Bactec.
- Hệ thống Bactec - MGIT giám sát liên tục sự phát quang của tuýp cấy dựa vào đơn vị sinh trưởng (GU).
- Kết quả KSĐ được báo cáo trong 4-13 ngày khi tuýp chứng đạt 400 GU dựa trên so sánh định lượng sự phát triển của M. tuberculosis trong tuýp chứng và các tuýp có thuốc:
+ Tuýp có thuốc GU < 100 là nhạy cảm
+ Tuýp có thuốc GU > = 100 là kháng thuốc
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: Cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Tủ an toàn sinh học cấp 2
- Máy lắc
- Tủ lạnh
- Đồng hồ phút.
- Nồi hấp
- Hệ thống máy BACTEC- MGIT 960 hoặc 320
- Pipet tự động loại 20-100 ml và 100-1000 ml.
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| I | Hoá chất |
|
|
| 1 | MGIT tuýp loại 7 ml | Tuýp | 5,500 |
| 2 | MGIT supplement - PANTA | Ml | 5,000 |
| 3 | Amikacin | G | 0,0005 |
| 4 | Capreomycin | G | 0,0006 |
| 5 | Ofloxacin | G | 0,0005 |
| 6 | Kanamycin | G | 0,0006 |
| 7 | Cồn 70o | Ml | 5,000 |
| 8 | Nước cất | Ml | 10,000 |
| 9 | Presept 2,5 | Viên | 0,050 |
| 10 | Microshiel | Ml | 1,000 |
| 11 | Mcfarland 1 | ống | 0,001 |
| 12 | Mcfarland 0.5 | ống | 0,001 |
| II | Vật tư tiêu hao |
|
|
| 13 | Tuyp vô trùng 15ml | Cái | 2,000 |
| 14 | Pipette Paster nhựa vô trùng | Cái | 3,000 |
| 15 | Chai thủy tinh trung tính 1000ml | Cái | 0,001 |
| 16 | Đầu côn nhựa loại 1ml | Cái | 2,000 |
| 17 | Đầu côn nhựa loại 0,1 ml | cỏi | 5,000 |
| 18 | Găng tay | Đôi | 1,000 |
| 19 | Bô can | cái | 0,010 |
| 20 | Túi nilon loại 2 lớp chịu nhiệt hấp | cái | 0,050 |
| 21 | Túi rác vàng hủy vật liệu lây nhiễm | cái | 0,020 |
| 22 | Thùng rác có nắp | cái | 0,001 |
| 23 | Thùng vận chuyển vật liệu lây nhiễm | cái | 0,001 |
| 24 | Khay đựng bệnh phẩm | cái | 0,001 |
| 25 | Giá đựng tuýp | cái | 0,001 |
| 26 | Giỏ AST 5 lỗ | cái | 0,001 |
| 27 | Mũ | cái | 0,020 |
| 28 | Khẩu trang | cái | 0,020 |
| 29 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 30 | Quần áo bảo hộ | Bộ | 0,001 |
| 31 | Dung dịch tẩy rửa dụng cụ | ml | 10,000 |
| 32 | Bút bi | cái | 0,010 |
| 33 | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 34 | Khăn lau tay | cái | 0,005 |
| 35 | Giấy trả kết quả xét nghiệm | Tờ | 2,000 |
| 36 | Nhãn mã vạch | cái | 5,000 |
| 37 | QC (nếu thực hiện) * |
| 0,1 |
| 38 | EQAS (nếu thực hiện) * |
| 0,005 |
* Ghi chú:
- Chi phí nội kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình nội kiểm (QC) là 1/10 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lượng ≥ 10 mẫu cho 1 lần tiến hành kỹ thuật).
- Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/200 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 2 lần/1 năm).
3. Bệnh phẩm
Tuýp cấy MGIT dương đã định danh là MTB. Hoặc chủng MTB trên LJ.
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Chuẩn bị môi trường dụng cụ
2. Tiến hành kỹ thuật
3. Xử lý vật liệu lây nhiễm
IV. NHẬN ĐỊNH KẾT QUẢ
Máy tự động đọc kết quả. Khi có tín hiệu máy báo, lấy bộ AST ra khỏi máy, quét mã vạch, in kết quả KSĐ
- Kết quả KSĐ: Nhạy (S); kháng (R), và không kết luận được(X).
- Kết quả KSĐ được máy báo tại thời điểm tuýp chứng (GC) đủ 400 đơn vị sinh trưởng (GU - growth unit) trong vòng 4-13 ngày. Ngưỡng kháng
thuốc là 100. Kết quả nhạy khi tuýp có thuốc có GU <100, kết quả kháng khi tuýp có thuốc có GU > = 100. Kết quả không kết luận được (X) có thể do:
+ GU > 400 thời gian máy báo < 4 ngày, có thể do pha huyền dịch vi khuẩn đặc hoặc chủng nhiễm trùng.
+ Một số chủng kháng thuốc đặc hiệu mọc chậm hoặc huyền dịch vi khuẩn loãng.
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
- Bảo trì và hiệu chuẩn hệ thống BACTEC MGIT theo định kỳ
- Theo dõi và kiểm tra định kỳ chất lượng môi trường MGIT, SIRE, supplement
- Máy báo lỗi E 400 và E 200 phải kiểm tra toàn bộ quá trình thực hiện kĩ thuật: có thể do chủng nhiễm, vi khuẩn tạo thành cụm trong huyền dịch, pha huyền dịch đặc hoặc loãng.
26. Mycobacterium tuberculosis kháng thuốc PZA môi trường lỏng
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Xác định mức độ kháng với pyrazinamid (PZA) của Mycobacterium tuberculosis.
2. Nguyên lý
Hệ thống Bactec MGIT 960 được dùng làm thử nghiệm kháng sinh đồ thuốc lao pyrazinamid. Hệ thống tự động so sánh lượng vi khuẩn mọc ở tuýp chứa thuốc với tuýp chứng không chứa thuốc, phân tích kết quả và trả lời kết quả nhạy hoặc kháng.
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện: Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: Cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Tủ an toàn sinh học cấp 2
- Hệ thống Bactec MGIT 960/320
- Vortex
- Tủ lạnh
- Nồi hấp (khử nhiễm và hấp sạch)
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Tuýp MGIT loại 7 ml | Tuýp | 3,000 |
| 2 | Tuýp MGIT loại 7 ml (kiểm chuẩn) | Tuýp | 0,300 |
| 3 | PZA Supplement | ml | 2,000 |
| 4 | PZA Supplement (kiểm chuẩn) | ml | 0,200 |
| 5 | BD BACTEC MGIT. PZA | ml | 0,150 |
| 6 | BD BACTEC MGIT. PZA (kiểm chuẩn) | ml | 0,015 |
| 7 | Colombia Blood Sheep ( Thạch máu) | đĩa | 1,200 |
| 8 | Mc Farland 1.0 | ml | 0,100 |
| 9 | Mc Farland 0.5 | ml | 0,100 |
| 10 | Nước cất | ml | 15,000 |
| 11 | Presept | viên | 0,500 |
| 12 | Tuýp loại 15 ml | cái | 5,000 |
| 13 | Tuýp thủy tinh nắp xoáy | cái | 1,000 |
| 15 | Bi thủy tinh | viên | 10,000 |
| 16 | Pipet nhựa vô trùng | cái | 3,000 |
| 17 | Que cấy nhựa vô trùng | cái | 1,000 |
| 18 | Đầu côn loại 100 mcl | cái | 5,000 |
| 19 | Đầu côn loại 1ml | cái | 2,000 |
| 20 | Bông | Kg | 0,001 |
| 21 | Cồn 96 độ (vệ sinh dụng cụ) | ml | 10,000 |
| 22 | Panh | Cái | 0,0001 |
| 23 | Khay, giá đựng bệnh phẩm | Cái | 0,0001 |
| 24 | Hộp vận chuyển bệnh phẩm | Cái | 0,0001 |
| 25 | Chai thủy tinh 500 ml | Cái | 0,0001 |
| 26 | Mũ | Cái | 0,020 |
| 27 | Khẩu trang N95 | Cái | 0,050 |
| 28 | Găng tay | Đôi | 3,000 |
| 29 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 30 | Quần áo bảo hộ | Bộ | 0,001 |
| 31 | Túi chứa rác thải lây nhiễm | Cái | 0,0001 |
| 32 | Khăn giấy vệ sinh các bàn làm việc | Tờ | 2,000 |
| 33 | Bút viết kính | Cái | 0,020 |
| 34 | Bút bi | Cái | 0,010 |
| 35 | Túi chứa rác thải lây nhiễm | Cái | 0,0001 |
| 36 | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 37 | Cồn sát trùng tay nhanh | ml | 2,000 |
| 38 | Dung dịch nước rửa tay Microshiel | ml | 1,000 |
| 39 | Khăn lau tay | Cái | 0,030 |
| 40 | Giấy trả kết quả xét nghiệm | Tờ | 2,000 |
| 41 | Nhãn mã vạch | Cái | 4,000 |
| 42 | QC (nếu thực hiện) * |
| 0,1 |
| 43 | EQAS (nếu thực hiện) * |
| 0,005 |
* Ghi chú:
- Chi phí nội kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình nội kiểm (QC) là 1/10 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lượng ≥ 10 mẫu cho 1 lần tiến hành kỹ thuật).
- Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/200 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 2 lần/1 năm).
3. Bệnh phẩm
Chủng vi khuẩn lao (môi trường đặc hoặc lỏng)
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Chuẩn bị chủng vi khuẩn
- Môi trường đặc: ống chủng thuần khiết, đã định danh MTB (+) Pha độ đục tương đương McFarland 0,5
Pha loãng 1:5
- Môi trường lỏng: Ống MGIT (+) đã định danh MTB (+).
Nếu: Máy báo dương ngày 1, 2 không pha loãng
Máy báo dương ngày 3 - 5; pha loãng 1:5
Máy báo dương > 5 ngày: cấy lại ống MGIT khác.
2. Chuẩn bị nồng độ PZA
Pha 2,5 ml nước cất. Hòa tan hoàn toàn.
Cho 0,1 ml vào tuýp MGIT 7 ml (cho 1 bệnh phẩm)
3. Chuẩn bị ống chứng GC
Từ nồng độ Mcfarland số 0,5 pha tỉ lệ 1: 10.
4. Cấy huyền dịch vi khuẩn vào ống chứng và ống PZA
Nồng độ vi khuẩn; 1:5: cấy 0,5 ml ống chứa PZA
1:10: cấy 0,5 ml ống GC
5. Nhập vào máy Bactec-MGIT 960
IV. NHẬN ĐỊNH KẾT QUẢ
Máy Bactec-MGIT tự động kiểm tra 60 phút/ 1 lần. Khi có dấu hiệu kết quả, máy sẽ báo trên màn hình và in kết quả xét nghiệm. Kết quả trong vòng 4 - 21 ngày.
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
- Nồng độ vi khuẩn pha quá đặc. Máy báo không phân tích được.
- Pha nồng độ thuốc, nồng độ vi khuẩn đảm bảo chính xác.
27. Mycobacterium tuberculosis pyrazinamidase
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Phát hiện các chủng M. tuberculosis nhạy cảm với pyrazinamide.
2. Nguyên lý
Phát hiện enzym pyrazinamidase ở chủng M. tuberculosis bằng phản ứng tạo màu đỏ nâu từ sự kết hợp của pyrazinoic với sắt 2. Chủng M. Tuberculosis có enzym pyrazinamidase sẽ nhạy cảm với pyrazinamide, chủng không có enzym pyrazinamidase sẽ đề kháng với pyrazinamide.
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: Cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Tủ an toàn sinh học cấp 2
- Tủ ấm
- Cân phân tích
- Tủ đổ môi trường
- Vortex
- Tủ lạnh
- Nồi hấp (khử nhiễm và hấp sạch)
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Middlebrook 7H11 | mg | 200,000 |
| 2 | Glyxerol | ml | 0,600 |
| 3 | Pyrazinamide | mg | 1,000 |
| 4 | Sodium pyruvate | mg | 20,000 |
| 5 | Ferrous ammonium sulfate (sắt 2) | g | 0,200 |
| 6 | Nước cất | ml | 30,000 |
| 7 | Presept | viên | 0,010 |
| 8 | Tuýp thủy tinh nắp xoáy | cái | 1,200 |
| 9 | Pipet nhựa vô trùng | cái | 3,000 |
| 10 | Que cấy nhựa vô trùng | cái | 1,500 |
| 11 | Đầu côn loại 1ml | cái | 2,000 |
| 12 | Bông | Kg | 0,001 |
| 13 | Cồn 96 độ (vệ sinh dụng cụ) | ml | 10,000 |
| 14 | Panh | Cái | 0,0001 |
| 15 | Khay, giá đựng bệnh phẩm | Cái | 0,0001 |
| 16 | Hộp vận chuyển bệnh phẩm | Cái | 0,0001 |
| 17 | Chai thủy tinh 500 ml | Cái | 0,0001 |
| 18 | Chai thủy tinh 100 ml | Cái | 0,0001 |
| 19 | Ống đong 500 ml | Cái | 0,0001 |
| 20 | Mũ | Cái | 0,020 |
| 21 | Khẩu trang N95 | Cái | 0,050 |
| 22 | Găng tay | Đôi | 3,000 |
| 23 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 24 | Quần áo bảo hộ | Bộ | 0,001 |
| 25 | Túi chứa rác thải lây nhiễm | Cái | 0,0001 |
| 26 | Khăn giấy vệ sinh các bàn làm việc | Tờ | 2,000 |
| 27 | Bút viết kính | Cái | 0,020 |
| 28 | Bút bi | Cái | 0,010 |
| 29 | Túi chứa rác thải lây nhiễm | Cái | 0,0001 |
| 30 | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 31 | Cồn sát trùng tay nhanh | ml | 2,000 |
| 32 | Dung dịch nước rửa tay | ml | 8,000 |
| 33 | Khăn lau tay | Cái | 0,030 |
| 35 | Giấy trả kết quả xét nghiệm | Tờ | 2,000 |
| 36 | Nhãn mã vạch | Cái | 4,000 |
| 37 | QC (nếu thực hiện) * |
| 0,1 |
| 38 | EQAS (nếu thực hiện) * |
| 0,005 |
* Ghi chú:
- Chi phí nội kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình nội kiểm (QC) là 1/10 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lượng ≥ 10 mẫu cho 1 lần tiến hành kỹ thuật).
- Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/200 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 2 lần/1 năm).
3. Bệnh phẩm: Chủng vi khuẩn lao
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Chuẩn bị chủng vi khuẩn
Vi khuẩn lao thuần nhất.
2. Chuẩn bị môi trường PZA
3. Chuẩn bị chứng dương (H37RV hoặc M. avium) và chứng âm (M. bovis BCG) cho mỗi mẻ thử nghiệm.
4. Các bước
- Gặt nhiều khuẩn lạc vi khuẩn lao (ở các vị trí khác nhau của ống chủng)
- Cho lên bề mặt của ống môi trường PZA
- Ủ ấm 37oC/ 4 ngày
- Pha dung dịch 1 % sắt II.
- Nhỏ 1 ml dd 1% sắt II lên bề mặt ống PZA
- Đọc kết quả phản ứng sau 30 phút
IV. NHẬN ĐỊNH KẾT QUẢ
- Dương tính: Xuất hiện băng màu hồng hoặc đỏ nâu: Kết luận: Nhạy cảm với PZA
- Âm tính : Không có băng màu: Kết luận: Kháng với PZA
- Không khẳng định được kết quả: làm lại thử nghiệm
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
Chuẩn bị môi trường đảm bảo chất lượng, bảo quản môi trường ở nhiệt độ 2-8oC.
Chỉ chuẩn bị dung dịch Fe 1% vào ngày thứ 4, ủ ấm ống môi trường khi đọc kết quả thử nghiệm
Chỉ sử dụng Fe II làm thử nghiệm. Nếu Fe III sẽ không cho phản ứng tạo màu.
Dùng nền đen để so màu sẽ tạo sự tương phản tốt.
28. Mycobacterium tuberculosis định danh và kháng RMP XPERT
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Phát hiện sự có mặt của gen đặc trưng cho M. tuberculosis và phát hiện kháng Rifampicin (RMP)
2. Nguyên lý
Xét nghiệm Xpert MTB/RIF được thiết kế để nhân đoạn trình tự 192bp của gene rpoB trên vi khuẩn lao bằng phản ứng PCR (heminested real-time PCR) . Trình tự các đoạn mồi và 5 mẫu dò được thiết kế đặc biệt để có khả năng phát hiện đột biến cao nhất và đảm bảo chắc chắn xác định được vùng thường xuyên xảy ra đột biến chứa 81bp. Mẫu dò huỳnh quang chứa trình tự có thể cặp đôi với AND của chủng hoang dại. Chỉ cần một mẫu dò không bắt cặp là dấu hiệu có đột biến kháng Rif.
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: Cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Hệ thống GeneXpert MTB/RIF
- Tủ an toàn sinh học cấp 2
- Máy Scan mã vạch 2D
- Máy tính điều khiển phần mềm
- Máy in (không bắt buộc)
- UPS 1500 AV
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Giá 1 test bao gồm Cartridge, Dung dịch đệm RS, 1 pipet nhựa | test | 1,200 |
| 2 | Tuýp Falcon 50 ml | tuýp | 1,100 |
| 3 | Găng tay | đôi | 1,000 |
| 4 | Khẩu trang N95 | cái | 0,500 |
| 5 | Khăn giấy | cuộn | 0,200 |
| 6 | Bút đánh dấu | cái | 0,010 |
| 7 | Nhãn mã vạch | Cái | 2,000 |
| 8 | QC (nếu thực hiện) * |
| 0,1 |
| 9 | EQAS (nếu thực hiện) * |
| 0,005 |
* Ghi chú:
- Chi phí nội kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình nội kiểm (QC) là 1/10 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lượng ≥ 10 mẫu cho 1 lần tiến hành kỹ thuật).
- Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/200 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 2 lần/1 năm).
3. Bệnh phẩm
Bệnh phẩm đờm có thể tích tối thiểu là 1ml, tối đa 3ml và có chất nhầy mủ, không được lẫn các dị vật (máu, mảnh vụn thức ăn, đất,...)
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu phiếu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
Theo đúng quy định của chuyên ngành Vi sinh (Xem Phụ lục 2)
2. Tiến hành kỹ thuật
2.1. Xử lý mẫu bệnh phẩm
2.2. Cho mẫu vào Xpert Cartridge
2.3. Vận hành máy GeneXpert
IV. NHẬN ĐỊNH KẾT QUẢ
| Máy báo trên ô “Test Result” | Trả kết quả trên phiếu Xét nghiệm |
| MTB NOT DETECTED | √ vào cột tương ứng |
| MTB DETECTED Rif Resistance DETECTED | √ vào cột tương ứng |
| MTB DETECTED Rif Resistance NOT DETECTED | √ vào cột tương ứng |
| MTB DETECTED Rif Resistance INDETERMINATE | Ghi vào cột “Khác”: Có vi khuẩn lao và không xác định được kháng Rifampicin |
| MTB INVALID | Ghi vào cột “Khác”: Không hợp lệ |
| MTB No RESULT | Ghi vào cột “Khác”: Không có kết quả |
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
| Sự cố | Giải thích | Xử lý |
| 5006/5007/5008/5009 | Sai thể tích tra mẫu vào Cartridge: quá ít hoặc quá nhày | Lặp lại xét nghiệm |
| 2008/2009 | Lỗi phần áp lực vì mẫu quá nhầy hay bịt màng lọc | Lặp lại xét nghiệm |
| INVALID | Đối chứng SPC không được nhân gene | Lặp lại xét nghiệm |
| NO RESULT | Người sử dụng ấn vào nút STOP hoặc Mất điện | Lặp lại xét nghiệm |
| ERROR | Lỗi hoá chất/Cartridge | Lặp lại xét nghiệm |
| Quét mã trên Cartridge | Không nghe thấy tiếng BÍP khi khởi động hệ thống | Cắm lại máy quét mã vạch từ cổng USB khác. |
| Không nhận mã vạch khi quét | Kiểm tra lại phần cài đặt máy quét mã vạch. |
29. Mycobacterium tuberculosis đa kháng LPA
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Phát hiện các gene rpoB (mã hóa cho tiểu phần β của RNA polymerase) đột biến mã hóa cho khả năng kháng Rifampicin, gene Kat G (gene mã hóa cho enzyme catalase - peroxidase) đột biến đột biến mã hóa cho khả năng kháng Isoniazid ở mức độ cao trên và gene inhA (mã hóa cho một NADH enoyl ACP reductase) đột biến mã hóa cho khả năng kháng Isoniazid ở mức độ thấp của các chủng M. tuberculosis.
2. Nguyên lý
Kỹ thuật Genotype MTBDRplus dựa trên công nghệ LPA (Line Probe Assay) bao gồm kỹ thuật PCR và gắn kết các đoạn gene sau khi được nhân lên vào màng lai (STRIP) đã gắn sẵn các mẫu dò chuyên biệt (oligonucleotide probes). Mẫu dò cho phép xác định vi khuẩn lao (Mycobacterium tuberculosis complex) có thể liên kết đặc hiệu với các đoạn gene được nhân lên từ các loài thuộc nhóm này.
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: Cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Tủ an toàn sinh học cấp 2
- Tủ thao tác PCR có đèn tím
- Máy ly tâm an toàn (có nắp đậy từng cối) cho tuýp 50ml
- Máy ly tâm lạnh cho tuýp 1.5ml
- Máy ủ nhiệt khô/ướt
- Máy siêu âm (Ultrasonic)
- Máy PCR
- Lò vi sóng (Microwave Oven)
- Bộ điện di
- Máy lai GT Blot 20
- Tủ lạnh 4oC và tủ lạnh - 20oC
- Nồi hấp khử trùng
- Tủ sấy
- Máy vortex
- Pipette tự động các loại 10P, 20P, 1000P
- Panh, kẹp (Forceps)
- Máy ly tâm mini (Spin down)
- Đồng hồ hẹn giờ
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | MTBDR plus (thế hệ 2 ) | test | 1,370 |
| 2 | NALC | gam | 0,450 |
| 3 | Nước tinh sạch pha PCR mix | ml | 0,700 |
| 4 | NaOH | gam | 0,650 |
| 5 | Natri Citrat | gam | 0,550 |
| 6 | Thạch điện di | gam | 0,100 |
| 7 | TAE x50 | ml | 0,500 |
| 8 | Ethidium Bromid | ml | 0,050 |
| 9 | Nước cất hai lần (ly tâm - Lai DNA) | ml | 90,000 |
| 10 | Tuýp Falcon 50 ml | tuýp | 1,200 |
| 11 | Đầu côn 10 µl | hộp | 0,050 |
| 12 | Đầu côn 100 µl | hộp | 0,050 |
| 13 | Đầu côn 1000 µl | hộp | 0,070 |
| 14 | Eppendorf 0,2 ml | cái | 1,200 |
| 15 | Eppendorf 1,5 ml | cái | 2,40 |
| 16 | Pipette nhựa 5 ml | cái | 1,200 |
| 17 | Pipette nhựa 20 ml | cái | 1,000 |
| 18 | Găng tay | đôi | 1,000 |
| 19 | Khẩu trang N95 | cái | 1,000 |
| 20 | Khăn giấy | cuộn | 0,020 |
| 21 | Cồn 70° | ml | 20,000 |
| 22 | Bút MARKER | cái | 0,010 |
| 23 | Bút chì kim 2B | cái | 0,010 |
| 24 | Băng dính trong | cuộn | 0,010 |
| 25 | Nhãn mã vạch | Cái | 2,000 |
3. Bệnh phẩm
Đờm AFB dương tính/ âm tính; dịch phế quản, dịch màng phổi, dịch hút khí quản; chủng vi khuẩn nuôi cấy lao môi trường lỏng/ đặc.
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu phiếu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
Theo đúng quy định của chuyên ngành Vi sinh (Xem Phụ lục 2).
2. Tiến hành kỹ thuật
2.1. Xử lý mẫu bệnh phẩm
2.2. Tách chiết DNA
2.3. Phản ứng khuếch đại
2.4. Lai tự động trên máy GT-blot 20
IV. NHẬN ĐỊNH KẾT QUẢ
| STT | Băng tín hiệu trên thanh STRIP | Trên phiếu dán thanh STRIP | Trên phiếu trả kết quả |
| 1 | Vùng đối chứng CC (AC) xuất hiện tín hiệu |
|
|
| 1.1 | TUB không hiện băng | Đánh dấu ở cột TUB “N” | Không tìm thấy vi khuẩn lao trong mẫu này |
| 1.2 | TUB hiện băng | Đánh dấu ở cột TUB “P” | Tìm thấy vi khuẩn lao trong mẫu |
| 1.2.1 | Các vùng đối chứng của rpoB/KatG, inhA không xuất hiện |
| Không xác định được có tính kháng R/H hay không |
| 1.2.2 | Các vùng đối chứng của rpoB/KatG, inhA xuất hiện |
|
|
| Tất cả các dải băng- hoang-dại (WT) đều xuất hiện tín hiệu | Đánh dấu ở cột WT của gene tương ứng là “P”. |
| |
| Ít nhất 1 trong số các dải băng-hoang-dại (WT) không xuất hiện tín hiệu | Đánh dấu ở cột WT của gene tương ứng là “N“ |
| |
| Tất cả các băng-đột- biến (MUT) đều không xuất hiện tín hiệu | Đánh dấu ở cột MUT của gene tương ứng “N” |
| |
| Ít nhất 1 trong số các băng-đột-biến (MUT) xuất hiện tín hiệu | Đánh dấu ở cột MUT của gene tương ứng “P” |
| |
| Ở cột WT của gene tương ứng là “N“ và/hoặc ở cột MUT của gene tương ứng “P” | Đánh dấu ở cột resistant của gene tương ứng “+” | Kháng thuốc ở gene tương ứng (R/H) | |
| Ở cột WT của gene tương ứng là “P “ và ở cột MUT của gene tương ứng “N” | Đánh dấu ở cột sensitive của gene tương ứng “+” | Nhạy cảm ở gene tương ứng (R/H) | |
| 2 | Vùng đối chứng CC không xuất hiện tín hiệu |
| Không nhận định được kết quả |
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
| Lỗi | Giải thích |
| Các băng tín hiệu đều yếu kể cả băng CC | - Kiểm tra thiết bị, hóa chất, nhiệt độ. - Nhiệt độ phòng quá thấp hoặc hóa chất không được đưa về đến nhiệt độ phòng. - Nhiệt độ ủ quá thấp - Lượng CON-C và/hoặc SUB-C không đủ - Hóa chất hết hạn |
| Các băng tín hiệu đều yếu hoặc không có, trừ băng CC | - Kiểm tra thiết bị, hóa chất, nhiệt độ. - PNM và HotstarTaq DNA Polymerase rã đông quá nhiều lần (tối ưu 5-6 lần) - PNM, HotstarTaq DNA Polymerase và các thành phần khác của Master Mix bị gia nhiệt. Sử dụng hộp giữ lạnh. - Nhiệt độ ủ quá cao hoặc quá thấp - Độ thuần, tinh sạch trong qúa trình xử lý mẫu - Có chất ức chế trong quá trình tách DNA ảnh hưởng đến quá trình nhân gene. - Kiểm tra sản phẩm PCR bằng điện di trên agarose 2%. Nếu không thấy có sản phẩm PCR thì lặp lại bước tách chiết DNA và PCR; Nếu xuất hiện băng mờ thì tăng lượng mẫu DNA từ 5ml thành 8ml; Nếu các băng sản phẩm PCR nhòe thì pha loãng lượng mẫu DNA. |
| Các băng được nhuộm mầu không đều | - Thanh Strips không hoàn toàn ngập trong dung dịch lai - Lắc khay có vấn đề trong khi lai |
| Mầu nền bị đậm | - Kiểm tra thiết bị, hóa chất, nhiệt độ. - CON-C và/hoặc SUB-C quá đậm đặc - Không đủ dung dịch rửa, bước rửa không sạch - Dung dịch rửa quá lạnh so với nhiệt độ phòng (25oC) - Phụ thuộc vào lượng DNA đem lai mà mầu nền có thể đậm hơn. - Trong trường hợp này thì ngắt SUB-D ngay khi các băng tín hiệu đã nhìn rõ để tránh bị nhòe băng. |
| Các yếu tố khác ảnh hưởng đến kết quả xét nghiệm | - Nhiệt độ ủ sai - Dung dịch lai và nước rửa không được làm ấm và pha trộn trước khi thực hiện. - Nhiễm DNA trong bước tách chiết hoặc/và trong hóa chất sử dụng. Trong trường hợp các hóa chất PCR bị nhiễm thì mẫu đối chứng âm cũng xuất hiện băng. - Bị nhiễm bởi các giếng bên cạnh trong qua trình bổ sung dung dịch lai. |
30. Mycobacterium tuberculosis siêu kháng LPA
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Phát hiện sự có mặt của gene gyrA (mã hóa cho enzim DNA gyrase) đột biến tạo khả năng đề kháng fluoroquinolones (ofloxaxin và moxifloxacin), gene rRNA 16S (rrs) đột biến tạo khả năng đề kháng của các peptit aminoglycosides/cyclic (các thuốc tiêm capreomycin, viomycin/kanamycin, amikacin), gene embB (mã hóa enzim arabinosyl transferase) đột biến tạo khả năng đề kháng ethambutol của M. tuberculosis.
2. Nguyên lý
Kỹ thuật Genotype MTBDRsl dựa trên công nghệ LPA (Line Probe Assay) bao gồm kỹ thuật nhân gene (PCR) và gắn kết các đoạn gene sau khi được nhân lên vào màng lai (STRIP) đã gắn sẵn các mẫu dò chuyên biệt (oligonucleotide probes). Mẫu dò cho phép xác định vi khuẩn lao (Mycobacterium tuberculosis complex) có thể liên kết đặc hiệu với các đoạn gene được nhân lên từ các loài thuộc nhóm này.
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: Cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Tủ an toàn sinh học cấp 2
- Tủ thao tác PCR có đèn tím
- Máy ly tâm an toàn (có nắp đậy từng cối) cho tuýp 50ml
- Máy ly tâm lạnh cho tuýp 1.5ml
- Máy ủ nhiệt khô/ướt
- Máy siêu âm (Ultrasonic)
- Máy PCR
- Lò vi sóng (Microwave Oven)
- Bộ điện di
- Máy lai GT Blot 20
- Tủ lạnh 4oC và tủ lạnh -20oC
- Nồi hấp khử trùng
- Tủ sấy
- Máy vortex
- Pipette tự động các loại 10P, 20P, 1000P
- Panh, kẹp (Forceps)
- Máy ly tâm mini (Spin down)
- Đồng hồ hẹn giờ
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | MTBDRsl | test | 1,370 |
| 2 | NALC | gam | 0,450 |
| 3 | Nước tinh sạch pha PCR mix | ml | 0,700 |
| 4 | NaOH | gam | 0,650 |
| 5 | Natri Citrat | gam | 0,550 |
| 6 | Thạch điện di | gam | 0,100 |
| 7 | TAE x50 | ml | 0,500 |
| 8 | Ethidium Bromid | ml | 0,050 |
| 9 | Nước cất hai lần (ly tâm - Lai DNA) | ml | 90,000 |
| 10 | Tuýp Falcon 50 ml | tuýp | 1,200 |
| 11 | Đầu côn 10 µl | hộp | 0,050 |
| 12 | Đầu côn 100 µl | hộp | 0,050 |
| 13 | Đầu côn 1000 µl | hộp | 0,070 |
| 14 | Eppendorf 0,2 ml | cái | 1,200 |
| 15 | Eppendorf 1,5 ml | cái | 2,400 |
| 16 | Pipette nhựa 5 ml | cái | 1,200 |
| 17 | Pipette nhựa 20 ml | cái | 1,000 |
| 18 | Găng tay | đôi | 1,000 |
| 19 | Khẩu trang N95 | cái | 1,000 |
| 20 | Khăn giấy | cuộn | 0,020 |
| 21 | Cồn 70° | ml | 20,000 |
| 22 | Bút MARKER | cái | 0,010 |
| 23 | Bút chì kim 2B | cái | 0,010 |
| 24 | Băng dính trong | cuộn | 0,010 |
| 25 | Nhãn mã vạch | Cái | 3,000 |
| 26 | QC (nếu thực hiện) * |
| 0,1 |
| 27 | EQAS (nếu thực hiện) * |
| 0,005 |
* Ghi chú:
- Chi phí nội kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình nội kiểm (QC) là 1/10 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lượng ≥ 10 mẫu cho 1 lần tiến hành kỹ thuật).
- Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/200 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 2 lần/1 năm).
3. Bệnh phẩm
Thực hiện xét nghiệm MTBDRsl chủng vi khuẩn nuôi cấy lao lỏng/đặc.
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu phiếu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
Theo đúng quy định của chuyên ngành Vi sinh (Xem Phụ lục 2).
2. Tiến hành kỹ thuật
2.1. Xử lý mẫu bệnh phẩm
2.2. Tách chiết DNA
2.3. Phản ứng khuếch đại
2.4. Lai tự động trên máy GT-blot 20
IV. NHẬN ĐỊNH KẾT QUẢ
| STT | Băng tín hiệu trên thanh STRIP | Trên phiếu dán thanh STRIP | Trên phiếu trả kết quả |
| 1 | Vùng đối chứng CC (AC) xuất hiện tín hiệu |
|
|
| 1.1 | TUB không hiện băng | Đánh dấu ở cột TUB “N” | Không tìm thấy vi khuẩn lao trong mẫu này |
| 1.2 | TUB hiện băng | Đánh dấu ở cột TUB “P” | Tìm thấy vi khuẩn lao trong mẫu |
| 1.2.1 | Các vùng đối chứng của gyrA/rrs/embB không xuất hiện |
| Không xác định được có tính kháng fluoroquinolones/ peptit aminoglycosides/cyclic/ ethambutol hay không |
| 1.2.2 | Các vùng đối chứng của gyrA/rrs/embB xuất hiện |
|
|
| Tất cả các dải băng-hoang-dại (WT) đều xuất hiện tín hiệu | Đánh dấu ở cột WT của gene tương ứng là “P”. |
| |
| Ít nhất 1 trong số các dải băng-hoang-dại (WT) không xuất hiện tín hiệu | Đánh dấu ở cột WT của gene tương ứng là “N” |
| |
| Tất cả các băng-đột-biến (MUT) đều không xuất hiện tín hiệu | Đánh dấu ở cột MUT của gene tương ứng “N” |
| |
| Ít nhất 1 trong số các băng-đột-biến (MUT) xuất hiện tín hiệu | Đánh dấu ở cột MUT của gene tương ứng “P” |
| |
| Ở cột WT của gene tương ứng là “N“ và/hoặc ở cột MUT của gene tương ứng “P” | Đánh dấu ở cột resistant của gene tương ứng “+” | Kháng thuốc ở gene tương ứng (fluoroquinolones/ peptit aminoglycosides/cyclic/ ethambutol ) | |
| Ở cột WT của gene tương ứng là “P “ và ở cột MUT của gene tương ứng “N” | Đánh dấu ở cột sensitive của gene tương ứng “+” | Nhạy cảm ở gene tương ứng (fluoroquinolones/ peptit aminoglycosides/cyclic/ ethambutol ) | |
| 2 | Vùng đối chứng CC không xuất hiện tín hiệu |
| Không nhận định được kết quả |
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
| Lỗi | Giải thích |
| Các băng tín hiệu đều yếu kể cả băng CC | - Kiểm tra thiết bị, hóa chất, nhiệt độ. - Nhiệt độ phòng quá thấp hoặc hóa chất không được đưa về đến nhiệt độ phòng. - Nhiệt độ ủ quá thấp - Lượng CON-C và/hoặc SUB-C không đủ - Hóa chất hết hạn |
| Các băng tín hiệu đều yếu hoặc không có, trừ băng CC | - Kiểm tra thiết bị, hóa chất, nhiệt độ. - PNM và HotstarTaq DNA Polymerase rã đông quá nhiều lần (tối ưu 5-6 lần) - PNM, HotstarTaq DNA Polymerase và các thành phần khác của Master Mix bị gia nhiệt. Sử dụng hộp giữ lạnh. - Nhiệt độ ủ quá cao hoặc quá thấp - Độ thuần, tinh sạch trong qúa trình xử lý mẫu - Có chất ức chế trong quá trình tách DNA ảnh hưởng đến quá trình nhân gene. - Kiểm tra sản phẩm PCR bằng điện di trên agarose 2%. Nếu không thấy có sản phẩm PCR thì lặp lại bước tách chiết DNA và PCR; Nếu xuất hiện băng mờ thì tăng lượng mẫu DNA từ 5ml thành 8ml; Nếu các băng sản phẩm PCR nhòe thì pha loãng lượng mẫu DNA. |
| Các băng được nhuộm mầu không đều | - Thanh Strips không hoàn toàn ngập trong dung dịch lai - Lắc khay có vấn đề trong khi lai |
| Mầu nền bị đậm | - Kiểm tra thiết bị, hóa chất, nhiệt độ. - CON-C và/hoặc SUB-C quá đậm đặc - Không đủ dung dịch rửa, bước rửa không sạch - Dung dịch rửa quá lạnh so với nhiệt độ phòng (25oC) - Phụ thuộc vào lượng DNA đem lai mà mầu nền có thể đậm hơn. - Trong trường hợp này thì ngắt SUB-D ngay khi các băng tín hiệu đã nhìn rõ để tránh bị nhòe băng. |
| Các yếu tố khác ảnh hưởng đến kết quả xét nghiệm | - Nhiệt độ ủ sai - Dung dịch lai và nước rửa không được làm ấm và pha trộn trước khi thực hiện. - Nhiễm DNA trong bước tách chiết hoặc/và trong hóa chất sử dụng. Trong trường hợp các hóa chất PCR bị nhiễm thì mẫu đối chứng âm cũng xuất hiện băng. - Bị nhiễm bởi các giếng bên cạnh trong qua trình bổ sung dung dịch lai. |
31. Mycobacterium tuberculosis PCR hệ thống tự động
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Xác định DNA đặc trưng của Mycoterium tuberculosis
2. Nguyên lý
Dựa trên nguyên lý của kỹ thuật Real-time PCR.
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: Cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Máy COBAS®TaqMan 48 Analyzer (Roche) và hệ thống máy vi tính (VD).
- Bộ lưu điện
- Máy ly tâm dùng cho tube 0,2ml
- Máy ly tâm thường
- Máy ly tâm 25000 x g
- Máy ủ nhiệt
- Máy vortex
- Tủ an toàn sinh học cấp 2
- Tủ lạnh 2 oC - 8 oC
- Tủ âm sâu (-20 oC) hoặc (- 80 oC) (nếu có)
- Micropipettes các thể tích từ 5 ml - 1000 ml.
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
Định mức sinh phẩm và vật tư tiêu hao cho 30 mẫu/lần thực hiện (VD)
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Bông | Kg | 0,001 |
| 2 | Dây garô | Cái | 0,001 |
| 3 | Cồn | ml | 1,000 |
| 4 | Bơm kim tiêm | Cái | 1,000 |
| 5 | Panh | Cái | 0,0001 |
| 6 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 7 | Hộp vận chuyển bệnh phẩm | Test | 0,001 |
| 8 | Lọ nhựa vô trùng | Cái | 2,000 |
| 9 | Găng không có bột tal | Đôi | 0,100 |
| 10 | Sinh phẩm chẩn đoán | Test | 1,000 |
| 11 | Khấu hao sinh phẩm cho chạy chứng, kiểm tra chất lượng | Test | 0,100 |
| 12 | Ngoại kiểm (nếu có)* |
|
|
| 13 | Kít tách DNA | Test | 1,050 |
| 14 | Ống Falcol 50ml | Cái | 0,010 |
| 15 | Ependoff 1,7ml | Tube | 2,000 |
| 16 | Đầu côn 10 µl có lọc | Cái | 2,000 |
| 17 | Đầu côn 30 µl | Cái | 2,000 |
| 18 | Đầu côn 200 µl có lọc | Cái | 2,000 |
| 19 | Đầu côn 1ml có lọc | Cái | 2,000 |
| 20 | K-Tube Rack, for CTM | Cái | 1,050 |
| 21 | Giấy thấm | Cuộn | 0,100 |
| 22 | Giấy xét nghiệm | Tờ | 3,000 |
| 23 | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 24 | Bút viết kính | Cái | 0,020 |
| 25 | Bút bi | Cái | 0,010 |
| 26 | Mũ | Cái | 0,020 |
| 27 | Khẩu trang | Cái | 0,020 |
| 28 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 29 | Quần áo bảo hộ | Bộ | 0,005 |
| 30 | Dung dịch nước rửa tay | ml | 8,000 |
| 31 | Cồn sát trùng tay nhanh | ml | 1,000 |
| 32 | Dung dịch khử trùng | ml | 10,000 |
| 33 | Khăn lau tay | Cái | 0,010 |
* Ghi chú:
- Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/200 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 2 lần/1 năm).
3. Bệnh phẩm
Đờm, dịch phế quản, dịch não tủy, các loại dịch khác, mảnh sinh thiết, phân.
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
Theo đúng quy định của chuyên ngành Vi sinh (Xem Phụ lục 3).
2. Tiến hành kỹ thuật
Bộ sinh phẩm COBAS®TaqMan MTB test - Roche (VD)
2.1. Thu nhận và Xử lý mẫu
Phải đồng nhất và xử lý mẫu trước khi tách chiết DNA
2.2. Tách chiết DNA
2.3. Thực hiện phản ứng real-time PCR
Khuyếch đại DNA, đọc kết kết trên máy COBAS® TaqMan 48
IV. NHẬN ĐỊNH KẾT QUẢ
1. Điều kiện của phản ứng
- Chứng âm: không phát hiện (Target Not Detected).
- Chứng dương: Dương tính (1Positive)
* Không nhận các kết quả của chứng không có giá trị khi xuất hiện thông báo lỗi (cờ báo flags):
- Chứng âm: Invalid (không giá trị)
- Chứng dương: Invalid (không giá trị)
2. Phân tích mẫu
- Mẫu dương tính: 1 Positive hoặc > 1 Positive
- Mẫu âm tính: Target Not Detected
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
Việc lấy mẫu, vận chuyển và bảo quản không đúng tiêu chuẩn có thể dẫn đến kết quả sai, cho dù phản ứng được thực hiện đúng.
32. Mycobacterium tuberculosis Real-time PCR
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Phát hiện gene đặc trưng của Mycobacterium tuberculosis trong các loại bệnh phẩm (đờm, dịch phế quản, các loại dịch sinh học, phân hoặc mảnh sinh thiết).
2. Nguyên lý
Xác định sự có mặt gene đặc trưng của Mycobacterium tuberculosis dựa trên nguyên lý của kỹ thuật Real-time PCR.
II. CHUẨN BỊ
1.Người thực hiện
- Người thực hiện Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Máy real-time PCR và hệ thống máy vi tính.
- Bộ lưu điện
- Tủ an toàn sinh học cấp 2
- Máy ly tâm dùng cho tube 0,2ml
- Máy ly tâm 25000 x g
- Máy ủ nhiệt
- Máy vortex
- Tủ lạnh 2 oC - 8 oC
- Tủ âm sâu (- 20 oC) hoặc (-70 oC) (nếu có)
- Micropipettes các thể tích từ 5 ml - 1000 ml.
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
Định mức sinh phẩm và vật tư tiêu hao cho 10 mẫu/lần thực hiện (VD)
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Lọ vô trùng | Cái | 1.000 |
| 2 | Bơm kim tiêm 10 ml | Cái | 1,000 |
| 3 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 4 | Hộp vận chuyển bệnh phẩm | Cái | 0,001 |
| 5 | Găng không có bột tal | Đôi | 0,020 |
| 6 | Sinh phẩm chẩn đoán | Test | 1,000 |
| 7 | Khấu hao sinh phẩm cho chạy chứng, kiểm tra chất lượng | Test | 0,300 |
| 8 | Kit tách DNA | Test | 1,300 |
| 9 | Ngoại kiểm (nếu có)* |
| 0,020 |
| 10 | Ống Falcol 50ml | Cái | 1,000 |
| 11 | Ependoff 1,7ml | Tube | 2,200 |
| 12 | Ependoff 0,2ml | Tube | 2,200 |
| 13 | Đầu côn 10 µl có lọc | Cái | 2,200 |
| 14 | Đầu côn 30 µl | Cái | 1,200 |
| 15 | Đầu côn 200 µl có lọc | Cái | 5,200 |
| 16 | Đầu côn 1 ml có lọc | Cái | 3,200 |
| 17 | Giấy thấm | Cuộn | 0,100 |
| 18 | Giấy xét nghiệm | Tờ | 2,000 |
| 19 | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 20 | Bút viết kính | Cái | 0,020 |
| 21 | Bút bi | Cái | 0,010 |
| 22 | Mũ | Cái | 0,020 |
| 23 | Khẩu trang | Cái | 0,020 |
| 24 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 25 | Quần áo bảo hộ | Bộ | 0,005 |
| 26 | Dung dịch nước rửa tay | ml | 8,000 |
| 27 | Cồn sát trùng tay nhanh | ml | 1,000 |
| 28 | Dung dịch khử trùng | ml | 10,000 |
| 29 | Khăn lau tay | Cái | 0,010 |
* Ghi chú: Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/50 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 3 lần/1 năm).
3. Bệnh phẩm
Đờm, dịch phế quản, dịch não tủy, các loại dịch khác, mảnh sinh thiết, phân.
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1.Lấy bệnh phẩm
- Theo đúng quy định của chuyên ngành Vi sinh (Xem phụ lục 3).
- Từ chối những bệnh phẩm không đạt yêu cầu (Xem phụ lục 6).
2.Tiến hành kỹ thuật
Bộ sinh phẩm Mycobacterium tuberculosis PCR Kit - GeneProof (VD)
2.1. Thu nhận và Xử lý mẫu
Phải đồng nhất và xử lý mẫu trước khi tách chiết DNA (nếu cần)
2.2. Tách chiết DNA
2.3. Thực hiện phản ứng real-time PCR
- Thực hiện bước này với tube PCR mix được giữ trong khay lạnh hoặc đá đang tan.
- Chỉ lấy đủ số tube PCR 0,2 ml cần dùng. Phân phối MasterMix vào từng tube.
- Cho chứng +, chứng - hoặc dịch DNA tách chiết vào từng tube MasterMix Xong, đặt các tube vào máy real-time PCR.
- Khởi động máy real-time PCR. Khởi động máy tính và chương trình real-time PCR.
- Cài đặt vị trí mẫu và chứng trên phần mềm đúng với vị trí mẫu đã đặt trên máy real-time PCR.
- Chọn màu “FAM” và “JOE” cho mẫu, chứng dương và chứng âm.
- Cài đặt chương trình cho máy real-time PCR hoạt động
- Lưu file dữ liệu vào máy tính
- Cho máy real-time PCR chạy chương trình.
IV. NHẬN ĐỊNH KẾT QUẢ
1. Điều kiện của phản ứng
- Chứng dương có đường biểu diễn tín hiệu huỳnh quang màu FAM tuyến tính vượt quá tín hiệu nền (đường biểu diễn dương tính) và đường biểu diễn tín hiệu huỳnh quang màu JOE dương tính hoặc thẳng và không vượt qua tín hiệu nền (đường biểu diễn âm tính).
- Chứng âm có đường biểu diễn tín hiệu huỳnh quang màu FAM âm tính và đường biểu diễn tín hiệu huỳnh quang màu JOE dương tính
2. Phân tích mẫu
- Mẫu dương tính: Mẫu có đường biểu diễn dương tính rõ ràng và bắt đầu từ chu kỳ 36 trở về trước.
- Mẫu nghi ngờ: Mẫu có đường biểu diễn dương tính và bắt đầu từ sau chu kỳ 36 → đề nghị lấy mẫu lại để thực hiện xét nghiệm.
- Mẫu âm tính: Mẫu có đường biểu diễn âm tính, chứng nội phải dương tính.
3. In đồ thị kết quả
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
Có mẫu và chứng nội cũng đều âm tính. Chứng bình thường, có mẫu dương, mẫu âm thật sự.
1. Nguyên nhân: Có thể mẫu âm thực sự, có thể phản ứng PCR bị ức chế.
2. Khắc phục
- Pha loãng mẫu từ 10-100 lần, thực hiện lại toàn bộ thí nghiệm từ bước tách chiết. Sau khi có kết quả phải nhân thêm với hệ số pha loãng mẫu. Nếu vẫn gặp sự cố trên, lấy lại mẫu theo đúng yêu cầu.
- Trừ những mẫu sự cố, tất cả các mẫu bình thường đều có thể lấy kết quả.
33. Mycobacterium tuberculosis Spoligotyping
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Phân nhóm di truyền các chủng M. tuberculosis.
2. Nguyên lý
Phương pháp Spoligotyping (Spacer Oligonucleotide Typing) dựa trên nguyên tắc của phương pháp lai phân tử Southern blot. Các trình tự chuyên biệt trên các chủng Mycobacterium tuberculosis được nhân gene (PCR) và lai với các đoạn nucleotide đặc hiệu.
Trên DNA của các chủng M. tuberculosis có một trình tự bảo tồn đặc biệt chỉ có ở các chủng này được gọi là Direct Repeat (DR), kích thước khoảng 36bp. Giữa các DR này là các spacer kích thước khoảng 35bp đến 41 bp. Có 43 spacer được xác định ở M. tuberculosis. Sự có mặt hoặc thiếu hụt các trình tự này được xác định bằng lai ghép sản phẩm PCR với 43 oligonucleotide tổng hợp từ các trình tự đệm của M. tuberculosis H37Rv. Spoligotyping có thể phân biệt được các chủng thuộc nhóm M. tuberculosis dựa trên sự mất hoặc hiện diện các DR được phân tích , so sánh với dữ liệu spoligotyping quốc tế SpolDB4.
Khả năng mất các đoạn DR có thể xảy ra nhiều lần, độc lập ở các chủng, dẫn đến sự tiến hóa, xuất hiện các nhóm spoligotype khác nhau.
Hinh 1. Các vùng DR trên bộ gene M. tuberculosis
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: Cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
| - Tủ ATSH cấp II | - Cân điện tử |
| - Máy siêu ly tâm 1.5ml tuýp | - Pipette tự động loại 10, 200, 1000µl. |
| - Máy ly tâm mini (Spin down) | - Panh, kẹp (Forceps |
| - Máy ủ nhiệt khô/ướt | - Tủ sấy |
| - Máy siêu âm (Ultrasonic) | - Nồi hấp khử trùng |
| - Máy nhân gene | - Tủ thao tác PCR |
| - Lò vi sóng (Microwave Oven) | - Đồng hồ hẹn giờ |
| - Bộ điện di | - Hộp giữ lạnh |
| - Máy vortex | - Lò lai DNA |
| - Máy lắc ngang | - Hộp ủ phim X-ray |
| - Tủ lạnh 4o /- 20o/-80o | - Hộp rửa phim |
| - Máy đọc gel | - Hệ thống buồng tối tráng phim |
| - Miniblotter | - Hệ thống máy tính |
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| I | Hóa chất |
|
|
| 1 | PuReTag PCR Beads | test | 1,500 |
| 2 | Dra gắn Biotinylabed 5” | µl | 0,500 |
| 3 | Drb | µl | 0,500 |
| 4 | Thạch điện di | gam | 0,100 |
| 5 | TAE x50 | ml | 0,500 |
| 6 | Ethidium Bromid | ml | 0,050 |
| 7 | Streptavidin - POD- Conjugate | ml | 0,500 |
| 8 | ECL Detection Reagents ( 1 + 2 ) | ml | 0,500 |
| 9 | Amersham Hyperfilm ECL ( 18 * 24 cm ) | Tờ | 0,100 |
| 10 | Miếng đệm | Tờ | 0,100 |
| 11 | SDS | gam | 0,700 |
| 12 | Na2HPO4 * 2H2O | gam | 0,500 |
| 13 | EDTA | gam | 0,500 |
| 14 | NaCl | gam | 2,500 |
| 15 | NaOH | gam | 0,100 |
| 16 | Tris-HCl | gam | 0,100 |
| 17 | Boric Acid | gam | 0,100 |
| 18 | Deverlop Film | ml | 10,000 |
| 19 | Nước tinh sạch (pha PCR Mix) | ml | 0,500 |
| 20 | Nước cất hai lần (pha buffer) | lít | 0,500 |
| II | Vật tư tiêu hao |
|
|
| 21 | Đầu côn 10 µl | cái | 3,000 |
| 22 | Đầu côn 100 µl | cái | 4,000 |
| 23 | Đầu côn 1000 µl | cái | 3,000 |
| 24 | Eppendorf 0,2 ml | cái | 2,000 |
| 25 | Eppendorf 1,5 ml | cái | 1,000 |
| 26 | Găng tay | đôi | 1,000 |
| 27 | Khẩu trang N95 | cái | 1,000 |
| 28 | Khăn giấy | cuộn | 0,020 |
| 29 | Cồn 70° | ml | 10,000 |
| 30 | Bút MARKER | cái | 0,010 |
| 31 | Bút chì kim 2B | cái | 0,010 |
| 32 | QC (nếu thực hiện) * |
| 0,1 |
| 33 | EQAS (nếu thực hiện) * |
| 0,005 |
* Ghi chú:
- Chi phí nội kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình nội kiểm (QC) là 1/10 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lượng ≥ 10 mẫu cho 1 lần tiến hành kỹ thuật).
- Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/200 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 2 lần/1 năm).
3. Bệnh phẩm
Thực hiện xét nghiệm phân nhóm M. tuberculosis cho các bệnh phẩm là chủng vi khuẩn lao mọc trên môi trường đặc hoặc lỏng.
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu phiếu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
Theo đúng quy định của chuyên ngành Vi sinh (Xem Phụ lục 2)
2. Tiến hành kỹ thuật
2.1. Lập danh sách, cập nhập thông tin mẫu cần xét nghiệm.
2.2. Xử lý mẫu theo danh sách đã trích lọc
2.3. Tách chiết DNA vi khuẩn theo quy trình chuẩn
2.4. Thực hiện phản ứng nhân gene
2.5. Lai sản phẩm PCR với màng lai Biodyne C
2.6. Phát hiện tín hiệu lai
2.7. Xử lý và phân tích kết quả
IV. NHẬN ĐỊNH KẾT QUẢ
Tín hiệu lai được thể hiện bằng những ô màu đen. Mỗi chấm đen tương ứng với một đoạn đệm. Phim được đọc từ trái sang phải và từ trên xuống dưới. Hai chủng đầu tiên được sử dụng làm mẫu chứng dương là H37Rv và P3. Một mẫu chứng âm là nước cất giúp kiểm soát các trường hợp dương tính giả, đồng thời kiểm tra sự nhiễm chéo giữa các rãnh lai DNA.

Hinh 2. Kết quả Spoligotyping
Các tín hiệu lai được nhập vào máy tính và xử lý trên phần mềm Bionumeric. Chủng Beijing có kết quả từ vị trí 1-34 là nốt trắng, vị trí số 35 đến 43 là các nốt đen. Các chủng khác cũng sẽ được xác định và nhóm theo từng phân nhóm.
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
| Lỗi | Giải thích và cách Xử lý |
| Không có tín hiệu lai được phát hiện | - Kiểm tra thiết bị, hóa chất, nhiệt độ. - Enzym đã bất hoạt. Chia nhỏ lượng enzym, bảo quản theo đúng điều kiện cần thiết và sử dụng hộp giữ lạnh khi pha mix. - Điện di 5 µl sản phẩm PCR trên thạch Agarose 2% để kiểm tra quá trình nhân gene có thang DNA hay không. - Streptavidin peroxidase bất hoạt hoặc nhiệt độ ủ không đúng - Quá trình biến tính chưa tốt. - Hóa chất ủ phim ECL hết hạn - Kiểm tra hoạt tính của màng Biodyne bẳng sản phẩm PCR của các chủng chứng dương. Nếu tín hiệu lai yếu thì nên thay màng mới. Thông thường màng dùng được 8-10 lần. |
| Hình nền quá đậm | - Kiểm tra các rãnh trên Miniblotter có bị sứt mẻ không. - Minibloter không sạch. Ngâm với Extran (Merck) qua đêm và rửa sạch bằng bàn trải mềm chuyên dụng. - Vặn chặt các ốc vít trên Minibloter khi lai DNA - Dung dịch, thời gian và nhiệt độ rửa màng không đảm bảo. - Nước rửa phim dùng nhiều lần và thời gian ủ phim quá lâu. |
| Các yếu tố khác ảnh hưởng đến kết quả xét nghiệm | - Nhiệt độ ủ sai. Dung dịch lai và nước rửa không được ủ ấm trước khi thực hiện. - Nhiễm DNA trong bước tách chiết hoặc/và trong hóa chất sử dụng. Trong trường hợp các hóa chất PCR bị nhiễm thì mẫu đối chứng âm cũng xuất hiện băng. - Bị nhiễm bởi các rãnh bên cạnh trong qua trình bổ sung mẫu lai DNA. - Tín hiệu lai không đều. ECL không được láng đều trên toàn bộ bề mặt của màng lai. - Lộ sáng trong quá trình ủ phim |
34. Mycobacterium tuberculosis RFLP typing
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Phân nhóm di truyền các chủng M. tuberculosis.
2. Nguyên lý
Kỹ thuật phân nhóm vi khuẩn M. tuberulosis - Restriction fragement length polymophism (RFLP) dựa trên phương pháp lai phân tử với mẫu dò đặc hiệu với DNA của vi khuẩn lao được cố định trên màng lai. Tính đa hình về kích thước tạo ra do sự khác biệt về số lượng bản sao và vị trí của các đoạn IS6110 trên nhiễm sắc thể vi khuẩn cho phép phân loai M.tuberculosis thành các nhóm nhỏ.
Trên nhiễm sắc thể Mycobacterium tuberculosis có các đoạn IS6110. Trên đoạn IS6110 có các vị trí cắt của enzyme cắt giới hạn, đồng thời ngoài đoạn IS6110 cũng có các vị trí cắt giới hạn tương ứng. Sử dụng enzyme cắt giới hạn chia bộ gene vi khuẩn thành nhiều đoạn có kích thước khác nhau. Số lượng bản sao IS6110 khác nhau cho ta số đoạn cắt khác nhau. Điện di, chuyển DNA lên màng lai, lai với mẫu dò đặc hiệu để phát hiện số lượng và kích thước các đoạn cắt.
Hinh 1. Vị trí đoạn IS 6110 và enzyme cắt giới hạn PvuII
II. CHUẨN BỊ
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
1. Người thực hiện
- Người thực hiện Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: Cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2. Phương tiện, hóa chất
2.1. Trang thiết bị
| - Tủ ATSH cấp II | - Cân điện tử |
| - Máy siêu ly tâm tuýp 1.5ml | - Pipette tự động 10, 200, 1000µl. |
| - Máy ly tâm mini (Spin down) | - Panh, kẹp (Forceps |
| - Máy ủ nhiệt khô/ướt | - Tủ sấy |
| - Máy siêu âm (Ultrasonic) | - Nồi hấp khử trùng |
| - Máy nhân gene | - Tủ thao tác PCR |
| - Lò vi sóng (Microwave Oven) | - Đồng hồ hẹn giờ |
| - Bộ điện di | - Hộp giữ lạnh |
| - Máy vortex | - Lò lai DNA |
| - Máy lắc ngang | - Hộp ủ phim X-ray |
| - Tủ lạnh 4o /- 20o/-80o | - Hộp rửa phim |
| - Hệ thống chụp ảnh điện di Pringraph | - Hệ thống US Stralinker |
| - Hệ thống Vacuum Blotter | - Hệ thống Gel Documentation |
| - Máy đo nồng độ DNA Spec™ Plus |
|
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| I | Hóa chất |
|
|
| 1 | Protein K | µl | 10,000 |
| 2 | SDS | gam | 0,500 |
| 3 | TE buffer | ml | 5,000 |
| 4 | Lysozym | mg | 0,010 |
| 5 | Chloroform | ml | 0,500 |
| 6 | Alcohol | ml | 0,500 |
| 7 | Isopropanol | ml | 0,500 |
| 8 | Ethanol | ml | 0,500 |
| 9 | CTAB | gam | 0,200 |
| 10 | NaCL | gam | 0,500 |
| 11 | Sodium acetat | gam | 0,500 |
| 12 | TAE buffer | ml | 5,000 |
| 13 | Hybridization buffer solution | ml | 5,000 |
| 14 | SSC buffer stock solution 20 X | ml | 1,000 |
| 15 | ECL Direct Nucleic Acid Labelling System | ml | 0,200 |
| 16 | ECL Detection Reagents | ml | 0,200 |
| 17 | Hot start TagDNA polymerase | µl | 0,500 |
| 18 | 100 bp DNA ladder | µl | 0,500 |
| 19 | (CGG)5 primer | µl | 0,500 |
| 20 | LightCycler FastStart DNA MasterplusHybprobe | gam | 0,100 |
| 21 | Pvu II | µl | 0,300 |
| 22 | Alu I | µl | 0,300 |
| 23 | Primer INS 1, 2 | µl | 0,300 |
| 25 | SeaKem Gold agarose | gam | 0,100 |
| 26 | Agarose | gam | 0,100 |
| 27 | Ethidium Bromid | ml | 0,050 |
| 28 | Streptavidin - POD- Conjugate | ml | 0,500 |
| 29 | Standard chemical for pH metter | ml | 0,500 |
| 30 | Nước tinh sạch ( pha PCR Mix ) | ml | 0,500 |
| 31 | Nước cất hai lần ( pha buffer ) | lít | 0,500 |
| II | Vật tư tiêu hao |
|
|
| 32 | Đầu côn 10 µl | cái | 3,000 |
| 33 | Đầu côn 100 µl | cái | 4,000 |
| 34 | Đầu côn 1000 µl | cái | 3,000 |
| 35 | Eppendorf 0,2 ml | cái | 2,000 |
| 36 | Eppendorf 1,5 ml | cái | 1,000 |
| 37 | Cryotube 1.5 ml | cái | 1,000 |
| 38 | Giấy tráng kim | Hộp | 0,01 |
| 39 | Capillary(20mcl) | cái | 1,000 |
| 40 | Màng hybbond | cái | 0,100 |
| 41 | Plastic Wrap | Hộp | 0,050 |
| 42 | Găng tay | đôi | 1,000 |
| 43 | Khẩu trang N95 | cái | 1,000 |
| 44 | Khăn giấy | cuộn | 0,020 |
| 45 | Cồn 70° | ml | 10,000 |
| 46 | Bút MARKER | cái | 0,010 |
3. Bệnh phẩm
Thực hiện xét nghiệm phân nhóm M. tuberculosis cho các bệnh phẩm là chủng vi khuẩn lao mọc trên môi trường đặc.
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu phiếu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
Theo đúng quy định của chuyên ngành Vi sinh (Xem Phụ lục 2)
2. Tiến hành kỹ thuật
2.1. Lập danh sách, cập nhập thông tin mẫu cần xét nghiệm.
2.2. Xử lý mẫu theo danh sách đã trích lọc
2.3. Tách chiết DNA vi khuẩn theo quy trình chuẩn
2.4. Chuẩn bị thang DNA và mẫu dò IS6110
2.5. Thực hiện phản ứng cắt bằng Enzyme cắt giới hạn
2.6. Ước lượng/đo nồng độ DNA sau phản ứng cắt
2.7. Điện di DNA
2.8. Xử lý gel sau khi điện di
2.9. Chuyển DNA lên màng lai
2.10. Lai với ECL kít
2.11. Rửa màng sau khi lai
2.12. Phát hiện tín hiệu lai bằng ECL
2.13. Đọc và phân tích kết quả
IV. NHẬN ĐỊNH KẾT QUẢ
Tín hiệu lai được thể hiện bằng những vach màu đen trên phim. Scan các phim này vào máy tính và phân tích bằng chương trình Bionumerics. Sau khi chuẩn hóa các phim, dựa trên hình ảnh các băng vạch, các mẫu chủng sẽ được so sánh với nhau và so với mẫu chuẩn để phân nhóm chủng M. tuberculosis.
Trong một số trường hợp khó nhận biết các băng vạch với nhau nên đôi khi kết quả không đồng nhất, cần lặp lại xét nghiệm để xác định kết quả.
Hình 2. Kết quả RFLP được phân tích bằng Bionumerics
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
| Lỗi | Giải thích và cách Xử lý |
| Không có tín hiệu lai được phát hiện | - Kiểm tra thiết bị, hóa chất, nhiệt độ. - Enzym đã bất hoạt. Chia nhỏ lượng enzym, bảo quản theo đúng điều kiện cần thiết và sử dụng hộp giữ lạnh khi pha mix. - Điện di 5 µl sản phẩm PCR trên thạch Agarose 2% để kiểm tra quá trình nhân gene có thang DNA hay không. - Enzym cắt mất hoạt tính - Hóa chất ủ phim ECL hết hạn - Kiểm tra quá trình thấm DNA lên màng |
| Ảnh điện di không đặc hiệu, các đoạn cắt không rõ ràng | - Quá trình tách DNA chưa tốt. DNA không tinh sạch, lẫn nhiều protein. - Enzyme cắt giới hạn (RE) cần được bảo quản tốt trong dung dịch đệm có 50% glycerol ở -20 oC. - Khi thực hiện phản ứng cắt bằng RE, cần sử dụng nồng độ NaCl của dung dịch đệm từ thấp đến cao. - Tối ưu hiệu quả hoạt động của Enzyme cắt giới hạn, đảm bảo thể tích RE không quá 1/10 thể tích phản ứng |
| Các yếu tố khác ảnh hưởng đến kết quả xét nghiệm | - Nhiệt độ ủ sai. Dung dịch lai và nước rửa không được ủ ấm trước khi thực hiện. - Nhiễm DNA trong bước tách chiết hoặc/và trong hóa chất sử dụng. - Tín hiệu lai không đều. ECL quá hạn hoặc ECL không được láng đều trên toàn bộ bề mặt của màng lai. - Đánh số, mã đánh dấu lên màng DNA bằng bút bi để phân biệt các file trên hệ thống máy tính. |
35. NTM (Non Tuberculosis Mycobacteria) nuôi cấy môi trường lỏng
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Phát hiện các Mycobacteria không phải là Mycobacterium tuberculosis bằng kỹ thuật nuôi cấy môi trường lỏng.
2. Nguyên lý
Tube MGIT chứa môi trường lỏng Middlebrook 7H9 có oxy hòa tan và 1 hợp chất gồm: chất màu huỳnh quang, tris 4, 7-diphenyl-1, 10-phenonthroline ruthenium chloride pentahydrate được gắn vào lớp silicone ở đáy tube. Khi vi khuẩn phát triển oxy bị tiêu thụ, nồng độ oxy giảm, chất màu huỳnh quang thoát ức chế sẽ phát quang trong tube MGIT, có thể quan sát bằng tia UV. Cường độ phát quang tương ứng với mức độ tiêu thụ oxy, tương ứng nồng độ vi khuẩn phát triển trong tube môi trường. Máy tự động giám sát sự phát quang 60 phút một lần. Vi khuẩn mọc càng nhiều càng tăng độ phát quang. Vi khuẩn mọc sẽ được định danh để xác định các Mycobacteria khác không phải là Mycobacterium tuberculosis.
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: Cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Tủ an toàn sinh học cấp 2
- Máy li tâm đủ tiêu chuẩn an toàn sinh học, đủ lực li tâm (>= 3000g).
- Máy lắc
- Tủ lạnh
- Cân
- Đồng hồ phút.
- Kính hiển vi
- Nồi hấp
- Hệ thống máy BACTEC- MGIT 960 hoặc 320
- Pipet tự động loại 100-1000 l.
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| I | Hóa chất |
|
|
| 1 | MGIT tuýp loại 7 ml | tuýp | 1,100 |
| 2 | MGIT supplement - PANTA | ml | 0,900 |
| 3 | KH2PO4 | gam | 0,250 |
| 4 | Na2HPO4 | gam | 0,250 |
| 5 | Cồn 70o | ml | 5,000 |
| 6 | Nước cất | ml | 60,000 |
| 7 | NaOH | gam | 0,020 |
| 8 | NaCitrat | gam | 0,015 |
| 9 | NALC | mg | 25,000 |
| 10 | Dầu soi | ml | 0,100 |
| 11 | Cồn 95o | ml | 4,500 |
| 12 | Cacbol Fuchsin | gam | 0,030 |
| 13 | HCL | ml | 0,300 |
| 14 | Phenol | ml | 0,500 |
| 15 | Methylen | gam | 0,030 |
| 16 | Thanh định danh nhanh (SD, TBcID..) | test | 0,400 |
| 17 | Presept 2,5 | viên | 0,050 |
| 18 | Microshiel | ml | 1,000 |
| 19 | Lòng trắng trứng | ml | 0,010 |
| II | Vật tư tiêu hao |
|
|
| 20 | Lam kính | cái | 2,200 |
| 21 | Tuyp nắp xoáy vô trùng 50ml | cái | 1,100 |
| 22 | Pipette Paster nhựa vô trùng | cái | 3,000 |
| 23 | Chai thủy tinh trung tính 1000ml | cái | 0,001 |
| 24 | Que phết đờm | cái | 0,500 |
| 25 | Giấy lau kính hiển vi | tờ | 0,100 |
| 26 | Bông thấm nước | gam | 0,500 |
| 27 | Đầu côn nhựa loại 1ml | cái | 0,010 |
| 28 | Găng tay | đôi | 0,200 |
| 29 | Tuýp 18 x 24 mm | cái | 0,100 |
| 30 | Bô can | cái | 0,010 |
| 31 | Hộp đựng tiêu bản | cái | 0,001 |
| 32 | Túi nilon loại 2 lớp chịu nhiệt hấp | cái | 0,050 |
| 33 | Túi rác vàng hủy vật liệu lây nhiễm | cái | 0,020 |
| 34 | Thùng rác có nắp | cái | 0,001 |
| 35 | Thùng vận chuyển vật liệu lây nhiễm | cái | 0,001 |
| 36 | Hộp đựng vật sắc nhọn | cái | 0,003 |
| 37 | Khay đựng bệnh phẩm | cái | 0,001 |
| 38 | Hộp vận chuyển bệnh phẩm | cái | 0,001 |
| 39 | Giá đựng tuýp | cái | 0,001 |
| 40 | Mũ | cái | 0,020 |
| 41 | Khẩu trang | cái | 0,020 |
| 42 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 43 | Quần áo bảo hộ | Bộ | 0,001 |
| 44 | Dung dịch tẩy rửa dụng cụ | ml | 10,000 |
| 45 | Bút chì đen HB | cái | 0,020 |
| 46 | Bút bi | cái | 0,010 |
| 47 | Bật lửa | cái | 0,010 |
| 48 | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 49 | Khăn lau tay | cái | 0,005 |
| 50 | Giấy trả kết quả xét nghiệm | Tờ | 2,000 |
| 51 | Nhãn mã vạch | cái | 3,000 |
| 52 | QC (nếu thực hiện) * |
| 0,1 |
| 53 | EQAS (nếu thực hiện) * |
| 0,005 |
* Ghi chú:
- Chi phí nội kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình nội kiểm (QC) là 1/10 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lượng ≥ 10 mẫu cho 1 lần tiến hành kỹ thuật).
- Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/200 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 2 lần/1 năm).
3. Bệnh phẩm
Đờm, dịch phế quản, phân, mủ, dịch não tủy, các loại dịch khác, …
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
Theo đúng quy định của chuyên ngành Vi sinh (Xem Phụ lục 1 và Phụ lục 4)
2. Tiến hành kỹ thuật
2.1. Chuẩn bị môi trường hóa chất
2.2. Xử lý bệnh phẩm, nhuộm soi, nuôi cấy
2.3. Định danh: soi định danh và định danh nhanh sắc ký miễn dịch
2.4. Xử lý vật liệu lây nhiễm
IV. NHẬN ĐỊNH KẾT QUẢ
1. Kết quả nhuộm soi:
| Số lượng AFB | Kết quả | Phân loại |
| Có > 10 AFB/ 1 vi trường (Soi ít nhất 20 vi trường) | Dương tính | AFB 3 (+) |
| Có từ 1-10 AFB/ 1 vi trường (Soi ít nhất 50 vi trường) | Dương tính | AFB 2 (+) |
| Có từ 10-99 AFB/ 100 vi trường | Dương tính | AFB 1 (+) |
| Có từ 1-9 AFB/ 100 vi trường | Dương tính | Ghi số lượng AFB/100 vi trường |
| Không AFB/ 100 vi trường | Âm tính |
|
2. Kết quả cấy
- Máy báo tự động mỗi giờ, kết quả dương tính trung bình trong vòng 3 ngày đến 2 tuần
- Kết quả cấy âm tính máy báo sau 6 tuần
- Ngoài ra tuýp cấy máy báo âm tính có đầu vào nhuộm soi dương phải ly tâm lấy cặn nhuộm soi, các tuýp máy báo âm phải quan sát bằng mắt thường phát hiện cặn vụn trước khi hủy
3. Kết quả định danh
3.1. Soi định danh (phân biệt NTM với MTB)
NTM (Mycobacteria không phải lao) soi định danh không thấy cuộn thừng, AFB vụn thành đám
3.2. Định danh nhanh bằng sắc ký (SD, TBcID…)(phân biệt NTM với MTB)
NTM (Mycobacteria không phải lao) âm tính (có 1 vạch màu tại vị trí “C”)
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
- Nhiễm chéo trong quá trình thao tác kỹ thuật: hạn chế nhiễm chéo bằng cách phân loại nguồn bệnh phẩm dịch, đờm, nghi MDR, người bệnh thường... để Xử lý thích hợp. Không cấy chuyển chủng không làm tiêu bản soi định danh cùng lúc Xử lý bệnh phẩm. Chia nhỏ hóa chất dung dịch đệm, thao tác nhẹ nhàng tránh tạo hạt mù, chắt dung dịch vào thành tuýp. Không mở đồng thời các tuýp mẫu Mỗi mẻ Xử lý 6 - 8 mẫu.
- Tỷ lệ ngoại nhiễm cao: giảm ngoại nhiễm bằng cách Xử lý mẫu càng sớm càng tốt. Mẫu bảo quản 2 - 80C không quá 72 giờ, dịch dạ dày, nước tiểu Xử lý sớm trước 4 giờ kể từ khi lấy mẫu. Tuân thủ quy trình xử lý, nồng độ và thời gian tiếp xúc với hóa chất. Đảm bảo chất lượng môi trường, sinh phẩm, hóa chất, dụng cụ trong hạn và vô trùng.
- Nhầm lẫn hành chính: Kiểm tra cẩn thận về hành chính từ khâu nhận bệnh phẩm, vào sổ, trả kết quả, tránh nhầm lẫn. Khi thao tác kỹ thuật xếp mẫu theo thứ tự, tuân thủ qui tắc để cách ô trống đầu tiên.
36. NTM (Non Tuberculosis Mycobacteria) nuôi cấy môi trường đặc
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Phát hiện các Mycobacteria không phải Mycobacterium tuberculosis bằng kỹ thuật nuôi cấy môi trường đặc.
2. Nguyên lý
Xác định Mycobacterum tuberculosis có trong bệnh phẩm dựa vào hình ảnh khuẩn lạc mọc trên môi trường đặc và được xác định khi các thử nghiệm khẳng định MTB cho kết quả âm tính.
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: Cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Tủ an toàn sinh học cấp 2
- Máy li tâm đủ tiêu chuẩn an toàn sinh học, đủ lực li tâm (>= 3000g).
- Máy lắc
- Tủ lạnh
- Cân
- Đồng hồ phút.
- Kính hiển vi
- Nồi hấp
- Tủ ấm hoặc buồng ấm (35 - 38oC)
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| I | Hóa chất |
|
|
| 1 | KH2PO4 | gam | 0,300 |
| 2 | MgSO4 | gam | 0,0033 |
| 3 | MgCitrat | gam | 0,0084 |
| 4 | Asparagin | gam | 0,051 |
| 5 | Glyxerol | ml | 0,168 |
| 6 | Malachite | gam | 0,0026 |
| 7 | Na2HPO4 | gam | 0,250 |
| 8 | Trứng gà | quả | 1/3 |
| 9 | Cồn 70o | ml | 150,000 |
| 10 | Nước cất | ml | 65,000 |
| 11 | NaOH | gam | 0,020 |
| 12 | NaCitrat | gam | 0,015 |
| 13 | NALC | mg | 25,000 |
| 14 | Dầu soi | ml | 0,050 |
| 15 | Cồn 95o | ml | 4,500 |
| 16 | Cacbol fuchsin | gam | 0,015 |
| 17 | HCL | ml | 0,150 |
| 18 | Phenol | ml | 0,250 |
| 19 | Methylen | gam | 0,015 |
| 20 | Thanh định danh Niacin | test | 0,400 |
| 21 | Presept 2,5 | viên | 0,050 |
| 22 | Microshiel | ml | 1,000 |
| II | Vật tư tiêu hao |
|
|
| 23 | Tuyp nắp xoáy vô trùng 50ml | cái | 1,100 |
| 24 | Lam kính | cái | 1,200 |
| 25 | Pipette Paster nhựa vô trùng | cái | 2,000 |
| 26 | Que phết đờm | cái | 0,500 |
| 27 | Giấy lau kính hiển vi | tờ | 0,100 |
| 28 | Gạc lọc | mét | 0,030 |
| 29 | Bông thấm nước | gam | 0,500 |
| 30 | Bông mỡ | gam | 0,500 |
| 31 | Pipette nhựa 10ml | cái | 0,200 |
| 32 | Đầu côn nhựa loại 1ml | cái | 0,010 |
| 33 | Găng tay | đôi | 0,200 |
| 34 | Tuýp thủy tinh trung tính nút xoáy | cái | 0,300 |
| 35 | Tuýp 18 x 24 mm | cái | 0,100 |
| 36 | Bô can | cái | 0,010 |
| 37 | Bình cầu 2000ml | cái | 0,001 |
| 38 | ống đong 500 ml | cái | 0,001 |
| 39 | ống đong 50 ml | cái | 0,001 |
| 40 | Phễu thuỷ tinh 500ml | cái | 0,001 |
| 41 | Cốc mỏ 500ml | cái | 0,001 |
| 42 | Cốc có mỏ 200 ml | cái | 0,001 |
| 43 | Chai thủy tinh trung tính 1000ml | cái | 0,002 |
| 44 | Hộp đựng tiêu bản | cái | 0,001 |
| 45 | Túi nilon loại 2 lớp chịu nhiệt hấp | cái | 0,050 |
| 46 | Túi rác vàng hủy vật liệu lây nhiễm | cái | 0,020 |
| 47 | Thùng rác có nắp | cái | 0,001 |
| 48 | Thùng vận chuyển vật liệu lây nhiễm | cái | 0,001 |
| 49 | Hộp đựng vật sắc nhọn | cái | 0,003 |
| 50 | Khay đựng bệnh phẩm | cái | 0,001 |
| 51 | Hộp vận chuyển bệnh phẩm | cái | 0,001 |
| 52 | Giá đựng tuýp | cái | 0,001 |
| 53 | Khay đựng môi trường | cái | 0,001 |
| 54 | Mũ | cái | 0,020 |
| 55 | Khẩu trang | cái | 0,020 |
| 56 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 57 | Quần áo bảo hộ | Bộ | 0,001 |
| 58 | Dung dịch tẩy rửa dụng cụ | ml | 10,000 |
| 59 | Bút chì đen HB | cái | 0,020 |
| 60 | Bút bi | cái | 0,010 |
| 61 | Bật lửa | cái | 0,010 |
| 62 | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 63 | Khăn lau tay | cái | 0,005 |
| 64 | Giấy trả kết quả xét nghiệm | Tờ | 2,000 |
| 65 | Nhãn mã vạch | cái | 4,000 |
| 66 | QC (nếu thực hiện) * |
| 0,1 |
| 67 | EQAS (nếu thực hiện) * |
| 0,005 |
* Ghi chú:
- Chi phí nội kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình nội kiểm (QC) là 1/10 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lượng ≥ 10 mẫu cho 1 lần tiến hành kỹ thuật).
- Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/200 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 2 lần/1 năm).
3. Bệnh phẩm
Đờm, dịch phế quản, phân, mủ, dịch não tủy, các loại dịch khác…
4. Phiếu xét nghiệm: Điền đầy đủ thông tin theo mẫu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
Theo đúng quy định của chuyên ngành Vi sinh (Xem Phụ lục 1 và Phụ lục 4)
2. Tiến hành kỹ thuật
2.1. Chuẩn bị môi trường hóa chất
2.2. Xử lý bệnh phẩm,nhuộm soi, nuôi cấy
2.3. Định danh
2.4. Xử lý vật liệu lây nhiễm
IV. NHẬN ĐỊNH KẾT QUẢ
1. Kết quả nhuộm soi
AFB có hình ảnh trực khuẩn mảnh, hơi cong, bắt màu đỏ đứng riêng lẻ hay xếp đôi hoặc từng đám trên nền xanh.
Đếm số lượng AFB và ghi kết quả như bảng sau:
| Số lượng AFB | Kết quả | Phân loại |
| Có > 10 AFB/ 1 vi trường (Soi ít nhất 20 vi trường) | Dương tính | AFB 3 (+) |
| Có từ 1-10 AFB/ 1 vi trường (Soi ít nhất 50 vi trường) | Dương tính | AFB 2 (+) |
| Có từ 10-99 AFB/ 100 vi trường | Dương tính | AFB 1 (+) |
| Có từ 1-9 AFB/ 100 vi trường | Dương tính | Ghi số lượng AFB/100 vi trường |
| Không AFB/ 100 vi trường | Âm tính |
|
2. Kết quả cấy
- Kiểm tra nhiễm trùng: sau 24 - 48 giờ
- Kiểm tra sau 72 giờ: mặt môi trường khô, xoáy nắp tuýp tránh bay hơi làm khô môi trường
- Theo dõi trong vòng 7 ngày để phát hiện chủng Mycobacteria mọc nhanh
- Đọc kết quả cấy hàng tuần đến 8 tuần.
- Khuẩn lạc nhóm Mycobacteria không phải lao (NTM) dạng S trơn bóng, nhày, có hoặc không sắc tố, có thể mọc nhanh trong vòng 7 ngày.
Quy định đánh giá kết quả
| Đọc kết quả cấy | Nhận định kết quả cấy |
| Không thấy khuẩn lạc | Âm tính |
| 1 - 19 khuẩn lạc | Dương tính: số khuẩn lạc |
| 20 - 100 khuẩn lạc (ước tính khuẩn lạc mọc 1/3 bề mặt môi trường) | Dương tính: 1 + |
| 100 - 200 khuẩn lạc (ước tính khuẩn lạc mọc ½ bề mặt môi trường) | Dương tính: 2 + |
| 200 - 500 khuẩn lạc | Dương tính: 3 + |
| (ước tính khuẩn lạc mọc 2/3 bề mặt môi trường) |
|
| > 500 khuẩn lạc (ước tính khuẩn lạc phủ kín toàn bộ bề mặt môi trường) | Dương tính: 4 + |
| Nhiễm vi khuẩn hoặc nấm | Ngoại nhiễm |
3. Phân biệt NTM với MTB
- NTM (Mycobacteria không phải lao): Niacin âm tính
- NTM: thử nghiệm TBcID cho kết quả âm tính
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
- Tỉ lệ soi âm cấy dương thấp: có thể do khử tạp quá mạnh (nồng độ hóa chất, thời gian tiếp xúc) làm chết NTM (NTM nhạy cảm với khử tạp hơn so với MTB).
- Tỉ lệ ngoại nhiễm cao: có thể tăng thể tích hoặc nồng độ hóa chất, không kéo dài thời gian khử nhiễm.
- Nhiễm chéo có thể xảy ra, đề phòng nhiễm chéo: mỗi mẻ chỉ Xử lý 6-8 bệnh phẩm không mở đồng thời các tuýp mẫu. Chia nhỏ lượng dung dịch khử nhiễm và dung dịch đệm, không chắt trực tiếp dung dịch khử nhiễm hay dung dịch đệm vào bệnh phẩm.
37. NTM (Non Tuberculosis Mycobacteria) LPA
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Định danh các loại mycobacteria không phải M. tuberculosis thường gặp trong lâm sàng: M. avium spp; M. chelonae; M. abscessus; M fortuitum; M. gordonae; M. intracellulare; M. scrofulaceum; M. interjectum; M. kansasii; M. malmoense; M. peregrrinum; M. marinum/M. ulcerans; M. xenopi
2. Nguyên lý
Sử dụng kỹ thuật LPA (Line Probe Assay) để khuếch đại đoạn gene của chủng vi khuẩn NTB, sau đó lai với mẫu dò được thiết kế sẵn đặc hiệu cho từng loài Mycobacterium. Tùy theo đoạn gene của chủng NTM có trong bệnh phẩm lai đặc hiệu với mẫu dò nào thì sẽ xác định được tên của chủng NTB.
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: Cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Tủ an toàn sinh học cấp 2
- Tủ thao tác PCR có đèn tím
- Máy ly tâm an toàn (có nắp đậy từng cối) cho tuýp 50ml
- Máy ly tâm lạnh cho tuýp 1.5ml
- Máy ủ nhiệt khô/ướt
- Máy siêu âm (Ultrasonic)
- Máy PCR
- Lò vi sóng (Microwave Oven)
- Bộ điện di
- Máy lai GT Blot 20
- Tủ lạnh 4oC và tủ lạnh - 20oC
- Nồi hấp khử trùng
- Tủ sấy
- Máy vortex
- Pipette tự động các loại 10P, 20P, 1000P
- Panh, kẹp (Forceps)
- Máy ly tâm mini (Spin down)
- Đồng hồ hẹn giờ
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | GenoType Mycobacterium CM (thế hệ 1 ) | test | 1,370 |
| 2 | NALC | gam | 0,450 |
| 3 | Nước tinh sạch pha PCR mix | ml | 0,700 |
| 4 | NaOH | gam | 0,650 |
| 5 | Natri Citrat | gam | 0,550 |
| 6 | Thạch điện di | gam | 0,100 |
| 7 | TAE x50 | ml | 0,500 |
| 8 | Ethidium Bromid | ml | 0,050 |
| 9 | Nước cất hai lần (ly tâm - Lai DNA) | ml | 90,000 |
| 10 | Tuýp Falcon 50 ml | tuýp | 1,200 |
| 11 | Đầu côn 10 µl | hộp | 0,050 |
| 12 | Đầu côn 100 µl | hộp | 0,050 |
| 13 | Đầu côn 1000 µl | hộp | 0,070 |
| 14 | Eppendorf 0,2 ml | cái | 1,200 |
| 15 | Eppendorf 1,5 ml | cái | 2,400 |
| 16 | Pipette nhựa 5 ml | cái | 1,200 |
| 17 | Pipette nhựa 20 ml | cái | 1,000 |
| 18 | Găng tay | đôi | 1,000 |
| 19 | Khẩu trang N95 | cái | 1,000 |
| 20 | Khăn giấy | cuộn | 0,020 |
| 21 | Cồn 70° | ml | 20,000 |
| 22 | Bút MARKER | cái | 0,010 |
| 23 | Bút chì kim 2B | cái | 0,010 |
| 24 | Băng dính trong | cuộn | 0,010 |
| 25 | Nhãn mã vạch | Cái | 20,000 |
| 26 | QC (nếu thực hiện) * |
| 0,1 |
| 27 | EQAS (nếu thực hiện) * |
| 0,005 |
* Ghi chú:
- Chi phí nội kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình nội kiểm (QC) là 1/10 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lượng ≥ 10 mẫu cho 1 lần tiến hành kỹ thuật).
- Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/200 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 2 lần/1 năm).
3. Bệnh phẩm
Thực hiện xét nghiệm GenoType Mycobacterium CM với chủng vi khuẩn nuôi cấy lao lỏng/đặc.
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu phiếu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
Theo đúng quy định của chuyên ngành Vi sinh (Xem Phụ lục 2).
2. Tiến hành kỹ thuật
2.1. Xử lý mẫu bệnh phẩm
2.2. Tách chiết DNA
2.3. Phản ứng khuếch đại
2.4. Lai tự động trên máy GT-blot 20 hoặc GT48
IV. NHẬN ĐỊNH KẾT QUẢ
- Vùng đối chứng liên hợp: CC: phải xuất hiện băng tín hiệu
- Vùng đối chứng cho họ Mycobacteria- UC: xuất hiện băng tín hiệu cho tất cả các mycobacteria và vi khuẩn Gram (+) có G+C cao
- Vùng đối chứng cho giống Mycobacterium: GC: xuất hiện băng khi có mặt các thành viên của giống mycobacterium
- Các vùng khác: đặc hiệu với các mẫu dò cho từng loài đã đề cập trong phần nguyên lí.
Trong trường hợp không định danh được chủng vi khuẩn với GenoType Mycobacterium CM, sử dụng GenoType Mycobacterium AS kit để có thể định danh các mycobacterium hiếm gặp hơn trong lâm sàng (sẽ được trình bày trong quy trình về GenoType Mycobacterium AS)
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
| Lỗi | Giải thích |
| Các băng tín hiệu đều yếu kể cả băng CC | - Kiểm tra thiết bị, hóa chất, nhiệt độ. - Nhiệt độ phòng quá thấp hoặc hóa chất không được đưa về đến nhiệt độ phòng. - Nhiệt độ ủ quá thấp - Lượng CON-C và/hoặc SUB-C không đủ - Hóa chất hết hạn |
| Các băng tín hiệu đều yếu hoặc không có, trừ băng CC | - Kiểm tra thiết bị, hóa chất, nhiệt độ. - PNM và HotstarTaq DNA Polymerase rã đông quá nhiều lần (tối ưu 5-6 lần) - PNM, HotstarTaq DNA Polymerase và các thành phần khác của Master Mix bị gia nhiệt. Sử dụng hộp giữ lạnh. - Nhiệt độ ủ quá cao hoặc quá thấp - Độ thuần, tinh sạch trong qúa trình xử lý mẫu - Có chất ức chế trong quá trình tách DNA ảnh hưởng đến quá trình nhân gene. - Kiểm tra sản phẩm PCR bằng điện di trên agarose 2%. Nếu không thấy có sản phẩm PCR thì lặp lại bước tách chiết DNA và PCR; Nếu xuất hiện băng mờ thì tăng lượng mẫu DNA từ 5ml thành 8ml; Nếu các băng sản phẩm PCR nhòe thì pha loãng lượng mẫu DNA. |
| Các băng được nhuộm mầu không đều | - Thanh Strips không hoàn toàn ngập trong dung dịch lai - Lắc khay có vấn đề trong khi lai |
| Mầu nền bị đậm | - Kiểm tra thiết bị, hóa chất, nhiệt độ. - CON-C và/hoặc SUB-C quá đậm đặc - Không đủ dung dịch rửa, bước rửa không sạch - Dung dịch rửa quá lạnh so với nhiệt độ phòng (25oC) - Phụ thuộc vào lượng DNA đem lai mà mầu nền có thể đậm hơn. - Trong trường hợp này thì ngắt SUB-D ngay khi các băng tín hiệu đã nhìn rõ để tránh bị nhòe băng. |
| Các yếu tố khác ảnh hưởng đến kết quả xét nghiệm | - Nhiệt độ ủ sai - Dung dịch lai và nước rửa không được làm ấm và pha trộn trước khi thực hiện. - Nhiễm DNA trong bước tách chiết hoặc/và trong hóa chất sử dụng. Trong trường hợp các hóa chất PCR bị nhiễm thì mẫu đối chứng âm cũng xuất hiện băng. - Bị nhiễm bởi các giếng bên cạnh trong qua trình bổ sung dung dịch lai. |
38. Mycobacterium leprae nhuộm soi
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Phát hiện các trực khuẩn Mycobacterium leprae còn goi là Bacillus Hansen (BH) bền vững với acid.
2. Nguyên lý
Do đặc tính kháng acid của Mycobacterium leprae nên khi được nhuộm bằng thuật nhuộm Ziehl-Neelsen và soi dưới kính hiển vi quang học, hình ảnh của Mycobacterium leprae sẽ có màu đỏ, các vi khuẩn và các tế bào (nếu có) không có đặc tính kháng acid sẽ xanh.
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: Cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Tủ an toàn sinh học cấp 2
- Kính hiển vi quang học
- Dụng cụ sấy lam (nếu có)
- Cán dao rạch da số 3 (Inox)
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Lưỡi dao rạch da số 15 | Cái | 2,000 |
| 2 | Lam kính | Cái | 2,000 |
| 3 | Dầu soi kính | ml | 1,000 |
| 4 | Xylen lau kính | ml | 1,000 |
| 5 | Dung dịch fuchsin 1% | ml | 5,000 |
| 6 | Dung dịch cồn tẩy HCL 1% | ml | 10,000 |
| 7 | Dung dịch xanh methylen 0,2% | ml | 5,000 |
| 8 | Bông | Kg | 0,001 |
| 9 | Cồn 90 độ (vệ sinh dụng cụ) | ml | 10,000 |
| 10 | Đèn cồn | Cái | 0,0001 |
| 11 | Panh | Cái | 0,0001 |
| 12 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 13 | Hộp vận chuyển bệnh phẩm | Cái | 0,0001 |
| 14 | Mũ | Cái | 0,020 |
| 15 | Khẩu trang | Cái | 0,200 |
| 16 | Găng tay xử lý dụng cụ | Đôi | 0,0200 |
| 17 | Quần áo bảo hộ | Bộ | 0,0010 |
| 18 | Hộp đựng dung dịch khử khuẩn ngâm lưỡi dao |
|
|
| 19 | Bút viết kính | Cái | 0,020 |
| 20 | Bút bi | Cái | 0,010 |
| 21 | Bật lửa | Cái | 0,010 |
| 22 | Sổ lưu kết quả xét nghiệm | Tờ | 0,01 |
| 23 | Cồn sát trùng tay nhanh | ml | 2,000 |
| 24 | Dung dịch nước rửa tay | ml | 8,000 |
| 25 | Khăn lau tay | Cái | 0,300 |
| 26 | Giấy trả kết quả xét nghiệm | Tờ | 2,000 |
| 27 | QC (nếu thực hiện) * |
| 0,1 |
| 28 | EQAS (nếu thực hiện) * |
| 0,005 |
* Ghi chú:
- Chi phí nội kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình nội kiểm (QC) là 1/10 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lượng ≥ 10 mẫu cho 1 lần tiến hành kỹ thuật).
- Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/200 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 2 lần/1 năm).
3. Bệnh phẩm
Chất tiết và tế bào dưới da ở vị trí: dái tai, tổn thương
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
Theo đúng quy định của chuyên ngành Vi sinh (Xem Phụ lục 1 và Phụ lục 6)
2. Tiến hành kỹ thuật
2.1. Chuẩn bị tiêu bản
2.2. Nhuộm Fuchsin
2.3. Tẩy màu bằng dung dịch cồn acid
2.4. Nhuộm nền bằng dung dịch xanh methylen
IV. NHẬN ĐỊNH KẾT QUẢ
BH có hình ảnh trực khuẩn mảnh, hơi cong, bắt màu đỏ đứng riêng lẻ hay xếp đôi hoặc từng đám trên nền xanh. Đếm số lượng BH và ghi kết quả như bảng sau:
| Số lượng BH | Kết quả | Phân loại |
| Có từ 1-10 BH/ 100 vi trường | Dương tính | BH 1 (+) |
| Có từ 1-10 BH/ 10 vi trường | Dương tính | BH 2 (+) |
| Có từ 1-10 BH/ 1 vi trường | Dương tính | BH 3 (+) |
| Có từ 1-100 BH/ 1 vi trường | Dương tính | BH 4 (+) |
| Có từ 100 -1000 BH/ 1 vi trường | Dương tính | BH 5 (+) |
| Có >1000 BH/ 1 vi trường | Dương tính | BH 6 (+) |
| Không thấy BH/ 100 vi trường | Âm tính |
|
Lưu ý: 1 dòng lam tương đương 100 vi trường. Soi ít nhất 3 dòng.
V. NHỮNG SAI SÓT VÀ X TRÍ
1. Bệnh phẩm
Phòng xét nghiệm sẽ yêu cầu lấy lại bệnh phẩm khi phát hiện bệnh phẩm lấy, vận chuyển, bảo quản không đúng qui định. Nếu lâm sàng vẫn yêu cầu, phòng xét nghiệm sẽ thông báo mức độ kém chính xác của kết quả xét nghiệm.
2. Kỹ thuật
- BH nhạt màu có thể do tẩy quá lâu hoặc nhuộm chưa đủ (thời gian, sức nóng).
- Nếu BH tối màu có thể do nhuộm nền quá lâu.
- Mỗi mẻ nhuộm không nên quá 12 tiêu bản, các tiêu bản để cách nhau ít nhất 1 cm.
39. Mycobacterium leprae PCR
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Phát hiện sự có mặt bộ gene của Mycobacterium leprae có trong bệnh phẩm.
2. Nguyên lý
dựa trên nguyên lý kỹ thuật PCR.
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện: Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: Cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Tủ an toàn sinh học tối thiểu cấp 2
- Máy ủ nhiệt
- Máy ly tâm 25000 x g
- Máy ly tâm dùng cho tube 0,2 ml
- Máy vortex
- Máy chạy PCR
- Các loại pipet điều chỉnh được: 1000 µl, 200 µl, 100 µl, 10 µl
- Máy điện di
- Máy đọc ảnh gel
- Tủ lạnh thường
- Tủ âm sâu (-20oC)
- Bộ lưu điện
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
Định mức sinh phẩm và vật tư tiêu hao cho 2 mẫu/lần thực hiện (VD)
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Dụng cụ lấy bệnh phẩm | Que | 2,000 |
| 2 | Găng không có bột (DNase-RNase free) | Đôi | 0,500 |
| 3 | Ống nhựa Ependoff 1.5ml | ống | 2,000 |
| 4 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 5 | Hộp lưu bệnh phẩm | Cái | 0,0001 |
| 6 | Nước muối sinh lý | ml | 5,000 |
| 7 | Bộ KIT chiết tách DNA Đóng gói 50 phản ứng | Hộp | 0,020 |
| 8 | Khấu hao sinh phẩm cho chứng và QC kiểm tra lại, standard các loại | Test | 1,350 |
| 9 | PBS Buffer Đóng gói 500ml | Chai | 0,002 |
| 10 | Absolute Ethanol Đóng gói 1000ml | Chai | 0,002 |
| 11 | 10mM dNTP mix Đóng gói 100µl | ống | 0,005 |
| 12 | Taq DNA Polymerase, Native Đóng gói: 5 units/ µl, 500 units (100 µl) | ống | 0,002 |
| 13 | Primer đặc hiệu cho vi khuẩn phong Đóng gói 50nM | bp | 0,100 |
| 14 | UltraPure DNase/RNase Distilled Water Đóng gói 500ml | Chai | 0,001 |
| 15 | Ultrapure Agarose Đóng gói 100g | Lọ | 0,001 |
| 16 | Ultrapure TBE Buffer 10X Đóng gói 1000ml | Chai | 0,001 |
| 17 | 100bp DNA ladder Đóng gói 50ug | ống | 0,001 |
| 18 | 10X BlueJuice Gel Loading dye Đóng gói 3x1ml | ống | 0,001 |
| 19 | Utrapure 10mg/ml Ethidium Bromide Đóng gói 10ml | lọ | 0,001 |
| 20 | Ống ly tâm 1,7ml Đóng gói 500c/túi | túi | 0,004 |
| 21 | ống PCR 0,2 ml, nắp phẳng Đóng gói: 500c/túi, 1000c/hộp | hộp | 0,001 |
| 22 | Đầu côn 1000ml có lọc | túi | 0,001 |
| 23 | Đầu côn 200ml có lọc | túi | 0,004 |
| 24 | Đầu côn 0,2-10µl có lọc | túi | 0,001 |
| 25 | Dung dịch khử trùng | ml | 1,000 |
| 26 | Sổ lưu kết quả xét nghiệm | Quyển | 0,001 |
| 27 | Giấy xét nghiệm | Tờ | 1,000 |
| 28 | Quần áo bảo hộ | Bộ | 0,005 |
| 29 | Mũ | Cái | 0,020 |
| 30 | Khẩu trang | Cái | 0,020 |
| 31 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 32 | Giấy thấm | Cuộn | 0,100 |
| 33 | Bút viết kính, bút bi, diêm | Cái | 0,020 |
| 34 | Xà phòng | Bánh | 0,010 |
| 35 | Khăn lau tay | Cái | 0,010 |
| 36 | Bông, cồn | Túi | 0,010 |
| 37 | EQAS (nếu thực hiện)* |
| 0,005 |
* Ghi chú:
- Chi phí nội kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình nội kiểm (QC) là 1/10 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lượng ≥ 10 mẫu cho 1 lần tiến hành kỹ thuật).
- Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/200 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 2 lần/1 năm).
3. Bệnh phẩm
Các loại dịch tiết và mô sinh thiết
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu phiếu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
Theo đúng quy định của chuyên ngành Vi sinh (Xem Phụ lục 3).
2. Tiến hành kỹ thuật
2.1. Tách chiết DNA từ bệnh phẩm
2.2. Pha hỗn hợp phản ứng PCR
2.3. Chạy phản ứng PCR
2.4. Điện di sản phẩm PCR
2.5. Đọc kết quả
IV. NHẬN ĐỊNH KẾT QUẢ
- Phản ứng dương tính: có vạch sản phẩm PCR tương ứng với cặp mồi
- Phản ứng âm tính: không có vạch sản phẩm PCR tương ứng với cặp mồi
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
1. Bệnh phẩm
Phòng xét nghiệm sẽ yêu cầu lấy lại bệnh phẩm khi phát hiện bệnh phẩm lấy, vận chuyển, bảo quản không đúng qui định. Nếu lâm sàng vẫn yêu cầu, phòng xét nghiệm sẽ thông báo mức độ kém chính xác của kết quả xét nghiệm.
2. Kỹ thuật
- Phản ứng dương tính giả: do tạp nhiễm từ môi trường
- Phản ứng âm tính giả: do phản ứng PCR bị ức chế
Để hạn chế các hiện tượng trên phải tuân thủ chặt chẽ quy trình kỹ thuật
40. Mycobacterium leprae mảnh sinh thiết
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Phát hiện các trực khuẩn Mycobacterium leprae còn goi là Bacillus Hansen (BH) bền vững với acid từ bệnh phẩm mảnh sinh thiết tổ chức da.
2. Nguyên lý
Do đặc tính kháng acid của Mycobacterium leprae nên khi được nhuộm bằng thuật nhuộm Ziehl-Neelsen và soi dưới kính hiển vi quang học, hình ảnh của Mycobacterium leprae sẽ có màu đỏ, các vi khuẩn và các tế bào (nếu có) không có đặc tính kháng acid sẽ xanh.
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: Cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Máy chuyển
- Tủ an toàn sinh học cấp 2
- Máy đúc
- Máy cắt
- Bể nhuộm
- Tủ ấm 56 độ
- Kính hiển vi quang học
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Formaldehyt | ml | 30,000 |
| 2 | Toluen | ml | 50,000 |
| 3 | Cồn tuyệt đối | ml | 50,000 |
| 4 | Paraplasts | gr | 40,000 |
| 5 | Cassett đúc bệnh phẩm | Cái | 3,000 |
| 6 | Dao cắt bệnh phẩm sử dụng 1 lần | Cái | 1,000 |
| 7 | Lam kính | Cái | 3,000 |
| 8 | Lamelle | Cái | 3,000 |
| 9 | Keo gắn Lamelle (Bom Canada) | ml | 1,000 |
| 10 | Thuốc nhuộm fucshin | ml | 20,000 |
| 11 | Thuốc nhuộm xanhmethylen | ml | 20,000 |
| 12 | Cồn Acid 1% | ml | 20,000 |
| 13 | Nước cất | ml | 300,000 |
| 14 | Gạc 30x30 (cm) | Cái | 1,000 |
| 15 | Bộ giá đựng tiêu bản | Cái | 0,003 |
| 16 | Mũ | Cái | 0,200 |
| 17 | Khẩu trang | Cái | 0,200 |
| 18 | Găng tay | đôi | 1,000 |
| 19 | Dung dịch rửa tay | ml | 20,000 |
| 20 | Bút bi | Cái | 0,020 |
| 21 | Giấy in A4 | tờ | 1,000 |
3. Bệnh phẩm
Mảnh sinh thiết tổ chức da.
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu phiếu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
Theo đúng quy định của chuyên ngành Vi sinh (Xem Phụ lục 1 và Phụ lục 6)
2. Tiến hành kỹ thuật
2.1. Cố định bệnh phẩm trong formon
2.2. Chuyển đúc bệnh phẩm
2.3. Cắt bệnh phẩm
2.4. Nhuộm bệnh phẩm theo phương pháp nhuộm Ziehl - Neelsen
III. NHẬN ĐỊNH KẾT QUẢ
Dựa vào số lượng, độ tập trung của trực khuẩn kết hợp với đặc điểm mô bệnh học trên nhuộm tiêu bản nhuôm HE để chẩn đoán các thể
IV. NHỮNG SAI SÓT VÀ XỬ TRÍ
- Trực khuẩn bị mất lớp mỡ do bước tẩy nến bằng xylen
- Khắc phục: phủ lại lam bằng dung dịch xylen với parafin tỷ lệ 1:1
41. Vibrio cholerae nhuộm soi
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Nhận định sơ bộ hình ảnh vi khuẩn vi khuẩn thuộc chi Vibrio trực tiếp từ bệnh phẩm.
2. Nguyên lý
Đánh giá hình thể, kích thước, tính chất bắt màu bằng kỹ thuật nhuộm và soi dưới kính hiển vi quang học.
II. CHUẨN BỊ
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
1. Người thực hiện
- Người thực hiện Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: Cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2. Phương tiện, hóa chất
2.1. Trang thiết bị
- Tủ an toàn sinh học cấp 2
- Kính hiển vi quang học
- Dụng cụ sấy lam (nếu có)
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Lọ lấy bệnh phẩm | lọ | 1,000 |
| 2 | Que lấy bệnh phẩm | cái | 1,000 |
| 3 | Lam kính | cái | 2,000 |
| 4 | Dầu soi kính | ml | 1,000 |
| 5 | Xylen lau kính | ml | 1,000 |
| 6 | Nước muối sinh lý | ml | 5,000 |
| 7 | Thuốc nhuộm đỏ fuchsin | ml | 5,000 |
| 8 | Thuốc nhuộm tím gentian | ml | 5,000 |
| 9 | Cồn tẩy 95 độ | ml | 10,000 |
| 10 | Lugol | ml | 5,000 |
| 11 | Bông | kg | 0,001 |
| 12 | Cồn 90 độ (vệ sinh dụng cụ) | ml | 10,000 |
| 13 | Đèn cồn | cái | 0,0001 |
| 14 | Panh | cái | 0,0001 |
| 15 | Khay đựng bệnh phẩm | cái | 0,0001 |
| 16 | Hộp vận chuyển bệnh phẩm | cái | 0,0001 |
| 17 | Mũ | cái | 0,020 |
| 18 | Khẩu trang | cái | 0,020 |
| 19 | Găng tay | đôi | 3,000 |
| 20 | Găng tay xử lý dụng cụ | đôi | 0,020 |
| 21 | Quần áo bảo hộ | bộ | 0,001 |
| 22 | Acid ngâm lam | ml | 10,000 |
| 23 | Ống nghiệm thủy tinh | ống | 1,000 |
| 24 | Bút viết kính | cái | 0,020 |
| 25 | Bút bi | cái | 0,010 |
| 26 | Bật lửa | cái | 0,010 |
| 27 | Sổ lưu kết quả xét nghiệm | tờ | 0,001 |
| 28 | Cồn sát trùng tay nhanh | ml | 2,000 |
| 29 | Dung dịch nước rửa tay | ml | 8,000 |
| 30 | Khăn lau tay | cái | 0,030 |
| 31 | Giấy trả kết quả xét nghiệm | tờ | 2,000 |
| 32 | QC (nếu thực hiện) * |
| 0,1 |
| 33 | EQAS (nếu thực hiện) * |
| 0,005 |
* Ghi chú:
- Chi phí nội kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình nội kiểm (QC) là 1/10 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lượng ≥ 10 mẫu cho 1 lần tiến hành kỹ thuật).
- Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/200 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 2 lần/1 năm).
3. Bệnh phẩm
Phân của người bệnh.
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
Theo đúng quy định của chuyên ngành Vi sinh (Xem Phụ lục 1).
2. Tiến hành kỹ thuật
2.1. Chuẩn bị tiêu bản
2.2. Nhuộm
- Nhuộm tím gentian trong vòng 60 giây
- Đổ toàn bộ phần thuốc nhuộm thừa rồi rửa nhẹ tiêu bản dưới vòi nước chảy
- Hỗ trợ bắt màu tím bằng lugol trong vòng 30 giây
- Đổ toàn bộ phần lugol thừa rồi rửa nhẹ tiêu bản dưới vòi nước chảy
- Tẩy màu bằng cồn 95% cho đến khi vừa hết màu tím phai ra
- Đổ toàn bộ phần cồn thừa rồi rửa nhẹ tiêu bản dưới vòi nước chảy
- Nhuộm tương phản bằng fuchsin trong vòng 60 giây
- Đổ toàn bộ phần thuốc nhuộm thừa rồi rửa nhẹ tiêu bản dưới vòi nước chảy
- Để tiêu bản khô và soi.
IV. NHẬN ĐỊNH KẾT QUẢ
Vibrio cholerae có hình ảnh phẩy khuẩn, bắt màu Gram âm (màu đỏ). Khi có hình ảnh nghi ngờ trên tiêu bản nhuộm soi, cần đề nghị nuôi cấy để chẩn đoán xác định.
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
1. Sai sót
- Vibrio cholerae có thể bắt màu không đúng do tẩy cồn chưa đủ hoặc làm lam quá dầy; thuốc nhuộm không đảm bảo chất lượng.
- Một số trường hợp trực khuẩn do cố định quá lâu tạo hình ảnh gần giống phẩy khuẩn.
2. Xử trí
- Tuân thủ đúng các bước của quy trình nhuộm Gram.
- Kiểm tra chất lượng thuốc nhuộm hàng tuần với chủng chuẩn.
42. Vibrio cholerae nhuộm huỳnh quang
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Phát hiện nhanh Vibrio cholerae từ bệnh phẩm.
2. Nguyên lý
Nếu trong bệnh phẩm có V. cholerae, vi khuẩn sẽ kết hợp với kháng thể đặc hiệu gắn huỳnh quang. Khi soi dưới kính hiển vi huỳnh quang sẽ thấy hình ảnh phẩy khuẩn phát sáng màu vàng xanh.
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: Cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Tủ an toàn sinh học cấp 2
- Kính hiển vi huỳnh quang
- Dụng cụ sấy lam (nếu có)
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Lọ lấy bệnh phẩm | lọ | 1,000 |
| 2 | Que lấy bệnh phẩm | cái | 1,000 |
| 3 | Lam kính | cái | 1,000 |
| 4 | Nước muối sinh lý | ml | 3,000 |
| 5 | Thuốc nhuộm Cholerae DFA | ml | 3,000 |
| 6 | Bông | kg | 0,001 |
| 7 | Cồn 90 độ (vệ sinh dụng cụ) | ml | 10,000 |
| 8 | Đèn cồn | cái | 0,0001 |
| 9 | Panh | cái | 0,0001 |
| 10 | Khay đựng bệnh phẩm | cái | 0,0001 |
| 11 | Hộp vận chuyển bệnh phẩm | cái | 0,0001 |
| 12 | Mũ | cái | 0,020 |
| 13 | Khẩu trang | cái | 0,020 |
| 14 | Găng tay | đôi | 3,000 |
| 15 | Găng tay xử lý dụng cụ | đôi | 0,020 |
| 16 | Quần áo bảo hộ | bộ | 0,001 |
| 17 | Acid ngâm lam | ml | 10,000 |
| 18 | Ống nghiệm thủy tinh | ống | 1,000 |
| 19 | Bút viết kính | cái | 0,020 |
| 20 | Bút bi | cái | 0,010 |
| 21 | Bật lửa | cái | 0,010 |
| 22 | Sổ lưu kết quả xét nghiệm | tờ | 0,001 |
| 23 | Cồn sát trùng tay nhanh | ml | 2,000 |
| 24 | Dung dịch nước rửa tay | ml | 8,000 |
| 25 | Khăn lau tay | cái | 0,030 |
| 26 | Giấy trả kết quả xét nghiệm | tờ | 2,000 |
| 27 | QC (nếu thực hiện) * |
| 0,1 |
| 28 | EQAS (nếu thực hiện) * |
| 0,005 |
* Ghi chú:
- Chi phí nội kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình nội kiểm (QC) là 1/10 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lượng ≥ 10 mẫu cho 1 lần tiến hành kỹ thuật).
- Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/200 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 2 lần/1 năm).
3. Bệnh phẩm
Phân của người bệnh
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
Theo đúng quy định của chuyên ngành Vi sinh (Xem Phụ lục 1).
2. Tiến hành kỹ thuật
2.1. Chuẩn bị tiêu bản
2.2. Nhuộm Cholerae DFA (direct fluorescent antibody)
- Phủ dung dịch nhuộm huỳnh quang lên tiêu bản, để 2 phút
- Rửa lại bằng nước để loại bỏ huỳnh quang thừa rồi để khô, soi dưới kính hiển vi huỳnh quang.
IV. NHẬN ĐỊNH KẾT QUẢ
Vibrio cholerae có hình ảnh phẩy khuẩn, bắt màu vàng xanh trên nền tím đen dưới kính hiển vi huỳnh quang.
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
Có thể gây âm tính giả nếu số lượng vi khuẩn quá ít.
43. Vibrio cholerae nuôi cấy, định danh và kháng thuốc
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Phát hiện và định danh V. cholerae bằng phương pháp nuôi cấy kinh điển. Xác định mức độ nhạy cảm với kháng sinh của V. cholerae.
2. Nguyên lý
Vi khuẩn được định danh dựa vào đặc điểm nuôi cấy, một số tính chất chuyển hóa, các đặc điểm về hình thái học và tính chất kháng nguyên.
Mức độ nhạy cảm với kháng sinh của V. cholerae được xác định bằng phương pháp kháng sinh đồ khoanh giấy khuếch tán và được phiên giải ra phân loại S, I, R dựa trên tái liêu hướng dẫn CLSI được cập nhật hàng năm.
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện: Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: Cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Tủ an toàn sinh học cấp 2
- Kính hiển vi quang học
- Dụng cụ sấy lam (nếu có)
- Tủ ấm thường
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
Thực hiện xét nghiệm 01 mẫu bệnh phẩm/lần
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Lọ lấy bệnh phẩm | lọ | 1,000 |
| 2 | Que lấy bệnh phẩm | cái | 2,000 |
| 3 | Lam kính | cái | 4,000 |
| 4 | Dầu soi kính | ml | 2,000 |
| 5 | Xylen lau kính | ml | 2,000 |
| 6 | Nước muối sinh lý | ml | 15,000 |
| 7 | Thuốc nhuộm đỏ Fuchsin | ml | 10,000 |
| 8 | Thuốc nhuộm tím Gentian | ml | 10,000 |
| 9 | Cồn tẩy 95 độ | ml | 20,000 |
| 10 | Lugol | ml | 10,000 |
| 11 | Môi trường nuôi cấy | test | 1,500 |
| 12 | Bộ sinh vật hóa học API 20 NE | test | 1,000 |
| 13 | Kháng sinh đồ Muller - Hinton | đĩa | 1,000 |
| 14 | Khoanh giấy kháng sinh | khoanh | 5,000 |
| 15 | Tăm bông vô trùng | cái | 1,000 |
| 16 | Ống nghiệm thủy tinh | ống | 1,000 |
| 17 | Bông | kg | 0,003 |
| 18 | Cồn 90 độ (vệ sinh dụng cụ) | ml | 30,000 |
| 19 | Đèn cồn | cái | 0,0002 |
| 20 | Panh | cái | 0,0001 |
| 21 | Khay đựng bệnh phẩm | cái | 0,0001 |
| 22 | Hộp vận chuyển bệnh phẩm | cái | 0,0001 |
| 23 | Mũ | cái | 0,060 |
| 24 | Khẩu trang | cái | 0,060 |
| 25 | Găng tay | đôi | 9,000 |
| 26 | Găng tay xử lý dụng cụ | đôi | 0,060 |
| 27 | Quần áo bảo hộ | bộ | 0,002 |
| 28 | Acid ngâm lam | ml | 20,000 |
| 29 | Ống nghiệm thủy tinh | ống | 1,000 |
| 30 | Bút viết kính | cái | 0,040 |
| 31 | Bút bi | cái | 0,020 |
| 32 | Bật lửa | cái | 0,020 |
| 33 | Sổ lưu kết quả xét nghiệm | tờ | 0,001 |
| 34 | Cồn sát trùng tay nhanh | ml | 6,000 |
| 37 | Dung dịch nước rửa tay | ml | 24,000 |
| 38 | Khăn lau tay | cái | 0,090 |
| 39 | Giấy trả kết quả xét nghiệm | tờ | 2,000 |
| 40 | QC (nếu thực hiện) * |
| 0,1 |
| 41 | EQAS (nếu thực hiện) * |
| 0,005 |
* Ghi chú:
- Chi phí nội kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình nội kiểm (QC) là 1/10 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lượng ≥ 10 mẫu cho 1 lần tiến hành kỹ thuật).
- Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/200 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 2 lần/1 năm).
3. Bệnh phẩm: Phân của người bệnh.
4. Phiếu xét nghiệm: Điền đầy đủ thông tin theo mẫu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
1. Lấy bệnh phẩm
Theo đúng quy định của chuyên ngành Vi sinh (Xem Phụ lục 1).
2. Tiến hành kỹ thuật
2.1. Nhuộm Gram và soi dưới kính hiển vi quang học
2.2. Nuôi cấy, định danh
- Nuôi cấy trên môi trường pepton kiềm, thạch kiềm và TCBS để ở điều kiện 37oC. Sau mỗi 6 giờ cấy chuyển váng ỏe ống pepton kiềm sang môi trường thạch kiểm và TCBS. Khi nhìn thấy có khuẩn lạc nghi ngờ V. cholera mọc thì dừng không cấy chuyển nữa.
- Bắt khuẩn lạc nghi ngờ.
- Xác định tính chất sinh vật hóa học bằng kít API 20E.
- Ngưng kết với kháng huyết thanh đặc hiệu.
2.3. háng sinh đồ
Lựa chọn các khoanh giấy kháng sinh thử nghiệm cho V. cholerae theo hướng dẫn của CLSI để làm kháng sinh đồ bằng phương pháp khoanh giấy khuếch tán.
IV. NHẬN ĐỊNH KẾT QUẢ
1. Định danh
- Hình thái học: Vibrio cholerae có hình ảnh phẩy khuẩn, bắt màu Gram âm
(màu đỏ).
- Tính chất nuôi cấy: Nuôi cấy trên môi trường thạch kiềm (37oC), khuẩn lạc dạng S, trong như giọt sương; trên môi trường TCBS, khuẩn lạc dạng S, màu vàng. Trong môi trường pepton kiềm, vi khuẩn mọc nhanh, sau 6-8 h tạo thành váng trên mặt môi trường.
- Một số tính chất sinh vật hóa học: lên men không sinh hơi đường glucose, saccharose, maltose, mannitol. Không lên men đường lactose, arabinose. Oxydase (+), indol (+), citrate simmons (+), LDC (+), ODC (+), ONPG (+). Urease (-), VP (±), ADH (-).
2. Phát hiện kháng thuốc
Đọc kháng sinh đồ và trả kết quả theo hướng dẫn của CLSI.
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
1. Sai sót
- Vibrio cholerae có thể bắt màu Gram dương do tẩy cồn chưa đủ hoặc làm đồ phiến quá dầy.
- Vibrio cholerae có thể không mọc do đốt ăng quá nóng, điều kiện nuôi cấy không đảm bảo, lượng bệnh phẩm quá ít.
2. Xử trí
- Tuân thủ đúng các bước của quy trình nhuộm Gram.
- Kiểm tra chất lượng thuốc nhuộm hàng tuần với chủng chuẩn. Để ăng nguội trước khi tiến hành nuôi cấy.
44. Vibrio cholerae PCR
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Xác định sự có mặt gene đặc trưng của vi khuẩn Vibrio cholera
2. Nguyên lý
Bằng kỹ thuật PCR, sử dụng cặp mồi có trình tự đặc hiệu.
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện: Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: Cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Tủ an toàn sinh học cấp 2
- Máy PCR
- Máy điện di
- Máy đọc điện di
- Máy ly tâm 25000 x g
- Máy ly tâm dùng cho tube 0,2 ml
- Máy ủ nhiệt
- Máy vortex
- Micropipette
- Bộ lưu điện
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
Định mức sinh phẩm và vật tư tiêu hao cho 2 mẫu/lần thực hiện (VD)
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Bông | kg | 0,001 |
| 2 | Cồn | ml | 1,000 |
| 3 | Bơm kim tiêm | Cái | 1,000 |
| 4 | Panh | Cái | 0,0001 |
| 5 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 6 | Hộp vận chuyển bệnh phẩm | Test | 0,001 |
| 7 | Tube đựng bệnh phẩm | Cái | 2,000 |
| 8 | Găng không có bột (DNase-RNase free) | Cái | 0,500 |
| 9 | Sinh phẩm chẩn đoán | Test | 1,000 |
| 10 | Khấu hao sinh phẩm cho kiểm tra lại | Test | 1,350 |
| 11 | Kit tách chiết DNA | Test | 2,350 |
| 12 | DNA marker | Bộ | 1,000 |
| 13 | Primer 1 | ml | 0,0001 |
| 14 | Primer 2 | ml | 0,0001 |
| 15 | Ependoff 1,7ml | Tube | 3,000 |
| 16 | Ependoff 0,2ml | Tube | 1,000 |
| 17 | Đầu côn 10 µl có lọc | Cái | 1,000 |
| 18 | Đầu côn 30 µl | Cái | 1,200 |
| 19 | Đầu côn 200 µl có lọc | Cái | 2,200 |
| 20 | Đầu côn 1 ml có lọc | Cái | 3,200 |
| 21 | Ethanol BDH | ml | 0,500 |
| 22 | Water-DEPC Treated | ml | 2,000 |
| 23 | Giấy thấm | Cuộn | 0,100 |
| 24 | Giấy xét nghiệm | Tờ | 2,000 |
| 25 | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 26 | Bút viết kính | Cái | 0,020 |
| 27 | Bút bi | Cái | 0,010 |
| 28 | Mũ | Cái | 0,020 |
| 29 | Khẩu trang | Cái | 0,020 |
| 30 | Găng tay | Đôi | 0,100 |
| 31 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 32 | Quần áo bảo hộ | Bộ | 0,005 |
| 33 | Dung dịch nước rửa tay | ml | 8,000 |
| 34 | Cồn sát trùng tay nhanh | ml | 1,000 |
| 35 | Dung dịch khử trùng | ml | 10,000 |
| 36 | Khăn lau tay | cái | 0,010 |
| 37 | EQAS (nếu thực hiện) * |
| 0,005 |
* Ghi chú:
- Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/200 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 2 lần/1 năm).
3. Bệnh phẩm
Bệnh phẩm phân.
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu phiếu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
Bệnh phẩm phân có thể lấy qua bô, lấy bằng tăm bông trực tràng. Đặc điểm phân thường trắng như nước vo gạo, không màu, không mùi, rất hiếm khi có nhày, máu.
Dụng cụ lấy phân phải có nắp xoáy, tốt nhất là 2 lớp, bên ngoài có thêm một lớp bảo vệ để tránh lây nhiễm. Bệnh phẩm sau khi lấy phải gửi ngay đến phòng xét nghiệm càng sớm càng tốt, nếu quá 2 tiếng phải bảo quản trong môi trường Cary - Blair.
2. Tiến hành kỹ thuật
2.1. Tách chiết DNA tổng số
2.2. Thực hiện PCR
2.3. Điện di kiểm tra sản phẩm
2.4. Đánh giá và kết luận
IV. NHẬN ĐỊNH KẾT QUẢ
Sản phẩm PCR phải có một băng đặc hiệu duy nhất, rõ nét và không bị đứt gẫy và có kích thước tương ứng so với thang DNA chuẩn.
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
Trong trường hợp không có sản phẩm PCR, cần phải kiểm tra lại quá trình tách chiết DNA tổng số, chất lượng primers và master mix, và thực hiện lại xét nghiệm.
45. Vibrio cholerae giải trình tự gene
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Xác định chính xác Vibrio cholera
2. Nguyên lý
Bằng kỹ thuật giải trình tự nucleotide dựa trên trình tự gen 16S RNA ribosome của vi khuẩn.
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: Cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Tủ an toàn Sinh học cấp 2
- Máy PCR
- Máy đọc điện di
- Máy giải trình tự gen
- Máy ly tâm 25000 x g
- Máy ly tâm dùng cho tube 0,2 ml
- Máy ủ nhiệt
- Máy vortex
- Micropipette
- Bộ lưu điện
4.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
Định mức sinh phẩm và vật tư tiêu hao cho 3 mẫu/lần thực hiện (VD)
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Bông | kg | 0,001 |
| 2 | Cồn | ml | 1,000 |
| 3 | Bơm kim tiêm | Cái | 1,000 |
| 4 | Panh | Cái | 0,0001 |
| 5 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 6 | Hộp vận chuyển bệnh phẩm | Test | 0,001 |
| 7 | Tube đựng bệnh phẩm | Cái | 2,000 |
| 8 | Găng không có bột (DNase-RNase free) | Cái | 0,500 |
| 9 | Sinh phẩm chẩn đoán | Test | 1,000 |
| 10 | Khấu hao sinh phẩm cho kiểm tra lại | Test | 1,350 |
| 11 | Kit tách chiết DNA | Test | 2,350 |
| 12 | DNA marker | Bộ | 1,000 |
| 13 | Primer 1 | ml | 0,0001 |
| 14 | Primer 2 | ml | 0,0001 |
| 15 | Ống Eppendorf 1,5 ml | Tube | 3,000 |
| 16 | Ống Eppendorf 0,2 ml | Tube | 1,000 |
| 17 | Đầu côn 10 µl có lọc | Cái | 1,000 |
| 18 | Đầu côn 30 µl | Cái | 1,200 |
| 19 | Đầu côn 200 µl có lọc | Cái | 2,200 |
| 20 | Đầu côn 1 ml có lọc | Cái | 3,200 |
| 21 | Ethanol BDH | ml | 0,500 |
| 22 | Water-DEPC Treated | ml | 2,000 |
| 23 | Giấy thấm | Cuộn | 0,100 |
| 24 | Giấy xét nghiệm | Tờ | 2,000 |
| 25 | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 26 | Bút viết kính | Cái | 0,020 |
| 27 | Bút bi | Cái | 0,010 |
| 28 | Mũ | Cái | 0,020 |
| 29 | Khẩu trang | Cái | 0,020 |
| 30 | Găng tay | Đôi | 0,100 |
| 31 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 32 | Quần áo bảo hộ | Bộ | 0,005 |
| 33 | Dung dịch nước rửa tay | ml | 8,000 |
| 34 | Cồn sát trùng tay nhanh | ml | 1,000 |
| 35 | Dung dịch khử trùng | ml | 10,000 |
| 36 | Khăn lau tay | cái | 0,010 |
| 37 | EQAS (nếu thực hiện)* |
| 0,005 |
* Ghi chú:
- Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/200 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 2 lần/1 năm).
3. Bệnh phẩm
Bệnh phẩm phân hoặc chủng Vibrio cholera nuôi cấy thuần.
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu phiếu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
Bệnh phẩm phân có thể lấy qua bô, lấy bằng tăm bông trực tràng. Đặc điểm phân thường trắng như nước vo gạo, không màu, không mùi, rất hiếm khi có nhày, máu.
Dụng cụ lấy phân phải có nắp xoáy, tốt nhất là 2 lớp, bên ngoài có thêm một lớp bảo vệ để tránh lây nhiễm. Bệnh phẩm sau khi lấy phải gửi ngay đến phòng xét nghiệm càng sớm càng tốt, nếu quá 2 tiếng phải bảo quản trong môi trường Cary - Blair.
2. Tiến hành kỹ thuật
2.1. Tách chiết DNA tổng số
2.2. Thực hiện PCR gen 16S ARN ribosome
2.3. Điện di kiểm tra sản phẩm
2.4. Giải trình tự gen
2.5. Kiểm tra độ tương đồng DNA
IV. NHẬN ĐỊNH KẾT QUẢ
Sản phẩm PCR phải có một băng đặc hiệu duy nhất, rõ nét và không bị đứt gẫy. Trình tự DNA của gen đích phải có độ tương đồng ≥ 95 % mới có thể kết luận được loài.
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
- Trong trường hợp không có sản phẩm PCR, cần phải kiểm tra lại quá trình tách chiết DNA tổng số, chất lượng primers và master mix, và thực hiện lại xét nghiệm.
- Nếu trình tự DNA bị nhiễu cần phải kiểm tra lại độ đặc hiệu của sản phẩm PCR hoặc quá trình chạy PCR sequencing bị nhiễm chéo.
46. Neisseria gonorrhoeae nhuộm soi
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Nhận định sơ bộ hình ảnh vi khuẩn và các hình ảnh tế bào (nếu có) trực tiếp từ bệnh phẩm.
2. Nguyên lý
Đánh giá hình thể, kích thước, tính chất bắt màu, cách sắp xếp đặc trưng của vi khuẩn N. gonorrhoeae và các hình ảnh tế bào (nếu có) bằng kỹ thuật nhuộm và soi dưới kính hiển vi quang học.
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện: Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: Cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Bàn phụ khoa
- Tủ an toàn sinh học cấp 2
- Kính hiển vi quang học
- Đèn phụ khoa
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Lam kính | Cái | 2,000 |
| 2 | Dầu soi kính | ml | 1,000 |
| 3 | Xylen lau kính | ml | 1,000 |
| 4 | Dung dịch tím Gentian 1% | ml | 5,000 |
| 5 | Dung dịch Lugol 2% | ml | 2,000 |
| 6 | Dung dịch cồn tẩy Aceton 25% | ml | 10,000 |
| 7 | Dung dịch Fuchsin 1% | ml | 5,000 |
| 8 | Bông | Kg | 0,001 |
| 9 | Cồn 90 độ (vệ sinh dụng cụ) | ml | 10,000 |
| 10 | Đèn cồn | Cái | 0,0001 |
| 11 | Panh | Cái | 0,0001 |
| 12 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 13 | Hộp vận chuyển bệnh phẩm | Cái | 0,0001 |
| 14 | Mũ | Cái | 0,020 |
| 15 | Mỏ vịt (to, vừa và nhỏ) | Cái | 1,000 |
| 16 | Thùng đựng dung dịch khử khuẩn ngâm mỏ vịt |
|
|
| 17 | Khẩu trang | Cái | 0,020 |
| 18 | Găng tay | Đôi | 3,000 |
| 19 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 20 | Quần áo bảo hộ | Bộ | 0,001 |
| 21 | Bút viết kính | Cái | 0,020 |
| 22 | Bút bi | Cái | 0,010 |
| 23 | Bật lửa | Cái | 0,010 |
| 24 | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 25 | Cồn sát trùng tay nhanh | ml | 2,000 |
| 26 | Dung dịch nước rửa tay | ml | 8,000 |
| 27 | Khăn lau tay | Cái | 0,030 |
| 28 | Giấy trả kết quả xét nghiệm | Tờ | 2,000 |
| 29 | QC (nếu thực hiện) * |
| 0,1 |
| 30 | EQAS (nếu thực hiện) * |
| 0,005 |
* Ghi chú:
- Chi phí nội kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình nội kiểm (QC) là 1/10 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lượng ≥ 10 mẫu cho 1 lần tiến hành kỹ thuật).
- Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/200 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 2 lần/1 năm).
3. Bệnh phẩm
Mủ hoặc dịch tiết đường sinh dục, hậu môn, họng…
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu yêu cầu.
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
Theo đúng quy định của chuyên ngành Vi sinh (Xem Phụ lục 1 và Phụ lục 6)
2. Tiến hành kỹ thuật
- Chuẩn bị tiêu bản nhuộm
- Nhuộm tím gentian trong vòng 60 giây
- Đổ toàn bộ phần thuốc nhuộm thừa rồi rửa nhẹ tiêu bản dưới vòi nước chảy
- Hỗ trợ bắt màu tím bằng lugol trong vòng 30 giây
- Đổ toàn bộ phần lugol thừa rồi rửa nhẹ tiêu bản dưới vòi nước chảy
- Tẩy màu bằng cồn aceton 25% cho đến khi vừa hết màu tím phai ra
- Đổ toàn bộ phần cồn thừa rồi rửa nhẹ tiêu bản dưới vòi nước chảy
- Nhuộm tương phản bằng fuchsin trong vòng 60 giây
- Đổ toàn bộ phần thuốc nhuộm thừa rồi rửa nhẹ tiêu bản dưới vòi nước chảy
- Để tiêu bản khô và soi.
IV. NHẬN ĐỊNH KẾT QUẢ
Nghĩ đến Neisseria gonorrhoeae khi quan sát thấy hình ảnh cầu khuẩn Gram âm xếp đôi, hình hạt cà phê nằm trong và ngoài bạch cầu đa nhân trung tính.
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
- Vi khuẩn nhạt màu có thể do tẩy quá lâu hoặc nhuộm chưa đủ (thời gian).
- Nếu vi khuẩn tối màu có thể do tẩy chưa đủ thời gian.
- Mỗi mẻ nhuộm không nên quá nhiều tiêu bản, các tiêu bản để cách nhau ít nhất 1 cm.
47. Neisseria gonorrhoeae nuôi cấy, định danh và kháng thuốc
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Phát hiện và định danh V. cholerae bằng phương pháp nuôi cấy kinh điển.
Xác định mức độ nhạy cảm với kháng sinh của V. cholerae.
2. Nguyên lý
Vi khuẩn được định danh dựa vào đặc điểm nuôi cấy, một số tính chất chuyển hóa, các đặc điểm về hình thái học.
Mức độ nhạy cảm với kháng sinh của N. gonorrhoeae được xác định bằng phương pháp kháng sinh đồ khoanh giấy khuếch tán và được phiên giải ra phân loại S, I, R dựa trên tái liêu hướng dẫn CLSI được cập nhật hàng năm.
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: Cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Tủ an toàn sinh học cấp 2.
- Kính hiển vi quang học.
- Bàn phụ khoa.
- Đèn phụ khoa.
- Tủ ấm CO2 35 - 37oC.
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Lam kính | Cái | 2,000 |
| 2 | Dầu soi kính | ml | 1,000 |
| 3 | Xylen lau kính | ml | 1,000 |
| 4 | Dung dịch tím Gentian 1% | ml | 5,000 |
| 5 | Dung dịch Lugol 2% | ml | 2,000 |
| 6 | Dung dịch cồn tẩy Aceton 25% | ml | 10,000 |
| 7 | Dung dịch Fuchsin 1% | ml | 5,000 |
| 8 | Que lấy bệnh phẩm hoặc tăm bông vô trùng | Cái | 2,000 |
| 9 | Mỏ vịt (to, vừa và nhỏ) | Cái | 1,000 |
| 10 | Pince dài 25 cm (thẳng hoặc cong) | Cái | 1,000 |
| 11 | Môi trường nuôi cấy (Thayer - Martin) | Đĩa | 1,000 |
| 12 | Môi trường làm kháng sinh đồ (Thayer - Martin) | Đĩa | 2,000 |
| 13 | Chủng chuẩn (Neisseria) |
| ,000 |
| 14 | Khoanh giấy tẩm kháng sinh làm KSĐ | Khoanh | 12,000 |
| 15 | Oxidase | Tube | 1,000 |
| 16 | Neisseria 4H | Thanh | 1,000 |
| 17 | Cồn 90 độ (vệ sinh dụng cụ) | ml | 10,000 |
| 18 | Đèn cồn | Cái | 0,0001 |
| 29 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 20 | Hộp vận chuyển bệnh phẩm | Cái | 0,0001 |
| 21 | Mũ | Cái | 0,020 |
| 22 | Khẩu trang | Cái | 0,020 |
| 23 | Găng tay | Đôi | 3,000 |
| 24 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 25 | Quần áo bảo hộ | Bộ | 0,001 |
| 26 | Thùng có dung dịch sát khuẩn ngâm mỏ vịt và Pince | ml | 10,000 |
| 27 | Ống nghiệm thủy tinh | Ống | 1,000 |
| 28 | Bút viết kính | Cái | 0,020 |
| 29 | Bút bi | Cái | 0,010 |
| 30 | Bật lửa | Cái | 0,010 |
| 31 | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 32 | Cồn sát trùng tay nhanh | ml | 2,000 |
| 33 | Dung dịch nước rửa tay | ml | 8,000 |
| 34 | Khăn lau tay | Cái | 0,030 |
| 35 | Giấy trả kết quả xét nghiệm | Tờ | 2,000 |
| 36 | QC (nếu thực hiện) * |
| 0,1 |
| 37 | EQAS (nếu thực hiện) * |
| 0,005 |
* Ghi chú:
- Chi phí nội kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình nội kiểm (QC) là 1/10 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lượng ≥ 10 mẫu cho 1 lần tiến hành kỹ thuật).
- Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/200 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 2 lần/1 năm).
3. Bệnh phẩm
Dịch, mủ: âm đạo, niệu đạo, họng, hậu môn…
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
Theo đúng quy định của chuyên ngành Vi sinh (Xem Phụ lục 1 và Phụ lục 6)
2. Tiến hành kỹ thuật
2.1. Nuôi cấy bệnh phẩm trên môi trường Thayer - Martin
2.2. Để vào tủ ấm 35 - 36 độ có 5% - 10% CO2, độ ẩm >80%
2.3. Chọn khuẩn lạc nghi ngờ
2.4. Phản ứng Oxidase (+)
2.5. Thử nghiệm tính chất sinh vật hóa học.
IV. NHẬN ĐỊNH KẾT QUẢ
Định danh Neisseria gonorrhoeae dựa vào:
- Nhuộm Gram: cầu khuẩn Gram âm, xếp đôi, hình hạt cà phê nằm trong và ngoài tế bào
- Khuẩn lạc điển hình trên môi trường Thayer - Martin.
- Tính chất sinh vật hóa học: Oxidase dương tính; Lên men đường glucose.
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
- Vi khuẩn không mọc do nồng độ CO2 và độ ẩm không đủ tiêu chuẩn.
- Chất lượng môi trường Thayer - Martin không đủ tiêu chuẩn.
48. Neisseria gonorrhoeae PCR
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Phát hiện sự có mặt bộ gen của Neisseria gonorrhoeae (vi khuẩn lậu) có trong bệnh phẩm.
2. Nguyên lý
Dựa trên nguyên lý thuật PCR.
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện: Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ
hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: Cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Tủ an toàn sinh học tối thiểu cấp 1
- Máy ủ nhiệt
- Máy ly tâm 25000 x g
- Máy ly tâm dùng cho tube 0,2 ml
- Máy vortex
- Máy chạy PCR
- Các loại pipet điều chỉnh được: 1000µl, 200µl, 100µl, 10µl
- Máy điện di
- Máy đọc ảnh gel
- Tủ lạnh thường
- Tủ âm sâu (-20oC) hoặc (-70oC) (nếu có)
- Bộ lưu điện
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
Định mức sinh phẩm và vật tư tiêu hao cho 2 mẫu/lần thực hiện (VD)
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Giấy xét nghiệm | Tờ | 1,000 |
| 2 | Dụng cụ lấy bệnh phẩm | Que | 2,000 |
| 3 | Găng không có bột (DNase-RNase free) | Đôi | 0,500 |
| 4 | Ống nhựa Ependoff 1.5ml | ống | 2,000 |
| 5 | Bút viết kính, bút bi, diêm | Cái | 0,020 |
| 6 | Xà phòng | Bánh | 0,010 |
| 7 | Khăn lau tay | Cái | 0,010 |
| 8 | Bông, cồn | Túi | 0,010 |
| 9 | Nước muối sinh lý | ml | 5,000 |
| 10 | Bộ KIT chiết tách DNA Đóng gói 50 phản ứng | Hộp | 0,020 |
| 11 | Khấu hao sinh phẩm cho chứng và QC kiểm tra lại, standard các loại | Test | 1,350 |
| 12 | PBS Buffer Đóng gói 500ml | Chai | 0,002 |
| 13 | Absolute Ethanol Đóng gói 1000ml | Chai | 0,002 |
| 14 | 10mM dNTP mix Đóng gói 100µl | ống | 0,005 |
| 15 | Taq DNA Polymerase, Native Đóng gói: 5 units/µl, 500 units (100 µl) | ống | 0,002 |
| 16 | Primer đặc hiệu cho vi khuẩn Neisseria gonorrhoeae Đóng gói 50nM | bp | 0,100 |
| 17 | UltraPure DNase/RNase Distilled Water Đóng gói 500ml | Chai | 0,001 |
| 18 | Ultrapure Agarose Đóng gói 100g | Lọ | 0,001 |
| 19 | Ultrapure TBE Buffer 10X Đóng gói 1000ml | Chai | 0,001 |
| 20 | 100bp DNA ladder Đóng gói 50ug | ống | 0,001 |
| 21 | 10X BlueJuice Gel Loading dye Đóng gói 3x1ml | ống | 0,001 |
| 22 | Utrapure 10mg/ml Ethidium Bromide Đóng gói 10ml | lọ | 0,001 |
| 23 | ống ly tâm 1,7ml Đóng gói 500c/túi | túi | 0,004 |
| 24 | ống PCR 0,2 ml, nắp phẳng Đóng gói: 500c/túi, 1000c/hộp | hộp | 0,001 |
| 25 | Đầu côn 1000ml có lọc | túi | 0,001 |
| 26 | Đầu côn 200ml có lọc | túi | 0,004 |
| 27 | Đầu côn 0,2-10µl có lọc | túi | 0,001 |
| 28 | Dung dịch khử trùng | ml | 1,000 |
| 29 | Sổ lưu kết quả xét nghiệm | Quyển | 0,001 |
| 30 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 31 | Hộp lưu bệnh phẩm | Cái | 0,0001 |
| 32 | Quần áo bảo hộ | Bộ | 0,005 |
| 33 | Mũ | Cái | 0,020 |
| 34 | Khẩu trang | Cái | 0,020 |
| 35 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 36 | Giấy thấm | Cuộn | 0,100 |
| 37 | EQAS (nếu thực hiện)* |
| 0,005 |
* Ghi chú:
Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/200 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 2 lần/1 năm).
3. Bệnh phẩm: Các loại dịch tiết và mô sinh thiết
4. Phiếu xét nghiệm: Điền đầy đủ thông tin theo mẫu phiếu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
Theo đúng quy định của chuyên ngành Vi sinh (Xem Phụ lục 3).
2. Tiến hành kỹ thuật
2.1. Tách chiết DNA từ bệnh phẩm
2.2. Pha hỗn hợp phản ứng PCR
2.3. Chạy phản ứng PCR
2.4. Điện di sản phẩm PCR
2.5. Đọc kết quả
IV. NHẬN ĐỊNH KẾT QUẢ
- Phản ứng dương tính: có vạch sản phẩm PCR tương ứng với cặp mồi.
- Phản ứng âm tính: không có vạch sản phẩm PCR tương ứng với cặp mồi.
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
1. Sai sót
- Phản ứng dương tính giả: do tạp nhiễm từ môi trường
- Phản ứng âm tính giả: do phản ứng PCR bị ức chế
2. Xử trí
Để hạn chế các hiện tượng trên phải tuân thủ chặt chẽ quy trình kỹ thuật
49. Neisseria gonorrhoeae Real-time PCR
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Phát hiện DNA đặc trưng của Neisseria gonorrhoeae từ các vết loét hoặc dịch đường sinh dục của người
2. Nguyên lý
Phát hiện DNA đặc trưng của Neisseria gonorrhoeae dựa trên nguyên lý của kỹ thuật real-time PCR.
II. CHUẨN BỊ
1.Người thực hiện
- Người thực hiện Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Máy real-time PCR và hệ thống máy vi tính.
- Bộ lưu điện
- Tủ an toàn sinh học cấp 2
- Máy ly tâm dùng cho tube 0,2ml
- Máy ly tâm 25000 x g
- Máy ủ nhiệt
- Máy vortex
- Tủ lạnh 2oC -8oC
- Tủ âm sâu (- 20oC) hoặc (-70oC) (nếu có)
- Micropipettes các thể tích từ 5 ml - 1000 ml.
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm) Ví dụ cho loại sinh phẩm/ kỹ thuật hoặc tương đương (tùy quy trình cụ thể) Định mức sinh phẩm và vật tư tiêu hao cho 3 mẫu/lần thực hiện (VD)
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Tăm bông vô trùng | Kg | 0,001 |
| 2 | Găng không có bột tal | Cái | 0,500 |
| 3 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 4 | Hộp vận chuyển bệnh phẩm | Cái | 0.001 |
| 5 | Sinh phẩm chẩn đoán | Test | 1,000 |
| 6 | Khấu hao sinh phẩm cho chạy chứng, kiểm tra chất lượng | Test | 1,200 |
| 7 | Kit tách DNA | Test | 2,200 |
| 8 | Ngoại kiểm (nếu có)* |
| 0,020 |
| 9 | ống Falcol 50ml | Cái | 0,010 |
| 10 | Ependoff 1,7ml | Tube | 2,200 |
| 11 | Ependoff 0,2ml | Tube | 2,200 |
| 12 | Đầu côn 10 µl có lọc | Cái | 2,200 |
| 13 | Đầu côn 30 µl | Cái | 1,200 |
| 14 | Đầu côn 200 µl có lọc | Cái | 5,200 |
| 15 | Đầu côn 1 ml có lọc | Cái | 3,200 |
| 21 | Water-DEPC Treated | ml | 1,000 |
| 22 | Giấy thấm | Cuộn | 0,100 |
| 23 | Giấy xét nghiệm | Tờ | 2,000 |
| 24 | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 25 | Bút viết kính | Cái | 0,020 |
| 26 | Bút bi | Cái | 0,010 |
| 27 | Mũ | Cái | 0,020 |
| 28 | Khẩu trang | Cái | 0,020 |
| 30 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 31 | Quần áo bảo hộ | Bộ | 0,005 |
| 32 | Dung dịch nước rửa tay | ml | 8,000 |
| 33 | Cồn sát trùng tay nhanh | ml | 1,000 |
| 34 | Dung dịch khử trùng | ml | 10,000 |
| 35 | Khăn lau tay | Cái | 0,010 |
* Ghi chú: Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/50 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 3 lần/1 năm)..
3. Bệnh phẩm
Dịch niệu đạo, dịch âm đạo, nước tiểu, dịch vết loét
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1.Lấy bệnh phẩm
- Theo đúng quy định của chuyên ngành Vi sinh (xem phụ lục 3)
- Từ chối những bệnh phẩm không đạt yêu cầu (xem phụ lục 6).
2. Tiến hành kỹ thuật: Bộ sinh phẩm NGN rPCR Mix (VD)
2.1. Thu nhận và Xử lý mẫu
Phải đồng nhất và xử lý mẫu trước khi tách chiết DNA
2.2. Tách chiết DNA: Tách chiết bằng hóa chất phenol/chloroform
2.3. Thực hiện phản ứng real-time PCR
- Thực hiện bước này với các tube PCR mix được giữ trong khay lạnh hoặc đá đang tan.
- Chỉ lấy đủ số tube PCR mix cầnTrước và sau khi đặt phản ứng PCR phải ly tâm tube để tất cả dung dịch nằm dước đáy tube.
- Cho chứng +, chứng - hoặc dịch DNA tách chiết vào từng tube NGN rPCR Mix. Xong, đặt các tube vào máy real-time PCR.
- Khởi động máy real-time PCR. Khởi động máy tính và chương trình real- time PCR.
- Cài đặt vị trí mẫu “Plate setup” trên phần mềm đúng với vị trí mẫu đã đặt trên máy real-time PCR.
- Chọn màu “FAM” và “HEX” và “CY5” cho mẫu, chứng dương và chứng âm.
- Cài đặt chương trình “Protocol” cho máy real-time PCR hoạt động
- Lưu file dữ liệu vào máy tính
- Cho máy real-time PCR chạy chương trình.
IV. NHẬN ĐỊNH KẾT QUẢ
1. Điều kiện của phản ứng
- Chứng dương có đường biểu diễn tín hiệu huỳnh quang màu FAM và màu HEX tuyến tính vượt quá tín hiệu nền (đường biểu diễn dương tính) và đường biểu diễn tín hiệu huỳnh quang màu CY5 dương tính hoặc thẳng và không vượt qua tín hiệu nền (đường biểu diễn âm tính).
- Chứng âm có đường biểu diễn tín hiệu huỳnh quang màu FAM và màu HEX âm tính và đường biểu diễn tín hiệu huỳnh quang màu CY5 dương tính
2. Phân tích mẫu
- Mẫu dương tính: Mẫu có đường biểu diễn dương tính rõ ràng tương ứng với màu của từng tác nhân và bắt đầu từ chu kỳ 36 trở về trước. Một mẫu có thể dương tính với 1 trong 2 tác nhân hoặc dương tính đồng thời cả 2 tác nhân.
- Mẫu nghi ngờ: Mẫu có đường biểu diễn dương tính và bắt đầu từ sau chu kỳ 36 → đề nghị lấy mẫu lại để thực hiện xét nghiệm hoặc thực hiện lại xét nghiệm sau 1-3 tháng.
- Mẫu âm tính: Mẫu có đường biểu diễn âm tính, chứng nội phải dương tính.
3. In đồ thị kết quả
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
Có mẫu và chứng nội cũng đều âm tính. Chứng bình thường, có mẫu dương, mẫu âm thật sự.
1. Nguyên nhân: Có thể mẫu âm thực sự, có thể phản ứng PCR bị ức chế.
2. Khắc phục
- Pha loãng mẫu từ 10-100 lần, thực hiện lại toàn bộ thí nghiệm từ bước tách chiết. Sau khi có kết quả phải nhân thêm với hệ số pha loãng mẫu. Nếu vẫn gặp sự cố trên, lấy lại mẫu theo đúng yêu cầu.
- Trừ những mẫu sự cố, tất cả các mẫu bình thường đều có thể lấy kết quả.
50. Neisseria meningitidis nhuộm soi
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Nhận định sơ bộ hình ảnh vi khuẩn N. meningitidis và các hình ảnh tế bào (nếu có) trực tiếp từ bệnh phẩm.
2. Nguyên lý
Đánh giá hình thể, kích thước, tính chất bắt màu, cách sắp xếp đặc trưng của vi khuẩn N. menigitidis và các hình ảnh tế bào (nếu có) bằng kỹ thuật nhuộm và soi dưới kính hiển vi quang học.
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: Cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Tủ an toàn sinh học cấp 2
- Kính hiển vi quang học
- Dụng cụ sấy lam (nếu có)
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
Thực hiện xét nghiệm 01 mẫu bệnh phẩm/lần
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Lọ lấy bệnh phẩm | lọ | 1,000 |
| 2 | Que lấy bệnh phẩm | cái | 1,000 |
| 3 | Lam kính | cái | 2,000 |
| 4 | Dầu soi kính | ml | 1,000 |
| 5 | Xylen lau kính | ml | 1,000 |
| 6 | Nước muối sinh lý | ml | 5,000 |
| 7 | Thuốc nhuộm đỏ Fuchsin | ml | 5,000 |
| 8 | Thuốc nhuộm tím Gentian | ml | 5,000 |
| 9 | Cồn tẩy 95 độ | ml | 10,000 |
| 10 | Lugol | ml | 5,000 |
| 11 | Bông | kg | 0,001 |
| 12 | Cồn 90 độ (vệ sinh dụng cụ) | ml | 10,000 |
| 13 | Đèn cồn | cái | 0,0001 |
| 14 | Panh | cái | 0,0001 |
| 15 | Khay đựng bệnh phẩm | cái | 0,0001 |
| 16 | Hộp vận chuyển bệnh phẩm | cái | 0.0001 |
| 17 | Mũ | cái | 0,020 |
| 18 | Khẩu trang | cái | 0.020 |
| 19 | Găng tay | đôi | 3,000 |
| 20 | Găng tay xử lý dụng cụ | đôi | 0,020 |
| 21 | Quần áo bảo hộ | bộ | 0,001 |
| 22 | Acid ngâm lam | ml | 10,000 |
| 23 | Ống nghiệm thủy tinh | ống | 1,000 |
| 24 | Bút viết kính | cái | 0,020 |
| 25 | Bút bi | cái | 0,010 |
| 26 | Bật lửa | cái | 0,010 |
| 27 | Sổ lưu kết quả xét nghiệm | tờ | 0,001 |
| 28 | Cồn sát trùng tay nhanh | ml | 2,000 |
| 29 | Dung dịch nước rửa tay | ml | 8,000 |
| 30 | Khăn lau tay | cái | 0,030 |
| 31 | Giấy trả kết quả xét nghiệm | tờ | 2,000 |
| 32 | QC (nếu thực hiện) * |
| 0,1 |
| 33 | EQAS (nếu thực hiện) * |
| 0,005 |
* Ghi chú:
- Chi phí nội kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình nội kiểm (QC) là 1/10 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lượng ≥ 10 mẫu cho 1 lần tiến hành kỹ thuật).
- Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/200 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 2 lần/1 năm).
3. Bệnh phẩm
Dịch não tủy, dịch ngoáy họng mũi, hồng ban trên da.
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
1. Lấy bệnh phẩm
Theo đúng quy định của chuyên ngành Vi sinh (Xem Phụ lục 1).
2. Tiến hành kỹ thuật
2.1. Chuẩn bị tiêu bản
2.2. Nhuộm Gram
- Nhuộm tím gentian trong vòng 60 giây
- Đổ toàn bộ phần thuốc nhuộm thừa rồi rửa nhẹ tiêu bản dưới vòi nước chảy
- Hỗ trợ bắt màu tím bằng lugol trong vòng 30 giây
- Đổ toàn bộ phần lugol thừa rồi rửa nhẹ tiêu bản dưới vòi nước chảy
- Tẩy màu bằng cồn 95% cho đến khi vừa hết màu tím phai ra
- Đổ toàn bộ phần cồn thừa rồi rửa nhẹ tiêu bản dưới vòi nước chảy
- Nhuộm tương phản bằng safranin trong vòng 60 giây
- Đổ toàn bộ phần thuốc nhuộm thừa rồi rửa nhẹ tiêu bản dưới vòi nước chảy
- Để tiêu bản khô và soi.
IV. NHẬN ĐỊNH KẾT QUẢ
Nghĩ đến Neisseria meningitidis khi quan sát thấy hình ảnh cầu khuẩn Gram âm xếp đôi, hình hạt cà phê nằm trong và ngoài bạch cầu đa nhân trung tính.
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
1. Sai sót
Neisseria meningitidis có thể bắt màu không đúng do tẩy cồn chưa đủ hoặc làm đồ phiến quá dầy.
2. Xử trí
- Tuân thủ đúng các bước của quy trình nhuộm Gram.
- Kiểm tra chất lượng thuốc nhuộm hàng tuần với chủng chuẩn
51. Neisseria meningitidis nuôi cấy, định danh và kháng thuốc
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Phát hiện và định danh N. meningitidis bằng phương pháp nuôi cấy kinh điển.
Xác định mức độ nhạy cảm với kháng sinh của N. meningitidis.
2. Nguyên lý
Vi khuẩn được định danh dựa vào đặc điểm nuôi cấy, một số tính chất chuyển hóa, các đặc điểm về hình thái học.
Mức độ nhạy cảm với kháng sinh của N. meningitidis được xác định bằng phương pháp kháng sinh đồ khoanh giấy khuếch tán và được phiên giải ra phân loại S, I, R dựa trên tái liêu hướng dẫn CLSI được cập nhật hàng năm.
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: Cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Tủ an toàn sinh học cấp 2
- Kính hiển vi quang học
- Dụng cụ sấy lam (nếu có)
- Tủ ấm CO2 Advatage - Lab
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Lọ lấy bệnh phẩm | lọ | 1,000 |
| 2 | Que lấy bệnh phẩm | cái | 2,000 |
| 3 | Lam kính | cái | 4,000 |
| 4 | Dầu soi kính | ml | 2,000 |
| 5 | Xylen lau kính | ml | 2,000 |
| 6 | Nước muối sinh lý | ml | 15,000 |
| 7 | Thuốc nhuộm đỏ fuchsin | ml | 10,000 |
| 8 | Thuốc nhuộm tím gentian | ml | 10,000 |
| 9 | Cồn tẩy 95 độ | ml | 20,000 |
| 10 | Lugol | ml | 10,000 |
| 11 | Môi trường nuôi cấy | test | 1,500 |
| 12 | Kháng sinh đồ sô cô la | đĩa | 4,000 |
| 13 | Khoanh giấy kháng sinh | khoanh | 8,000 |
| 14 | Dải giấy kháng sinh | cái | 3,000 |
| 15 | Tăm bông vô trùng | cái | 1,000 |
| 16 | Ống nghiệm thủy tinh | ống | 1,000 |
| 17 | Bông | kg | 0,003 |
| 18 | Cồn 90 độ (vệ sinh dụng cụ) | ml | 30,000 |
| 19 | Đèn cồn | cái | 0,0002 |
| 20 | Panh | cái | 0,0001 |
| 21 | Khay đựng bệnh phẩm | cái | 0,0001 |
| 22 | Hộp vận chuyển bệnh phẩm | cái | 0,0001 |
| 23 | Mũ | cái | 0,060 |
| 24 | Khẩu trang | cái | 0,060 |
| 25 | Găng tay | đôi | 9,000 |
| 26 | Găng tay xử lý dụng cụ | đôi | 0,060 |
| 27 | Quần áo bảo hộ | bộ | 0,002 |
| 28 | Acid ngâm lam | ml | 20,000 |
| 29 | Ống nghiệm thủy tinh | ống | 1,000 |
| 30 | Bút viết kính | cái | 0,040 |
| 31 | Bút bi | cái | 0,020 |
| 32 | Bật lửa | cái | 0,020 |
| 33 | Sổ lưu kết quả xét nghiệm | tờ | 0,001 |
| 34 | Cồn sát trùng tay nhanh | ml | 6,000 |
| 35 | Dung dịch nước rửa tay | ml | 24,000 |
| 36 37 | Khăn lau tay Giấy trả kết quả xét nghiệm | cái tờ | 0,090 2,000 |
| 38 | QC (nếu thực hiện) * |
| 0,1 |
| 39 | EQAS (nếu thực hiện) * |
| 0,005 |
* Ghi chú:
- Chi phí nội kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình nội kiểm (QC) là 1/10 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lượng ≥ 10 mẫu cho 1 lần tiến hành kỹ thuật).
- Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/200 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 2 lần/1 năm).
3. Bệnh phẩm
Dịch não tủy, dịch ngoáy họng mũi, tổn thương da.
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
1. Lấy bệnh phẩm
Theo đúng quy định của chuyên ngành Vi sinh (Xem Phụ lục 1 và Phụ lục 6)
2. Tiến hành kỹ thuật
2.1. Nhuộm soi
2.2. Nuôi cấy
Nuôi cấy trên môi trường sô cô la để ở điều kiện 37oC/5% CO2.
2.3. Định danh
Thử nghiệm tính chất sinh vật hóa học.
2.4. Kháng sinh đồ
Thử nghiệm các khoanh giấy kháng sinh và thanh Etest trên môi trường Muller-Hinton máu theo hướng dẫn của CLSI.
IV. NHẬN ĐỊNH KẾT QUẢ
Neisseria meningitidis có hình ảnh song cầu, hình hạt cà phê, bắt màu Gram âm (màu đỏ).
Nuôi cấy trên môi trường sô cô la (370C/5% CO2), khuẩn lạc dạng S, xám.
Một số tính chất sinh vật hóa học: oxydase (+), glucose (+), maltose (+), lactose (-), saccarose (-.
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
1. Sai sót
- Neisseria meningitidis có thể bắt màu không đúng do tẩy cồn chưa đủ hoặc làm đồ phiến quá dầy.
- Neisseria meningitidis có thể không mọc do đốt ăng quá nóng, điều kiện nuôi cấy không đảm bảo, lượng bệnh phẩm quá ít.
2. Xử trí
- Tuân thủ đúng các bước của quy trình nhuộm Gram.
- Kiểm tra chất lượng thuốc nhuộm hàng tuần với chủng chuẩn.
- Để ăng nguội trước khi tiến hành nuôi cấy; thường xuyên kiểm tra nhiệt độ, nồng độ CO2 cho nuôi cấy.
52. Neisseria menigititdis PCR
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Xác định sự có mặt gen đặc trưng của Neisseria meningitides (não mô cầu)
2. Nguyên lý
Thực hiện bằng kỹ thuật PCR sử dụng cặp mồi đặc hiệu.
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện: Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: Cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Tủ an toàn sinh học cấp 2
- Máy PCR
- Máy điện di
- Máy đọc điện di
- Máy ly tâm 25000 x g
- Máy ly tâm dùng cho tube 0,2 ml
- Máy ủ nhiệt
- Máy vortex
- Micropipette
- Bộ lưu điện
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
Định mức sinh phẩm và vật tư tiêu hao cho 3 mẫu/lần thực hiện (VD)
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Bông | kg | 0,001 |
| 2 | Cồn | ml | 1,000 |
| 3 | Bơm kim tiêm | Cái | 1,000 |
| 4 | Panh | Cái | 0,0001 |
| 5 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 6 | Hộp vận chuyển bệnh phẩm | Test | 0,001 |
| 7 | Tube đựng bệnh phẩm | Cái | 2,000 |
| 8 | Găng không có bột (DNase-RNase free) | Cái | 0,500 |
| 9 | Sinh phẩm chẩn đoán | Test | 1,000 |
| 10 | Khấu hao sinh phẩm cho kiểm tra lại | Test | 1,350 |
| 11 | Kit tách chiết DNA | Test | 2,350 |
| 12 | DNA marker | Bộ | 1,000 |
| 13 | Primer 1 | ml | 0,0001 |
| 14 | Primer 2 | ml | 0,0001 |
| 15 | Ống Eppendorf 1,5 ml | Tube | 3,000 |
| 16 | Ống Eppendorf 0,2 ml | Tube | 1,000 |
| 17 | Đầu côn 10 µl có lọc | Cái | 1,000 |
| 18 | Đầu côn 30 µl | Cái | 1,200 |
| 19 | Đầu côn 200 µl có lọc | Cái | 2,200 |
| 20 | Đầu côn 1 ml có lọc | Cái | 3,200 |
| 21 | Ethanol BDH | ml | 0,500 |
| 22 | Water-DEPC Treated | ml | 2,000 |
| 23 | Giấy thấm | Cuộn | 0,100 |
| 24 | Giấy xét nghiệm | Tờ | 2,000 |
| 25 | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 26 | Bút viết kính | Cái | 0,020 |
| 27 | Bút bi | Cái | 0,010 |
| 28 | Mũ | Cái | 0,020 |
| 29 | Khẩu trang | Cái | 0,020 |
| 30 | Găng tay | Đôi | 0,100 |
| 31 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 32 | Quần áo bảo hộ | Bộ | 0,005 |
| 33 | Dung dịch nước rửa tay | ml | 8,000 |
| 34 | Cồn sát trùng tay nhanh | ml | 1,000 |
| 35 | Dung dịch khử trùng | ml | 10,000 |
| 36 | Khăn lau tay | cái | 0,010 |
| 37 | EQAS (nếu thực hiện)* |
| 0,005 |
* Ghi chú:
- Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/200 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 2 lần/1 năm).
3. Bệnh phẩm
Máu, dịch ngoáy họng, dịch não tủy,…
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu phiếu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1.Lấy bệnh phẩm
Theo đúng quy định của chuyên ngành Vi sinh (Xem Phụ lục 3)
2. Tiến hành kỹ thuật
2.1. Tách chiết DNA tổng số
2.2. Thực hiện PCR
2.3. Điện di kiểm tra sản phẩm
2.4. Đánh giá và kết luận
IV. NHẬN ĐỊNH KẾT QUẢ
Sản phẩm PCR phải có một băng đặc hiệu duy nhất, rõ nét và không bị đứt gẫy và có kích thước phù hợp tương ứng với thang DNA chuẩn.
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
Trong trường hợp không có sản phẩm PCR, cần phải kiểm tra lại quá trình tách chiết DNA tổng số, chất lượng primers và master mix, và thực hiện lại xét nghiệm.
53. Neisseria meningitidis Real-time PCR
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Phát hiện DNA đặc trưng của Neisseria meningititdis từ dịch não tủy.
2. Nguyên lý
Dựa trên nguyên lý của kỹ thuật real-time PCR.
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện: Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: Cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Máy realime PCR và hệ thống máy vi tính
- Bộ lưu điện
- Tủ an toàn sinh học cấp 2
- Máy ly tâm dùng cho tube 0,2ml
- Máy ly tâm 25000 x g
- Máy ủ nhiệt
- Máy vortex
- Tủ lạnh 2 oC - 8 oC
- Tủ âm sâu (-20oC) hoặc (-70oC)
- Micropipettes các thể tích từ 5-1000µl
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
Định mức sinh phẩm và vật tư tiêu hao cho 03 mẫu/lần thực hiện (VD)
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Tăm bông vô trùng | kg | 0,001 |
| 2 | Găng không bột tal | cái | 0,500 |
| 3 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 4 | Hộp vận chuyển bệnh phẩm | Test | 0,001 |
| 5 | Sinh phẩm chẩn đoán | Test | 1,000 |
| 6 | Khấu hao sinh phẩm cho chạy chứng, kiểm tra chất lượng | Test | 1,200 |
| 7 | Kit tách chiết DNA | Test | 2,200 |
| 8 | Ngoại kiểm (nếu có)* |
| 0,020 |
| 9 | Ống Falcol 50 ml | Cái | 0,010 |
| 10 | Eppendorf 1,7 ml | Tube | 2,200 |
| 11 | Eppendorf 0,2 ml | Tube | 2,200 |
| 12 | Đầu côn 10 µl có lọc | Cái | 1,000 |
| 13 | Đầu côn 30 µl | Cái | 1,200 |
| 14 | Đầu côn 200 µl có lọc | Cái | 5,200 |
| 15 | Đầu côn 1ml có lọc | Cái | 3,200 |
| 16 | Water-DEPC treated | ml | 1,000 |
| 17 | Giấy thấm | Cuộn | 0,100 |
| 18 | Giấy xét nghiệm | Tờ | 2,000 |
| 19 | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 20 | Bút viết kính | Cái | 0,020 |
| 21 | Bút bi | Cái | 0,010 |
| 22 | Mủ | Cái | 0,020 |
| 23 | Khẩu trang | Cái | 0,020 |
| 24 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 25 | Quần áo bảo hộ | Bộ | 0,005 |
| 26 | Dung dịch nước rửa tay | ml | 8,000 |
| 27 | Cồn sát trùng tay nhanh | ml | 1,000 |
| 28 | Dung dịch khử trùng | ml | 10,000 |
| 29 | Khăn lau tay | Cái | 0,010 |
* Ghi chú:
- Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/50 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 3 lần/1 năm).
3. Bệnh phẩm: Dịch não tủy.
4. Phiếu xét nghiệm: Điền đầy đủ thông tin theo mẫu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
- Theo đúng quy định của chuyên ngành Vi sinh (xem phụ lục 3)
- Từ chối những bệnh phẩm không đạt yêu cầu (xem phụ lục 6)
2. Tiến hành kỹ thuật
Bộ sinh phẩm NHS Meningitidis Real-TM (Sacace -VD)
2.1. Thu nhận và xử lý mẫu
2.2. Tách chiết DNA
2.3. Thực hiện phản ứng real-time PCR
- Thực hiện bước này với các tube PCR mix được giữ trong khay đá lạnh hoặc đá đang tan.
- PCR 0.2 ml.
- Chỉ lấy đủ số tube PCR 0.2 ml cần. Chuẩn bị MasterMix và phân phối vào các tube sau đó ly tâm tube để tất cả dung dịch nằm dưới đáy tube.
- Cho các chứng dương, chứng âm và IC (internal control) hoặc dịch DNA tách chiết vào từng tube PCR mix. Xong đặt các tube vào máy realtime PCR
- Khởi động máy realtime PCR. Khởi động máy tính và chương trình real-time PCR
- Cài đặt vị trí mẫu “Plate setup” trên phần mềm đúng với vị trí mẫu đặt trên máy real-time PCR.
- Chọn màu “FAM” và “JOE” cho mẫu, chứng dương và chứng âm.
- Cài đặt chương trình “Protocol” cho máy realtime PCR hoạt động.
- Lưu file dữ liệu vào máy tính.
- Cho máy realtime chạy chương trình
IV. NHẬN ĐỊNH KẾT QUẢ
1. Điều kiện của phản ứng
- Chứng dương có đường biểu diễn tín hiệu huỳnh quang màu JOE dương tính và đường biểu diễn tín hiệu huỳnh quang màu FAM âm tính.
- Chứng âm có đường biểu diễn tín hiệu huỳnh quang màu FAM dương tính, đường biểu diễn tín hiệu huỳnh quang màu JOE âm tính.
2. Phân tích mẫu
- Mẫu dương tính: Mẫu có đường biểu diễn dương tính rõ ràng với màu bắt đầu từ chu kỳ 36 trở về trước.
- Mẫu nghi ngờ: Mẫu có đường biểu diễn dương tính và bắt đầu từ sau chu kỳ 36 → đề nghị lấy mẫu lại để thực hiện xét nghiệm.
- Mẫu âm tính: Mẫu có đường biểu diễn âm tính, chứng nội phải dương tính.
3. In đồ thị kết quả
V. NHỮNG SAI SÓT CẦN XỬ TRÍ
Có mẫu và chứng nội cũng đều âm tính. Chứng bình thường, có mẫu dương, mẫu âm thật sự.
1. Nguyên nhân: Có thể mẫu âm thật sự, có thể phản ứng PCR bị ức chế
2. Khắc phục
- Pha loãng mẫu từ 10-100 lần, thực hiện lại toàn bộ thí nghiệm từ bước tách chiết. Sau khi có kết quả phải nhân thêm với hệ số pha loãng mẫu. Nếu vẫn gặp sự cố trên, lấy lại mẫu theo đúng yêu cầu.
- Trừ những mẫu sự cố, tất cả các mẫu bình thường đều có thể lấy kết quả.
54. Chlamydia test nhanh
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Xác định nhanh Chlamydia có trong bệnh phẩm.
2. Nguyên lý
Sử dụng kháng thể đặc hiệu kháng lại lipopolysacchride (LPS) của vi khuẩn Chlamydia trachomatis để phát hiện sự có mặt của Chlamydia trachomatis trong bệnh phẩm.
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: Cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Bàn phụ khoa
- Tủ an toàn sinh học cấp 2
- Đèn phụ khoa
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Bộ Kit làm xét nghiệm | test | 1,000 |
| 2 | Micropipette 50 - 200 µl | cái | 1,000 |
| 3 | Đầu côn 200 µl | cái | 3,000 |
| 4 | Bông | Kg | 0,001 |
| 5 | Cồn 90 độ (vệ sinh dụng cụ) | ml | 10,000 |
| 6 | Đèn cồn | Cái | 1,000 |
| 7 | Panh | Cái | 1,000 |
| 8 | Mỏ vịt (to, vừa và nhỏ) | Cái | 1,000 |
| 9 | Thùng đựng dung dịch khử khuẩn ngâm mỏ vịt |
|
|
| 10 | Khay đựng bệnh phẩm | Cái | 1,000 |
| 11 | Hộp vận chuyển bệnh phẩm | Cái | 1,000 |
| 12 | Mũ | Cái | 1,000 |
| 13 | Khẩu trang | Cái | 1,000 |
| 14 | Găng tay | Đôi | 2,000 |
| 15 | Găng tay xử lý dụng cụ | Đôi | 2,000 |
| 16 | Quần áo bảo hộ | Bộ | 1,000 |
| 17 | Ống nghiệm thủy tinh | Ống | 1,000 |
| 18 | Bút viết kính | Cái | 1,000 |
| 19 | Bút bi | Cái | 1,000 |
| 20 | Bật lửa | Cái | 1,000 |
| 21 | Sổ lưu kết quả xét nghiệm | Tờ | 1,000 |
| 22 | Cồn sát trùng tay nhanh | ml | 2,000 |
| 23 | Dung dịch nước rửa tay | ml | 8,000 |
| 24 | Khăn lau tay | Cái | 1,000 |
| 25 | Giấy trả kết quả xét nghiệm | Tờ | 2,000 |
3. Bệnh phẩm
Dịch, mủ âm đạo, mủ niệu đạo
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
Theo đúng quy định của chuyên ngành Vi sinh (Xem Phụ lục 1).
2. Tiến hành kỹ thuật
2.1. Bỏ thanh thử ra khỏi túi bảo quản
2.2. Xoay tăm bông bệnh phẩm trong lọ, tách chiết tế bào 3 - 4 lần, bỏ tăm bông ra
2.3. Sử dụng micropipette hút 150µl dung dịch bệnh phẩm nhỏ vào thanh thử.
2.4. Để thanh thử ở nhiệt độ phòng. Đọc kết quả sau 20 phút
IV. NHẬN ĐỊNH KẾT QUẢ
Trên thanh thử xuất hiện 2 vạch màu tím đỏ: C là vạch kiểm tra (Control line), T là vạch thử nghiệm (Test line) hoặc chỉ có 1 vạch
Ghi kết quả như bảng sau:
| Hiện tượng | Kết quả |
| Trên thanh thử xuất hiện 2 vạch màu tím đỏ | Dương tính |
| Trên thanh thử xuất hiện 1 vạch (kiểm tra C) | Âm tính |
| Trên thanh thử không xuất hiện vạch C | Test hỏng |
Lưu ý: Bệnh phẩm chưa cho vào dung dịch tách chiết tế bào có thể giữ ở nhiệt độ phòng 24h và 72h ở tủ lạnh 2 - 8 độ C
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
- Dịch nhầy ở niệu đạo (nam giới) và ở cổ tử cung (nữ giới) cần được lau sạch để tránh cho kết quả dương tính giả.
- Bệnh phẩm để trong ống nghiệm khô có thể bảo quản trong tủ lạnh (2-8 oC) lâu nhất là 72h. Không được bảo quản trong ngăn đá.
- Phải làm lại mẫu xét nghiệm mới khi thanh thử bị hỏng (thanh thử không xuất hiện vạch tím tại vạch C).
55. Chlamydia nhuộm huỳnh quang
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Phát hiện nhanh sự có mặt của Chlamydia trong bệnh phẩm.
2. Nguyên lý
Phát hiện các tiểu thể Chlamydia có trong bệnh phẩm bằng phương pháp nhuộm soi trên kính hiển vi huỳnh quang, các tiểu thể Chlamydia được phát sáng trên nền tối.
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: Cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Tủ an toàn sinh học cấp 2
- Kính hiển vi huỳnh quang đèn LED
- Thiết bị sấy lam (nếu có)
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | FAST Auramin O stain | ml | 1,300 |
| 2 | FAST Decolorizer | ml | 1,200 |
| 3 | Cồn 96 độ (vệ sinh dụng cụ và ngâm lam) | ml | 20,000 |
| 4 | Dung dịch khử khuẩn ngâm que phết đờm | ml | 15,000 |
| 5 | Cồn sát trùng tay nhanh | ml | 2,000 |
| 6 | Dung dịch nước rửa tay | ml | 8,000 |
| 7 | Lọ/cốc/ tuýp lấy bệnh phẩm | Lọ | 1,200 |
| 8 | Lam kính | Cái | 1,500 |
| 9 | Lam kính (kiểm chuẩn) | Cái | 0,200 |
| 10 | Que phết đờm | Cái | 1,500 |
| 11 | Giấy lau kính | Tờ | 2,000 |
| 12 | Bông | Kg | 0,001 |
| 13 | Panh | Cái | 0,0001 |
| 14 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 15 | Hộp vận chuyển bệnh phẩm | Cái | 0,0001 |
| 16 | Hộp lưu tiêu bản | Cái | 0,0001 |
| 17 | Bô can (bình chứa) vật nhiễm | Cái | 0,0001 |
| 18 | Mũ | Cái | 0,020 |
| 19 | Khẩu trang | Cái | 0,020 |
| 20 | Găng tay | Đôi | 2,000 |
| 21 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 22 | Quần áo bảo hộ | Bộ | 0,001 |
| 23 | Khăn lau tay | Cái | 0,030 |
| 24 | Túi chứa rác thải lây nhiễm | Cái | 0,0001 |
| 25 | Khăn giấy vệ sinh các bàn làm việc | Tờ | 2,000 |
| 26 | Bút viết kính | Cái | 0,020 |
| 27 | Bút bi | Cái | 0,010 |
| 28 | Sổ nhận bệnh phẩm | Tờ | 0,001 |
| 29 | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 30 | Sổ bàn giao kết quả xét nghiệm | Tờ | 0,001 |
| 31 | Giấy trả kết quả xét nghiệm | Tờ | 2,000 |
| 32 | Nhãn mã vạch | Cái | 3,000 |
| 33 | QC (nếu thực hiện) * |
| 0,1 |
| 34 | EQAS (nếu thực hiện) * |
| 0,005 |
* Ghi chú:
- Chi phí nội kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình nội kiểm (QC) là 1/10 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lượng ≥ 10 mẫu cho 1 lần tiến hành kỹ thuật).
- Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/200 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 2 lần/1 năm).
3. Bệnh phẩm
Dịch niệu đạo, dịch cổ tử cung, các loại dịch khác. …
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
1. Lấy bệnh phẩm
Theo đúng quy định của chuyên ngành Vi sinh (Xem Phụ lục 1 và Phụ lục 6)
2. Tiến hành kỹ thuật
2.1. Chuẩn bị tiêu bản
2.2. Cố định tiêu bản
2.3. Nhuộm màu bằng FAST Auramin O
2.4. Tẩy và nhuộm nền bằng FAST Decolorizer
2.5. Đọc và đánh giá kết quả trên kính hiển vi huỳnh quang đèn LED
IV. NHẬN ĐỊNH KẾT QUẢ
Quan sát các tiểu thể Chlamydia trachomatis bằng vật kính 40 trên kính huỳnh quang đèn LED. Các tiểu thể Chlamydia trachomatis có hình tròn, bầu dục, riêng lẻ hoặc từng đám. tiểu thể bắt màu vàng sáng phát quang trên nền tối. Đếm số lượng tiểu thể và ghi kết quả như bảng sau:
| Số lượng tiểu thể | Kết quả | Mức độ |
| > 50 tiểu thể/ 1 vi trường (Đọc ít nhất 8 vi trường) | Dương tính | 3 + |
| 5-50 tiểu thể/ 1 vi trường (Đọc ít nhất 20 vi trường) | Dương tính | 2+ |
| 20-199 tiểu thể/ 1 dòng (Đọc ít nhất 1 dòng) | Dương tính | 1 + |
| 1-19 tiểu thể/ 1 dòng | Dương tính | Ghi số lượng cụ thể |
| 0 tiểu thể/ ít nhất 1 dòng | Âm tính |
|
Lưu ý: 1 dòng lam tương đương 40 vi trường.
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
- Mỗi mẻ nhuộm không nên quá 12 tiêu bản, các tiêu bản để cách nhau ít nhất 1 cm.
- Tiểu thể phát quang yếu có thể do tiêu bản sau khi nhuộm không đọc ngay, tiêu bản bị tiếp xúc nhiều với ánh sáng.
- Tiểu thể phát quang yếu có thể do chất lượng hóa chất không đạt do bảo quản chưa đúng, quá hạn.
56. Chlamydia Ab miễn dịch bán tự động
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Phát hiện kháng thể (Ab) kháng Chlamydia
2. Nguyên lý
Bằng kỹ thuật ELISA (miễn dịch gắn enzym) gián tiếp (VD).
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: Cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Dàn máy ELISA
- Máy ly tâm
- Tủ lạnh 4 oC - 8 oC
- Tủ âm sâu (-20 oC) hoặc (-70 oC) (nếu có)
- Pipet đơn kênh thể tích từ 10µl đến 1000µl .
- Micropipette
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
Định mức sinh phẩm và vật tư tiêu hao cho 2 mẫu/lần thực hiện (VD)
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Bông | Kg | 0,001 |
| 2 | Dây garô | Cái | 0,001 |
| 3 | Cồn | ml | 1,000 |
| 4 | Bơm kim tiêm | Cái | 1,000 |
| 5 | Panh | Cái | 0,0001 |
| 6 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 7 | Hộp vận chuyển bệnh phẩm | Cái | 0,001 |
| 8 | Tube đựng bệnh phẩm | Cái | 2,000 |
| 9 | Sinh phẩm chẩn đoán | Test | 1,000 |
| 10 | Khấu hao sinh phẩm cho chạy chứng, kiểm tra chất lượng | Test | 3,000 |
| 11 | Chứng ngoại kiểm âm (nếu có) | ml | 0,030 |
| 12 | Chứng ngoại kiểm dương (nếu có) | ml | 0,030 |
| 13 | Nước cất | ml | 8,000 |
| 14 | Đầu côn 1000 µl | Cái | 2,000 |
| 15 | Đầu côn 200 µl | Cái | 6,000 |
| 16 | Giấy thấm | Cuộn | 0,100 |
| 17 | Giấy xét nghiệm | Tờ | 2,000 |
| 18 | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 19 | Bút viết kính | Cái | 0,020 |
| 20 | Bút bi | Cái | 0,010 |
| 21 | Mũ | Cái | 0,020 |
| 22 | Khẩu trang | Cái | 0,020 |
| 23 | Găng tay | Đôi | 0,100 |
| 24 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 25 | Quần áo bảo hộ | Bộ | 0,005 |
| 26 | Dung dịch nước rửa tay | ml | 8,000 |
| 27 | Cồn sát trùng tay nhanh | ml | 1,000 |
| 28 | Dung dịch khử trùng | ml | 10,000 |
| 29 | Khăn lau tay | Cái | 0,010 |
| 30 | EQAS (nếu thực hiện)* |
| 0,005 |
* Ghi chú:
- Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/50 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 3 lần/1 năm).
3. Bệnh phẩm
Huyết thanh hoặc huyết tương.
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu yêu cầu.
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
Theo đúng quy định của chuyên ngành Vi sinh (Xem Phụ lục 2).
2. Tiến hành kỹ thuật
Bộ sinh phẩm PlateliaTM Chlamydia IgG TMB - BioRad (VD)
| Các bước | Xét nghiệm định tính Chlamydia IgG |
| 1 | Để số lượng sinh phẩm cần dùng ở nhiệt độ phòng 30 phút trước khi làm xét nghiệm |
| 2 | Đánh số, sắp xếp bệnh phẩm và viết sơ đồ theo thứ tự. |
| 3 | Chuẩn bị dung dịch rửa. |
| 4 | Pha loãng chứng và mẫu bệnh phẩm. |
| 5 | Lấy đủ số giếng cần dùng và đặt vào giá. |
| 6 | Rửa các giếng1 lần bằng dung dịch rửa đã pha loãng. |
| 7 | Cho chứng và bệnh phẩm vào các giếng của phiến nhựa theo hướng dẫn của qui trình. |
| 8 | Đậy tấm và ủ. |
| 9 | Rửa phiến nhựa. |
| 10 | Chuẩn bị chất cộng hợp |
| 11 | Đậy tấm và ủ |
| 12 | Rửa phiến nhựa |
| 13 | Nhỏ dung dịch hiện màu vào mỗi giếng |
| 14 | Ủ phiến nhựa , không đậy tấm và tránh ánh sang |
| 15 | Nhỏ dung dịch dừng phản ứng |
| 16 | Đọc độ hấp thụ ở bước sóng 450 và 620nm trong vòng 30 phút sau khi dừng phản ứng. |
IV. NHẬN ĐỊNH KẾT QUẢ
1. Điều kiện của phản ứng
- OD chứng âm < 0,175.
- OD cut -off > 0 ,175 .
- OD chứng dương > 0 ,5
- OD cut - off/OD chứng âm > 1,3
- OD chứng dương/ OD cut-off > 2
Nếu một trong các điều kiện trên không đạt, phải chạy lại xét nghiệm
3. Tính giá trị ngưỡng
Cut-off (CO) = Giá trị trung bình của các cut-off
3. Diễn giải kết quả
- Dương tính: nếu OD bệnh phẩm ≥ CO
- Nghi ngờ: nếu CO x 0,8 ≤ OD bệnh phẩm < CO
- Âm tính: nếu OD bệnh phẩm < CO x 0,8
Nếu kết quả nghi ngờ → làm lại xét nghiệm sau lần xét nghiệm đầu tiên 15 - 20 ngày.
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
1. Sai sót
Có thể xảy ra hiện tượng âm tính giả hoặc dương tính giả, thông thường do:
- Thực hiện sai các bước trong quy trình hướng dẫn.
- Chứng âm và những mẫu bệnh phẩm âm tính bị nhiễm chéo bởi huyết thanh/ huyết tương có nồng độ kháng thể cao.
- Dung dịch cơ chất bị nhiễm bởi các tác nhân oxid hoá (thuốc tẩy, ion kim loại v.v…)
- Dung dịch dừng phản ứng bị nhiễm bẩn.
2. Xử trí
- Tuân thủ đúng các bước quy trình hướng dẫn của nhà sản xuất và hướng dẫn về độ ổn định hóa chất xét nghiệm trong bộ sinh phẩm sử dụng.
Kiểm tra và vệ sinh máy rửa thường xuyên trước và sau khi làm xét nghiệm.
57. Chlamydia PCR
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Phát hiện sự có mặt bộ gen của vi khuẩn Chlamydia trachomatis có trong bệnh phẩm
2. Nguyên lý
Dựa trên nguyên lý kỹ thuật PCR.
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: Cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Tủ an toàn sinh học tối thiểu cấp 2
- Máy ủ nhiệt
- Máy ly tâm 25000 x g
- Máy ly tâm dùng cho tube 0,2 ml
- Máy vortex
- Máy chạy PCR
- Các loại Micropipette điều chỉnh được: 1000µl, 200µl, 100µl, 10µl
- Máy điện di
- Máy đọc ảnh gel
- Lò vi sóng
- Tủ lạnh thường
- Tủ âm sâu (20 oC) hoặc (-70 oC) (nếu có)
- Bộ lưu điện
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
Định mức sinh phẩm và vật tư tiêu hao cho 2 mẫu/lần thực hiện (VD)
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Giấy xét nghiệm | Tờ | 1,000 |
| 2 | Dụng cụ lấy bệnh phẩm | Que | 2,000 |
| 3 | Găng không có bột (DNase-RNase free) | Đôi | 0,500 |
| 4 | Ống nhựa Ependoff 1.5ml | ống | 2,000 |
| 5 | Bút viết kính, bút bi, diêm | Cái | 0,020 |
| 6 | Xà phòng | Bánh | 0,010 |
| 7 | Khăn lau tay | Cái | 0,010 |
| 8 | Bông, cồn | Túi | 0,010 |
| 9 | Nước muối sinh lý | ml | 5,000 |
| 10 | Bộ KIT chiết tách DNA Đóng gói 50 phản ứng | Hộp | 0,020 |
| 11 | Khấu hao sinh phẩm cho chứng và QC kiểm tra lại, standard các loại | Test | 1,350 |
| 12 | PBS Buffer Đóng gói 500ml | Chai | 0,002 |
| 13 | Absolute Ethanol Đóng gói 1000ml | Chai | 0,002 |
| 14 | 10mM dNTP mix Đóng gói 100µl | ống | 0,005 |
| 15 | Taq DNA Polymerase, Native Đóng gói: 5 units/µl, 500 units(100 µl) | ống | 0,002 |
| 16 | Primer đặc hiệu cho vi khuẩn Chlamydia trachomatis Đóng gói 50nM | bp | 0,100 |
| 17 | UltraPure DNase/RNase Distilled Water Đóng gói 500ml | Chai | 0,001 |
| 18 | Ultrapure Agarose Đóng gói 100g | Lọ | 0,001 |
| 19 | Ultrapure TBE Buffer 10X Đóng gói 1000ml | Chai | 0,001 |
| 20 | 100bp DNA ladder Đóng gói 50ug | ống | 0,001 |
| 21 | 10X BlueJuice Gel Loading dye Đóng gói 3x1ml | ống | 0,001 |
| 22 | Utrapure 10mg/ml Ethidium Bromide Đóng gói 10ml | lọ | 0,001 |
| 23 | ống ly tâm 1,7ml Đóng gói 500c/túi | túi | 0,004 |
| 24 | ống PCR 0,2 ml, nắp phẳng Đóng gói: 500c/túi, 1000c/hộp | hộp | 0,001 |
| 25 | Đầu côn 1000ml có lọc | túi | 0,001 |
| 26 | Đầu côn 200ml có lọc | túi | 0,004 |
| 27 | Đầu côn 0,2-10µl có lọc | túi | 0,001 |
| 28 | Dung dịch khử trùng | ml | 1,000 |
| 29 | Sổ lưu kết quả xét nghiệm | Quyển | 0,001 |
| 30 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 31 | Hộp lưu bệnh phẩm | Cái | 0,0001 |
| 32 | Quần áo bảo hộ | Bộ | 0,005 |
| 33 | Mũ | Cái | 0,020 |
| 34 | Khẩu trang | Cái | 0,020 |
| 35 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 36 | Giấy thấm | Cuộn | 0,100 |
| 37 | EQAS (nếu thực hiện)* |
| 0,005 |
* Ghi chú:
- Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/200 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 2 lần/1 năm).
3. Bệnh phẩm
Các loại dịch tiết và mô sinh thiết
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu phiếu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
Theo đúng quy định của chuyên ngành Vi sinh (Xem Phụ lục 3).
2. Tiến hành kỹ thuật
2.1. Tách chiết DNA từ bệnh phẩm
2.2. Pha hỗn hợp phản ứng PCR
2.3. Chạy phản ứng PCR
2.4. Điện di sản phẩm PCR
2.5. Đọc kết quả
IV. NHẬN ĐỊNH KẾT QUẢ
- Phản ứng dương tính nếu có vạch sản phẩm PCR tương ứng với cặp mồi
- Phản ứng âm tính nếu không có vạch sản phẩm PCR tương ứng với cặp mồi
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
- Phản ứng dương tính giả: do tạp nhiễm từ môi trường
- Phản ứng âm tính giả: do phản ứng PCR bị ức chế
- Để hạn chế các hiện tượng trên phải tuân thủ chặt chẽ quy trình kỹ thuật.
58. Chlamydia Real-time PCR
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Xác định DNA đặc trưng của Chlamydia
2. Nguyên lý
Dựa trên nguyên lý kỹ thuật Real-time PCR.
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện: Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: Cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Máy real-time PCR và hệ thống máy vi tính.
- Bộ lưu điện
- Máy ủ nhiệt
- Máy ly tâm dùng cho tube 0,2 ml
- Máy ly tâm 25000 x g
- Tủ lạnh 2 oC -8 oC
- Tủ âm sâu (-20 oC) hoặc (-70 oC) (nếu có)
- Máy vortex
- Tủ an toàn sinh học
- Micropipettes các thể tích từ 5 ml - 1000 ml.
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
Định mức sinh phẩm và vật tư tiêu hao cho 3 mẫu/lần thực hiện (VD)
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Tăm bông vô trùng | Kg | 0,001 |
| 2 | Găng không có bột tal (DNase-RNase free) | Cái | 0,001 |
| 3 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 4 | Hộp vận chuyển bệnh phẩm | Cái | 0,001 |
| 5 | Sinh phẩm chẩn đoán | Test | 1,000 |
| 6 | Khấu hao sinh phẩm cho chạy chứng, kiểm tra chất lượng | Test | 1,200 |
| 7 | Kit tách DNA | Test | 2,200 |
| 8 | Ngoại kiểm (nếu có)* |
| 0,020 |
| 9 | ống Falcol 50ml | Cái | 0,010 |
| 10 | Ependoff 1,7ml | Tube | 2,200 |
| 11 | Ependoff 0,2ml | Tube | 2,200 |
| 12 | Đầu côn 10 µl có lọc | Cái | 2,200 |
| 13 | Đầu côn 30 µl | Cái | 1,200 |
| 14 | Đầu côn 200 µl có lọc | Cái | 5,200 |
| 15 | Đầu côn 1 ml có lọc | Cái | 3,200 |
| 21 | Water-DEPC Treated | ml | 1,000 |
| 22 | Giấy thấm | Cuộn | 0,100 |
| 23 | Giấy xét nghiệm | Tờ | 2,000 |
| 24 | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 25 | Bút viết kính | Cái | 0,020 |
| 26 | Bút bi | Cái | 0,010 |
| 27 | Mũ | Cái | 0,020 |
| 28 | Khẩu trang | Cái | 0,020 |
| 29 | Găng tay | Đôi | 0,100 |
| 30 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 31 | Quần áo bảo hộ | Bộ | 0,005 |
| 32 | Dung dịch nước rửa tay | ml | 8,000 |
| 33 | Cồn sát trùng tay nhanh | ml | 1,000 |
| 34 | Dung dịch khử trùng | ml | 10,000 |
| 35 | Khăn lau tay | Cái | 0,010 |
| 36 | EQAS (nếu thực hiện)* |
| 0,005 |
* Ghi chú:
- Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/50 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 3 lần/1 năm).
3. Bệnh phẩm
Dịch niệu đạo, dịch âm đạo, nước tiểu, dịch vết loét
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
Theo đúng quy định của chuyên ngành Vi sinh (Xem Phụ lục 3).
2. Tiến hành kỹ thuật
Bộ sinh phẩm CHT rPCR Mix (VD)
2.1. Thu nhận và Xử lý mẫu
Phải đồng nhất và xử lý mẫu trước khi tách chiết DNA
2.2. Tách chiết DNA: Tách chiết bằng hóa chất phenol/chloroform
2.3. Thực hiện phản ứng real-time PCR
- Thực hiện bước này với các tube PCR mix được giữ trong khay lạnh hoặc đá đang tan.
- Chỉ lấy đủ số tube PCR mix cầnTrước và sau khi đặt phản ứng PCR phải ly tâm tube để tất cả dung dịch nằm dước đáy tube.
- Cho chứng +, chứng - hoặc dịch DNA tách chiết vào từng tube CHT rPCR Mix. Xong, đặt các tube vào máy real-time PCR.
- Bật máy real-time PCR. Bật máy tính và chờ cho máy tính khởi động xong, gọi chương trình real-time PCR lên.
- Cài đặt vị trí mẫu “Plate setup” trên phần mềm đúng với vị trí mẫu đã đặt trên máy real-time PCR.
- Chọn màu “FAM” và “HEX” và “CY5” cho mẫu, chứng dương và chứng âm.
- Cài đặt chương trình “Protocol” cho máy real-time PCR hoạt động
- Lưu file dữ liệu vào máy tính
- Cho máy real-time PCR chạy chương trình.
IV. NHẬN ĐỊNH KẾT QUẢ
1. Điều kiện của phản ứng
- Chứng dương có đường biểu diễn tín hiệu huỳnh quang màu FAM và màu HEX tuyến tính vượt quá tín hiệu nền (đường biểu diễn dương tính) và đường biểu diễn tín hiệu huỳnh quang màu CY5 dương tính hoặc thẳng và không vượt qua tín hiệu nền (đường biểu diễn âm tính).
- Chứng âm có đường biểu diễn tín hiệu huỳnh quang màu FAM và màu HEX âm tính và đường biểu diễn tín hiệu huỳnh quang màu CY5 dương tính
2. Phân tích mẫu
- Mẫu dương tính: Mẫu có đường biểu diễn dương tính rõ ràng tương ứng với màu của từng tác nhân và bắt đầu từ chu kỳ 36 trở về trước. Một mẫu có thể dương tính với 1 trong 2 tác nhân hoặc dương tính đồng thời cả 2 tác nhân.
- Mẫu nghi ngờ: Mẫu có đường biểu diễn dương tính và bắt đầu từ sau chu kỳ 36 → đề nghị lấy mẫu lại để thực hiện xét nghiệm hoặc thực hiện lại xét nghiệm sau 1-3 tháng.
- Mẫu âm tính: Mẫu có đường biểu diễn âm tính, chứng nội phải dương tính.
3. In đồ thị kết quả
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
1. Sự cố: Có mẫu và chứng nội cũng đều âm tính. Chứng bình thường, có mẫu dương, mẫu âm thật sự.
2. Nguyên nhân: Có thể mẫu âm thực sự, có thể phản ứng PCR bị ức chế.
3. Khắc phục: Pha loãng mẫu từ 10-100 lần, thực hiện lại toàn bộ thí nghiệm từ bước tách chiết. Sau khi có kết quả phải nhân thêm với hệ số pha loãng mẫu. Nếu vẫn gặp sự cố trên, lấy lại mẫu theo đúng yêu cầu.
59. Chlamydia Real-time PCR hệ thống tự động
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Xác định DNA đặc trưng của Chlamydia tracomatis
2. Nguyên lý
Bằng kỹ thuật Real-time PCR trên hệ thống tự động.
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện: Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: Cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Hệ thống máy tách chiết tự động, máy khuyếch đại và phát hiện tự động
- Hệ thống máy tính
- Máy vortex
- Tủ an toàn sinh học cấp 2
- Bộ lưu điện
- Tủ lạnh 2 oC - 8 oC
- Pipette nhựa 1-3ml
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
Định mức sinh phẩm và vật tư tiêu hao cho 22 mẫu/lần thực hiện (VD)
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Lọ vô trùng | Cái | 1,000 |
| 2 | Bộ lấy mẫu và xử lý bệnh phẩm | Cái | 1,000 |
| 3 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 4 | Hộp vận chuyển bệnh phẩm | Cái | 0,001 |
| 5 | Sinh phẩm chẩn đoán | Test | 1,000 |
| 6 | Khấu hao sinh phẩm cho chạy chứng, kiểm tra chất lượng | Test | 0,100 |
| 7 | Control (chứng dương+chứng âm) | Test | 0,050 |
| 8 | Control Diluent | Test | 0,050 |
| 9 | Kít tách DNA | Test | 1.100 |
| 10 | Kít tách DNA 2 | Test | 1,100 |
| 11 | Elution plate | Cái | 0,050 |
| 12 | Extraction plate | Cái | 0,050 |
| 13 | Máng đựng hóa chất to 200ml | Cái | 0,050 |
| 14 | Máng đựng hóa chất nhỏ 50 ml | Cái | 0,100 |
| 15 | Tip CORE TIPS w. Filter 1ml | Cái | 10,000 |
| 16 | Giấy thấm | Cuộn | 0,100 |
| 17 | Giấy xét nghiệm | Tờ | 3,000 |
| 18 | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 19 | Bút viết kính | Cái | 0,020 |
| 20 | Bút bi | Cái | 0,010 |
| 21 | Mũ | Cái | 0,020 |
| 22 | Khẩu trang | Cái | 0,020 |
| 23 | Găng không có bột tal | Đôi | 0,500 |
| 24 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 25 | Quần áo bảo hộ | Bộ | 0,005 |
| 26 | Dung dịch nước rửa tay | ml | 8,000 |
| 27 | Cồn sát trùng tay nhanh | ml | 1,000 |
| 28 | Dung dịch khử trùng | ml | 10,000 |
| 29 | Khăn lau tay | Cái | 0,010 |
| 30 | EQAS (nếu thực hiện)* |
| 0,020 |
* Ghi chú:
- Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/50 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 3 lần/1 năm).
3. Bệnh phẩm
Dịch cổ tử cung, dịch âm đạo, nước tiểu, dịch niệu đạo
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
Theo đúng quy định của chuyên ngành Vi sinh (Xem phụ lục 3).
2. Tiến hành kỹ thuật: Cobas 4800 CT/NG test - Roche (VD)
2.1. Thu nhận và Xử lý mẫu
Bệnh phẩm lấy xong phải cho vào ống xử lý mẫu trong vòng 24 giờ.
2.2. Tách chiết DNA
Thực hiện tách chiết DNA tự động.
2.3. Thực hiện phản ứng real-time PCR
Khuyếch đại DNA real-time - PCR, đọc kết quả bằng máy tự động
IV. NHẬN ĐỊNH KẾT QUẢ
1. Điều kiện của phản ứng
- Chứng âm: Valid (Có giá trị)
- Chứng dương: Valid (Có giá trị)
* Không nhận các kết quả của chứng không có giá trị khi xuất hiện thông báo lỗi:
- Chứng âm: Invalid (Không có giá trị)
- Chứng dương: Invalid (Không có giá trị)
2. Phân tích kết quả
| Khi chọn subtest CT | Diễn giải kết quả |
| CT POS | Mẫu dương tính với Chlamydia |
| CT NEG | Mẫu âm tính với Chlamydia |
| CT invalid | Không ra kết quả, cần chạy lại mẫu |
| Failed | Bị lỗi, cần xem chi tiết báo cờ để tìm ra nguyên nhân. Sau đó chạy lại mẫu. |
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
- Việc lấy mẫu, vận chuyển và bảo quản không đúng tiêu chuẩn có thể dẫn đến kết quả sai, cho dù phản ứng được thực hiện đúng.
- Khuyến cáo: Nhịn tiểu ít nhất 2giờ, lấy tia đầu tiên.
60. Clostridium nuôi cấy, định danh
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Phát hiện và định danh vi khuẩn Clostridium bằng phương pháp nuôi cấy kinh điển.
2. Nguyên lý
Vi khuẩn được định danh dựa vào đặc điểm nuôi cấy, một số tính chất chuyển hóa, các đặc điểm về hình thái học.
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: Cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Kính hiển vi quang học
- Tủ an toàn sinh học cấp 2
- Hệ thống máy nuôi cấy vi khuẩn kỵ khí
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Lọ lấy bệnh phẩm | Lọ | 1,000 |
| 2 | Lam kính | Cái | 2,000 |
| 3 | Dầu soi kính | ml | 1,000 |
| 4 | Xylen lau kính | ml | 1,000 |
| 5 | Nước muối sinh lý | ml | 5,000 |
| 6 | Thuốc nhuộm đỏ fuchsin | ml | 5,000 |
| 7 | Thuốc nhuộm tím gentian | ml | 5,000 |
| 8 | Cồn tẩy 95 độ | ml | 10,000 |
| 9 | Lugol | ml | 5,000 |
| 10 | Thuốc nhuộm xanh methylen | ml | 5,000 |
| 11 | Môi trường nuôi cấy kỵ khí | chai | 1,000 |
| 12 | Môi trường thạch máu thường | Đĩa | 2,000 |
| 13 | Môi trường thạch máu kỵ khí | Đĩa | 2,000 |
| 14 | Bộ giá đường API | Test | 1,000 |
| 15 | Bình khí trộn (tính theo giờ) | Giờ | 168,000 |
| 16 | Bơm kim tiêm | Cái | 1,000 |
| 17 | Bông | Kg | 0,001 |
| 18 | Cồn 90 độ (vệ sinh dụng cụ) | ml | 10,000 |
| 19 | Đèn cồn | Cái | 0,0001 |
| 20 | Panh | Cái | 0,0001 |
| 21 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 22 | Hộp vận chuyển bệnh phẩm | Cái | 0,0001 |
| 23 | Mũ | Cái | 0,020 |
| 24 | Khẩu trang | Cái | 0,020 |
| 25 | Găng tay | Đôi | 3,000 |
| 26 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 27 | Quần áo bảo hộ | Bộ | 0,001 |
| 28 | Acid ngâm lam | ml | 10,000 |
| 29 | Ống nghiệm thủy tinh | Ống | 1,000 |
| 30 | Bút viết kính | Cái | 0,020 |
| 31 | Bút bi | Cái | 0,010 |
| 32 | Bật lửa | Cái | 0,010 |
| 33 | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 34 | Cồn sát trùng tay nhanh | ml | 1,000 |
| 35 | Dung dịch nước rửa tay | ml | 8,000 |
| 36 | Khăn lau tay | Cái | 0,030 |
| 37 | Giấy trả kết quả xét nghiệm | Tờ | 2,000 |
| 38 | QC (nếu thực hiện) * |
| 0,1 |
| 39 | EQAS (nếu thực hiện) * |
| 0,005 |
* Ghi chú:
- Chi phí nội kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình nội kiểm (QC) là 1/10 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lượng ≥ 10 mẫu cho 1 lần tiến hành kỹ thuật).
- Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/200 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 2 lần/1 năm).
3. Bệnh phẩm
Bệnh phẩm phân.
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu phiếu yêu cầu
III. Các bước tiến hành
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
Theo đúng quy định của chuyên ngành Vi sinh (Xem Phụ lục 1 và Phụ lục 6)
2. Tiến hành kỹ thuật
2.1. Nhuộm soi bệnh phẩm, đánh giá sơ bộ
2.2. Nuôi cấy bệnh phẩm vào môi trường phân lập
2.3. Ủ ấm qua đêm
2.4. Nhận định khuẩn lạc
2.5. Nhuộm soi, thử nghiệm các thử nghiệm sinh vật hóa học đơn giản và định danh bằng các bộ sinh vật hóa học chuyên dụng.
Tất cả các bước tiến hành và ủ ấm đều được thực hiện bên trong hệ thống máy nuôi cấy vi khuẩn kỵ khí nhằm đẳm bảo điều kiện môi trường nuôi cấy.
IV. NHẬN ĐỊNH KẾT QUẢ
- Dương tính: Phân lập và định danh được C. difficile.
- Âm tính: Không tìm thấy hoặc không phân lập được Clostridium.
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
Kết quả âm tính không có nghĩa là không có C. difficile trong bệnh phẩm mà là không tìm thấy C. difficile.
Tất cả các thao tác kỹ thuật phải diễn ra bên trong hệ thống máy để đảm bảo điều kiện môi trường nuôi cấy kỵ khí.
Môi trường kỵ khí sử dụng để nuôi cấy vi khuẩn phải đảm bảo đúng nồng độ.
61. Clostridium difficile miễn dịch bán tự động
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Phát hiện độc tố A và B của Clostridium difficile trực tiếp từ bệnh phẩm phân.
2. Nguyên lý
Dựa trên nguyên lý của kỹ thuật ELFA (Enzyme-linked Fluorescent Assay).
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện: Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: Cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Dàn máy ELFA.
- Máy ly tốc độ > 12000 gpm/phút
- Tủ lạnh 2 oC - 8 oC
- Micropipette 100 µl, 1000 µl.
- Giá đựng ống tube eppendorf
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
Định mức sinh phẩm và vật tư tiêu hao cho 2 mẫu/lần thực hiện (VD)
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Bông | Kg | 0,001 |
| 2 | Dây garô | Cái | 0,001 |
| 3 | Cồn | ml | 1,000 |
| 4 | Bơm kim tiêm | Cái | 1,000 |
| 5 | Panh | Cái | 0,0001 |
| 6 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 7 | Hộp vận chuyển bệnh phẩm | Cái | 0,001 |
| 8 | Tube đựng bệnh phẩm | Cái | 2,000 |
| 9 | Sinh phẩm chẩn đoán | Test | 1,000 |
| 10 | Khấu hao sinh phẩm cho chạy chứng, kiểm tra chất lượng | Test | 3,000 |
| 11 | Chứng ngoại kiểm âm (nếu có) | ml | 0,030 |
| 12 | Chứng ngoại kiểm dương (nếu có) | ml | 0,030 |
| 13 | EQAS (nếu thực hiện)* |
| 0,005 |
| 14 | Nước cất | ml | 8,000 |
| 15 | Đầu côn 1000 µl | Cái | 2,000 |
| 16 | Đầu côn 200 µl | Cái | 6,000 |
| 17 | Giấy thấm | Cuộn | 0,100 |
| 18 | Giấy xét nghiệm | Tờ | 2,000 |
| 19 | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 20 | Bút viết kính | Cái | 0,020 |
| 21 | Bút bi | Cái | 0,010 |
| 22 | Mũ | Cái | 0,020 |
| 23 | Khẩu trang | Cái | 0,020 |
| 24 | Găng tay | Đôi | 0,100 |
| 25 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 26 | Quần áo bảo hộ | Bộ | 0,005 |
| 27 | Dung dịch nước rửa tay | ml | 8,000 |
| 28 | Cồn sát trùng tay nhanh | ml | 1,000 |
| 29 | Dung dịch khử trùng | ml | 10,000 |
| 30 | Khăn lau tay | Cái | 0,010 |
* Ghi chú:
- Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/200 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 2 lần/1 năm).
3. Bệnh phẩm: Bệnh phẩm phân
4. Phiếu xét nghiệm: Điền đầy đủ thông tin theo mẫu phiếu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm:
Theo đúng quy định của chuyên ngành Vi sinh (Xem Phụ lục 2).
2. Tiến hành kỹ thuật:
Bộ sinh phẩm VIDAS® C. difficile Toxin A & B (Biomerieux) (VD)
| Các bước tiến hành | Xét nghiệm định tính |
| 1 | Chuẩn bị sinh phẩm |
| 2 | Chuẩn bị mẫu phân Chuẩn bị standards và các chứng |
| 3 | Nhỏ chứng và bệnh phẩm theo thứ tự hướng dẫn |
| 4 | Đưa kít vào máy chạy theo hướng dẫn |
| 5 | Quá trình thực hiện hoàn toàn tự động trên máy trong vòng 75 phút |
| 6 | Đọc kết quả |
IV. NHẬN ĐỊNH KẾT QUẢ
1. Điều kiện
Các giá trị của chứng phải nằm trong khoảng giới hạn chấp nhận.
2. Nhận định, trả lời kết quả
| Giá trị của mẫu = | RFV mẫu | RFV = Relative Fluorescence Value |
| REV standard |
Kết quả
| Giá trị mẫu | Kết quả |
| < 0.13 | Âm tính |
| ≥ 0.13 đến < 0.37 | Không rõ ràng |
| ≥ 0.37 | Dương tính |
Nếu kết quả không rõ ràng, làm lại xét nghiệm từ mẫu phân ban đầu hoặc lấy mẫu phân mới. Nếu kết quả vẫn không rõ ràng thì nên xét nghiệm bằng phương pháp khác.
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
- Mẫu phân của trẻ dưới 2 tuổi: VIDAS test có thể bị ảnh hưởng bởi Meconium nên không thực hiện trên mẫu phân của trẻ dưới 2 tuổi.
- Phân chứa quá nhiều lượng chất béo: Không thực hiện trên mẫu phân chứa quá nhiều lượng chất béo.
- Trộn mẫu phân không đều: Lấy lại bệnh phẩm và xét nghiệm lại.
- Kết quả xét nghiệm dương tính dùng để chẩn đoán viêm đại tràng hoặc tiêu chảy do C. Difficile: Không dựa vào một mình kết quả xét nghiệm mà phải phối hợp với dấu hiệu lâm sàng và tiền sử bệnh khi chẩn đoán bệnh có liên quan đến C. difficile.
62. Clostridium difficile PCR
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Phát hiện gen mã hóa cho 2 loại độc chất A và B của vi khuẩn Clostridium difficile từ mẫu phân.
2. Nguyên lý
Bằng kỹ thuật PCR sử dụng bộ kit C. difficile A/B (VD).
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện: Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: Cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Máy real-time PCR và hệ thống máy vi tính.
- Bộ lưu điện
- Máy ủ nhiệt
- Máy ly tâm dùng cho tube 0,2 ml
- Máy ly tâm 25000 x g
- Tủ lạnh 2 oC -8 oC
- Tủ âm sâu (-20 oC) hoặc (-70 oC) (nếu có)
- Máy vortex
- Tủ an toàn sinh học
- Micropipettes các thể tích từ 5 ml - 1000 ml.
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
Định mức sinh phẩm và vật tư tiêu hao cho 2 mẫu/lần thực hiện (VD)
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | C. difficile A/B kit (VD) | Test | 1,000 |
| 2 | Nước cất | ml | 0,500 |
| 3 | Khay đựng bệnh phẫm | Cái | 0,100 |
| 4 | Tube ly tâm 1.5 ml | Tube | 2,000 |
| 5 | PRC tube thể tích 200 ml | Tube | 1,000 |
| 6 | Đầu côn có lọc1000 µl | cái | 6,000 |
| 7 | Đầu côn có lọc 200 µl | cái | 12,000 |
| 8 | Đầu côn có lọc 10 µl | cái | 6,000 |
| 9 | Micropipette 2-20 µl | cái | 0,010 |
| 10 | Micropipette 10-100 µl | cái | 0,010 |
| 11 | Micropipette 100-1000 µl | cái | 0,010 |
| 12 | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 13 | Cồn 90 độ (vệ sinh dụng cụ) | ml | 20,000 |
| 14 | Cồn sát trùng tay nhanh | ml | 2,000 |
| 15 | Dung dịch nước rửa tay | ml | 8,000 |
| 16 | Khăn lau tay | Cái | 0,030 |
| 17 | Giấy trả kết quả xét nghiệm | Tờ | 2,000 |
| 18 | Bông | kg | 0,010 |
| 19 | Giấy y tế | Tờ | 2,000 |
| 20 | Giá đỡ PCR tube | Cái | 0,001 |
| 21 | Kẹp nhựa, marker | Cái | 0,001 |
| 22 | Tube Eppendorf | Cái | 2,000 |
| 23 | Tube đặt phản ứng | Cái | 2,000 |
| 24 | Khẩu trang | Cái | 1,000 |
| 25 | Găng tay không bột tal | Đôi | 2,000 |
| 26 | Quần áo bảo hộ | Cái | 1,000 |
| 27 | Mũ | Cái | 1,000 |
| 28 | QC (nếu thực hiện) * |
| 0,100 |
| 29 | EQAS (nếu thực hiện) * |
| 0,005 |
* Ghi chú:
- Chi phí nội kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình nội kiểm (QC) là 1/10 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lượng ≥ 10 mẫu cho 1 lần tiến hành kỹ thuật).
- Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/200 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 2 lần/1 năm).
3. Bệnh phẩm
- Thu thập các mẫu phân vào các ống chứa kín, không cần chất bảo quản.
- Mẫu phải được bảo quản ở 2-8 oC và làm xét nghiệm ngay lập tức hoặc giới hạn trong 24 giờ. Trong trường hợp khác, mẫu phải được đông lạnh ngay lập tức và được trữ lên tới 10 ngày ở nhiệt độ -20 oC hoặc lạnh hơn. Sự rã đông không được ảnh hưởng đến kết quả.
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu phiếu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
Theo đúng quy định của chuyên ngành Vi sinh (Xem Phụ lục 3).
2. Tiến hành kỹ thuật
2.1. Chuẩn bị mẫu
2.2. Tách chiết DNA
2.3. Cài đặt máy luân nhiệt
2.4. Chuẩn bị cho PCR mix
2.5. Chạy phản ứng PCR
IV. NHẬN ĐỊNH KẾT QUẢ
| FAM | HEX | Kết quả |
| Ct > 0 | Không liên quan (Ct >0) | Dương tính |
| Ct = 0 | Ct > 0 | Âm tính |
| Ct = 0 | Ct = 0 | Bị ức chế |
Kết quả chỉ có giá trị nếu:
- Mẫu blank phải dương tính ở kênh HEX, nhưng âm tính ở kênh FAM
- Chứng dương phải dương tính ở kênh FAM
Nếu 2 điều kiện gặp nhau, kết quả có giá trị và có khả năng phân tích kết quả. Ngoài ra các kết quả khác đều không có giá trị
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
Vấn đề 1: Không tín hiệu
- Sai kênh được chọn
- Hút sai dẫn tới bỏ quên 1 số thuốc thử hoặc mẫu
- Tác động ức chế của mẫu: DNA không đủ lượng hoặc không đủ độ tinh sạch
- Kiểm tra bộ kit được bảo quản đúng
- Kiểm tra hoạt động của máy luân nhiệt
Vấn đề 2: Mật độ huỳnh quang quá thấp
- Hư thuốc nhuộm và/hoặc primers trong thuốc thử do điều kiện bảo quản không phù hợp
- Lượng mẫu và.hoặc độ tinh sạch thấp của DNA
Vấn đề 3: Mật độ huỳnh quang thay đổi
- Master mix không được phối trộn tốt
- Bọt khí có trong ống PCR
63. Leptospira test nhanh
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Phát hiện sự có mặt của Leptospira IgM trong mẫu huyết thanh hoặc huyết tương.
2. Nguyên lý
Sử dụng kháng nguyên có nguồn gốc từ Leptospira để phát hiện mặt của Leptospira IgM trong mẫu huyết thanh
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: Cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Tủ an toàn sinh học cấp 2
- Micropipet
- Đồng hồ bấm giây
- Máy ly tâm thường
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Ống lấy bệnh phẩm | ống | 1,000 |
| 2 | Bơm tiêm | cái | 1,000 |
| 3 | Bông | Kg | 0,001 |
| 4 | Cồn 90 độ (vệ sinh dụng cụ) | ml | 10,000 |
| 5 | Panh | Cái | 0,0001 |
| 6 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 7 | Hộp vận chuyển bệnh phẩm | Cái | 0,0001 |
| 8 | Hóa chất chính | test | 1,000 |
| 9 | Khấu hao sinh phẩm cho chạy chứng và kiểm tra chất lượng | test | 0,300 |
| 10 | Đầu côn vàng | Cái | 2,000 |
| 11 | Acid ngâm rửa | ml | 10,000 |
| 12 | Ống nghiệm thủy tinh | Ống | 1,000 |
| 13 | Mũ | Cái | 0,020 |
| 14 | Khẩu trang | Cái | 0,020 |
| 15 | Găng tay | Đôi | 2,000 |
| 16 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 17 | Quần áo bảo hộ | Bộ | 0,001 |
| 18 | Bút viết kính | Cái | 0,020 |
| 19 | Bút bi | Cái | 0,010 |
| 20 | Sổ lưu kết quả xét nghiệm | Quyển | 0,001 |
| 21 | Cồn sát trùng tay nhanh | ml | 1,000 |
| 22 | Dung dịch nước rửa tay | ml | 8,000 |
| 23 | Khăn lau tay | Cái | 0,010 |
| 24 | Giấy trả kết quả xét nghiệm | Tờ | 2,000 |
3. Bệnh phẩm: Mẫu huyết thanh hoặc huyết tương.
4. Phiếu xét nghiệm: Điền đầy đủ thông tin theo mẫu phiếu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm:
Theo đúng quy định của chuyên ngành Vi sinh (Xem Phụ lục 2).
2. Tiến hành kỹ thuật
Bộ sinh phẩm SD Bioline Leptospira IgG/IgM (Hàn Quốc)
2.1. Ly tâm ống bệnh phẩm
2.2. Bóc vỏ thanh xét nghiệm, ghi mã bệnh phẩm tương ứng
2.3. Nhỏ huyết thanh hoặc huyết tương vào vùng nhỏ bệnh phẩm
2.4. Nhỏ dung dịch pha loãng vào vùng nhỏ pha loãng theo hướng dẫn
2.5. Đọc kết quả sau 15 - 20 phút
IV. NHẬN ĐỊNH KẾT QUẢ
- Kết quả được chấp nhận khi xuất hiện màu rõ ràng, sắc nét ở vạch chứng C
+ Dương tính khi xuất hiện màu ở vạch C và vạch T.
+ Âm tính khi xuất hiện màu ở vạch chứng C và không xuất hiện màu ở các vạch còn lại.
- Không có giá trị: vạch chứng C không xuất hiện sau 15-10 phút thì cần kiểmtra lại hóa chất, các bước thực hiện, làm lại test khác.
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
- Đọc kết quả trước 15-20 phút hoặc sau 30 phút có thể làm sai lệch kết quả.
- Cho quá ít bệnh phẩm, hay quá nhiều dung dịch pha loãng có thể làm ảnh hưởng đến nhận định kết quả.
- Tham khảo thêm hướng dẫn của nhà sản xuất.
64. Mycoplasma pneumoniae Real-time PCR
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Xác định DNA đặc trưng của Mycoplasma pneumoniae.
2. Nguyên lý
Dựa trên nguyên lý kỹ thuật Real-time PCR.
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện: Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: Cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Máy real-time PCR và hệ thống máy vi tính.
- Bộ lưu điện
- Máy ly tâm dùng cho tube 0,2ml
- Máy ly tâm 25000 x g
- Tủ lạnh 2 oC - 8oC
- Tủ âm sâu (-20 oC) hoặc (-70 oC) (nếu có)
- Máy vortex
- Tủ an toàn sinh học
- Micropipettes các thể tích từ 5 ml - 1000 ml.
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
Định mức sinh phẩm và vật tư tiêu hao cho 2 mẫu/lần thực hiện (VD)
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Lọ vô trùng | Cái | 1,000 |
| 2 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 3 | Hộp vận chuyển bệnh phẩm | Cái | 0,001 |
| 4 | Sinh phẩm chẩn đoán | Test | 1,000 |
| 5 | Khấu hao sinh phẩm cho chạy chứng, kiểm tra chất lượng | Test | 2,000 |
| 6 | Kit tách DNA | Test | 3,000 |
| 7 | EQAS (nếu thực hiện)* |
| 0,005 |
| 8 | Ống Falcon 50ml | Cái | 1,000 |
| 9 | Ependoff 1,7ml | Tube | 6,000 |
| 10 | Ependoff 0,2ml | Tube | 3,000 |
| 11 | Đầu côn 10 µl có lọc | Cái | 3,000 |
| 12 | Đầu côn 30 µl | Cái | 3,000 |
| 13 | Đầu côn 200 µl có lọc | Cái | 3,000 |
| 14 | Đầu côn 1 ml có lọc | Cái | 7,000 |
| 15 | Giấy thấm | Cuộn | 0,100 |
| 16 | Giấy xét nghiệm | Tờ | 2,000 |
| 17 | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 18 | Bút viết kính | Cái | 0,020 |
| 19 | Bút bi | Cái | 0,010 |
| 20 | Mũ | Cái | 0,020 |
| 21 | Khẩu trang | Cái | 0,020 |
| 22 | Găng không có bột tal | Đôi | 0,100 |
| 23 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 24 | Quần áo bảo hộ | Bộ | 0,005 |
| 25 | Dung dịch nước rửa tay | ml | 8,000 |
| 26 | Cồn sát trùng tay nhanh | ml | 1,000 |
| 27 | Dung dịch khử trùng | ml | 10,000 |
| 28 | Khăn lau tay | Cái | 0,010 |
| 29 | EQAS (nếu thực hiện)* |
| 0,005 |
* Ghi chú:
- Chi phí nội kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình nội kiểm (QC) là 1/10 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lượng ≥ 10 mẫu cho 1 lần tiến hành kỹ thuật).
- Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/200 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 2 lần/1 năm).
3. Bệnh phẩm
Đờm, dịch phế quản, dịch tỵ hầu.
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
Theo đúng quy định của chuyên ngành Vi sinh (Xem Phụ lục 3).
2. Tiến hành kỹ thuật
Bộ sinh phẩm Mycoplasma pneumonia PCR Kit - Gene Proof (VD)
2.1. Thu nhận và Xử lý mẫu
Phải đồng nhất và xử lý mẫu trước khi tách chiết DNA
2.2. Tách chiết DNA
2.3. Thực hiện phản ứng real-time PCR
- Lấy đủ số tube 0,2 ml cần dùng.
- Thực hiện bước này với mastermix và các tube phản ứng được giữ trong khay lạnh hoặc đá đang tan.
- Phân phối MasterMix vào mỗi tube.
- Cho chứng [+], chứng [-] hoặc dịch DNA tách chiết vào từng tube MasterMix.
- Ly tâm nhẹ cho dịch nằm hết dưới đáy tube. Xong, đặt các tube vào máy real-time PCR.
- Khởi động máy real-time PCR. Khởi động máy tính và chương trình real-time PCR.
- Cài đặt vị trí mẫu “Plate setup” trên phần mềm đúng với vị trí mẫu đã đặt trên máy real-time PCR.
- Chọn màu “FAM” và “JOE” cho mẫu, chứng dương và chứng âm.
- Cài đặt chương trình “Protocol” cho máy real-time PCR hoạt động
- Lưu file dữ liệu vào máy tính
- Cho máy real-time PCR chạy chương trình.
IV. NHẬN ĐỊNH KẾT QUẢ
1. Điều kiện của phản ứng
- Chứng dương có đường biểu diễn tín hiệu huỳnh quang màu FAM dương tính và đường biểu diễn tín hiệu huỳnh quang màu JOE dương tính hoặc âm tính.
- Chứng âm có đường biểu diễn tín hiệu huỳnh quang màu FAM và màu âm tính và đường biểu diễn tín hiệu huỳnh quang màu JOE dương tính
2. Phân tích mẫu
- Mẫu dương tính: Mẫu có đường biểu diễn dương tính rõ ràng tương ứng với màu của từng tác nhân và bắt đầu từ chu kỳ 36 trở về trước.
- Mẫu nghi ngờ: Mẫu có đường biểu diễn dương tính và bắt đầu từ sau chu kỳ 36 → đề nghị lấy mẫu lại để thực hiện xét nghiệm hoặc thực hiện lại xét nghiệm sau 1-3 tháng.
- Mẫu âm tính: Mẫu có đường biểu diễn âm tính, chứng nội phải dương tính.
3. In đồ thị kết quả
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
Có mẫu và chứng nội cũng đều âm tính. Chứng bình thường, có mẫu dương, mẫu âm thật sự.
1. Nguyên nhân: Có thể mẫu âm thực sự, có thể phản ứng PCR bị ức chế.
2. Khắc phục
- Pha loãng mẫu từ 10-100 lần, thực hiện lại toàn bộ thí nghiệm từ bước tách chiết. Sau khi có kết quả phải nhân thêm với hệ số pha loãng mẫu. Nếu vẫn gặp sự cố trên, lấy lại mẫu theo đúng yêu cầu.
- Trừ những mẫu sự cố, tất cả các mẫu bình thường đều có thể lấy kết quả.
65. Mycoplasma hominis nuôi cấy, định danh và kháng thuốc
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Phát hiện và định danh M. hominis bằng phương pháp nuôi cấy. Xác định mức độ nhạy cảm với kháng sinh của M. hominis.
2. Nguyên lý
Vi khuẩn được định danh dựa vào đặc điểm nuôi cấy, một số tính chất chuyển hóa.
Mức độ nhạy cảm với kháng sinh của M. hominis được xác định bằng phương pháp cấy trong canh thang đã có sẵn lượng kháng sinh nhất định. Đánh giá mức độ nhạy cảm với kháng sinh tùy theo khả năng mọc của vi khuẩn trong môi trường có chứa kháng sinh.
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện: Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: Cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Tủ ấm CO2
- Tủ an toàn sinh học cấp 2
- Bàn phụ khoa
- Đèn phụ khoa
- Kính hiển vi quang học
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Que lấy bệnh phẩm hoặc tăm bông vô trùng | Cái | 2,000 |
| 2 | Mỏ vịt (to, vừa và nhỏ) | Cái | 1,000 |
| 3 | Môi trường A7 | Đĩa | 1,000 |
| 4 | Môi trường DUO KIT | Bộ | 1,000 |
| 5 | Bông | Kg | 0,001 |
| 6 | Cồn 90 độ (vệ sinh dụng cụ) | ml | 10,000 |
| 7 | Đèn cồn | Cái | 0,0001 |
| 8 | Panh | Cái | 0,0001 |
| 9 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 10 | Hộp vận chuyển bệnh phẩm | Cái | 0,0001 |
| 11 | Mũ | Cái | 0,020 |
| 12 | Khẩu trang | Cái | 0,020 |
| 13 | Găng tay | Đôi | 3,000 |
| 14 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 15 | Quần áo bảo hộ | Bộ | 0,001 |
| 16 | Hộp đựng dung dịch khử khuẩn ngâm mỏ vịt | ml | 10,000 |
| 17 | Bút viết kính | Cái | 0,020 |
| 18 | Bút bi | Cái | 0,010 |
| 19 | Bật lửa | Cái | 0,010 |
| 20 | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 21 | Cồn sát trùng tay nhanh | ml | 2,000 |
| 22 | Dung dịch nước rửa tay | ml | 8,000 |
| 23 | Khăn lau tay | Cái | 0,030 |
| 24 | Giấy trả kết quả xét nghiệm | Tờ | 2,000 |
| 25 | QC (nếu thực hiện) * |
| 0,1 |
| 26 | EQAS (nếu thực hiện) * |
| 0,005 |
* Ghi chú:
- Chi phí nội kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình nội kiểm (QC) là 1/10 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lượng ≥ 10 mẫu cho 1 lần tiến hành kỹ thuật).
- Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/200 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 2 lần/1 năm).
3. Bệnh phẩm
Dịch, mủ: dịch cổ tử cung, niệu đạo…
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
Theo đúng quy định của chuyên ngành Vi sinh (Xem Phụ lục 1 và Phụ lục 6)
2. Tiến hành kỹ thuật
2.1. Ngâm tăm bông bệnh phẩm trong dung dịch trộn bệnh phẩm.
2.2. Nhỏ 200ml dung dịch pha loãng vào các giếng U, D, H.
2.3. Nhỏ 100ml dung dịch trộn bệnh phẩm vào các giếng U, X, H, D.
2.4. Trộn đều trong giếng D, hút 25ml sang các giếng U và H.
2.5. Dán khay thử và để vào tủ ấm với nhiệt độ 37oC.
IV. NHẬN ĐỊNH KẾT QUẢ
4.1. Kết quả định danh
| Quan sát | Kết quả |
| Có sự đổi màu ở giếng H (hồng tím) | Nuôi cấy dương tính |
| Không có sự đổi màu | Âm tính |
4.2. Kết quả kháng sinh đồ
| Quan sát | Kết quả |
| Có sự đổi màu ở cả 2 giếng chứa cùng một loại kháng sinh | R |
| Có sự đổi màu ở cả 1 trong 2 giếng chứa cùng một loại kháng sinh | I |
| Không có sự đổi màu ở cả 2 giếng chứa cùng một loại kháng sinh | S |
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
- Nồng độ tủ ấm CO2 không đủ tiêu chuẩn.
- Nhỏ dung dịch không chính xác.
66. Ricketsia Ab miễn dịch bán tự động
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Phát hiện kháng thể IgM, IgG và IgA kháng Ricketsia orientia tsusugamushi.
2. Nguyên lý
Bằng kỹ thuật ELISA (miễn dịch gắn enzym).
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện: Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: Cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Dàn máy ELISA
- Máy ly tâm thường.
- Tủ lạnh 4 oC - 8 oC
- Tủ âm sâu (-20 oC) hoặc (-70 oC) (nếu có)
- Pipet đơn kênh thể tích từ 10µl đến 1000µl.
- Micropipette
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
Định mức sinh phẩm và vật tư tiêu hao cho 2 mẫu/lần thực hiện (VD)
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Bông | Kg | 0,001 |
| 2 | Dây garô | Cái | 0,001 |
| 3 | Cồn | ml | 1,000 |
| 4 | Bơm kim tiêm | Cái | 1,000 |
| 5 | Panh | Cái | 0,0001 |
| 6 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 7 | Hộp vận chuyển bệnh phẩm | Cái | 0,001 |
| 8 | Tube đựng bệnh phẩm | Cái | 1,000 |
| 9 | Sinh phẩm chẩn đoán | Test | 1,000 |
| 10 | Khấu hao sinh phẩm cho kiểm tra chất lượng | Test | 3,000 |
| 11 | Nước cất | ml | 8,000 |
| 12 | Đầu côn 1000 µl | Cái | 2,000 |
| 13 | Đầu côn 200 µl | Cái | 5,000 |
| 14 | Giấy thấm | Cuộn | 0,100 |
| 15 | Giấy xét nghiệm | Tờ | 2,000 |
| 16 | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 17 | Bút viết kính | Cái | 0,020 |
| 18 | Bút bi | Cái | 0,010 |
| 19 | Mũ | Cái | 0,020 |
| 20 | Khẩu trang | Cái | 0,020 |
| 21 | Găng tay | Đôi | 0,100 |
| 22 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 23 | Quần áo bảo hộ | Bộ | 0,005 |
| 24 | Dung dịch nước rửa tay | ml | 8,000 |
| 25 | Cồn sát trùng tay nhanh | ml | 1,000 |
| 26 | Dung dịch khử trùng | ml | 10,000 |
| 27 | Khăn lau tay | Cái | 0,010 |
| 28 | EQAS (nếu thực hiện)* |
| 0,005 |
* Ghi chú:
- Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/200 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 2 lần/1 năm).
3. Bệnh phẩm
Huyết thanh, huyết tương hoặc máu toàn phần.
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
Theo đúng quy định của chuyên ngành Vi sinh (xem phụ lục 2).
2. Tiến hành kỹ thuật: Bộ sinh phẩm Ricketsia Ab (VD)
| Các bước | Xét nghiệm định tính Ricketsia Ab |
| 1 | Để số lượng sinh phẩm cần dùng ở nhiệt độ phòng 30 phút trước khi làm xét nghiệm |
| 2 | Đánh số, sắp xếp bệnh phẩm và viết sơ đồ theo thứ tự. |
| 3 | Chuẩn bị dung dịch rửa. |
| 4 | Pha loãng chứng và mẫu bệnh phẩm. |
| 5 | Lấy đủ số giếng cần dùng và đặt vào giá. |
| 6 | Rửa các giếng 1 lần bằng dung dịch rửa đã pha loãng. |
| 7 | Cho chứng và bệnh phẩm vào các giếng của phiến nhựa theo hướng dẫn của qui trình. |
| 8 | Đậy tấm và ủ. |
| 9 | Rửa phiến nhựa. |
| 10 | Chuẩn bị chất cộng hợp |
| 11 | Đậy tấm và ủ |
| 12 | Rửa phiến nhựa |
| 13 | Nhỏ dung dịch hiện màu vào mỗi giếng |
| 14 | Ủ phiến nhựa , không đậy tấm và tránh ánh sang |
| 15 | Nhỏ dung dịch dừng phản ứng |
| 16 | Đọc độ hấp thụ ở bước sóng 450 và 620 nm trong vòng 30 phút sau khi dừng phản ứng. |
IV. NHẬN ĐỊNH KẾT QUẢ
1. Điều kiện của phản ứng
Theo hướng dẫn của nhà sản xuất
2. Tính giá trị ngưỡng
Cut-off (CO)
3. Diễn giải kết quả
- Theo hướng dẫn của nhà sản xuất
- Nếu kết quả nghi ngờ → làm lại xét nghiệm theo hướng dẫn của nhà sản xuất
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
1. Sai sót
Có thể xảy ra hiện tượng âm tính giả hoặc dương tính giả, thông thường do:
- Thực hiện sai các bước trong quy trình hướng dẫn.
- Chứng âm và những mẫu bệnh phẩm âm tính bị nhiễm chéo bởi huyết thanh/ huyết tương có nồng độ kháng thể cao.
- Dung dịch cơ chất bị nhiễm bởi các tác nhân oxid hoá (thuốc tẩy, ion kim loại v.v…)
- Dung dịch dừng phản ứng bị nhiễm bẩn.
2. Xử trí
- Tuân thủ đúng các bước quy trình hướng dẫn của nhà sản xuất và hướng dẫn về độ ổn định hóa chất xét nghiệm trong bộ sinh phẩm sử dụng.
- Kiểm tra và vệ sinh máy rửa thường xuyên trước và sau khi làm xét nghiệm.
67. Salmonella Widal
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Phát hiện kháng thể O và H kháng Salmonella trong huyết thanh
2. Nguyên lý
Phản ứng ngưng kết.
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện: Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: Cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Máy ly tâm thường.
- Ống nghiệm 12 mm.
- Micropipette các loại: 100 µl, 500 µl, 1000 µl.
- Giá cắm ống nghiệm.
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
Định mức sinh phẩm và vật tư tiêu hao cho 1 mẫu/lần thực hiện (VD)
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Bông | Kg | 0,001 |
| 2 | Dây garô | Cái | 0,001 |
| 3 | Tube đựng bệnh phẩm | Cái | 1,000 |
| 4 | Tube thủy tinh làm xét nghiệm | Cái | 14,000 |
| 5 | Sinh phẩm chẩn đoán | ml | 10,800 |
| 6 | Khấu hao sinh phẩm cho kiểm tra lại | ml | 0,100 |
| 7 | NaCl 0.9 % | ml | 2,000 |
| 8 | Đầu côn 1000 µl | Cái | 8,000 |
| 9 | Đầu côn 200 µl | Cái | 3,000 |
| 10 | Giấy thấm | Cuộn | 0,100 |
| 11 | Giấy xét nghiệm | Tờ | 2,000 |
| 12 | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 13 | Bút viết kính | Cái | 0,020 |
| 14 | Bút bi | Cái | 0,010 |
| 15 | Mũ | Cái | 0,020 |
| 16 | Khẩu trang | Cái | 0,020 |
| 17 | Găng tay | Đôi | 0,100 |
| 18 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 19 | Quần áo bảo hộ | Bộ | 0,005 |
| 20 | Dung dịch nước rửa tay | ml | 8,000 |
| 21 | Cồn sát trùng tay nhanh | ml | 1,000 |
| 22 | Dung dịch khử trùng | ml | 10,000 |
| 23 | Khăn lau tay | Cái | 0,010 |
| 24 | QC (nếu thực hiện) * |
| 0,100 |
| 25 | EQAS (nếu thực hiện) * |
| 0,005 |
* Ghi chú:
- Chi phí nội kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình nội kiểm (QC) là 1/10 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lượng ≥ 10 mẫu cho 1 lần tiến hành kỹ thuật).
- Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/200 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 2 lần/1 năm).
3. Bệnh phẩm
Huyết thanh hoặc huyết tương của người bệnh
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu yêu cầu.
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
Theo đúng quy định của chuyên ngành Vi sinh (Xem Phụ lục 2).
2. Tiến hành kỹ thuật
Sinh phẩm chẩn đoán thương hàn của hãng Bio-Rad gồm 6 loại kháng nguyên TO, TH, AO, AH, BO, BH là các kháng nguyên thân và kháng nguyên lông của S. typhi, S. paratyphi A, S. paratyphi B (VD).
| TT | Các bước thực hiện | ||||||||||||||
| 1. | Để sinh phẩm ở nhiệt độ phòng 15-20 phút trước khi làm xét nghiệm | ||||||||||||||
| 2. | Kiểm tra tên, tuổi giữa bệnh phẩm và giấy xét nghiệm Ghi tên và đánh dấu từng ống xét nghiệm | ||||||||||||||
| 3. | Pha loãng huyết thanh (HT) người bệnh: + Pha loãng huyết thanh 1/10: 0,2ml huyết thanh + 1,8 ml NaCl 0,9% + Pha loãng huyết thanh 1/20: 0,1ml huyết thanh + 1,9 ml NaCl 0,9% | ||||||||||||||
| 4. | Cho vào các ống xét nghiệm theo sơ đồ | ||||||||||||||
|
| Ống | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 |
| |
|
| nghiệm |
|
|
|
|
|
|
|
|
|
|
|
| ||
|
| HT pha loãng 1/20 |
| 0,1 ml |
| 0,1 ml |
| 0,1 ml |
| 0,1 ml |
| 0,1 ml |
| 0,1 ml | ||
|
| HT pha loãng 1/100 | 0,1 ml |
| 0,1 l |
| 0,1 m |
| 0,1 ml |
| 0,1 ml |
| 0,1 ml |
| ||
|
| Khán nguyên | 0,9 ml TO | 0,9 ml TO | 0,9 ml TH | 0,9 ml TH | 0,9 ml AO | 0,9 ml AO | 0,9 ml AH | 0,9 ml AH | 0,9 ml BO | 0,9 ml BO | 0,9 ml BH | 0,9 ml BH | ||
|
| Độ pha loãng cuối cùng | 1/10 0 | 1/2 00 | 1/1 00 | 1/2 00 | 1/1 00 | 1/2 00 | 1/10 0 | 1/20 0 | 1/10 0 | 1/20 0 | 1 1 00 | 1/2 0 | ||
| 5. | Ly tâm 3000 vòng trong 5 phút | ||||||||||||||
| 6. | Đọc kết quả bằng mắt thường hoặc kính lúp trên nền màu đen | ||||||||||||||
IV. NHẬN ĐỊNH KẾT QUẢ
Gõ nhẹ vào đáy của ống nghiệm và quan sát:
- Phản ứng âm tính: nếu hỗn hợp phản ứng đồng nhất.
- Phản ứng dương tính: các hạt ngưng kết có thể quan sát được bằng mắt thường.
+ Kháng thể O: ngưng kết hạt nhỏ, bền vững, lắc khó tan.
+ Kháng thể H: ngưng kết như bông, hạt to, khi lắc dễ tan.
+ Hiệu giá kháng thể được tính ở ống huyết thanh nào có độ pha loãng lớn nhất vẫn còn hiện tượng ngưng kết xảy ra.
Ví dụ: nếu hiện tượng ngưng kết với TO và TH xảy ra ở độ pha loãng 1:200, trong khi những ống nghiệm còn lại vẫn âm tính thì phải làm lại phản ứng bằng cách pha loãng huyế thanh ở độ pha loãng là 1:40, 1:80, 1:160. Mục đích để xác định lại hiệu giá kháng thể đối với TO, TH và hiệu giá cuối cùng đối với mẫu huyết thanh đã được pha loãng sẽ là 1:400, 1:800 và 1: 1600.
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
- Âm tính giả: có thể do lấy máu quá sớm.
- Dương tính giả: gặp ở người bệnh nhiễm Ricketsia, một số trường hợp viêm gan mãn tính, nhiễm vi khuẩn gram (-).
- Phản ứng Widal chỉ có giá trị định hướng cho chẩn đoán.
- Có thể xảy ra hiện tượng ngưng kết vùng do đó dễ bỏ sót.
- Sai sót do người làm kỹ thuật.
- Tham khảo thêm hướng dẫn của nhà sản xuất.
68. Streptococcus pyogenes ASO
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Phát hiện kháng thể Anti Streptolysin O (ASO).
2. Nguyên lý
Dựa trên phản ứng ngưng kết thụ động (gián tiếp).
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện: Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: Cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Máy ly tâm thường.
- Đồng hồ bấm giây.
- Micropipette
- Que trộn dùng một lần có sẵn trong hộp sinh phẩm
- Ống nghiệm vô trùng.
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
Định mức sinh phẩm và vật tư tiêu hao cho 5 mẫu/lần thực hiện (VD)
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Bông | Kg | 0,001 |
| 2 | Dây garô | Cái | 0,001 |
| 3 | Cồn | ml | 1,000 |
| 4 | Bơm kim tiêm | Cái | 1,000 |
| 5 | Panh | Cái | 0,0001 |
| 6 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 7 | Hộp vận chuyển bệnh phẩm | Cái | 0,001 |
| 8 | Tube đựng bệnh phẩm | Cái | 1,000 |
| 9 | Sinh phẩm chẩn đoán | Test | 1,000 |
| 10 | Khấu hao sinh phẩm cho chạy chứng, kiểm tra lại | Test | 0,400 |
| 11 | Đầu côn 200 µl | Cái | 2,000 |
| 12 | Giấy thấm | Cuộn | 0,100 |
| 13 | Giấy xét nghiệm | Tờ | 2,000 |
| 14 | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 15 | Bút viết kính | Cái | 0,020 |
| 16 | Bút bi | Cái | 0,010 |
| 17 | Mũ | Cái | 0,020 |
| 18 | Khẩu trang | Cái | 0,020 |
| 19 | Găng tay | Đôi | 0,100 |
| 20 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 21 | Quần áo bảo hộ | Bộ | 0,005 |
| 22 | Dung dịch nước rửa tay | ml | 8,000 |
| 23 | Cồn sát trùng tay nhanh | ml | 1,000 |
| 24 | Dung dịch khử trùng | ml | 10,000 |
| 25 | Khăn lau tay | Cái | 0,010 |
| 26 | EQAS (nếu thực hiện)* |
| 0,005 |
* Ghi chú:
- Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/200 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 2 lần/1 năm).
3. Bệnh phẩm
Huyết thanh hoặc huyết tương của người bệnh
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu phiếu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
Theo đúng quy định của chuyên ngành Vi sinh (Xem Phụ lục 2).
2. Tiến hành kỹ thuật
Bộ sinh phẩm Rapet ASO (VD).
| Các bước thực hiện | Kỹ thuật |
| 1 | Đưa sinh phẩm ra ngoài nhiệt độ phòng Đánh số thứ tự các bệnh phẩm và số thứ tự trên tấm kính |
| 2 | Lắc nhẹ nhàng lọ chứa hạt latex, không được lắc quá mạnh |
| 3 | Dùng pipet nhỏ 1 giọt huyết thanh của người bệnh vào ô tương ứng đã đánh số trên phiến kính. Nhỏ chứng dương và chứng âm |
| 4 | Lắc nhẹ nhàng lọ có chứa hạt latex và nhỏ một giọt vào cạnh giọt huyết thanh của người bệnh |
| 5 | Trộn đều 2 loại với nhau bằng que trộn phủ đều bề mặt của mỗi ô. |
| 6 | Lắc đều cả phiến kính bằng tay hoặc dùng máy lắc 80-100 vòng trong 2 phút |
| 7 | Đọc kết quả |
IV. NHẬN ĐỊNH KẾT QUẢ
- Ô chứng dương: có hiện tượng ngưng kết hạt latex
- Ô chứng âm: không có hiện tượng ngưng kết, hỗn dịch nhìn thấy mịn, đồng nhất
- Ô không có hiện tượng ngưng kết, hỗn dịch nhìn thấy mịn, đồng nhất: Âm tính
- Ô có hiện tượng ngưng kết, hỗn dịch nhìn thấy thô, có hạt ngưng kết rõ trên nền đen: Ngưng kết hạt latex với nồng độ Anti Streptolysin O ≥ 200 IU/ml. Cần làm tiếp kỹ thuật bán định lượng nồng độ Anti Streptolysin O trong huyết thanh như sau:
+ Pha loãng huyết thanh của người bệnh và tiếp tục làm phản ứng như ở phần trên:
| Pha loãng huyết thanh | ASO (IU/ml) |
| 1 huyết thanh (HT) + 1 dung dịch đệm (DD) (1:2) | 400 IU/ml |
| 1 HT + 2 DD (1:3) | 600 IU/ml |
| 1 HT + 3DD (1:4) | 800 IU/ml |
| 1HT + 3DD (1:4) | 1000 IU/ml |
+ Ở độ loãng huyết thanh lớn nhất mà còn xảy ra hiện tượng ngưng kết thì đọc nồng độ ASO tương ứng ở đó. Ví dụ: ngưng kết xảy ra ở độ loãng huyết thanh lớn nhất là 1:4 thì nồng độ ASO là 800 IU/ml.
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
1. Sai sót
- Nếu lắc quá thời gian (>2 phút) có thể xảy ra dương tính giả.
- Khi nồng độ ASO> 2000 IU/ml có thể ức chế sự ngưng kết. Trên lâm sàng mà có triệu chứng rõ thì cần pha loãng huyết thanh để làm phản ứng.
2. Xử trí: Tham khảo thêm hướng dẫn của nhà sản xuất.
69. Treponema pallidum soi tươi
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Phát hiện sự có mặt của Treponema pallidum tại tổn thương vết chancre hoặc ở nốt hồng ban.
2. Nguyên lý
Dựa trên hình ảnh sóng hình sin và tính chất di động đặc trưng của T. pallidum bằng kính hiển vi nền đen.
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện: Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: Cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
Kính hiển vi nền đen
Tủ an toàn sinh học cấp 2
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Lam kính | Cái | 2,000 |
| 2 | Lamen | Cái | 1,000 |
| 3 | Kim chủng | Cái | 1,000 |
| 4 | Bông | Kg | 0,001 |
| 5 | Nước muối sinh lý NaCL 9‰ | ml | 2,000 |
| 6 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 7 | Mũ | Cái | 0,020 |
| 8 | Khẩu trang | Cái | 0,020 |
| 9 | Găng tay | Đôi | 3,000 |
| 10 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 11 | Quần áo bảo hộ | Bộ | 0,001 |
| 12 | Bút viết kính | Cái | 0,020 |
| 13 | Bút bi | Cái | 0,010 |
| 14 | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 15 | Cồn sát trùng tay nhanh | ml | 2,000 |
| 16 | Dung dịch nước rửa tay | ml | 8,000 |
| 17 | Khăn lau tay | Cái | 0,030 |
| 18 | Giấy trả kết quả xét nghiệm | Tờ | 2,000 |
| 19 | Bơm kim tiêm | Cái | 1,000 |
| 20 | QC (nếu thực hiện) * |
| 0,1 |
| 21 | EQAS (nếu thực hiện) * |
| 0,005 |
* Ghi chú:
- Chi phí nội kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình nội kiểm (QC) là 1/10 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lượng ≥ 10 mẫu cho 1 lần tiến hành kỹ thuật).
- Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/200 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 2 lần/1 năm).
3. Bệnh phẩm: Dịch tiết ở vết loét, sẩn, dịch chọc hạch…
4. Phiếu xét nghiệm: Điền đầy đủ thông tin theo mẫu phiếu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
- Tổn thương là vết trợt, vết loét: Rửa tổn thương bằng nước muối đẳng trương 0,9%, kẹp chặt thương tổn vào giữa ngón trỏ và ngón cái của bàn tay trái, dùng tăm bông sạch xát lên rìa thương tổn vài ba lần để lấy một ít dịch tiết thoát ra. Dàn lên một lam kính đã nhỏ sẵn một giọt nước muối sinh lý 0,9%.
- Tổn thương là sẩn, đào ban: Lau sạch tổn thương như trên. Dùng ngòi chủng cào nhẹ lên tổn thương lấy ít dịch (tránh làm chảy máu).
- Tổn thương là hạch: Cố định hạch bằng hai ngón tay, dùng bơm tiêm vô trùng bơm vào hạch một ít nước muối sinh lý 9‰, day nhẹ hạch rồi hút ra một ít dịch.
2. Tiến hành kỹ thuật
- Chuẩn bị tiêu bản soi dưới kính hiển vi nền đen: Dàn bệnh phẩm lấy được vào giọt nước muối sinh lý 0,9% đã nhỏ sẵn trên lam kính, đậy lamen lên.
- Soi ngay dưới kính hiển vi nền đen.
IV. NHẬN ĐỊNH KẾT QUẢ
- Thường đọc dưới vật kính x40.
- Xoắn khuẩn giang mai hình lò xo, vòng xoắn đều và mau, chiều dài khoảng 6-14 micromet, chiều ngang mảnh khoảng 0,15 micromet, trắng sáng trên nền đen, vừa tự dao động quanh trục vừa di chuyển .
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
- Các tổn thương đã bôi chất sát khuẩn, uống thuốc kháng sinh hoặc tiêm thuốc kháng sinh đều khó tìm thấy xoắn khuẩn.
- Lấy bệnh phẩm lẫn nhiều máu, mủ thì khó nhận định.
- Kết quả khi đọc có thể nhầm với xoắn khuẩn sốt hồi qui, xoắn khuẩn gây bệnh ghẻ cóc…nên cần cán bộ có kinh nghiệm.
70. Treponema pallidum nhuộm soi
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Phát hiện sự có mặt của Treponema pallidum tại tổn thương vết chancre hoặc ở nốt hồng ban.
2. Nguyên lý
Dựa trên hình ảnh xoắn khuẩn sóng hình sin bắt màu nâu đặc trưng khi nhuộm bằng phương pháp Fontana-Tribondeau.
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện: Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: Cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
Kính hiển vi quang học
Tủ an toàn sinh học cấp 2
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Lam kính | Cái | 2,000 |
| 2 | Kim chủng | Cái | 1,000 |
| 3 | Dầu soi kính | ml | 1,000 |
| 4 | Xylen lau kính | ml | 1,000 |
| 5 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 6 | Mũ | Cái | 0,020 |
| 7 | Khẩu trang | Cái | 0,020 |
| 8 | Găng tay | Đôi | 3,000 |
| 9 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 10 | Quần áo bảo hộ | Bộ | 0,001 |
| 11 | Bút viết kính | Cái | 0,020 |
| 12 | Bút bi | Cái | 0,010 |
| 13 | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 14 | Cồn sát trùng tay nhanh | ml | 2,000 |
| 15 | Dung dịch nước rửa tay | ml | 8,000 |
| 16 | Khăn lau tay | Cái | 0,030 |
| 17 | Giấy trả kết quả xét nghiệm | Tờ | 2,000 |
| 18 | Dung dịch cố định (Ruge) | ml | 1,000 |
| 19 | Cồn 900 | ml | 1,000 |
| 20 | Dung dịch gắn màu Tanin | ml | 1,000 |
| 21 | Dung dịch Nitorat bạc AgNO3 5% | ml | 1,000 |
| 22 | Dung dịch NH4OH | ml | 1,000 |
| 23 | QC (nếu thực hiện) * |
| 0,1 |
| 24 | EQAS (nếu thực hiện) * |
| 0,005 |
* Ghi chú:
- Chi phí nội kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình nội kiểm (QC) là 1/10 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lượng ≥ 10 mẫu cho 1 lần tiến hành kỹ thuật).
- Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/200 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 2 lần/1 năm).
3. Bệnh phẩm
Các tổn thương giang mai như chancre, chợt, sẩn, mảng niêm mạc, hạch ..
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu phiếu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
- Tổn thương là vết trợt, vết loét: Rửa tổn thương bằng nước muối đẳng trương 9%o, kẹp chặt thương tổn vào giữa ngón trỏ và ngón cái của bàn tay trái, dùng tăm bông sạch xát lên rìa thương tổn vài ba lần để lấy một ít dịch tiết thoát ra. Dàn lên một lam kính để khô tự nhiên.
- Tổn thương là sẩn, đào ban: Lau sạch tổn thương như trên, dùng ngòi chủng cào nhẹ lên tổn thương lấy ít dịch (tránh làm chảy máu), dàn lên một lam kính để khô tự nhiên.
- Tổn thương là hạch: Cố định hạch bằng hai ngón tay, dùng bơm tiêm vô trùng bơm vào hạch một ít nước muối sinh lý 9%o, day nhẹ hạch hút ra một ít dịch rồi dàn mỏng lên lam kính để khô tự nhiên.
2. Tiến hành kỹ thuật
- Phủ dung dịch cố định Ruge trong khoảng 30-60 giây, đổ đi.
- Cố định bệnh phẩm bằng cồn 90 độ (để nghiêng, nhỏ từng giọt cồn, để cồn bay).
- Phủ dung dịch gắn màu Tanin lên lam kính, hơ trên ngọn lửa đèn cồn tới khi bốc hơi, để nguội rồi đổ đi và rửa nước.
- Thấm bạc: nhỏ một giọt dung dịch Nitrat bạc 5% -> tráng đều trên bệnh phẩm -> đổ đi, nhỏ dung dịch NH4OH lên trên cho tới khi trong thì thôi -> hơ trên ngọn lửa đèn cồn đến khi bốc hơi -> để nguội rồi rửa nước. Để tiêu bản khô tự nhiên. Soi trên kính hiển vi quang học - vật kính dầu.
IV. NHẬN ĐỊNH KẾT QUẢ
- Soi ở vật kính dầu
- Hình ảnh xoắn khuẩn giống sóng hình sin đều, mảnh, bắt màu nâu xám trên nền vàng nhạt.
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
- Dàn bệnh phẩm lên lam kính không được dày quá.
- Không hơ lam kính trên ngọn lửa đèn cồn quá lâu gây biến dạng xoắn khuẩn.
71. Treponema pallidum RPR định tính và định lượng
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Phát hiện kháng thể kháng kháng nguyên Cardiolipin trong huyết tương (huyết thanh) của người bệnh bị giang mai.
2. Nguyên lý
Kháng nguyên Cardiolipin gắn trên hạt than khi cho tiếp xúc với huyết tương (huyết thanh) người bệnh bị giang mai sẽ cho phản ứng dương tính biểu hiện bằng hiện tượng lên bông.
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: Cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Máy ly tâm thường.
- Máy lắc tròn.
- Tủ lạnh 4 oC - 8 oC
- Micropipette 50µl - 100 µl
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
Định mức sinh phẩm và vật tư tiêu hao cho 1 mẫu/lần thực hiện (VD)
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Bông | Kg | 0,001 |
| 2 | Dây garô | Cái | 0,001 |
| 3 | Cồn | ml | 1,000 |
| 4 | Bơm kim tiêm | Cái | 1,000 |
| 5 | Panh | Cái | 0,0001 |
| 6 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 7 | Hộp vận chuyển bệnh phẩm | Cái | 0,001 |
| 8 | Tube đựng bệnh phẩm | Cái | 1,000 |
| 9 | Sinh phẩm RPR | Test | 1,000 |
| 10 | Khấu hao sinh phẩm RPR cho chạy chứng, kiểm tra chất lượng | Test | 6,000 |
| 11 | Đầu côn 200 µl | Cái | 6,000 |
| 12 | Giấy thấm | Cuộn | 0,100 |
| 13 | Giấy xét nghiệm | Tờ | 2,000 |
| 14 | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 15 | Bút viết kính | Cái | 0,020 |
| 16 | Bút bi | Cái | 0,010 |
| 17 | Mũ | Cái | 0,020 |
| 18 | Khẩu trang | Cái | 0,020 |
| 19 | Găng tay | Đôi | 0,100 |
| 20 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 21 | Quần áo bảo hộ | Bộ | 0,005 |
| 22 | Dung dịch nước rửa tay | ml | 8,000 |
| 23 | Cồn sát trùng tay nhanh | ml | 1,000 |
| 24 | Dung dịch khử trùng | ml | 10,000 |
| 25 | Khăn lau tay | Cái | 0,010 |
3. Bệnh phẩm
Huyết thanh hoặc huyết tương của người bệnh.
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu phiếu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
- Theo đúng quy định của chuyên ngành Vi sinh (xem phụ lục 2)
- Từ chối những bệnh phẩm không đạt yêu cầu (xem phụ lục 6).
2. Tiến hành kỹ thuật
Bộ sinh phẩm RPR quicktest - Stanbio (VD)
2.1 Phản ứng RPR định tính
| Các bước | Nội dung thực hiện |
| 1 | Để sinh phẩm ở nhiệt độ phòng trước khi tiên hành phản ứng |
| 2 | Nhỏ mẫu (Huyết thanh) vào một vòng tròn trên bìa phản ứng, để giọt rơi tự do. Chứng dương, chứng âm tương ứng theo hướng dẫn của nhà sản xuất. |
| 3 | Dàn đều mẫu trong giới hạn vòng tròn |
| 4 | Lắc nhẹ lọ kháng nguyên Nhỏ 1 giọt kháng nguyên vào vòng tròn đã có mẫu |
| 5 | Không khuấy trộn. Để tấm phản ứng lên máy lắc và lắc ở tốc độ 100 vòng/phút trong 8 phút theo hướng dẫn của nhà sản xuất. |
| 6 | Đọc kết quả trực tiếp ở nơi có đủ ánh sáng |
2.2. Phản ứng RPR định lượng:
Thực hiện phản ứng bằng huyết thanh được pha loãng dần tới độ pha loãng lớn nhất còn cho kết quả dương tính. Pha loãng huyết thanh tiến hành với lượng gấp đôi: 1/2, 1/4, 1/8, 1/16...
| Các bước | Nội dung thực hiện |
| 1 | Để sinh phẩm ở nhiệt độ phòng trước khi làm phản ứng. |
| 2 | Nhỏ 50 µl NaCL 9‰ vào vòng tròn trên bìa phản ứng từ số 2-5 |
| 3 | Nhỏ 50 µl mẫu vào vòng tròn 1và 2 |
| 4 | Pha loãng bậc hai từ vòng tròn 2 |
| 5 | Dàn đều mẫu trong giới hạn vòng tròn. |
| 6 | Nhỏ kháng nguyên vào vòng tròn đã có mẫu |
| 7 | Để tấm phản ứng lên máy lắc và lắc ở tốc độ 100 vòng/phút trong 8 phút |
| 8 | Đọc kết quả trực tiếp ở nói có đủ ánh sáng |
IV. NHẬN ĐỊNH KẾT QUẢ
Phản ứng dương tính: Có các hạt kết cụm màu đen (hiện tượng lên bông) trên khắp mặt hoặc trung tâm vòng tròn của bìa phản ứng.
Phản ứng dương tính yếu: Có ít các hạt kết cụm màu đen bao quanh rìa vòng tròn bìa phản ứng.
Kết quả âm tính: đám than hoạt tập trung ở giữa vòng tròn, màu xám đồng nhất.
Nhận định kết quả RPR định lượng
| Hiệu giá | Vòng tròn 1 1:1 | Vòng tròn 2 1:2 | Vòng tròn 3 1:4 | Vòng tròn 4 1:8 | Vòng tròn 5 1:16 |
| 1:2 | (+) | (+) | (-) | (-) | (-) |
| 1:4 | (+) | (+) | (+) | (-) | (-) |
| 1:8 | (+) | (+) | (+) | (+) | (-) |
| 1:16 | (+) | (+) | (+) | (+) | (+) |
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
- Phản ứng có thể dương tính giả trong một số bệnh: Lupus ban đỏ, bệnh sốt rét, bệnh phong, bệnh tăng tế bào đơn nhân nhiễm trùng, phụ nữ có thai... những trường hợp này cần làm thêm phản ứng TPHA để xác định chẩn đoán.
- Tham khảo thêm hướng dẫn của nhà sản xuất.
72. Treponema pallidum TPHA định tính và định lượng
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Phát hiện kháng thể kháng xoắn khuẩn giang mai trong huyết tương (huyết thanh) của người bệnh bị giang mai.
2. Nguyên lý
Dựa trên nguyên lý của phản ứng ngưng kết. Tế bào (hồng cầu) đã được gắn kháng nguyên xoắn khuẩn giang mai, khi cho tiếp xúc huyết thanh (huyết tương) của người bệnh giang mai sẽ bị ngưng kết.
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện: Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: Cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1.Trang thiết bị
- Máy lắc tròn tốc độ 100 vòng/ phút (nếu có).
- Máy ly tâm thường.
- Tủ lạnh 4 oC - 8 oC
- Micropipette các loại: 5 µl - 10 µl, 25 µl, 75 µl, 200 µl.
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
Định mức sinh phẩm và vật tư tiêu hao cho 1 mẫu/lần thực hiện (VD)
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Bông | Kg | 0,001 |
| 2 | Dây garô | Cái | 0,001 |
| 3 | Cồn | ml | 1,000 |
| 4 | Bơm kim tiêm | Cái | 1,000 |
| 5 | Panh | Cái | 0,0001 |
| 6 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 7 | Hộp vận chuyển bệnh phẩm | Cái | 0,001 |
| 8 | Tube đựng bệnh phẩm | Cái | 1,000 |
| 9 | Sinh phẩm TPHA | Test | 1,000 |
| 10 | Khấu hao sinh phẩm TPHA cho chạy chứng, kiểm tra chất lượng | Test | 6,000 |
| 11 | Đầu côn 200 µl | Cái | 6,000 |
| 12 | Giấy thấm | Cuộn | 0,100 |
| 13 | Giấy xét nghiệm | Tờ | 2,000 |
| 14 | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 15 | Bút viết kính | Cái | 0,020 |
| 16 | Bút bi | Cái | 0,010 |
| 17 | Mũ | Cái | 0,020 |
| 18 | Khẩu trang | Cái | 0,020 |
| 19 | Găng tay | Đôi | 0,100 |
| 20 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 21 | Quần áo bảo hộ | Bộ | 0,005 |
| 22 | Dung dịch nước rửa tay | ml | 8,000 |
| 23 | Cồn sát trùng tay nhanh | ml | 1,000 |
| 24 | Dung dịch khử trùng | ml | 10,000 |
| 25 | Khăn lau tay | Cái | 0,010 |
3. Bệnh phẩm
Huyết thanh hoặc huyết tương của người bệnh.
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu phiếu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
- Theo đúng quy định của chuyên ngành Vi sinh (xem phụ lục 2)
- Từ chối những bệnh phẩm không đạt yêu cầu (xem phụ lục 6).
2. Tiến hành kỹ thuật
Bộ sinh phẩm TPHA new M của BIO-Rad (VD)
2.1. Phản ứng TPHA định tính
| Các bước | Nội dung thực hiện |
| 1. | Để sinh phẩm ở nhiệt độ phòng Pha loãng huyết thanh 1/20 |
| 2. | Huyết thanh pha loãng 1/20 ở giếng số một nhỏ vào giếng thứ 2 và thứ 3 |
| 3. | Nhỏ control cell (dung dịch tế bào không gắn kháng nguyên) vào giếng 2 (độ pha loãng của huyết thanh là 1/80) theo hướng dẫn. |
| 4. | Nhỏ test cell (dung dịch tế bào gắn kháng nguyên) vào giếng 3 (độ pha loãng của huyết thanh là 1/80) theo hướng dẫn. |
| 5. | Lắc nhẹ phiến nhựa hoặc để máy rung ở tốc độ… trong 5 phút |
| 6. | Đậy khay nhựa và để nhiệt độ phòng từ 45-60 phút |
| 7. | Nhận định kết quả sau 45 - 60 phút |
2.2. Phản ứng TPHA định lượng
Huyết thanh người bệnh được pha loãng theo tỷ lệ 1/20, 1/40, 1/80, 1/160...
| Các bước | Nội dung thực hiện |
| 1. | Pha loãng huyết thanh 1/20 |
| 2. | Nhỏ huyết thanh pha loãng 1/20 nhỏ vào giếng 2 và 3 theo hướng dẫn. |
| 3. | Nhỏ dung dịch pha loãng huyết thanh vào mỗi giếng từ thứ 4 trở đi theo hướng dẫn. |
| 4. | Nhỏ huyết thanh pha loãng 1/20 nhỏ vào giếng thứ 4 trộn đều, chuyển tiếp huyết thanh pha loãng sang giếng sau, tiếp tục như vậy tới độ pha loãng cần thiết theo hướng dẫn. |
| 5. | Nhỏ dung dịch control cell vào giếng 2 theo hướng dẫn. |
| 6. | Nhỏ test cell vào các giếng tiếp theo, theo hướng dẫn. |
| 7. | Lắc nhẹ, để ở nhiệt độ phòng |
| 8. | Nhận định kết quả sau 45 phút |
IV. NHẬN ĐỊNH KẾT QUẢ
1. Điều kiện phản ứng
- Giếng hai chứa mẫu bệnh phẩm với dung dịch tế bào không gắn kháng nguyên (control cell) phải âm tính: tế bào lắng xuống đáy giếng thành một nút nhỏ (nồng độ pha loãng 1:80).
- Mẫu xét nghiệm chứng dương phải dương tính.
- Mẫu xét nghiệm chứng âm phải âm tính
2. Đọc kết quả
Đặt nhẹ nhàng phiến nhựa lên mặt phẳng, đọc với nguồn ánh sáng trực tiếp. So sánh hình thái ngưng kết của các mẫu thử với mẫu chứng âm tính và chứng dương tính, nhận định kết quả theo bảng sau:
| Kêt quả | Test cell | Control cell |
| Dương tính mạnh | Tế bào ngưng kết dàn mỏng toàn bộ đáy giếng | Tế bào lắng tạo thành nút nhỏ ở đáy giếng |
| Dương tính yếu | Tế bào ngưng kết dàn mỏng 1/3 đáy giếng | Tế bào lắng tạo thành nút nhỏ ở đáy giếng |
| Âm tính | Tế bào lắng xuống tạo thành một nút nhỏ ở đáy giếng | Tế bào lắng tạo thành nút nhỏ ở đáy giếng |
| Không xác định* | Tế bào lắng xuống giống hình một cái nhẫn có viền đều xung quanh | Tế bào lắng tạo thành nút nhỏ ở đáy giếng |
| Phản ứng không đặc hiệu | Phản ứng dương tính | Phản ứng dương tính |
* Nếu một mẫu ngưng kết với cả giếng có tế bào không gắn kháng nguyên (control cell) và giếng có tế bào gắn kháng nguyên (test cell) cần phải làm lại mẫu với thao tác hấp phụ:
+ Nhỏ 100µl mẫu bệnh phẩm vào ống nghiệm.
+ Nhỏ tiếp 400µl control cell.
+ Đồng nhất phản ứng bằng cách trộn đều và ủ ở nhiệt độ phòng 1 giờ.
+ Ly tâm ở 1000 vòng x15 phút.
+ Dùng pipet hút lấy nước nổi ở bề mặt (độ pha loãng mẫu là 1:5) để làm phản ứng. Cần phải tính toán lại khi pha loãng mẫu.
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
- Thực hiện đúng các bước kỹ thuật theo hướng dẫn của nhà sản xuất.
- Tham khảo thêm hướng dẫn của nhà sản xuất.
73. Ureaplasma urealyticum nuôi cấy, định danh và kháng thuốc
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Phát hiện và định danh U. urealyticum bằng phương pháp nuôi cấy. Xác định mức độ nhạy cảm với kháng sinh của U. urealyticum.
2. Nguyên lý
Vi khuẩn được định danh dựa vào đặc điểm nuôi cấy, một số tính chất chuyển hóa.
Mức độ nhạy cảm với kháng sinh của U. urealyticum được xác định bằng phương pháp cấy trong canh thang đã có sẵn lượng kháng sinh nhất định. Đánh giá mức độ nhạy cảm với kháng sinh tùy theo khả năng mọc của vi khuẩn trong môi trường có chứa kháng sinh.
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện: Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: Cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Tủ ấm CO2
- Tủ an toàn sinh học cấp 2
- Bàn phụ khoa
- Đèn phụ khoa
- Kính hiển vi quang học
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Que lấy bệnh phẩm hoặc tăm bông vô trùng | Cái | 2,000 |
| 2 | Mỏ vịt (to, vừa và nhỏ) | Cái | 1,000 |
| 3 | Môi trường A7 | Đĩa | 1,000 |
| 4 | Môi trường DUO KIT | Bộ | 1,000 |
| 5 | Bông | Kg | 0,001 |
| 6 | Cồn 90 độ (vệ sinh dụng cụ) | ml | 10,000 |
| 7 | Đèn cồn | Cái | 0,0001 |
| 8 | Panh | Cái | 0,0001 |
| 9 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 10 | Hộp vận chuyển bệnh phẩm | Cái | 0,0001 |
| 11 | Mũ | Cái | 0,020 |
| 12 | Khẩu trang | Cái | 0,020 |
| 13 | Găng tay | Đôi | 3,000 |
| 14 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 15 | Quần áo bảo hộ | Bộ | 0,001 |
| 16 | Hộp đựng dung dịch khử khuẩn ngâm mỏ vịt | ml | 10,000 |
| 17 | Bút viết kính | Cái | 0,020 |
| 18 | Bút bi | Cái | 0,010 |
| 19 | Bật lửa | Cái | 0,010 |
| 20 | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 21 | Cồn sát trùng tay nhanh | ml | 2,000 |
| 22 | Dung dịch nước rửa tay | ml | 8,000 |
| 23 | Khăn lau tay | Cái | 0,030 |
| 24 | Giấy trả kết quả xét nghiệm | Tờ | 2,000 |
| 25 | QC (nếu thực hiện) * |
| 0,1 |
| 26 | EQAS (nếu thực hiện) * |
| 0,005 |
* Ghi chú:
- Chi phí nội kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình nội kiểm (QC) là 1/10 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lượng ≥ 10 mẫu cho 1 lần tiến hành kỹ thuật).
- Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/200 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 2 lần/1 năm).
3. Bệnh phẩm
Dịch, mủ: dịch cổ tử cung, niệu đạo…
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu yêu cầu.
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
Theo đúng quy định của chuyên ngành Vi sinh (Xem Phụ lục 1 và Phụ lục 6)
2. Tiến hành kỹ thuật
2.1. Ngâm tăm bông bệnh phẩm trong dung dịch trộn bệnh phẩm.
2.2. Nhỏ 200ml dung dịch pha loãng vào các giếng U, D, H.
2.3. Nhỏ 100ml dung dịch trộn bệnh phẩm vào các giếng U, X, H, D.
2.4. Trộn đều trong giếng D, hút 25ml sang các giếng U và H.
2.5. Dán khay thử và để vào tủ ấm với nhiệt độ 37oC.
IV. NHẬN ĐỊNH KẾT QUẢ
4.3. Kết quả định danh
| Quan sát | Kết quả |
| Có sự đổi màu ở giếng U (hồng tím) | Nuôi cấy dương tính |
| Không có sự đổi màu | Âm tính |
4.4. Kết quả kháng sinh đồ
| Quan sát | Kết quả |
| Có sự đổi màu ở cả 2 giếng chứa cùng một loại kháng sinh | R |
| Có sự đổi màu ở cả 1 trong 2 giếng chứa cùng một loại kháng sinh | I |
| Không có sự đổi màu ở cả 2 giếng chứa cùng một loại kháng sinh | S |
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
- Nồng độ tủ ấm CO2 không đủ tiêu chuẩn.
- Nhỏ dung dịch không chính xác.
74. Virus test nhanh
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Phát hiện kháng nguyên hoặc kháng thể của 1 số loại virus từ bệnh phẩm.
2. Nguyên lý
Dựa trên nguyên lý của kỹ thuật sắc ký miễn dịch.
II. CHUẨN BỊ
1.Người thực hiện
- Người thực hiện: Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: Cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2.Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Tủ an toàn sinh học
- Micropipette
- Đồng hồ bấm giây
- Máy ly tâm thường
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
Định mức sinh phẩm và vật tư tiêu hao cho 10 mẫu/lần thực hiện (VD)
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Ống lấy bệnh phẩm | Ống | 1,000 |
| 2 | Bơm tiêm | Cái | 1,000 |
| 3 | Bông | Kg | 0,001 |
| 4 | Cồn 90 độ (vệ sinh dụng cụ) | Ml | 10,000 |
| 5 | Panh | Cái | 0,0001 |
| 6 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 7 | Hộp vận chuyển bệnh phẩm | Cái | 0,0001 |
| 8 | Hóa chất chính | Test | 1,000 |
| 9 | Khấu hao sinh phẩm cho chạy chứng và kiểm tra chất lượng | Test | 0,200 |
| 10 | Đầu côn vàng | Cái | 2,000 |
| 11 | Axít ngâm rửa | Ml | 10,000 |
| 12 | Ống nghiệm thủy tinh | Ống | 1,000 |
| 13 | Mũ | Cái | 0,020 |
| 14 | Khẩu trang | Cái | 0,020 |
| 15 | Găng tay | Đôi | 2,000 |
| 16 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 17 | Quần áo bảo hộ | Bộ | 0,001 |
| 18 | Bút viết kính | Cái | 0,020 |
| 19 | Bút bi | Cái | 0,010 |
| 20 | Sổ lưu kết quả xét nghiệm | Quyển | 0,001 |
| 21 | Cồn sát trùng tay nhanh | Ml | 1,000 |
| 22 | Dung dịch nước rửa tay | Ml | 8,000 |
| 23 | Khăn lau tay | Cái | 0,010 |
| 24 | Giấy trả kết quả xét nghiệm | Tờ | 2,000 |
3. Bệnh phẩm
Huyết thanh hoặc huyết tương của người bệnh
4.Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu phiếu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1.Lấy bệnh phẩm
- Theo đúng quy định của chuyên ngành Vi sinh (xem phụ lục 2)
- Từ chối những bệnh phẩm không đạt yêu cầu (xem phụ lục 6).
2.Tiến hành kỹ thuật
2.1. Ly tâm ống bệnh phẩm
2.2. Bóc thanh xét nghiệm và ghi mã số bệnh phẩm tương ứng
Thực hiện các bước tiếp theo quy trình hướng dẫn của nhà sản xuất
IV. NHẬN ĐỊNH KẾT QUẢ
Đọc kết quả theo hướng dẫn của nhà sản xuất.
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
- Đọc kết quả trước hoặc sau thời gian qui định có thể làm sai lệch kết quả.
- Cho quá ít bệnh phẩm, hay quá nhiều dung dịch pha loãng có thể làm kết quả khó đọc.
- Tham khảo thêm hướng dẫn của nhà sản xuất
75. Virus Ag miễn dịch tự động
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Phát hiện kháng nguyên virus từ bệnh phẩm.
2. Nguyên lý
Dựa trên nguyên lý kết hợp kháng nguyên và kháng thể thực hiện trên hệ thống miễn dịch tự động.
II. CHUẨN BỊ
1.Người thực hiện
- Người thực hiện Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: Cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2.Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1.Trang thiết bị
- Hệ thống máy miễn dịch tự động
- Tủ âm sâu (-20 oC) (nếu có)
- Tủ lạnh
- Micropipette
- Máy ly tâm thường.
2.2.Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
Định mức sinh phẩm và vật tư tiêu hao cho 5 mẫu/lần thực hiện (VD)
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Ống lấy bệnh phẩm | Cái | 1,000 |
| 2 | Bông | Kg | 0,001 |
| 3 | Dây garô | Cái | 0,001 |
| 4 | Cồn | ml | 3,000 |
| 5 | Bơm kim tiêm | Cái | 1,000 |
| 6 | Panh | Cái | 0,0001 |
| 7 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 8 | Hộp vận chuyển bệnh phẩm | Test | 0,001 |
| 9 | Tube đựng bệnh phẩm | Cái | 1,000 |
| 10 | Sinh phẩm chẩn đoán | Test | 1,000 |
| 11 | Khấu hao sinh phẩm cho chạy chứng, kiểm tra chất lượng | Test | 0,400 |
| 12 | Chứng ngoại kiểm âm (nếu có) | ml | 0,005 |
| 13 | Chứng ngoại kiểm dương (nếu có) | ml | 0,005 |
| 14 | Control | Test | 0,300 |
| 15 | Ngoại kiểm* |
| 0,020 |
| 16 | Elecsys clean-cell M | ml | 5,000 |
| 17 | Procell M | ml | 5,000 |
| 18 | Probe Wash M | ml | 2,000 |
| 19 | Preclean M | ml | 2,000 |
| 20 | Assay Tip/Cup E170 | Chiếc | 3,000 |
| 21 | ISE Cleaning Solution F. HIT | ml | 0,500 |
| 22 | Nước cất | ml | 5,000 |
| 23 | Sample cup | Chiếc | 3,000 |
| 24 | Giấy thấm | Cuộn | 0,100 |
| 25 | Giấy xét nghiệm | Tờ | 2,000 |
| 26 | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 27 | Bút viết kính | Cái | 0,020 |
| 28 | Bút bi | Cái | 0,010 |
| 29 | Mũ | Cái | 0,020 |
| 30 | Khẩu trang | Cái | 0,020 |
| 31 | Găng tay | Đôi | 0,100 |
| 32 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 33 | Quần áo bảo hộ | Bộ | 0,005 |
| 34 | Dung dịch nước rửa tay | Ml | 8,000 |
| 35 | Cồn sát trùng tay nhanh | Ml | 1,000 |
| 36 | Dung dịch khử trùng | Ml | 10,000 |
| 37 | Khăn lau tay | Cái | 0,010 |
* Ghi chú: Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/50 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 2 lần/1 năm).
3. Bệnh phẩm
Huyết thanh hoặc huyết tương của người bệnh
3. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu phiếu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
- Theo đúng quy định của chuyên ngành Vi sinh (xem phụ lục 2)
- Từ chối những bệnh phẩm không đạt yêu cầu (xem phụ lục 6).
2. Tiến hành kỹ thuật
Bộ sinh phẩm Elecsys trên hệ thống máy miễn dịch tự động Roche (VD)
| Các bước | Xét nghiệm virus Ag miễn dịch |
| 1 | Vào Reagent để kiểm tra số lượng tests |
| 2 | Vào Calibration → Status để kiểm tra hiệu chuẩn. |
| 3 | Chạy chứng |
| Chạy mẫu không dùng barcode | |
| 1 | Đánh số sample cup theo mã số bệnh phẩm. Hút mẫuvà chứng ngoại kiểm (nếu có) vào sample cup tương ứng |
| 2 | Vào màn hình Workplace → Test Selection |
| 3 | Nhập mã bệnh phẩm và ngày thực hiện xét nghiệm |
| 4 | Chọn tên test cần xét nghiệm |
| 5 | Vào Barcode Read Error |
| 6 | Nhập số rack và vị trí mẫu → Add → OK → Save |
| 7 | Đặt mẫu huyết thanh người bệnh Sample Cup lên Rack đúng vị trí đưa vào khu nạp giá mẫu. |
| 8 | Chọn Start → Chọn START ở màn hình Start Conditions |
| Chạy mẫu có barcode | |
| 1 | Nhập chỉ định vào hệ thống LIS |
| 2 | Đưa ống máu dán barcode vào rack vào khu nạp giá mẫu |
| 3 | Chọn Start → Chọn START ở màn hình Start Conditions |
IV. NHẬN ĐỊNH KẾT QUẢ
Kết quả được hiển thị tự động trên máy miễn dịch.Kết quả của mẫu bệnh phẩm sẽ được thông báo là dương tính hoặc âm tính cùng với chỉ số ngưỡng (COI).
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
- Dung dịch huyết thanh/huyết tương phải đảm bảo, tránh còn lẫn hồng cầu
- Huyết thanh/huyết tương có bọt khí sẽ làm sai lệch kết quả
- Tránh làm thuốc thử có bọt
76. Virus Ab miễn dịch tự động
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Phát hiện kháng thể (Ab) kháng virus trong huyết thanh (huyết tương).
2. Nguyên lý
Dựa trên nguyên lý kết hợp kháng nguyên và kháng thể thực hiện trên hệ thống miễn dịch tự động.
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện: Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: Cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Hệ thống máy miễn dịch tự động
- Bộ lưu điện
- Tủ âm sâu (-20 oC) (nếu có)
- Tủ lạnh
- Micropipette
- Máy ly tâm thường.
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
Định mức sinh phẩm và vật tư tiêu hao cho 5 mẫu/lần thực hiện (VD)
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Ống lấy bệnh phẩm | Cái | 1,000 |
| 2 | Bông | Kg | 0,001 |
| 3 | Dây garô | Cái | 0,001 |
| 4 | Cồn | Ml | 3,000 |
| 5 | Bơm kim tiêm | Cái | 1,000 |
| 6 | Panh | Cái | 0,0001 |
| 7 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 8 | Hộp vận chuyển bệnh phẩm | Test | 0,001 |
| 9 | Tube đựng bệnh phẩm | Cái | 1,000 |
| 10 | Sinh phẩm chẩn đoán | Test | 1,000 |
| 11 | Khấu hao sinh phẩm cho chạy chứng, kiểm tra chất lượng | Test | 0,400 |
| 12 | Chứng ngoại kiểm âm (nếu có) | ml | 0,005 |
| 13 | Chứng ngoại kiểm dương (nếu có) | ml | 0,005 |
| 14 | Control | Test | 0,300 |
| 15 | Ngoại kiểm* |
| 0,020 |
| 16 | Elecsys clean-cell M | ml | 5,000 |
| 17 | Procell M | ml | 5,000 |
| 18 | Probe Wash M | ml | 2,000 |
| 19 | Preclean M | ml | 2,000 |
| 20 | Assay Tip/Cup E170 | Chiếc | 3,000 |
| 21 | ISE Cleaning Solution F. HIT | ml | 0,500 |
| 22 | Nước cất | ml | 5,000 |
| 23 | Sample cup | Chiếc | 3,000 |
| 24 | Giấy thấm | Cuộn | 0,100 |
| 25 | Giấy xét nghiệm | Tờ | 2,000 |
| 26 | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 27 | Bút viết kính | Cái | 0,020 |
| 28 | Bút bi | Cái | 0,010 |
| 29 | Mũ | Cái | 0,020 |
| 30 | Khẩu trang | Cái | 0,020 |
| 31 | Găng tay | Đôi | 0,100 |
| 32 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 33 | Quần áo | Bộ | 0,005 |
| 34 | Dung dịch nước rửa tay | Ml | 8,000 |
| 35 | Cồn sát trùng tay nhanh | Ml | 1,000 |
| 36 | Dung dịch khử trùng | Ml | 10,000 |
| 37 | Khăn lau tay | Cái | 0,010 |
* Ghi chú: Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/50 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 2 lần/1 năm).
3. Bệnh phẩm
Huyết thanh hoặc huyết tương của người bệnh
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu phiếu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
- Theo đúng quy định của chuyên ngành Vi sinh (xem phụ lục 2)
- Từ chối những bệnh phẩm không đạt yêu cầu (xem phụ lục 6).
2. Tiến hành kỹ thuật
Bộ sinh phẩm Elecsys trên hệ thống máy miễn dịch tự động Roche (VD)
| Các bước | Xét nghiệm virus Ab miễn dịch |
| 1 | Vào Reagent để kiểm tra số lượng tests |
| 2 | Vào Calibration → Status để kiểm tra hiệu chuẩn. |
| 3 | Chạy chứng |
| Chạy mẫu không dùng barcode | |
| 1 | Đánh số sample cup theo mã số bệnh phẩm. Hút mẫu và chứng ngoại kiểm (nếu có) vào sample cup tương ứng |
| 2 | Vào màn hình Workplace → Test Selection |
| 3 | Nhập mã bệnh phẩm và ngày thực hiện xét nghiệm |
| 4 | Chọn tên test cần xét nghiệm |
| 5 | Vào Barcode Read Error |
| 6 | Nhập số rack và vị trí mẫu → Add → OK → Save |
| 7 | Đặt mẫu huyết thanh người bệnh Sample Cup lên Rack đúng vị trí đưa vào khu nạp giá mẫu. |
| 8 | Chọn Start → Chọn START ở màn hình Start Conditions |
| Chạy mẫu có barcode | |
| 1 | Nhập chỉ định vào hệ thống LIS |
| 2 | Đưa ống máu dán barcode vào rack vào khu nạp giá mẫu |
| 3 | Chọn Start → Chọn START ở màn hình Start Conditions |
IV. NHẬN ĐỊNH KẾT QUẢ
Kết quả được hiển thị tự động trên máy miễn dịch. Kết quả của mẫu bệnh phẩm sẽ được thông báo là dương tính hoặc âm tính cùng với chỉ số ngưỡng (COI).
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
- Dung dịch huyết thanh/huyết tương phải đảm bảo, tránh còn lẫn hồng cầu
- Huyết thanh có bọt khí sẽ làm sai lệch kết quả.
- Tránh làm thuốc thử có bọt.
77. HBsAg test nhanh
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Phát hiện kháng nguyên HBsAg của virus viêm gan B (HBV) trong huyết thanh (huyết tương).
2. Nguyên lý
Dựa trên nguyên lý của kỹ thuật sắc ký miễn dịch.
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: Cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1.Trang thiết bị
- Micropipette 50 µl -100 µl.
- Máy ly tâm thường.
- Đồng hồ bấm giây
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
Định mức sinh phẩm và vật tư tiêu hao cho 10 mẫu/lần thực hiện (VD)
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Bông | Kg | 0,001 |
| 2 | Dây garô | Cái | 0,001 |
| 3 | Tube đựng bệnh phẩm | Cái | 1,000 |
| 4 | Sinh phẩm chẩn đoán | Test | 1,000 |
| 5 | Khấu hao sinh phẩm cho kiểm tra chất lượng | Test | 0,200 |
| 6 | Ngoại kiểm (nếu có)* |
| 0,020 |
| 7 | Đầu côn 200 µl | Cái | 1,200 |
| 8 | Giấy thấm | Cuộn | 0,100 |
| 9 | Giấy xét nghiệm | Tờ | 2,000 |
| 10 | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 11 | Bút viết kính | Cái | 0,020 |
| 12 | Bút bi | Cái | 0,010 |
| 13 | Mũ | Cái | 0,020 |
| 14 | Khẩu trang | Cái | 0,020 |
| 15 | Găng tay | Đôi | 0,100 |
| 16 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 17 | Quần áo bảo hộ | Bộ | 0,005 |
| 18 | Dung dịch nước rửa tay | Ml | 8,000 |
| 19 | Cồn sát trùng tay nhanh | Ml | 1,000 |
| 20 | Dung dịch khử trùng | Ml | 10,000 |
| 21 | Khăn lau tay | Cái | 0,010 |
* Ghi chú: Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/50 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 2 lần/1 năm).
3. Bệnh phẩm
Huyết thanh hoặc huyết tương của người bệnh.
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu phiếu yêu cầu.
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
- Theo đúng quy định của chuyên ngành Vi sinh (xem phụ lục 2)
- Từ chối những bệnh phẩm không đạt yêu cầu (xem phụ lục 6).
2. Tiến hành kỹ thuật
Bộ sinh phẩm Determine (VD).
| Các bước | Xét nghiệm phát hiện HBsAg nhanh |
| 1 | Tách rời từng thanh xét nghiệm rồi bóc vỏ Ghi mã bệnh phẩm tương ứng |
| 2 | Nhỏ 50 µl huyết thanh hoặc huyết tương vào vùng nhỏ bệnh phẩm |
| 3 | Chờ 15 phút đọc kết quả |
IV. NHẬN ĐỊNH KẾT QUẢ
- Dương tính: Xuất hiện 2 vạch đỏ ở phần chứng và phần bệnh phẩm.
- Âm tính: Chỉ có 1 vạch đỏ ở phần chứng.
- Không xác định:
+ Chỉ có 1 vạch đỏ ở phần bệnh phẩm.
+ Không có vạch đỏ nào xuất hiện ở phần chứng và phần bệnh phẩm.
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
- Thời gian đọc kết quả ® ghi lại thời gian làm xét nghiệm và thời gian đọc kết quả để tránh dương tính giả và âm tính giả.
- Chất lượng bệnh phẩm: những mẫu bệnh phẩm tan huyết sẽ ảnh hưởng đến chất lượng và kết quả xét nghiệm.
78. HBsAg miễn dịch bán tự động
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Phát hiện kháng nguyên HBsAg của virus viêm gan B (HBV) trong huyết thanh (huyết tương).
2. Nguyên lý
Dựa trên nguyên lý của kỹ thuật ELISA (miễn dịch gắn enzym) (VD)
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: Cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1.Trang thiết bị
- Dàn máy ELISA.
- Máy ly tâm thường.
- Tủ âm sâu (-20 oC) (nếu có).
- Tủ lạnh 2 oC - 8 oC
- Micropipette 100 µl, 1000 µl.
- Giá đựng ống máu
- Bộ pipetman 8 kênh (nếu có).
- Ống đong có vạch dung tích 25ml, 100ml, 1000ml
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
Định mức sinh phẩm và vật tư tiêu hao cho 20 mẫu/lần thực hiện (VD)
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Bông | Kg | 0,001 |
| 2 | Dây garô | Cái | 0,001 |
| 3 | Tube đựng bệnh phẩm | Cái | 1,000 |
| 4 | Sinh phẩm chẩn đoán | Test | 1,000 |
| 5 | Khấu hao sinh phẩm cho chạy chứng, kiểm tra chất lượng | Test | 0,200 |
| 6 | Chứng ngoại kiểm âm (nếu có) | ml | 0,005 |
| 7 | Chứng ngoại kiểm dương (nếu có) | ml | 0,005 |
| 8 | Ngoại kiểm (nếu có)* |
| 0,020 |
| 9 | Nước cất | ml | 2,000 |
| 10 | Đầu côn 1000 µl | Cái | 1,000 |
| 11 | Đầu côn 200 µl | Cái | 1,050 |
| 12 | Giấy thấm | Cuộn | 0,100 |
| 13 | Giấy xét nghiệm | Tờ | 2,000 |
| 14 | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 15 | Bút viết kính | Cái | 0,020 |
| 16 | Bút bi | Cái | 0,010 |
| 17 | Mũ | Cái | 0,020 |
| 18 | Khẩu trang | Cái | 0,020 |
| 19 | Găng tay | Đôi | 0,100 |
| 20 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 21 | Quần áo bảo hộ | Bộ | 0,005 |
| 22 | Dung dịch nước rửa tay | ml | 8,000 |
| 23 | Cồn sát trùng tay nhanh | ml | 1,000 |
| 24 | Dung dịch khử trùng | ml | 10,000 |
| 25 | Khăn lau tay | Cái | 0,010 |
* Ghi chú: Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/50 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 2 lần/1 năm).
3. Bệnh phẩm
Huyết thanh hoặc huyết tương của người bệnh
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu phiếu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
- Theo đúng quy định của chuyên ngành Vi sinh (xem phụ lục 2)
- Từ chối những bệnh phẩm không đạt yêu cầu (xem phụ lục 6).
2. Tiến hành kỹ thuật
Bộ sinh phẩm MONOLISA HBsAg UlTra Bio-Rad (VD)
| Các bước | Xét nghiệm định tính HBsAg |
| 1 | Chuẩn bị sinh phẩm, sơ đồ nhỏ mẫu |
| 2 | Chuẩn bị dung dịch rửa pha loãng. Chuẩn bị dung dịch cộng hợp Chuẩn bị số giếng cần dùng. |
| 3 | Nhỏ chứng và bệnh phẩm theo thứ tự hướng dẫn |
| 4 | Nhỏ dung dịch cộng hợp vào các giếng |
| 5 | Đậy tấm và ủ nhiệt theo quy trình hướng dẫn của nhà sản xuất. |
| 6 | Rửa phiến phản ứng và làm khô |
| 7 | Pha dung dịch cơ chất TMB và nhỏ vào mỗi giếng. |
| 8 | Để ở nhiệt độ phòng (18 oC - 30 oC) tránh ánh sáng theo quy trình hướng dẫn của nhà sản xuất. |
| 9 | Dừng phản ứng |
| 10 | Đọc kết quả ở bước sóng 450 và 620 nm bằng máy đo mật độ quang. |
IV. NHẬN ĐỊNH KẾT QUẢ
1. Điều kiện
- NC: Độ hấp phụ của chứng âm (R3).
- PC: Độ hấp phụ của chứng dương.
- CO: Giá trị ngưỡng.
- NCx: Giá trị trung bình của chứng âm.
- NC ≤ 0,08.
- PC ≥ 1,000.
- NCx = R3 OD / 4.
- Loại chứng âm NC > 0,08 hoặc NC > 40% NCx. Chỉ được loại 1 chứng âm và tiếp tục tính kết quả theo 3 chứng âm còn lại.
2. Nhận định, trả lời kết quả
| Tỉ lệ = | OD mẫu | CO = NCx + 0,05 |
| Giá trị ngưỡng |
|
Kết quả
Giá trị ngưỡng
- Mẫu huyết thanh có giá trị tỉ lệ < 1 được coi là âm tính.
- Mẫu huyết thanh có giá trị tỉ lệ ≥ 1 được làm lại. Nếu lần xét nghiệm thứ 2 giá trị tỉ lệ ≥ 1. Mẫu huyết thanh coi là dương tính.
- Mẫu huyết thanh có 0,9 < tỉ lệ < 1. xét nghiệm lại 2 lần:
+ Giá trị tỉ lệ xét nghiệm lặp lại ≥ 1: mẫu được coi là dương tính.
+ Giá trị tỉ lệ xét nghiệm lặp lại có 0,9 < tỉ lệ < 1: nên xét nghiệm lại cho người bệnh bằng phương pháp khác hoặc yêu cầu lấy lại bệnh phẩm.
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
1. Sai sót
Có thể xảy ra hiện tượng âm tính giả hoặc dương tính giả, thông thường do:
- Thực hiện sai các bước trong quy trình hướng dẫn.
- Chứng âm và những mẫu bệnh phẩm âm tính bị nhiễm chéo bởi huyết thanh/ huyết tương có nồng độ kháng thể cao.
- Dung dịch cơ chất bị nhiễm bởi các tác nhân oxy hoá (thuốc tẩy, ion kim loại v.v…)
- Dung dịch dừng phản ứng bị nhiễm bẩn.
2. Xử trí
- Tuân thủ đúng các bước quy trình hướng dẫn của nhà sản xuất và hướng dẫn về độ ổn định hóa chất xét nghiệm trong bộ sinh phẩm sử dụng.
- Kiểm tra và vệ sinh máy rửa thường xuyên trước và sau khi làm xét nghiệm
- Chia hóa chất (chất cộng hợp, dung dịch hiện màu và dừng phản ứng) vào ống nghiệm sạch trước mỗi lần nhỏ.
79. HBsAg miễn dịch tự động
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Phát hiện kháng nguyên HBsAg của virus viêm gan B (HBV) trong huyết thanh (huyết tương).
2. Nguyên lý
Dựa trên nguyên lý của kỹ thuật CLIA (miễn dịch hóa phát quang) (VD).
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện: Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: Cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1.Trang thiết bị
- Hệ thống máy miễn dịch tự động.
- Bộ lưu điện
- Máy ly tâm thường.
- Tủ âm sâu (-20 oC) (nếu có).
- Tủ lạnh 2 oC -8 oC
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
Định mức sinh phẩm và vật tư tiêu hao cho 200 mẫu/lần thực hiện (VD).
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Bông | Kg | 0,001 |
| 2 | Dây garô | Cái | 0,001 |
| 3 | Cồn | Ml | 1,000 |
| 4 | Bơm kim tiêm | Cái | 1,000 |
| 5 | Panh | Cái | 0,0001 |
| 6 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 7 | Hộp vận chuyển bệnh phẩm | Cái | 0,001 |
| 8 | Tube đựng bệnh phẩm | Cái | 1,000 |
| 9 | Sinh phẩm chẩn đoán | Test | 1,000 |
| 10 | Khấu hao sinh phẩm cho chạy chuẩn | Test | 0,002 |
| 11 | Khấu hao sinh phẩm cho chạy chứng, kiểm tra chất lượng | Test | 0,010 |
| 12 | Chứng ngoại kiểm âm (nếu có) | ml | 0,005 |
| 13 | Chứng ngoại kiểm dương (nếu có) | ml | 0,005 |
| 14 | Chứng nội kiểm | Test | 0,010 |
| 15 | Ngoại kiểm (nếu có)* |
| 0,020 |
| 16 | Cleancell M | ml | 2,060 |
| 17 | Procell M | ml | 2,060 |
| 18 | Probe Wash M | ml | 2,000 |
| 19 | Preclean M | ml | 2,000 |
| 20 | Assay Tip/Cup E170 | Chiếc | 3,000 |
| 21 | ISE Cleaning Solution F. HIT | ml | 0,500 |
| 22 | Nước cất | ml | 5,000 |
| 23 | Sample cup | Chiếc | 1,000 |
| 24 | Giấy thấm | Cuộn | 0,100 |
| 25 | Giấy xét nghiệm | Tờ | 2,000 |
| 26 | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 27 | Bút viết kính | Cái | 0,020 |
| 28 | Bút bi | Cái | 0,010 |
| 29 | Mũ | Cái | 0,020 |
| 30 | Khẩu trang | Cái | 0,020 |
| 31 | Găng tay | Đôi | 0,100 |
| 32 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 33 | Quần áo bảo hộ | Bộ | 0,005 |
| 34 | Dung dịch nước rửa tay | ml | 8,000 |
| 35 | Cồn sát trùng tay nhanh | ml | 1,000 |
| 36 | Dung dịch khử trùng | ml | 10,000 |
| 37 | Khăn lau tay | Cái | 0,010 |
* Ghi chú: Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/50 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 2 lần/1 năm).
3. Bệnh phẩm
Huyết thanh hoặc huyết tương của người bệnh
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu phiếu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
- Theo đúng quy định của chuyên ngành Vi sinh (xem phụ lục 2)
- Từ chối những bệnh phẩm không đạt yêu cầu (xem phụ lục 6).
2. Tiến hành kỹ thuật
Bộ sinh phẩm Elecsys HBsAg II - Roche (VD)
| Các bước | Xét nghiệm định tính HbsAg |
| 1 | Vào Reagent để kiểm tra số lượng tests |
| 2 | Vào Calibration → Status để kiểm tra hiệu chuẩn. |
| 3 | Chạy chứng |
| Chạy mẫu không dùng barcode | |
| 1 | Đánh số sample cup theo mã số bệnh phẩm. Hút mẫu và chứng, chứng ngoại kiểm (nếu có) vào sample cup tương ứng |
| 2 | Vào màn hình Workplace → Test Selection |
| 3 | Nhập mã bệnh phẩm và ngày thực hiện xét nghiệm |
| 4 | Chọn tên test là HbsAg |
| 5 | Vào Barcode Read Error |
| 6 | Nhập số rack và vị trí mẫu → Add → OK → Save |
| 7 | Đặt mẫu huyết thanh người bệnh Sample Cup lên Rack đúng vị trí đưa vào khu nạp giá mẫu. |
| 8 | Chọn Start → Chọn START ở màn hình Start Conditions |
| Chạy mẫu có barcode | |
| 1 | Nhập chỉ định định vào hệ thống LIS |
| 2 | Đưa ống máu dán barcode vào rack vào khu nạp giá mẫu |
| 3 | Chọn Start → Chọn START ở màn hình Start Conditions |
IV. NHẬN ĐỊNH KẾT QUẢ
1. Đánh giá theo tiêu chuẩn nhà sản xuất
- Chạy kiểm tra chứng 1 và chứng 2 trên tất cả các điện cực dùng để chạy xét nghiệm.
- Giá trị chứng đạt được phải nằm trong khoảng giới hạn xác định.
2. Đánh giá theo tiêu chuẩn phòng xét nghiệm
Chứng nội kiểm, ngoại kiểm (nếu có).
3. Kết quả và báo cáo
- Mẫu huyết thanh: Máy sẽ tự động tính toán giá trị ngưỡng dựa trên số đo của Cal1 và Cal2. Kết quả của mẫu bệnh phẩm sẽ được thông báo là dương tính hoặc âm tính cùng với chỉ số ngưỡng (COI).
Kết quả được diễn giải như sau:
- Nếu COI < 0.90: mẫu bệnh phẩm được coi là âm tính với HBsAg.
- Nếu 0.90 ≤ COI ≤ 1.0: mẫu bệnh phẩm này cần phải kiểm tra lại
- Nếu COI > 1.0:
+ Mẫu bệnh phẩm có COI > 70: được coi là dương tính với HBsAg
+ Mẫu bệnh phẩm có COI < 70: thực hiện lại xét nghiệm với cùng phương pháp hoặc với một phương pháp khác (ELISA)
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
- Máy sẽ báo sample short (bệnh phẩm đông hoặc không đủ). Chú ý ly tâm mẫu thật kỹ ngay từ đầu hoặc hút mẫu ra cup (thực hiện theo đúng yêu cầu của lấy mẫu xét nghiệm Vi sinh)
- Không sử dụng thuốc thử đã quá hạn sử dụng.
- Tránh tạo bọt ở lọ thuốc thử và các loại mẫu (bệnh phẩm, calibration và chứng).
- Tham khảo thêm hướng dẫn của nhà sản xuất.
80. HBsAg khẳng định
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Khẳng định sự hiện diện của kháng nguyên bề mặt của virus viêm gan B (HBsAg) trong mẫu huyết thanh và huyết tương đã có phản ứng dương tính lặp lại khi xét nghiệm bằng các kỹ thuật miễn dịch.
2. Nguyên lý
Khẳng định sự hiện diện của kháng nguyên bề mặt của virus viêm gan B (HBsAg) dựa theo nguyên lý trung hòa kháng thể đặc hiệu.
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: Cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1.Trang thiết bị
- Hệ thống máy miễn dịch tự động hoặc bán tự động.
- Máy ly tâm thường.
- Micropipette loại 200 ml và 1000 ml.
- Tủ âm sâu (-20 oC) (nếu có).
- Tủ lạnh 2 oC - 8 oC
2.2.Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
Định mức sinh phẩm và vật tư tiêu hao cho 200 mẫu/lần thực hiện (VD)
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Bông | Kg | 0,001 |
| 2 | Dây garô | Cái | 0,001 |
| 3 | Cồn | ml | 1,000 |
| 4 | Bơm kim tiêm | Cái | 1,000 |
| 5 | Panh | Cái | 0,0001 |
| 6 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 7 | Hộp vận chuyển bệnh phẩm | Cái | 0,001 |
| 8 | Tube đựng bệnh phẩm | Cái | 1,000 |
| 9 | HBsAg 2 Elec | Test | 4,000 |
| 10 | HBsAg Confirmation | Test | 4,000 |
| 11 | Khấu hao sinh phẩm cho chạy chuẩn | Test | 0,002 |
| 12 | Khấu hao sinh phẩm cho chạy chứng, kiểm tra chất lượng | Test | 0,010 |
| 13 | Control | Test | 2,000 |
| 14 | Cleancell M | ml | 8,000 |
| 15 | Procell M | ml | 8,000 |
| 16 | Probe Wash M | ml | 2,000 |
| 17 | Preclean M | ml | 2,000 |
| 18 | Assay Tip/Cup E170 | chiếc | 8,000 |
| 19 | ISE Cleaning Solution F, HIT | ml | 0,500 |
| 20 | Nước cất | Cái | 5,000 |
| 21 | Sample cup | Cuộn | 1,000 |
| 22 | Giấy thấm | Cuộn | 0,100 |
| 23 | Giấy xét nghiệm | Tờ | 2,000 |
| 24 | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 25 | Bút viết kính | Cái | 0,020 |
| 26 | Bút bi | Cái | 0,010 |
| 27 | Mũ | Cái | 0,020 |
| 28 | Khẩu trang | Cái | 0,020 |
| 29 | Găng tay | Đôi | 0,100 |
| 30 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 31 | Quần áo | Bộ | 0,005 |
| 32 | Dung dịch nước rửa tay | ml | 8,000 |
| 33 | Cồn sát trùng tay nhanh | ml | 1,000 |
| 34 | Dung dịch khử trùng | ml | 10,000 |
| 35 | Khăn lau tay | Cái | 0,010 |
3. Bệnh phẩm
Huyết thanh hoặc huyết tương của người bệnh
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu phiếu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
- Theo đúng quy định của chuyên ngành Vi sinh (xem phụ lục 2)
- Từ chối những bệnh phẩm không đạt yêu cầu (xem phụ lục 6).
2. Tiến hành kỹ thuật
Bộ sinh phẩm Elecsys HBsAg Confirmatory test - Roche (VD)
| Các bước | Xét nghiệm HBsAg khẳng định |
| 1 | Tiền xử lý mẫu: ● Mẫu dương tính có chỉ số ngưỡng < 7.0: 270 mL mẫu + 30 mL thuốc thử khẳng định 270 mL mẫu + 30 mL thuốc thử chứng hoặc ● Mẫu dương tính có chỉ số ngưỡng trong khoảng 7.0 và < 30: 150 mL mẫu + 150 mL thuốc thử khẳng định 150 mL mẫu + 150 mL thuốc thử chứng hoặc ● Mẫu dương tính có chỉ số ngưỡng ≥ 30 Tiền pha loãng mẫu theo tỷ lệ 1:20 với Diluent Universal 150 mL mẫu pha loãng + 150 mL thuốc thử khẳng định 150 mL mẫu pha loãng + 150 mL thuốc thử chứng PreciControl HBsAg II 2, mẫu chứng dương, nên chạy song hành như kiểm tra hiệu năng xét nghiệm: 270 mL PreciControl HBsAg II 2 + 30 mL thuốc thử khẳng định 270 mL PreciControl HBsAg II 2 + 30 mL thuốc thử chứng Ủ hỗn hợp phản ứng: 30-60 phút ở 15-25 °C hoặc qua đêm ở 2-8 °C. |
| 2 | Xét nghiệm Elecsys HBsAg II: theo hướng dẫn của nhà sản xuất |
IV. NHẬN ĐỊNH KẾT QUẢ
1. Đánh giá theo tiêu chuẩn nhà sản xuất
- Chạy kiểm tra chứng 1 và chứng 2 trên tất cả các điện cực dùng để chạy xét nghiệm.
- Giá trị chứng đạt được phải nằm trong khoảng giới hạn xác định.
2. Đánh giá theo tiêu chuẩn phòng xét nghiệm
Chứng nội kiểm, ngoại kiểm HBsAg định tính (nếu có).
3. Kết quả và báo cáo
3.1 Đánh giá hiệu lực xét nghiệm
● Chỉ số ngưỡng của PreciControl HBsAg II 2 trong xét nghiệm với thuốc thử khẳng định phải < 50 % so với chỉ số ngưỡng trong xét nghiệm với thuốc thử chứng:
COI cho xét nghiệm với thuốc thử chứng » 100 %
COI cho xét nghiệm với thuốc thử khẳng định » x %
Nếu x > 50 %, cần kiểm tra điều kiện thực hiện xét nghiệm. Nếu cần thiết, lặp lại xét nghiệm với thuốc thử mới.
m Mẫu được đánh giá là có hiệu lực khi chỉ số ngưỡng của mẫu xử lý với thuốc thử chứng phải ≥ 0.9.
Chỉ số ngưỡng < 0.9 cho biết tỷ lệ pha loãng quá cao. Các mẫu này phải được xét nghiệm lại với mẫu không pha loãng hoặc tỷ lệ pha loãng thấp hơn.
3.2. Đánh giá và biện luận kết quả
● Để khẳng định mẫu có kết quả Dương tính, chỉ số ngưỡng của mẫu với thuốc thử khẳng định phải < 50 % so với chỉ số ngưỡng của mẫu với thuốc thử chứng, và chỉ số ngưỡng này phải ≥ 0.9.
Đánh giá:
COI cho xét nghiệm với thuốc thử chứng =^ 100 %
COI cho xét nghiệm với thuốc thử khẳng định =^ x %
Biện luận:
x > 50 % và COI cho thuốc thử chứng ≥ 0.9 = Âm tính
x > 50 % và COI cho thuốc thử chứng < 0.9 = Không giá trị
x < 50 % và COI cho thuốc thử chứng ≥ 0.9 = Dương tính
x < 50 % và COI cho thuốc thử chứng < 0.9 = Không xác định
Sử dụng thuốc thử mới và đo lại các mẫu có kết quả không giá trị.
Trong trường hợp kết quả vẫn không giá trị, nên xét nghiệm mẫu theo dõi tiếp theo.
Nên đo lặp lại các kết quả không xác định. Trong trường hợp kết quả vẫn không xác định, nên xét nghiệm mẫu theo dõi tiếp theo.
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
- Máy sẽ báo sample short (bệnh phẩm đông hoặc không đủ) →. Chú ý hút mẫu ra cup đủ thể tích (ít nhất 200 ml).
- Không sử dụng thuốc thử đã quá hạn sử dụng.
- Tránh tạo bọt ở lọ thuốc thử và các loại mẫu (bệnh phẩm và chứng).
- Tham khảo thêm hướng dẫn của nhà sản xuất.
81. HBsAg định lượng
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Xác định nồng độ kháng nguyên HBsAg của virus viêm gan B trong huyết thanh (huyết tương).
2. Nguyên lý
Dựa trên nguyên lý của kỹ thuật CLIA (miễn dịch điện hóa phát quang) (VD).
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: Cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Hệ thống máy Cobas e 6000 (VD).
- Bộ lưu điện.
- Micropipette đơn kênh thể tích từ 2 µl đến 200 µl .
- Máy ly tâm thường.
- Tủ âm sâu (-20 oC) (nếu có).
- Tủ lạnh 2 oC - 8 oC
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
Định mức sinh phẩm và vật tư tiêu hao cho 5 mẫu/lần thực hiện (VD)
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Bông | Kg | 0,001 |
| 2 | Dây garô | Cái | 0,001 |
| 3 | Cồn | ml | 1,000 |
| 4 | Bơm kim tiêm | Cái | 1,000 |
| 5 | Panh | Cái | 0,0001 |
| 6 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 7 | Hộp vận chuyển bệnh phẩm | Test | 0,001 |
| 8 | Tube đựng bệnh phẩm | Cái | 1,000 |
| 9 | Sinh phẩm chẩn đoán | Test | 1,000 |
| 10 | Khấu hao sinh phẩm cho chạy chứng, kiểm tra chất lượng | Test | 0,400 |
| 11 | Control | Test | 0,010 |
| 12 | Chứng ngoại kiểm âm (nếu có) | ml | 0,005 |
| 13 | Chứng ngoại kiểm dương (nếu có) | ml | 0,005 |
| 14 | Ngoại kiểm (nếu có)* |
| 0,020 |
| 15 | Diluent Universal | ml | 1,000 |
| 16 | Elecsys clean-cell M | ml | 5,000 |
| 17 | Procell M | ml | 5,000 |
| 18 | Probe Wash M | ml | 2,000 |
| 19 | Preclean M | ml | 2,000 |
| 20 | Assay Tip/Cup E170 | chiếc | 3,000 |
| 21 | ISE Cleaning Solution F. HIT | ml | 0,500 |
| 22 | Nước cất | ml | 5,000 |
| 23 | Sample cup | chiếc | 3,000 |
| 24 | Giấy thấm | Cuộn | 0,100 |
| 25 | Giấy xét nghiệm | Tờ | 2,000 |
| 26 | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 27 | Bút viết kính | Cái | 0,020 |
| 28 | Bút bi | Cái | 0,010 |
| 29 | Mũ | Cái | 0,020 |
| 30 | Khẩu trang | Cái | 0,020 |
| 31 | Găng tay | Đôi | 0,100 |
| 32 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 33 | Quần áo bảo hộ | Bộ | 0,005 |
| 34 | Dung dịch nước rửa tay | ml | 8,000 |
| 35 | Cồn sát trùng tay nhanh | ml | 1,000 |
| 36 | Dung dịch khử trùng | ml | 10,000 |
| 37 | Khăn lau tay | Cái | 0,010 |
* Ghi chú: Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo chương trình ngoại kiểm (EQAS) ) là 1/50 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 2 lần/1 năm).
3. Bệnh phẩm
Huyết thanh hoặc huyết tương
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1.Lấy bệnh phẩm
- Theo đúng quy định của chuyên ngành Vi sinh (xem phụ lục 2)
- Từ chối những bệnh phẩm không đạt yêu cầu (xem phụ lục 6).
2.Tiến hành kỹ thuật
Bộ sinh phẩm Elecsys HBsAg II Quant - Roche (VD)
Độ pha loãng bệnh phẩm đã được cài đặt mặc định là 1:400
| Các bước | Xét nghiệm định lượng HBsAg |
| 1 | Vào Reagent để kiểm tra số lượng tests |
| 2 | Vào Calibration → Status để kiểm tra hiệu chuẩn |
| 3 | Chạy chứng |
| Chạy mẫu không dùng barcode: | |
| 1. | Đánh số sample cup theo mã số bệnh phẩm. Hút huyết thanh/huyết tương, EQC vào sample cup tương ứng |
| 2. | Vào màn hình Workplace → Test Selection |
| 3. | Nhập mã bệnh phẩm |
| 4. | Chọn tên test là HBsAg-Quant |
| 5. | Vào Barcode Read Error |
| 6. | Nhập số rack và vị trí mẫu → Add → OK → Save |
| 7. | Đặt mẫu cần chạy đã được hút vào Sample Cup lên Rack màu xám đúng vị trí đã order rồi đưa vào khu nạp giá mẫu. |
| 8. | Chọn Start → Chọn START ở màn hình Start Conditions |
| Chạy mẫu có barcode: | |
| 1. | Nhập chỉ định xét nghiệm trên máy tính bằng phần mềm LIS |
| 2. | Đặt ống máu đã được dán barcode vào rack màu xám, quay mặt barcode ra phía ngoài rồi đưa vào khu nạp giá mẫu |
| 3. | Chọn Start → Chọn START ở màn hình Start Conditions |
IV. NHẬN ĐỊNH KẾT QUẢ
1. Đánh giá theo tiêu chuẩn nhà sản xuất
- Chạy kiểm tra chứng 1 và chứng 2 trên tất cả các điện cực dùng để chạy xét nghiệm.
- Giá trị chứng đạt được phải nằm trong khoảng giới hạn xác định.
2. Đánh giá theo tiêu chuẩn phòng xét nghiệm
Chứng nội kiểm, ngoại kiểm: Đánh giá kết quả dựa trên biểu đồ Levey-Jenning (nếu có)
3. Kết quả và báo cáo
Kết quả của mẫu bệnh phẩm sẽ được thông báo là một giá trị cụ thể.
3.1. Bệnh phẩm pha loãng 1/400: Dải định lượng là 20 - 52.000 IU/ml.
* Nếu giá trị đo được nằm trong dải định lượng này thì kết quả cuối cùng là kết quả đo được trên máy.
* Nếu giá trị đo được < 20 → chạy lại bệnh phẩm không pha loãng.
* Nếu giá trị đo được > 52.000 → Pha loãng bệnh phẩm 1: 100 và chạy lại xét nghiệm theo các bước chạy mẫu.
3.2. Bệnh phẩm không pha loãng: Dải định lượng là 0,05 - 130 IU/ml.
Ngưỡng phát hiện: 0,05 IU/ml
* Nếu giá trị đo được thấp hơn ngưỡng phát hiện thì máy báo < 0,05 → Xét nghiệm lại HBsAg định tính.
- Nếu HBsAg âm tính → Trả kết quả âm tính
- Nếu HBsAg âm tính → Trả kết quả dưới ngưỡng phát hiện.
* Nếu giá trị đo được lớn hơn dải định lượng thì máy báo > 130 → Trả kết quả > 130 IU/ml
3.3. Bệnh phẩm pha loãng 1: 100
Những mẫu bệnh phẩm ở nồng độ pha loãng 1:400 cho kết quả > 52.000 thì pha loãng bệnh phẩm 1: 100 với dung dịch Dil Hep được cung cấp sẵn trong bộ sinh phẩm (như vậy mẫu đã được pha loãng 40.000 lần) và chạy lại xét nghiệm theo các bước chạy mẫu ở phần II.2.
Kết quả cuối cùng (IU/ml) = giá trị đo được trên máy x 100
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
- Máy báo sample short (do bệnh phẩm bị đông hoặc không đủ) → Chú ý ly tâm mẫu thật kỹ ngay từ đầu hoặc hút mẫu ra cup.
- Không sử dụng thuốc thử đã quá hạn sử dụng.
- Tránh tạo bọt ở lọ thuốc thử và các loại mẫu (bệnh phẩm, calibration và chứng).
82. HBsAb miễn dịch bán tự động
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Phát hiện kháng thể HBsAb trong huyết thanh (huyết tương).
2. Nguyên lý
Dựa trên nguyên lý của kỹ thuật ELISA (miễn dịch gắn enzym) (VD).
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: Cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Dàn máy ELISA.
- Máy ly tâm thường.
- Tủ âm sâu (-20 oC) (nếu có).
- Tủ lạnh 2 oC - 8 oC
- Micropipette vi lượng 100, 1000 µl.
- Giá đựng ống máu
- Bộ pipetman 8 kênh (nếu có).
- Ống đong có vạch dung tích 25ml, 100ml, 1000ml
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
Định mức sinh phẩm và vật tư tiêu hao cho 3 mẫu/lần thực hiện (VD)
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Bông | Kg | 0,001 |
| 2 | Dây garô | Cái | 0,001 |
| 3 | Tube đựng bệnh phẩm | Cái | 1,000 |
| 4 | Sinh phẩm chẩn đoán | Test | 1,000 |
| 5 | Khấu hao sinh phẩm cho chạy chứng, kiểm tra chất lượng | Test | 1,600 |
| 6 | Chứng ngoại kiểm âm (nếu có) | ml | 0,033 |
| 7 | Chứng ngoại kiểm dương (nếu có) | ml | 0,033 |
| 8 | Ngoại kiểm (nếu có)* |
| 0,020 |
| 9 | Nước cất | ml | 2,000 |
| 10 | Đầu côn 1000 µl | Cái | 1,000 |
| 11 | Đầu côn 200 µl | Cái | 3,000 |
| 12 | Giấy thấm | Cuộn | 0,100 |
| 13 | Giấy xét nghiệm | Tờ | 2,000 |
| 14 | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 15 | Bút viết kính | Cái | 0,020 |
| 16 | Bút bi | Cái | 0,010 |
| 17 | Mũ | Cái | 0,020 |
| 18 | Khẩu trang | Cái | 0,020 |
| 19 | Găng tay | Đôi | 0,100 |
| 20 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 21 | Quần áo bảo hộ | Bộ | 0,005 |
| 22 | Dung dịch nước rửa tay | ml | 8,000 |
| 23 | Cồn sát trùng tay nhanh | ml | 1,000 |
| 24 | Dung dịch khử trùng | ml | 10,000 |
| 25 | Khăn lau tay | Cái | 0,010 |
* Ghi chú: Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) ) là 1/50 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 2 lần/1 năm).
3. Bệnh phẩm
Huyết thanh hoặc huyết tương người.
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu phiếu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
- Theo đúng quy định của chuyên ngành Vi sinh (xem phụ lục 2)
- Từ chối những bệnh phẩm không đạt yêu cầu (xem phụ lục 6).
2. Tiến hành kỹ thuật
Bộ sinh phẩm MONOLISA Anti - HBs PLUS Bio-Rad (VD)
| Các bước | Xét nghiệm xác định Anti HBs |
| 1 | Chuẩn bị sinh phẩm, tấm phản ứng, sơ đồ nhỏ mẫu |
| 2 | Nhỏ dung dịch loãng bệnh phẩm vào mỗi giếng. |
| 3 | Nhỏ chứng và bệnh phẩm, theo thứ tự hướng dẫn |
| 4 | Đậy tấm và ủ nhiệt theo quy trình hướng dẫn của nhà sản xuất. |
| 5 | Chuẩn bị dung dịch rửa. Rửa tấm phản ứng bằng chương trình theo quy trình hướng dẫn của nhà sản xuất |
| 6 | Nhỏ dung dịch cộng hợp vào các giếng |
| 7 | Đậy tấm và ủ nhiệt theo quy trình hướng dẫn của nhà sản xuất. |
| 8 | Rửa tấm phản ứng bằng chương trình theo quy trình hướng dẫn của nhà sản xuất |
| 9 | Pha dung dịch cơ chất và nhỏ vào mỗi giếng. Để ở nhiệt độ phòng (18 oC - 30 oC) tránh ánh sáng theo hướng dẫn của nhà sản xuất. |
| 10 | Dừng phản ứng |
| 11 | Đọc kết quả ở bước sóng 450/620 -700 nm bằng máy đo mật độ quang. |
IV. NHẬN ĐỊNH KẾT QUẢ
1. Điều kiện
- Giá trị trung bình của Calibrator 10 mIU/ml (C1) là giá trị ngưỡng của phản ứng (Cut-off ).
- Độ hấp phụ của chứng âm phải 0,000<ODCO≤ 0,070.
- Độ hấp phụ của chứng dương C2 phải ODCO ≥0,400.
- Nếu một trong các giá trị của chứng âm hoặc chứng dương ở ngoài khoảng cho phép thì phản ứng không có giá trị và phải làm lại.
- Độ hấp phụ của Calibrator 10 mIU/ml phải 0,050≤ ODC1≤ 0,200 và ODC1≥ (1,5x ODCO).
Nếu một trong hai giá trị của Calibrator 10 mIU/ml (C1) ODC1 ở ngoài khoảng cho phép thì phản ứng không có giá trị và phải làm lại.
2. Kết quả và biện luận
Sự có mặt hay không có mặt của anti-HBs được xác định bằng cách đo so sánh mật độ quang của mỗi mẫu thử với giá trị ngưỡng.
- Kết quả âm tính: Mẫu thử có OD < C.O được coi như âm tính với MONOLISA Anti-HBs PLUS.
- Kết quả dương tính: Mẫu thử có OD ³ C.O được coi như dương tính với MONOLISA Anti-HBs PLUS.
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
1. Sai sót
Có thể xảy ra hiện tượng âm tính giả hoặc dương tính giả, thông thường do:
- Thực hiện sai các bước trong quy trình hướng dẫn.
- Chứng âm và những mẫu bệnh phẩm âm tính bị nhiễm chéo bởi huyết thanh/ huyết tương có nồng độ kháng thể cao.
- Cơ chất bị nhiễm bởi các tác nhân oxy hoá (thuốc tẩy, ion kim loại v.v…)
- Dung dịch dừng phản ứng bị nhiễm bẩn.
2. Xử trí
- Tuân thủ đúng các bước quy trình hướng dẫn của nhà sản xuất và hướng dẫn về độ ổn định hóa chất xét nghiệm trong bộ sinh phẩm sử dụng.
- Kiểm tra và vệ sinh máy rửa thường xuyên trước và sau khi làm xét nghiệm
- Chia hóa chất (chất cộng hợp, dung dịch hiện màu và dừng phản ứng) vào ống nghiệm sạch trước mỗi lần nhỏ.
83. HBsAb định lượng
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Định lượng kháng thể HBsAb trong huyết thanh (huyết tương).
2. Nguyên lý
Dựa trên nguyên lý của kỹ thuật CLIA (miễn dịch điện hóa phát quang). (VD)
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện: Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: Cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1.Trang thiết bị
- Hệ thống máy miễn dịch tự động.
- Bộ lưu điện.
- Máy ly tâm thường.
- Tủ âm sâu (-20 oC) (nếu có).
- Tủ lạnh 2 oC - 8 oC
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
Định mức sinh phẩm và vật tư tiêu hao cho 10 mẫu/lần thực hiện (VD)
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Bông | Kg | 0,001 |
| 2 | Dây garô | Cái | 0,001 |
| 3 | Cồn | ml | 1,000 |
| 4 | Bơm kim tiêm | Cái | 1,000 |
| 5 | Panh | Cái | 0,0001 |
| 6 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 7 | Hộp vận chuyển bệnh phẩm | Cái | 0,001 |
| 8 | Tube đựng bệnh phẩm | Cái | 1,000 |
| 9 | Sinh phẩm chẩn đoán | Test | 1,000 |
| 10 | Khấu hao sinh phẩm cho chạy chứng, kiểm tra chất lượng | Test | 0,200 |
| 11 | Chứng ngoại kiểm âm (nếu có) | ml | 0,005 |
| 12 | Chứng ngoại kiểm dương (nếu có) | ml | 0,005 |
| 13 | Chứng nội kiểm | Test | 0,300 |
| 14 | Ngoại kiểm (nếu có)* |
| 0,020 |
| 15 | Elecsys clean-cell M | ml | 5,000 |
| 16 | Procell M | ml | 5,000 |
| 17 | Probe Wash M | ml | 2,000 |
| 18 | Preclean M | ml | 2,000 |
| 19 | Assay Tip/Cup E170 | Chiếc | 3,000 |
| 20 | ISE Cleaning Solution F. HIT | ml | 0,500 |
| 21 | Nước cất | ml | 5,000 |
| 22 | Sample cup | Chiếc | 3,000 |
| 23 | Giấy thấm | Cuộn | 0,100 |
| 24 | Giấy xét nghiệm | Tờ | 2,000 |
| 25 | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 26 | Bút viết kính | Cái | 0,020 |
| 27 | Bút bi | Cái | 0,010 |
| 28 | Mũ | Cái | 0,020 |
| 29 | Khẩu trang | Cái | 0,020 |
| 30 | Găng tay | Đôi | 0,100 |
| 31 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 32 | Quần áo bảo hộ | Bộ | 0,005 |
| 33 | Dung dịch nước rửa tay | ml | 8,000 |
| 34 | Cồn sát trùng tay nhanh | ml | 1,000 |
| 35 | Dung dịch khử trùng | ml | 10,000 |
| 36 | Khăn lau tay | Cái | 0,010 |
* Ghi chú: Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) ) là 1/50 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 2 lần/1 năm).
3. Bệnh phẩm
Huyết thanh hoặc huyết tương người.
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu phiếu yêu cầu.
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
- Theo đúng quy định của chuyên ngành Vi sinh (xem phụ lục 2)
- Từ chối những bệnh phẩm không đạt yêu cầu (xem phụ lục 6).
2. Tiến hành kỹ thuật
Bộ sinh phẩm Anti-HBs Elecsys - Roche (VD).
| Các bước | Xét nghiệm định lượng HBsAb |
| 1 | Vào Reagent để kiểm tra số lượng tests |
| 2 | Vào Calibration → Status để kiểm tra hiệu chuẩn. |
| 3 | Chạy chứng |
| Chạy mẫu không dùng barcode | |
| 1 | Đánh số sample cup theo mã số bệnh phẩm. Hút mẫu và chứng vào sample cup tương ứng |
| 2 | Vào màn hình Workplace → Test Selection |
| 3 | Nhập mã bệnh phẩm và ngày thực hiện xét nghiệm |
| 4 | Chọn tên test là anti - HBs |
| 5 | Vào Barcode Read Error |
| 6 | Nhập số rack và vị trí mẫu → Add → OK → Save |
| 7 | Đặt mẫu huyết thanh người bệnh Sample Cup lên Rack đúng vị trí đưa vào khu nạp giá mẫu. |
| 8 | Chọn Start → Chọn START ở màn hình Start Conditions |
| Chạy mẫu có barcode | |
| 1 | Nhập chỉ định định vào hệ thống LIS |
| 2 | Đưa ống máu dán barcode vào rack vào khu nạp giá mẫu |
| 3 | Chọn Start → Chọn START ở màn hình Start Conditions |
IV. NHẬN ĐỊNH KẾT QUẢ
1. Kiểm tra chất lượng
- Chạy kiểm tra chứng 1 và chứng 2.
- Giá trị chứng đạt được phải nằm trong khoảng giới hạn xác định. Giá trị chứng đạt được phải nằm trong khoảng giới hạn xác định. Giới hạn này được qui định trong bộ chứng và trong mỗi lô hóa chất Anti HBs khác nhau có thể có sự thay đổi về giới hạn chứng.
2.Kết quả và báo cáo
Máy sẽ tự động tính toán nồng độ phân tích của mỗi mẫu bệnh phẩm theo đơn vị IU/l. Dải đo được giới hạn từ 2.00 - 1000 IU/l (được xác định bằng giới hạn thấp nhất và giới hạn cao nhất của đường cong chuẩn)
Nhận định kết quả
- Những mẫu có nồng độ < 10 IU/l: mẫu bệnh phẩm được coi là âm tính với anti-HBs.
- Những mẫu có nồng độ ≥ 10 IU/l: mẫu bệnh phẩm được coi là dương tính với anti-HBs.
- Những mẫu có giá trị ≥1000 IU/l thì có thể pha loãng với dung dịch pha loãng bệnh phẩm (Elecsys Diluent Universal) theo tỷ lệ 1:100. Kết quả định lượng anti-HBs sau khi đã pha loãng phải > 10 IU/l.
+ Nếu pha loãng bằng tay thì tính kết quả bằng cách nhân kết quả hiển thị trên máy với độ pha loãng.
+ Nếu pha loãng tự động bằng máy thì máy sẽ tự động tính toán kết quả bằng phần mềm đã có sẵn
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
- Máy sẽ báo sample short (bệnh phẩm đông hoặc không đủ). Chú ý ly tâm mẫu thật kỹ ngay từ đầu hoặc hút mẫu ra cup (thực hiện theo đúng yêu cầu của lấy mẫu xét nghiệm Vi sinh)
- Không sử dụng thuốc thử đã quá hạn sử dụng.
- Tránh tạo bọt ở lọ thuốc thử và các loại mẫu (bệnh phẩm, calibration và chứng).
- Tham khảo thêm hướng dẫn của nhà sản xuất.
84. HBc IgM miễn dịch bán tự động
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Phát hiện kháng thể HBc-IgM trong huyết thanh (huyết tương).
2. Nguyên lý
Dựa trên nguyên lý của kỹ thuật ELISA (miễn dịch gắn enzym) (VD).
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: Cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1.Trang thiết bị
- Dàn máy ELISA.
- Máy ly tâm thường.
- Tủ âm sâu (-20 oC) (nếu có).
- Tủ lạnh 2 oC - 8 oC
- Micropipette 100 µl, 1000 µl.
- Giá đựng ống máu
- Bộ pipetman 8 kênh (nếu có).
- Ống đong có vạch dung tích 25ml, 100ml, 1000ml
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
Định mức sinh phẩm và vật tư tiêu hao cho 3 mẫu/lần thực hiện (VD)
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Bông | Kg | 0,001 |
| 2 | Dây garô | Cái | 0,001 |
| 3 | Tube đựng bệnh phẩm | Cái | 1,000 |
| 4 | Sinh phẩm chẩn đoán | Test | 1,000 |
| 5 | Khấu hao sinh phẩm cho chạy chứng, kiểm tra chất lượng | Test | 1,600 |
| 6 | Chứng ngoại kiểm âm (nếu có) | ml | 0,033 |
| 7 | Chứng ngoại kiểm dương (nếu có) | ml | 0,033 |
| 8 | Ngoại kiểm (nếu có)* |
| 0,020 |
| 9 | Nước cất | ml | 2,000 |
| 10 | Đầu côn 1000 µl | Cái | 1,000 |
| 11 | Đầu côn 200 µl | Cái | 3,000 |
| 12 | Giấy thấm | Cuộn | 0,100 |
| 13 | Giấy xét nghiệm | Tờ | 2,000 |
| 14 | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 15 | Bút viết kính | Cái | 0,020 |
| 16 | Bút bi | Cái | 0,010 |
| 17 | Mũ | Cái | 0,020 |
| 18 | Khẩu trang | Cái | 0,020 |
| 19 | Găng tay | Đôi | 0,100 |
| 20 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 21 | Quần áo bảo hộ | Bộ | 0,005 |
| 22 | Dung dịch nước rửa tay | ml | 8,000 |
| 23 | Cồn sát trùng tay nhanh | ml | 1,000 |
| 24 | Dung dịch khử trùng | ml | 10,000 |
| 25 | Khăn lau tay | Cái | 0,010 |
* Ghi chú: Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) ) là 1/50 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 2 lần/1 năm).
3. Bệnh phẩm
Huyết thanh hoặc huyết tương của người bệnh.
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu phiếu yêu cầu.
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
- Theo đúng quy định của chuyên ngành Vi sinh (xem phụ lục 2)
- Từ chối những bệnh phẩm không đạt yêu cầu (xem phụ lục 6).
2. Tiến hành kỹ thuật
Bộ sinh phẩm MONOLISA Anti - HBc IgM PLUS Bio-Rad (VD)
| Các bước | Xét nghiệm định tính HBc IgM |
| 1. | Chuẩn bị sinh phẩm, sơ đồ nhỏ mẫu Chuẩn bị dung dịch rửa |
| 2. | Pha loãng bệnh phẩm trong dung dịch pha loãng bệnh phẩm theo quy trình hướng dẫn của nhà sản xuất. |
| 3. | Rửa giếng phản ứng theo hướng dẫn quy trình |
| 4. | Nhỏ chứng và bệnh phẩm theo thứ tự hướng dẫn |
| 5. | Ủ khay phản ứng trong thời gian và nhiệt độ theo hướng dẫn. |
| 6. | Rửa khay phản ứng bằng chương trình theo quy trình hướng dẫn của nhà sản xuất |
| 7. | Chuẩn bị dung dịch cộng hợp Nhỏ dung dịch cộng hợp vào các giếng |
| 8. | Ủ tấm phản ứng ở nhiệt độ thích hợp trong thời gian quy định theo hướng dẫn của nhà sản xuất. |
| 9. | Rửa khay phản ứng bằng chương trình theo quy trình hướng dẫn của nhà sản xuất |
| 10. | Pha dung dịch cơ chất và nhỏ vào mỗi giếng. Để ở nhiệt độ phòng (18 oC - 30 oC) và tránh ánh sáng theo hướng dẫn. |
| 11. | Dừng phản ứng |
| 12. | Đọc KQ ở bước sóng 450/620 -700 nm bằng máy đo mật độ quang. |
IV. NHẬN ĐỊNH KẾT QUẢ
1. Điều kiện
- Giá trị trung bình chứng dương phải ³ 0.400.
- Nếu một giá trị của chứng dương nằm ngoài giới hạn này hoặc sai khác trên 25 % giá trị trung bình, cần phải tính lại lần nữa với hai giá trị chứng dương còn lại.
- Giá trị trung bình chứng âm phải £ 0.100.
2. Kết quả và báo cáo
- Tính giá trị trung bình của chứng âm (OD R3):
![]() = Tổng của OD R3/3
= Tổng của OD R3/3
- Tính giá trị trung bình của chứng dương (![]() ):
):
![]() = Tổng của OD R4/3
= Tổng của OD R4/3
- Tính giá trị ngưỡng (CO)
CO = ![]() + (
+ (![]() /7)
/7)
- Giá trị của thử nghiệm:
Tính tỉ số mẫu:
Tỉ số mẫu = OD mẫu/CO
Giải thích kết quả
- Các mẫu có tỉ số mẫu nhỏ hơn 1 được coi là âm tính với anti-HBc IgM.
- Các mẫu có tỉ số mẫu ³ 1 được coi là dương tính với anti-HBc IgM.
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
1. Sai sót
Có thể xảy ra hiện tượng âm tính giả hoặc dương tính giả, thông thường do:
- Thực hiện sai các bước trong quy trình hướng dẫn.
- Chứng âm và những mẫu bệnh phẩm âm tính bị nhiễm chéo bởi huyết thanh/ huyết tương có nồng độ kháng thể cao.
- Cơ chất bị nhiễm bởi các tác nhân oxy hoá (thuốc tẩy, ion kim loại v.v…)
- Dung dịch dừng phản ứng bị nhiễm bẩn.
2. Xử trí
- Tuân thủ đúng các bước quy trình hướng dẫn của nhà sản xuất và hướng dẫn về độ ổn định hóa chất xét nghiệm trong bộ sinh phẩm sử dụng.
- Kiểm tra và vệ sinh máy rửa thường xuyên trước và sau khi làm xét nghiệm
- Chia hóa chất (chất cộng hợp, dung dịch hiện màu và dừng phản ứng) vào ống nghiệm sạch trước mỗi lần nhỏ.
85. HBc IgM miễn dịch tự động
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Phát Phát hiện kháng thể HBc-IgM trong huyết thanh (huyết tương).
2. Nguyên lý
Dựa trên nguyên lý của kỹ thuật CLIA (miễn dịch điện hóa phát quang) (VD).
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện: Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: Cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Hệ thống máy miễn dịch tự động.
- Bộ lưu điện.
- Máy ly tâm thường.
- Tủ âm sâu (-20 oC) (nếu có).
- Tủ lạnh 2 oC - 8 oC
- Micropipette thể tích 50 µl - 200 µl
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
Định mức sinh phẩm và vật tư tiêu hao cho 5 mẫu/lần thực hiện (VD)
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Bông | Kg | 0,001 |
| 2 | Dây garô | Cái | 0,001 |
| 3 | Cồn | ml | 1,000 |
| 4 | Bơm kim tiêm | Cái | 1,000 |
| 5 | Panh | Cái | 0,0001 |
| 6 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 7 | Hộp vận chuyển bệnh phẩm | Test | 0,001 |
| 8 | Tube đựng bệnh phẩm | Cái | 1,000 |
| 9 | Sinh phẩm chẩn đoán | Test | 1,000 |
| 10 | Khấu hao sinh phẩm cho chạy chuẩn | Test | 0,100 |
| 11 | Khấu hao sinh phẩm cho chạy chứng, kiểm tra chất lượng | Test | 0,400 |
| 12 | Chứng ngoại kiểm âm (nếu có) | ml | 0,005 |
| 13 | Chứng ngoại kiểm dương (nếu có) | ml | 0,005 |
| 14 | Chứng nội kiểm | Test | 0,400 |
| 15 | Ngoại kiểm (nếu có)* | ml | 0,020 |
| 16 | Cleancell M | ml | 3,000 |
| 17 | Procell M | ml | 3,000 |
| 18 | Probe Wash M | ml | 2,000 |
| 19 | Preclean M | ml | 2,000 |
| 20 | Assay Tip/Cup E170 | chiếc | 3,000 |
| 21 | ISE Cleaning Solution F. HIT | ml | 0,500 |
| 22 | Nước cất | ml | 5,000 |
| 23 | Sample cup | chiếc | 1,000 |
| 24 | Giấy thấm | Cuộn | 0,100 |
| 25 | Giấy xét nghiệm | Tờ | 2,000 |
| 26 | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 27 | Bút viết kính | Cái | 0,020 |
| 28 | Bút bi | Cái | 0,010 |
| 29 | Mũ | Cái | 0,020 |
| 30 | Khẩu trang | Cái | 0,020 |
| 31 | Găng tay | Đôi | 0,100 |
| 32 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 33 | Quần áo bảo hộ | Bộ | 0,005 |
| 34 | Dung dịch nước rửa tay | ml | 8,000 |
| 35 | Cồn sát trùng tay nhanh | ml | 1,000 |
| 36 | Dung dịch khử trùng | ml | 10,000 |
| 37 | Khăn lau tay | Cái | 0,010 |
* Ghi chú: Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) ) là 1/50 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 2 lần/1 năm).
3. Bệnh phẩm
Huyết thanh hoặc huyết tương của người bệnh
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu phiếu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
- Theo đúng quy định của chuyên ngành Vi sinh (xem phụ lục 2)
- Từ chối những bệnh phẩm không đạt yêu cầu (xem phụ lục 6).
2. Tiến hành kỹ thuật
Bộ sinh phẩm Elecsys Anti-HBc IgM - Roche (VD)
| Các bước | Xét nghiệm định tính Anti-HBc IgM |
| 1 | Vào Reagent để kiểm tra số lượng tests |
| 2 | Vào Calibration → Status để kiểm tra hiệu chuẩn. |
| 3 | Chạy chứng |
| Chạy mẫu không dùng barcode | |
| 1 | Đánh số sample cup theo mã số bệnh phẩm. Hút mẫu và chứng ngoại kiểm (nếu có) vào sample cup tương ứng |
| 2 | Vào màn hình Workplace → Test Selection |
| 3 | Nhập mã bệnh phẩm và ngày thực hiện xét nghiệm |
| 4 | Chọn tên test là anti-HBc IgM |
| 5 | Vào Barcode Read Error |
| 6 | Nhập số rack và vị trí mẫu → Add → OK → Save |
| 7 | Đặt mẫu huyết thanh người bệnh Sample Cup lên Rack đúng vị trí đưa vào khu nạp giá mẫu. |
| 8 | Chọn Start → Chọn START ở màn hình Start Conditions |
| Chạy mẫu có barcode | |
| 1 | Nhập chỉ định vào hệ thống LIS |
| 2 | Đưa ống máu dán barcode vào rack vào khu nạp giá mẫu |
| 3 | Chọn Start → Chọn START ở màn hình Start Conditions |
IV. NHẬN ĐỊNH KẾT QUẢ
1. Đánh giá theo tiêu chuẩn nhà sản xuất
- Chạy kiểm tra chứng 1 và chứng 2. Giá trị chứng đạt được phải nằm trong khoảng giới hạn xác định. Giới hạn này được qui định trong bộ chứng và trong mỗi lô hóa chất Anti-HBc IgM khác nhau có thể có sự thay đổi về giới hạn chứng
2. Đánh giá theo tiêu chuẩn phòng xét nghiệm
Chứng nội kiểm, ngoại kiểm (nếu có).
3. Kết quả và báo cáo
Máy sẽ tự động tính toán giá trị ngưỡng dựa trên số đo của Cal1 và Cal2. Kết quả của mẫu bệnh phẩm sẽ được thông báo là dương tính hoặc âm tính cùng với chỉ số ngưỡng (COI).
- Nếu COI ≥ 1.0: mẫu bệnh phẩm được coi là dương tính với Anti-HBc IgM.
- Nếu COI < 1.0: mẫu bệnh phẩm được coi là âm tính với Anti-HBc IgM.
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
- Máy sẽ báo sample short (bệnh phẩm đông hoặc không đủ) → Chú ý ly tâm mẫu thật kỹ ngay từ đầu hoặc hút mẫu ra cup (thực hiện theo đúng yêu cầu của lấy mẫu xét nghiệm Vi sinh).
- Không sử dụng thuốc thử đã quá hạn sử dụng.
- Tránh tạo bọt ở lọ thuốc thử và các loại mẫu (bệnh phẩm, calibration và chứng).
- Tham khảo thêm hướng dẫn của nhà sản xuất.
86. HBc total miễn dịch bán tự động
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Phát hiện kháng thể tống số HBc Ab total kháng HBcAg trong huyết thanh (huyết tương).
2. Nguyên lý
Dựa trên nguyên lý của kỹ thuật ELISA (miễn dịch gắn enzym) (VD).
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: Cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1.Trang thiết bị
- Dàn máy ELISA.
- Máy ly tâm thường.
- Tủ âm sâu (-20 oC) (nếu có).
- Tủ lạnh 2 oC - 8 oC
- Micropipette 100 µl, 1000 µl.
- Giá đựng ống máu
- Bộ pipetman 8 kênh (nếu có).
- Ống đong có vạch dung tích 25ml, 100ml, 1000ml
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
Định mức sinh phẩm và vật tư tiêu hao cho 3 mẫu/lần thực hiện (VD)
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Bông | Kg | 0,001 |
| 2 | Dây garô | Cái | 0,001 |
| 3 | Tube đựng bệnh phẩm | Cái | 1,000 |
| 4 | Sinh phẩm chẩn đoán | Test | 1,000 |
| 5 | Khấu hao sinh phẩm cho chạy chứng, kiểm tra chất lượng | Test | 1,600 |
| 6 | Chứng ngoại kiểm âm (nếu có) | ml | 0,033 |
| 7 | Chứng ngoại kiểm dương (nếu có) | ml | 0,033 |
| 8 | Ngoại kiểm (nếu có)* |
| 0,020 |
| 9 | Nước cất | ml | 2,000 |
| 10 | Đầu côn 1000 µl | Cái | 1,000 |
| 11 | Đầu côn 200 µl | Cái | 3,000 |
| 12 | Giấy thấm | Cuộn | 0,100 |
| 13 | Giấy xét nghiệm | Tờ | 2,000 |
| 14 | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 15 | Bút viết kính | Cái | 0,020 |
| 16 | Bút bi | Cái | 0,010 |
| 17 | Mũ | Cái | 0,020 |
| 18 | Khẩu trang | Cái | 0,020 |
| 19 | Găng tay | Đôi | 0,100 |
| 20 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 21 | Quần áo bảo hộ | Bộ | 0,005 |
| 22 | Dung dịch nước rửa tay | ml | 8,000 |
| 23 | Cồn sát trùng tay nhanh | ml | 1,000 |
| 24 | Dung dịch khử trùng | ml | 10,000 |
| 25 | Khăn lau tay | Cái | 0,010 |
* Ghi chú: Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) ) là 1/50 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 2 lần/1 năm).
3. Bệnh phẩm: Huyết thanh hoặc huyết tương của người bệnh
4. Phiếu xét nghiệm: Điền đầy đủ thông tin theo mẫu phiếu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
- Theo đúng quy định của chuyên ngành Vi sinh (xem phụ lục 2)
- Từ chối những bệnh phẩm không đạt yêu cầu (xem phụ lục 6).
2. Tiến hành kỹ thuật
Bộ sinh phẩm MONOLISA Anti - HBc Total PLUS Bio-Rad (VD)
| Các bước | Xét nghiệm định tính Anti HBc Total |
| 1 | Chuẩn bị sinh phẩm, sơ đồ nhỏ mẫu |
| 2 | Nhỏ dung dịch pha loãng |
| 3 | Nhỏ chứng và bệnh phẩm theo thứ tự hướng dẫn |
| 4 | Ủ khay nhựa theo quy trình hướng dẫn của nhà sản xuất. |
| 5 | Rửa khay phản ứng bằngchương trình theo quy trình hướng dẫn của nhà sản xuất |
| 6 | Nhỏ dung dịch cộng hợp vào các giếng |
| 7 | Ủ khayphản ứng ở nhiệt độ phòng theo hướng dẫn. |
| 8 | Rửa khay phản ứng và làm khô. |
| 9 | Pha dung dịch cơ chất và nhỏ vào mỗi giếng. Để ở nhiệt độ phòng (18 oC - 30 oC) và tránh ánh sáng theo hướng dẫn. |
| 10 | Dừng phản ứng |
| 11 | Đọc KQ ở bước sóng 450/620 -700 nm bằng máy đo mật độ quang. |
IV. NHẬN ĐỊNH KẾT QUẢ
1. Điều kiện
- Đối với chứng âm: mỗi giá trị hấp thụ đơn phải nhỏ hơn 0.100.
- Đối với chứng dương:
+ Mỗi giá trị hấp thụ phải lớn hơn hoặc bằng 1.000 và nhỏ hơn hoặc bằng 2.400.
+ Nếu một giá trị của chứng dương nằm ngoài giới hạn này hoặc sai khác trên 30% giá trị trung bình, cần phải tính lại lần nữa với hai giá trị chứng dương còn lại.
Xét nghiệm nên được thực hiện lặp lại nếu có trên một giá trị chứng dương nằm ngoài các giới hạn ở trên.
2. Kết quả và báo cáo
Tính giá trị trung bình của độ hấp thụ đối với huyết thanh chứng dương (OD R4)
| Giá trị trung bình OD R4 = | Tổng mật độ quang học |
| 3 |
Tính giá trị ngưỡng (CO)
Tổng mật độ quang học
| CO = | Giá trị trung bình OD R4 |
| 3 |
Giải thích kết quả
- Các mẫu có giá trị OD < giá trị ngưỡng được coi là âm tính với xét nghiệm MONOLISA anti-HBc PLUS.
- Các mẫu có giá trị OD ³ giá trị ngưỡng được coi là dương tính ban đầu với xét nghiệm MONOLISA anti-HBc PLUS và phải được xét nghiệm lại bằng xét nghiệm tương tự trước khi đưa ra nhận định cuối cùng.
- Các kết quả nằm dưới giá trị ngưỡng CO - 10% < OD nên được nhận định một cách thận trọng (nên thực hiện xét nghiệm lại các mẫu liên quan bằng xét nghiệm lặp lại 2 lần khi hệ thống sử dụng và quy trình thí nghiệm cho phép điều đó).
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
1. Sai sót
Có thể xảy ra hiện tượng âm tính giả hoặc dương tính giả, thông thường do:
- Thực hiện sai các bước trong quy trình hướng dẫn.
- Chứng âm và những mẫu bệnh phẩm âm tính bị nhiễm chéo bởi huyết thanh/ huyết tương có nồng độ kháng thể cao.
- Cơ chất bị nhiễm bởi các tác nhân oxy hoá (thuốc tẩy, ion kim loại v.v…)
- Dung dịch dừng phản ứng bị nhiễm bẩn.
2. Xử trí
- Tuân thủ đúng các bước quy trình hướng dẫn của nhà sản xuất và hướng dẫn về độ ổn định hóa chất xét nghiệm trong bộ sinh phẩm sử dụng.
- Kiểm tra và vệ sinh máy rửa thường xuyên trước và sau khi làm xét nghiệm
- Chia hóa chất (chất cộng hợp, dung dịch hiện màu và dừng phản ứng) vào ống nghiệm sạch trước mỗi lần nhỏ.
87. HBc total miễn dịch tự động
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Phát hiện kháng thể tống số HBc Ab total kháng HBcAg trong huyết thanh (huyết tương).
2. Nguyên lý
Dựa trên nguyên lý của kỹ thuật CLIA (miễn dịch điện hóa phát quang) (VD)
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện: Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: Cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1.Trang thiết bị
- Hệ thống máy miễn dịch tự động.
- Bộ lưu điện
- Máy ly tâm thường.
- Tủ âm sâu (-20oC) (nếu có).
- Tủ lạnh 2 oC - 8 oC
2.2.Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
Định mức sinh phẩm và vật tư tiêu hao cho 5 mẫu/lần thực hiện (VD)
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Bông | Kg | 0,001 |
| 2 | Dây garô | Cái | 0,001 |
| 3 | Cồn | ml | 1,000 |
| 4 | Bơm kim tiêm | Cái | 1,000 |
| 5 | Panh | Cái | 0,0001 |
| 6 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 7 | Hộp vận chuyển bệnh phẩm | Cái | 0,001 |
| 8 | Tube đựng bệnh phẩm | Cái | 1,000 |
| 9 | Sinh phẩm chẩn đoán | Test | 1,000 |
| 10 | Khấu hao sinh phẩm cho chạy chuẩn | Test | 0,100 |
| 11 | Khấu hao sinh phẩm cho chạy chứng, kiểm tra chất lượng | Test | 0,400 |
| 12 | Chứng ngoại kiểm âm (nếu có) | ml | 0,005 |
| 13 | Chứng ngoại kiểm dương (nếu có) | ml | 0,005 |
| 14 | Chứng nội kiểm | Test | 0,400 |
| 15 | Ngoại kiểm (nếu có)* |
| 0,020 |
| 16 | Cleancell M | ml | 3,000 |
| 17 | Procell M | ml | 3,000 |
| 18 | Probe Wash M | ml | 2,000 |
| 19 | Preclean M | ml | 2,000 |
| 20 | Assay Tip/Cup E170 | chiếc | 3,000 |
| 21 | ISE Cleaning Solution F. HIT | ml | 0,500 |
| 22 | Nước cất | ml | 5,000 |
| 23 | Sample cup | chiếc | 1,000 |
| 24 | Giấy thấm | Cuộn | 0,100 |
| 25 | Giấy xét nghiệm | Tờ | 2,000 |
| 26 | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 27 | Bút viết kính | Cái | 0,020 |
| 28 | Bút bi | Cái | 0,010 |
| 29 | Mũ | Cái | 0,020 |
| 30 | Khẩu trang | Cái | 0,020 |
| 31 | Găng tay | Đôi | 0,100 |
| 32 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 33 | Quần áo bảo hộ | Bộ | 0,005 |
| 34 | Dung dịch nước rửa tay | ml | 8,000 |
| 35 | Cồn sát trùng tay nhanh | ml | 1,000 |
| 36 | Dung dịch khử trùng | ml | 10,000 |
| 37 | Khăn lau tay | Cái | 0,010 |
* Ghi chú: Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) ) là 1/50 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 2 lần/1 năm).
3. Bệnh phẩm
Huyết thanh hoặc huyết tương của người bệnh
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu phiếu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
- Theo đúng quy định của chuyên ngành Vi sinh (xem phụ lục 2)
- Từ chối những bệnh phẩm không đạt yêu cầu (xem phụ lục 6).
2. Tiến hành kỹ thuật: Bộ sinh phẩm Elecsys Anti-HBc - Roche (VD)
| Các bước | Xét nghiệm định tính Anti-HBc |
| 1 | Vào Reagent để kiểm tra số lượng tests |
| 2 | Vào Calibration → Status để kiểm tra hiệu chuẩn. |
| 3 | Chạy chứng |
| Chạy mẫu không dùng barcode | |
| 1 | Đánh số sample cup theo mã số bệnh phẩm. Hút mẫu và chứng ngoại kiểm (nếu có) vào sample cup tương ứng |
| 2 | Vào màn hình Workplace → Test Selection |
| 3 | Nhập mã bệnh phẩm và ngày thực hiện xét nghiệm |
| 4 | Chọn tên test là anti-HBc |
| 5 | Vào Barcode Read Error |
| 6 | Nhập số rack và vị trí mẫu → Add → OK → Save |
| 7 | Đặt mẫu huyết thanh người bệnh Sample Cup lên Rack đúng vị trí đưa vào khu nạp giá mẫu. |
| 8 | Chọn Start → Chọn START ở màn hình Start Conditions |
| Chạy mẫu có barcode | |
| 1 | Nhập chỉ định định vào hệ thống LIS |
| 2 | Đưa ống máu dán barcode vào rack vào khu nạp giá mẫu |
| 3 | Chọn Start → Chọn START ở màn hình Start Conditions |
IV. NHẬN ĐỊNH KẾT QUẢ
1. Đánh giá theo tiêu chuẩn nhà sản xuất
Chạy kiểm tra chứng 1 và chứng 2. Giá trị chứng đạt được phải nằm trong khoảng giới hạn xác định. Giới hạn này được qui định trong bộ chứng và trong mỗi lô hóa chất Anti-HBc khác nhau có thể có sự thay đổi về giới hạn chứng
2. Đánh giá theo tiêu chuẩn phòng xét nghiệm
Chứng nội kiểm, ngoại kiểm (nếu có)
3. Kết quả và báo cáo
Máy sẽ tự động tính toán giá trị ngưỡng dựa trên số đo của Cal1 và Cal2. Kết quả của mẫu bệnh phẩm sẽ được thông báo là dương tính hoặc âm tính cùng với chỉ số ngưỡng (COI).
- Nếu COI ≤ 1.0: mẫu bệnh phẩm được coi là dương tính với Anti-HBc.
- Nếu COI > 1.0: mẫu bệnh phẩm được coi là âm tính với Anti-HBc.
- Tất cả những mẫu dương tính cần phải kiểm tra lại 2 lần trên cùng bộ sinh phẩm Elecsys Anti-HBc:
+ Nếu cả hai kết quả lặp lại > 1: Kết luận âm tính
+ Nếu một trong hai lần lặp lại có kết quả £ 1.0: Kết luận dương tính.
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
- Máy sẽ báo sample short (bệnh phẩm đông hoặc không đủ) →. Chú ý ly tâm mẫu thật kỹ ngay từ đầu hoặc hút mẫu ra cup (thực hiện theo đúng yêu cầu của lấy mẫu xét nghiệm Vi sinh)
- Không sử dụng thuốc thử đã quá hạn sử dụng.
- Tránh tạo bọt ở lọ thuốc thử và các loại mẫu (bệnh phẩm, calibration và chứng).
- Tham khảo thêm hướng dẫn của nhà sản xuất.
88. HBeAg miễn dịch bán tự động
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Phát hiện kháng nguyên HBeAg của virus viêm gan B (HBV) trong huyết thanh (huyết tương).
2. Nguyên lý
Dựa trên nguyên lý của kỹ thuật ELISA (miễn dịch gắn enzym) (VD).
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: Cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1.Trang thiết bị
- Dàn máy ELISA.
- Máy ly tâm thường.
- Tủ âm sâu (-20 oC) (nếu có).
- Tủ lạnh 2 oC - 8 oC
- Micropipette 100 µl, 1000 µl.
- Giá đựng ống máu
- Bộ pipetman 8 kênh (nếu có).
- Ống đong có vạch dung tích 25ml, 100ml, 1000ml
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
Định mức sinh phẩm và vật tư tiêu hao cho 20 mẫu/lần thực hiện (VD)
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Bông | Kg | 0,001 |
| 2 | Dây garô | Cái | 0,001 |
| 3 | Tube đựng bệnh phẩm | Cái | 1,000 |
| 4 | Sinh phẩm chẩn đoán | Test | 1,000 |
| 5 | Khấu hao sinh phẩm cho chạy chứng, kiểm tra chất lượng | Test | 0,300 |
| 6 | Chứng ngoại kiểm âm (nếu có) | ml | 0,010 |
| 7 | Chứng ngoại kiểm dương (nếu có) | ml | 0,010 |
| 8 | Ngoại kiểm (nếu có)* |
| 0,020 |
| 9 | Nước cất | ml | 2,000 |
| 10 | Đầu côn 1000 µl | Cái | 0,100 |
| 11 | Đầu côn 200 µl | Cái | 1,100 |
| 12 | Giấy thấm | Cuộn | 0,100 |
| 13 | Giấy xét nghiệm | Tờ | 2,000 |
| 14 | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 15 | Bút viết kính | Cái | 0,020 |
| 16 | Bút bi | Cái | 0,010 |
| 17 | Mũ | Cái | 0,020 |
| 18 | Khẩu trang | Cái | 0,020 |
| 19 | Găng tay | Đôi | 0,100 |
| 20 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 21 | Quần áo bảo hộ | Bộ | 0,005 |
| 22 | Dung dịch nước rửa tay | ml | 8,000 |
| 23 | Cồn sát trùng tay nhanh | ml | 1,000 |
| 24 | Dung dịch khử trùng | ml | 10,000 |
| 25 | Khăn lau tay | Cái | 0,010 |
* Ghi chú: Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) ) là 1/50 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 2 lần/1 năm).
3. Bệnh phẩm
Huyết thanh hoặc huyết tương của người bệnh
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu phiếu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
- Theo đúng quy định của chuyên ngành Vi sinh (xem phụ lục 2)
- Từ chối những bệnh phẩm không đạt yêu cầu (xem phụ lục 6).
2. Tiến hành kỹ thuật
Bộ sinh phẩm MONOLISA HBeAg/Ab Plus Bio-Rad (VD)
| Các bước | Xét nghiệm định tính HbeAg |
| 1 | Chuẩn bị sinh phẩm xét nghiệm, sơ đồ mẫu |
| 2 | Nhỏ bệnh phẩm và chứng theo quy trình hướng dẫn của nhà sản xuất. |
| 3 | Ủ tấm phản ứng theo hướng dẫn quy trình của nhà sản xuất. |
| 4 | Pha dung dịch rửa Rửa tấm phản ứng theo quy trình hướng dẫn của nhà sản xuất. |
| 5 | Pha dung dịch cộng hợp Nhỏ dung dịch cộng hợp vào giếng phản ứng |
| 6 | Ủ tấm phản ứng trong thời gian và nhiệt độ theo hướng dẫn của nhà sản xuất. |
| 7 | Rửa tấm phản ứng theo quy trình hướng dẫn của nhà sản xuất. |
| 8 | Pha dung dịch cơ chất Nhỏ dung dịch cơ chất vào mỗi giếng phản ứng |
| 9 | Để tấm phản ứng trong tối theo quy trình ở nhiệt độ phòng (18 oC - 30 oC) như hướng dẫn của nhà sản xuất. |
| 10 | Dừng phản ứng |
| 11 | Đọc kết quả ở bước sóng 450/620 nm-700 nm bằng máy đo mật độ quang. |
IV. NHẬN ĐỊNH KẾT QUẢ
1. Điều kiện
NC: Độ hấp phụ của chứng âm (R3).
PC: Độ hấp phụ của chứng dương.
CO: Giá trị ngưỡng.
NCx: Giá trị trung bình của chứng âm.
NCx = R3 OD / 3.
Loại chứng âm lớn hơn 25% giá trị trung bình chứng âm. Chỉ được loại 1 chứng âm và tính kết quả theo 2 chứng âm còn lại.
CO = NCx + 0,025.
NCx <0,060.
PC > 0,800.
| Tỉ lệ = | OD mẫu |
| Giá trị ngưỡng |
2. Nhận định, trả lời kết quả
Mẫu huyết thanh:
+ Dương tính: khi có giá trị tỉ lệ ≥ 1.
+ Âm tính: khi có giá trị tỉ lệ < 1.
Trường hợp dương tính nên xét nghiệm lại 2 giếng. Nếu có ít nhất 1 giá trị dương, mẫu được coi là dương tính.
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
1. Sai sót
Có thể xảy ra hiện tượng âm tính giả hoặc dương tính giả, thông thường do:
- Thực hiện sai các bước trong quy trình hướng dẫn.
- Chứng âm và những mẫu bệnh phẩm âm tính bị nhiễm chéo bởi huyết thanh/ huyết tương có nồng độ kháng thể cao.
- Cơ chất bị nhiễm bởi các tác nhân oxy hoá (thuốc tẩy, ion kim loại v.v…) ,
- Dung dịch dừng phản ứng bị nhiễm bẩn.
2. Xử trí
- Tuân thủ đúng các bước quy trình hướng dẫn của nhà sản xuất và hướng dẫn về độ ổn định hóa chất xét nghiệm trong bộ sinh phẩm sử dụng.
- Kiểm tra và vệ sinh máy rửa thường xuyên trước và sau khi làm xét nghiệm
- Chia hóa chất (chất cộng hợp, dung dịch hiện màu và dừng phản ứng) vào ống nghiệm sạch trước mỗi lần nhỏ.
89. HBeAg miễn dịch tự động
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Phát hiện kháng nguyên HBeAg của virus viêm gan B (HBV) trong huyết thanh (huyết tương).
2. Nguyên lý
Dựa trên nguyên lý của kỹ thuật CLIA (miễn dịch điện hóa phát quang) (VD)
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện: Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: Cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1.Trang thiết bị
- Hệ thống máy miễn dịch tự động.
- Bộ lưu điện
- Máy ly tâm thường.
- Tủ âm sâu (-20 oC) (nếu có).
- Tủ lạnh 2 oC - 8 oC
- Micropipette thể tích 50 µl - 200 µl
2.2.Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
Định mức sinh phẩm và vật tư tiêu hao cho 15 mẫu/lần thực hiện (VD)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
* Ghi chú: Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) ) là 1/50 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 2 lần/1 năm).
3. Bệnh phẩm
Huyết thanh hoặc huyết tương của người bệnh
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu phiếu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
- Theo đúng quy định của chuyên ngành Vi sinh (xem phụ lục 2)
- Từ chối những bệnh phẩm không đạt yêu cầu (xem phụ lục 6).
2. Tiến hành kỹ thuật
Bộ sinh phẩm Elecsys HBeAg - Roche (VD)
| Các bước | Xét nghiệm xác định HbeAg |
| 1 | Vào Reagent để kiểm tra số lượng tests |
| 2 | Vào Calibration → Status để kiểm tra hiệu chuẩn. |
| 3 | Chạy chứng |
| Chạy mẫu không dùng barcode | |
| 1 | Đánh số sample cup theo mã số bệnh phẩm. Hút mẫu và chứng ngoại kiểm (nếu có) vào sample cup tương ứng |
| 2 | Vào màn hình Workplace → Test Selection |
| 3 | Nhập mã bệnh phẩm và ngày thực hiện xét nghiệm |
| 4 | Chọn tên test là HbeAg |
| 5 | Vào Barcode Read Error |
| 6 | Nhập số rack và vị trí mẫu → Add → OK → Save |
| 7 | Đặt mẫu huyết thanh người bệnh Sample Cup lên Rack đúng vị trí đưa vào khu nạp giá mẫu. |
| 8 | Chọn Start → Chọn START ở màn hình Start Conditions |
| Chạy mẫu có barcode | |
| 1 | Nhập chỉ định xét nghiệm vào hệ thống LIS |
| 2 | Đưa ống máu dán barcode vào rack vào khu nạp giá mẫu |
| 3 | Chọn Start → Chọn START ở màn hình Start Conditions |
IV. NHẬN ĐỊNH KẾT QUẢ
1. Đánh giá theo tiêu chuẩn nhà sản xuất
- Chạy kiểm tra chứng 1 và chứng 2 trên tất cả các điện cực dùng để chạy xét nghiệm.
- Giá trị chứng đạt được phải nằm trong khoảng giới hạn xác định.
2. Đánh giá theo tiêu chuẩn phòng xét nghiệm
Chứng nội kiểm, ngoại kiểm (nếu có).
3. Kết quả và báo cáo
- Mẫu huyết thanh: Máy sẽ tự động tính toán giá trị ngưỡng dựa trên số đo của Cal1 và Cal2. Kết quả của mẫu bệnh phẩm sẽ được thông báo là dương tính hoặc âm tính cùng với chỉ số ngưỡng (COI).
+ Nếu COI < 1: mẫu bệnh phẩm được coi là âm tính với HBeAg.
+ Nếu COI ≥ 1.0: mẫu bệnh phẩm được coi là dương tính với HBeAg.
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
- Máy sẽ báo sample short (bệnh phẩm đông hoặc không đủ) →. Chú ý ly tâm mẫu thật kỹ ngay từ đầu hoặc hút mẫu ra cup (thực hiện theo đúng yêu cầu của lấy mẫu xét nghiệm Vi sinh)
- Không sử dụng thuốc thử đã quá hạn sử dụng.
- Tránh tạo bọt ở lọ thuốc thử và các loại mẫu (bệnh phẩm, calibration và chứng).
90. HBeAb miễn dịch bán tự động
I. NGUYÊN LÝ
1. Mục đích
Phát hiện kháng thể HBeAb (Anti-HBe) trong huyêt thanh (huyết tương).
2. Nguyên lý
Dựa trên nguyên lý của kỹ thuật ELISA (miễn dịch gắn enzym) (VD).
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện: Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: Cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1.Trang thiết bị
- Dàn máy ELISA.
- Máy ly tâm thường.
- Tủ âm sâu (-20 oC) (nếu có).
- Tủ lạnh 24 oC - 8 oC
- Micropipette 100 µl, 1000 µl.
- Giá đựng ống máu
- Bộ pipetman 8 kênh (nếu có).
- Ống đong có vạch dung tích 25ml, 100ml, 1000ml
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
Định mức sinh phẩm và vật tư tiêu hao cho 20 mẫu/lần thực hiện (VD)
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Bông | Kg | 0,001 |
| 2 | Dây garô | Cái | 0,001 |
| 3 | Tube đựng bệnh phẩm | Cái | 1,000 |
| 4 | Sinh phẩm chẩn đoán | Test | 1,000 |
| 5 | Khấu hao sinh phẩm cho chạy chứng, kiểm tra chất lượng | Test | 0,300 |
| 6 | Chứng ngoại kiểm âm (nếu có) | ml | 0,010 |
| 7 | Chứng ngoại kiểm dương (nếu có) | ml | 0,010 |
| 8 | Ngoại kiểm (nếu có)* |
| 0,020 |
| 9 | Nước cất | ml | 2,000 |
| 10 | Đầu côn 1000 µl | Cái | 0,100 |
| 11 | Đầu côn 200 µl | Cái | 1,100 |
| 12 | Giấy thấm | Cuộn | 0,100 |
| 13 | Giấy xét nghiệm | Tờ | 2,000 |
| 14 | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 15 | Bút viết kính | Cái | 0,020 |
| 16 | Bút bi | Cái | 0,010 |
| 17 | Mũ | Cái | 0,020 |
| 18 | Khẩu trang | Cái | 0,020 |
| 19 | Găng tay | Đôi | 0,100 |
| 20 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 21 | Quần áo bảo hộ | Bộ | 0,005 |
| 22 | Dung dịch nước rửa tay | ml | 8,000 |
| 23 | Cồn sát trùng tay nhanh | ml | 1,000 |
| 24 | Dung dịch khử trùng | ml | 10,000 |
| 25 | Khăn lau tay | Cái | 0,010 |
* Ghi chú: Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) ) là 1/50 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 2 lần/1 năm).
3. Bệnh phẩm
Huyết thanh hoặc huyết tương của người bệnh
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu phiếu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
- Theo đúng quy định của chuyên ngành Vi sinh (xem phụ lục 2)
- Từ chối những bệnh phẩm không đạt yêu cầu (xem phụ lục 6).
2. Tiến hành kỹ thuật
Bộ sinh phẩm MONOLISA HBeAg/Ab Plus Bio-Rad (VD)
| Các bước | Xét nghiệm định tính anti-Hbe |
| 1 | Chuẩn bị sinh phẩm xét nghiệm Tấm phản ứng, sơ đồ mẫu |
| 2 | Nhỏ bệnh phẩm và chứng theo quy trình hướng dẫn của nhà sản xuất |
| 3 | Nhỏ dung dịch kháng nguyên trung hòa vào mỗi giếng |
| 4 | Ủ tấm phản ứng ở nhiệt độ và trong thời gian thích hợp theo hướng dẫn của nhà sản xuất. |
| 5 | Chuẩn bị dung dịch rửa Rửa tấm phản ứng theo quy trình hướng dẫn của nhà sản xuất |
| 6 | Nhỏ dung dịch cộng hợp vào giếng phản ứng |
| 7 | Ủ tấm phản ứng ở nhiệt độ và trong thời gian thích hợp theo hướng dẫn của nhà sản xuất. |
| 8 | Pha dung dịch cơ chất theo hướng dẫn. |
| 9 | Chuẩn bị dung dịch cơ chất Nhỏ dung dịch cơ chất vào mỗi giếng phản ứng |
| 10 | Để tấm phản ứng trong tối ở nhiệt độ phòng (18 oC - 30 oC) theo hướng dẫn của nhà sản xuất. |
| 11 | Dừng phản ứng. |
| 12 | Đọc kết quả ở bước sóng 450/620 nm-700 nm bằng máy đo mật độ quang. |
IV. NHẬN ĐỊNH KẾT QUẢ
1.Điều kiện
NC: Độ hấp phụ của chứng âm (R3).
PC: Độ hấp phụ của chứng dương.
CO: Giá trị ngưỡng.
NCx: Giá trị trung bình của chứng âm.
NCx = R3 OD / 3.
Loại chứng âm lớn hơn 25% giá trị trung bình chứng âm. Chỉ được loại 1 chứng âm và tính kết quả theo 2 chứng âm còn lại.
CO = NCx x 0,4.
NCx > 0,900.
PC < 0,150.
| Tỉ lệ = | OD mẫu |
| Giá trị ngưỡng |
2. Nhận định, trả lời kết quả
Mẫu huyết thanh:
+ Dương tính: khi có giá trị tỉ lệ ≤ 0,9.
+ Âm tính: khi có giá trị tỉ lệ > 1,1.
Tuy nhiên, thận trọng khi 0,9 < giá trị tỷ lệ <1,1. Nên làm lại xét nghiệm.
Trường hợp dương tính nên xét nghiệm lại 2 giếng. Nếu có ít nhất 1 giá trị dương, mẫu được coi là dương tính.
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
1. Sai sót
Có thể xảy ra hiện tượng âm tính giả hoặc dương tính giả, thông thường do:
- Thực hiện sai các bước trong quy trình hướng dẫn.
- Chứng âm và những mẫu bệnh phẩm âm tính bị nhiễm chéo bởi huyết thanh/ huyết tương có nồng độ kháng thể cao.
- Cơ chất bị nhiễm bởi các tác nhân oxy hoá (thuốc tẩy, ion kim loại v.v…) ,
- Dung dịch dừng phản ứng bị nhiễm bẩn.
2. Xử trí
- Tuân thủ đúng các bước quy trình hướng dẫn của nhà sản xuất và hướng dẫn về độ ổn định hóa chất xét nghiệm trong bộ sinh phẩm sử dụng.
- Kiểm tra và vệ sinh máy rửa thường xuyên trước và sau khi làm xét nghiệm
- Chia hóa chất (chất cộng hợp, dung dịch hiện màu và dừng phản ứng) vào ống nghiệm sạch trước mỗi lần nhỏ.
91. HBeAb miễn dịch tự động
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Phát hiện kháng thể HBeAb (Anti-HBe) trong huyêt thanh (huyết tương) .
2. Nguyên lý
Dựa trên nguyên lý của kỹ thuật CLIA (miễn dịch điện hóa phát quang) (VD).
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện: Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: Cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Hệ thống máy miễn dịch tự động.
- Bộ lưu điện
- Máy ly tâm thường.
- Tủ âm sâu (-20 oC) (nếu có).
- Tủ lạnh 2 oC - 8 oC
- Micropipette thể tích 50 µl - 200 µl
2.2.Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
Định mức sinh phẩm và vật tư tiêu hao cho 15 mẫu/lần thực hiện (VD)
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Bông | Kg | 0,001 |
| 2 | Dây garô | Cái | 0,001 |
| 3 | Tube đựng bệnh phẩm | Cái | 1,000 |
| 4 | Sinh phẩm chẩn đoán | Test | 1,000 |
| 5 | Khấu hao sinh phẩm cho chạy chuẩn | Test | 0,050 |
| 6 | Khấu hao sinh phẩm cho chạy chứng, kiểm tra chất lượng | Test | 0,150 |
| 7 | Chứng ngoại kiểm âm (nếu có) | ml | 0,010 |
| 8 | Chứng ngoại kiểm dương (nếu có) | ml | 0,010 |
| 9 | Chứng nội kiểm | Test | 0,010 |
| 10 | Ngoại kiểm (nếu có)* |
| 0,020 |
| 11 | Cleancell M | ml | 3,000 |
| 12 | Procell M | ml | 3,000 |
| 13 | Probe Wash M | ml | 2,000 |
| 14 | Preclean M | ml | 2,000 |
| 15 | Assay Tip/Cup E170 | Cái | 3,000 |
| 16 | ISE Cleaning Solution F. HIT | ml | 0,500 |
| 17 | Nước cất | ml | 5,000 |
| 18 | Sample cup | Chiếc | 1,000 |
| 19 | Giấy thấm | Cuộn | 0,100 |
| 20 | Giấy xét nghiệm | Tờ | 2,000 |
| 21 | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 22 | Bút viết kính | Cái | 0,020 |
| 23 | Bút bi | Cái | 0,010 |
| 24 | Mũ | Cái | 0,020 |
| 25 | Khẩu trang | Cái | 0,020 |
| 26 | Găng tay | Đôi | 0,100 |
| 27 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 28 | Quần áo bảo hộ | Bộ | 0,005 |
| 29 | Dung dịch nước rửa tay | ml | 8,000 |
| 30 | Cồn sát trùng tay nhanh | ml | 1,000 |
| 31 | Dung dịch khử trùng | ml | 10,000 |
| 32 | Khăn lau tay | Cái | 0,010 |
* Ghi chú: Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) ) là 1/50 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 2 lần/1 năm).
3. Bệnh phẩm
Huyết thanh hoặc huyết tương của người bệnh
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu phiếu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
- Theo đúng quy định của chuyên ngành Vi sinh (xem phụ lục 2)
- Từ chối những bệnh phẩm không đạt yêu cầu (xem phụ lục 6).
2. Tiến hành kỹ thuật
Bộ sinh phẩm Elecsys Anti-HBe - Roche (VD)
| Các bước | Xét nghiệm xác định HBeAb |
| 1 | Vào Reagent để kiểm tra số lượng tests |
| 2 | Vào Calibration → Status để kiểm tra hiệu chuẩn. |
| 3 | Chạy chứng |
| Chạy mẫu không dùng barcode | |
| 1 | Đánh số sample cup theo mã số bệnh phẩm. Hút mẫu và chứng ngoại kiểm (nếu có) vào sample cup tương ứng |
| 2 | Vào màn hình Workplace → Test Selection |
| 3 | Nhập mã bệnh phẩm và ngày thực hiện xét nghiệm |
| 4 | Chọn tên test là Anti-HBe |
| 5 | Vào Barcode Read Error |
| 6 | Nhập số rack và vị trí mẫu → Add → OK → Save |
| 7 | Đặt mẫu huyết thanh người bệnh Sample Cup lên Rack đúng vị trí đưa vào khu nạp giá mẫu. |
| 8 | Chọn Start → Chọn START ở màn hình Start Conditions |
| Chạy mẫu có barcode | |
| 1 | Nhập chỉ định xét nghiệm vào hệ thống LIS |
| 2 | Đưa ống máu dán barcode vào rack vào khu nạp giá mẫu |
| 3 | Chọn Start → Chọn START ở màn hình Start Conditions |
IV. NHẬN ĐỊNH KẾT QUẢ
1. Đánh giá theo tiêu chuẩn nhà sản xuất
- Chạy kiểm tra chứng 1 và chứng 2 trên tất cả các điện cực dùng để chạy xét nghiệm.
- Giá trị chứng đạt được phải nằm trong khoảng giới hạn xác định.
2. Đánh giá theo tiêu chuẩn phòng xét nghiệm
Chứng nội kiểm, ngoại kiểm (nếu có).
3. Kết quả và báo cáo
- Mẫu huyết thanh: Máy sẽ tự động tính toán giá trị ngưỡng dựa trên số đo của Cal1 và Cal2. Kết quả của mẫu bệnh phẩm sẽ được thông báo là dương tính hoặc âm tính cùng với chỉ số ngưỡng (COI).
+ Nếu COI < 1: mẫu bệnh phẩm được coi là âm tính với Anti-HBe.
+ Nếu COI ≥ 1.0: mẫu bệnh phẩm được coi là dương tính với Anti-HBe.
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
- Máy sẽ báo sample short (bệnh phẩm đông hoặc không đủ). Chú ý ly tâm mẫu thật kỹ ngay từ đầu hoặc hút mẫu ra cup (thực hiện theo đúng yêu cầu của lấy mẫu xét nghiệm Vi sinh)
- Không sử dụng thuốc thử đã quá hạn sử dụng.
- Tránh tạo bọt ở lọ thuốc thử và các loại mẫu (bệnh phẩm, calibration và chứng).
- Tham khảo thêm hướng dẫn của nhà sản xuất.
92. HBV đo tải lượng Real-time PCR
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Đo số lượng bản sao HBV DNA trong một đơn vị thể tích huyết thanh hoặc huyết tương (copies/ml).
2. Nguyên lý
Dựa trên nguyên lý của kỹ thuật Real-time PCR.
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện: Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: Cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2.Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Máy real-time PCR và hệ thống máy vi tính.
- Bộ lưu điện
- Máy ủ nhiệt
- Máy ly tâm dung cho tube 0,2 ml
- Máy ly tâm 25000 x g
- Tủ lạnh 2 oC - 8 oC
- Tủ âm sâu (-20 oC) hoặc (-70 oC) (nếu có)
- Máy vortex
- Tủ an toàn sinh học
- Micropipettes các thể tích từ 5 ml - 1000 ml.
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
Định mức sinh phẩm và vật tư tiêu hao cho 10 mẫu/lần thực hiện (VD)
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng | |
| 1 | Bông | Kg | 0,001 | |
| 2 | Dây garô | Cái | 0,001 | |
| 3 | Cồn | ml | 1,000 | |
| 4 | Bơm kim tiêm | Cái | 1,000 | |
| 5 | Panh | Cái | 0,0001 | |
| 6 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 7 | Hộp vận chuyển bệnh phẩm | Test | 0,001 |
| 8 | Tube đựng bệnh phẩm | Cái | 2,000 |
| 9 | Găng không có bột tal | Đôi | 0,500 |
| 10 | Sinh phẩm chẩn đoán | Test | 1,000 |
| 11 | Khấu hao sinh phẩm cho chạy chứng và kiểm tra chất lượng | Test | 0,400 |
| 12 | Kít tách DNA | Test | 1,400 |
| 13 | HBV Standard | Bộ | 1,200 |
| 14 | EQAS (nếu thực hiện)* |
| 0,02 |
| 15 | Ependoff 1,7ml | Tube | 2,200 |
| 16 | Ependoff 0,2ml | Tube | 1,000 |
| 17 | Đầu côn 10 µl có lọc | Cái | 1,000 |
| 18 | Đầu côn 30 µl | Cái | 1,200 |
| 19 | Đầu côn 200 µl có lọc | Cái | 2,200 |
| 20 | Đầu côn 1 ml có lọc | Cái | 3,200 |
| 21 | Ethanol BDH | ml | 0,500 |
| 22 | Water-DEPC Treated | ml | 2,000 |
| 23 | Giấy thấm | Cuộn | 0,100 |
| 24 | Giấy xét nghiệm | Tờ | 2,000 |
| 25 | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 26 | Bút viết kính | Cái | 0,020 |
| 27 | Bút bi | Cái | 0,010 |
| 28 | Mũ | Cái | 0,020 |
| 29 | Khẩu trang | Cái | 0,020 |
| 30 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 31 | Quần áo bảo hộ | Bộ | 0,005 |
| 32 | Dung dịch nước rửa tay | ml | 8,000 |
| 33 | Cồn sát trùng tay nhanh | ml | 1,000 |
| 34 | Dung dịch khử trùng | ml | 10,000 |
| 35 | Khăn lau tay | Cái | 0,010 |
* Ghi chú: Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) ) là 1/50 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 2 lần/1 năm).
3. Bệnh phẩm
Huyết thanh, huyết tương hoặc máu toàn phần
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
- Theo đúng quy định của chuyên ngành Vi sinh (xem phụ lục 3)
- Từ chối những bệnh phẩm không đạt yêu cầu (xem phụ lục 6).
2. Tiến hành kỹ thuật: Bộ sinh phẩm HBV Real-time Quant (VD)
2.1. Tách chiết DNA
2.2. Thực hiện phản ứng real-time PCR
- Thực hiện bước này với các tube PCR mix được giữ trong khay lạnh hoặc đá đang tan.
- Chỉ lấy đủ số tube PCR mix cần
- Trước và sau khi đặt phản ứng PCR phải ly tâm tube để tất cả dung dịch nằm dước đáy tube.
- Cho chứng +, chứng - hoặc dịch DNA tách chiết vào từng tube HBV qPCR Mix. Xong, đặt các tube vào máy real-time PCR cùng với 1 bộ standard.
- Khởi động máy real-time PCR. Khởi động máy tính và chương trình real- time PCR.
- Cài đặt vị trí mẫu “Plate setup” trên phần mềm đúng với vị trí mẫu đã đặt trên máy real-time PCR.
- Chọn màu “FAM” cho standard. Màu “FAM” và “HEX” cho mẫu, chứng dương và chứng âm.
- Cài đặt chương trình “Protocol” cho máy real-time PCR hoạt động
- Lưu file dữ liệu vào máy tính.
- Cho máy real-time PCR chạy chương trình.
IV. NHẬN ĐỊNH KẾT QUẢ
1. Điều kiện của phản ứng
- Chứng dương có đường biểu diễn tín hiệu huỳnh quang màu FAM dương tính và đường biểu diễn tín hiệu huỳnh quang màu HEX dương tính hoặc âm tính
- Chứng âm có đường biểu diễn tín hiệu huỳnh quang màu FAM âm tính và đường biểu diễn tín hiệu huỳnh quang màu HEX dương tính
2. Phân tích standard
- Hệ số tuyến tính (R2) phải nằm trong khoảng 0.960-1.000, tốt nhất 0.990-1.000.
- Hiệu suất nhân bản (PCR efficiency) phải nằm trong khoảng 90-115%, tốt nhất 95-110%.
- Hệ số dốc (Slope) phải nằm trong khoảng -3 đến -4, tốt nhất -3.3 đến -3.6.
3. Phân tích mẫu
- Ngưỡng phát hiện của bộ kit là 3x102 copies/ml
- Những mẫu dương tính chỉ cần chọn màu FAM để phân tích
Các kết quả dương tính được nhân với hệ số pha loãng tuỳ thuộc vào loại kit tách chiết DNA sẽ thu được kết quả hàm lượng virus/ml máu (copies/ml), do đó kết quả sau khi nhân:
+ Nếu ≥ 3x102 thì kết luận “Mẫu dương tính: a copies/ml”
+ Nếu < 3x102 thì kết luận “Mẫu dương tính dưới ngưỡng định lượng”.
- Những mẫu âm tính, chứng nội phải dương tính thì mới kết luận mẫu âm tính thật sự.
4. In đồ thị kết quả
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
Có mẫu và chứng nội cũng đều âm tính. Chứng bình thường, có mẫu dương, mẫu âm thật sự.
1. Nguyên nhân: Có thể mẫu âm thực sự, có thể phản ứng PCR bị ức chế.
2. Khắc phục
- Pha loãng mẫu từ 10-100 lần, thực hiện lại toàn bộ thí nghiệm từ bước tách chiết. Sau khi có kết quả phải nhân thêm với hệ số pha loãng mẫu. Nếu vẫn gặp sự cố trên, lấy lại mẫu theo đúng yêu cầu.
- Trừ những mẫu sự cố, tất cả các mẫu bình thường đều có thể lấy kết quả.
93. HBV đo tải lượng hệ thống tự động
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Đếm số lượng bản copies của HBV DNA trong một đơn vị thể tích (ml) huyết tương.
2. Nguyên lý
Dựa trên nguyên lý của kỹ thuật Real-time PCR.
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: Cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Máy ly tâm thường.
- Tủ lạnh 2 oC - 8 oC
- Tủ âm sâu (-20 oC) hoặc (-70 oC) (nếu có)
- Tủ an toàn sinh học cấp 2
- Máy vortex
- Hệ thống máy tách chiết tự động (RNA, DNA) và định lượng COBAS®AmpliPrep/COBAS® TaqMan 48 Analyzer (Roche) (VD hoặc tương đương)
- Bộ lưu điện
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
Định mức sinh phẩm và vật tư tiêu hao cho 10 mẫu/lần thực hiện (VD)
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Bông | Kg | 0,001 |
| 2 | Dây garô | Cái | 0,001 |
| 3 | Cồn | ml | 1,000 |
| 4 | Bơm kim tiêm | Cái | 1,000 |
| 5 | Panh | Cái | 0,0001 |
| 6 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 7 | Hộp vận chuyển bệnh phẩm | Cái | 0,001 |
| 8 | Tube đựng bệnh phẩm | Cái | 3,000 |
| 9 | Sinh phẩm chẩn đoán | Test | 1,000 |
| 10 | Khấu hao sinh phẩm cho chạy chứng, kiểm tra chất lượng. | Test | 0,340 |
| 11 | SPU | Cái | 1,300 |
| 12 | Tube-S | Cái | 1,300 |
| 13 | Tube-K | Cái | 1,300 |
| 14 | Tip-K | Cái | 1,300 |
| 15 | Kit CAP-G/CTM Wash Reagent 5.1 L | test | 1,300 |
| 16 | Ngoại kiểm (nếu có)* |
| 0,02 |
| 17 | Đầu côn 1000 µl | Cái | 1,000 |
| 18 | Đầu côn có lọc 1000 µl (DNAase- RNAase free) | Cái | 1,3 00 |
| 19 | Giấy thấm | Cuộn | 0,100 |
| 20 | Giấy xét nghiệm | Tờ | 3,000 |
| 21 | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 22 | Bút viết kính | Cái | 0,020 |
| 23 | Bút bi | Cái | 0,010 |
| 24 | Mũ | Cái | 0,020 |
| 25 | Khẩu trang | Cái | 0,020 |
| 26 | Găng không có bột tal | Đôi | 0,100 |
| 27 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 28 | Quần áo bảo hộ | Bộ | 0,005 |
| 29 | Dung dịch nước rửa tay | ml | 8,000 |
| 30 | Cồn sát trùng tay nhanh | ml | 1,000 |
| 31 | Dung dịch khử trùng | ml | 10,000 |
| 32 | Khăn lau tay | Cái | 0,010 |
* Ghi chú: Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) ) là 1/50 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 3 lần/1 năm).
3. Bệnh phẩm
Huyết tương của người bệnh
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu phiếu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
- Theo đúng quy định của chuyên ngành Vi sinh (xem phụ lục 3)
- Từ chối những bệnh phẩm không đạt yêu cầu (xem phụ lục 6).
2. Tiến hành kỹ thuật
Bộ sinh phẩm COBAS®Ampliprep/COBAS®TaqMan HBV Test 2.0 (Roche Diagnostics GmbH) (VD)
2.1. Tách chiết DNA vận hành máy COBAS AmpliPrep (thực hiện theo quy trình hướng dẫn máy của nhà sản xuất)
2.2. Khuyếch đại DNA, đọc kết quả trên máy COBAS TaqMan 48 (thực hiện theo quy trình hướng dẫn máy của nhà sản xuất)
IV. NHẬN ĐỊNH KẾT QUẢ
1. Kiểm tra chất lượng
Giá trị định lượng chấp nhận được nếu :
- Chứng âm là không phát hiện.
- Chứng nội cho giá trị Ct mong đợi.
Không nhận các kết quả của chứng không có giá trị khi xuất hiện thông báo lỗi :
- Chứng âm: Invalid (không giá trị)
- Chứng dương thấp: Invalid, < 2.00E+01 IU/ml, > 1.70E+08 IU/ml, không phát hiện (Target Not Detected)
- Chứng dương cao: Invalid, < 2.00E+01 IU/ml, > 1.70E+08 IU/ml, không phát hiện (Target Not Detected)
2. Kết quả và báo cáo
Kết quả định lượng HBV DNA của máy COBAS TaqMan 48 được tính theo đơn vị quốc tế (IU), quy đổi ra số copies/ml theo công thức tính toán của máy đã được thiết lập dựa theo quy chuẩn của WHO.
1IU = 5,82copies
Giá trị tham số Ct (được định nghĩa là số chu kỳ ngưỡng tại đó huỳnh quang vượt ngưỡng cố định, để so sánh với chu kỳ ngưỡng của mẫu chứng chuẩn từ đó suy ra số lượng DNA mẫu đưa vào phản ứng) cho HBV DNA và HBV QS DNA.
Các giá trị chứng của HBV có nồng độ trong giới hạn được thực hiện đồng thời với mẫu bệnh phẩm để thiết lập đường chuẩn, cho thấy mối tương quan giữa giá trị Ct và số log cp/ml.
| Giá trị trên máy | Trả lời kết quả |
| Target Not Detected | Không phát hiện thấy HBV DNA |
| <2.00E+01IU/ml | < 116 cp/ml |
| > 2.00E+01IU/ml đến <1.70E+08IU/ml | nhận những kết quả trong giới hạn này > 116 cp /ml đến < 9.89 x 108 cp/ml |
| >1.70E+08IU/ml | > 9.89 x 108 cp/ml |
| Invalid | Không giá trị, chạy lại mẫu bệnh phẩm |
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
- Việc lấy mẫu máu, vận chuyển và bảo quản không đúng tiêu chuẩn có thể dẫn đến kết quả sai, cho dù phản ứng được thực hiện đúng.
- Tham khảo thêm hướng dẫn của nhà sản xuất.
94. HBV genotype PCR
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Sử dụng cặp mồi đặc hiệu để xác định genotype của HBV (virus viêm gan B)
2. Nguyên lý
Dựa trên nguyên lý của kỹ thuật PCR
II. CHUẨN BỊ
1.Người thực hiện
- Người thực hiện: Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: Cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Tủ an toàn Sinh học cấp 2
- Máy PCR
- Máy điện di
- Máy đọc điện di
- Máy ly tâm 25000 x g
- Máy ly tâm dùng cho tube 0,2 ml
- Máy ủ nhiệt
- Máy vortex
- Micropipette
- Bộ lưu điện
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
Định mức sinh phẩm và vật tư tiêu hao cho 2 mẫu/lần thực hiện (VD)
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Bông | kg | 0,001 |
| 2 | Cồn | ml | 1,000 |
| 3 | Bơm kim tiêm | Cái | 1,000 |
| 4 | Panh | Cái | 0,0001 |
| 5 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 6 | Hộp vận chuyển bệnh phẩm | Test | 0,001 |
| 7 | Tube đựng bệnh phẩm | Cái | 2,000 |
| 8 | Găng không có bột | Cái | 0,500 |
| 9 | Sinh phẩm chẩn đoán | Test | 1,000 |
| 10 | Khấu hao sinh phẩm cho kiểm tra lại | Test | 1,350 |
| 11 | EQAS (nếu thực hiện) * |
| 0,020 |
| 12 | Kit tách chiết DNA từ virus | Test | 2,350 |
| 13 | DNA marker | Bộ | 1,000 |
| 14 | Primer 1-1 xác định genotype A | ml | 0,0001 |
| 15 | Primer 1-2 xác định genotype A | ml | 0,0001 |
| 16 | Primer 2-1 xác định genotype B | ml | 0,0001 |
| 17 | Primer 2-2 xác định genotype B | ml | 0,0001 |
| 18 | Primer 3-1 xác định genotype C | ml | 0,0001 |
| 19 | Primer 3-2 xác định genotype C | ml | 0,0001 |
| 20 | Primer 4-1 xác định genotype D | ml | 0,0001 |
| 21 | Primer 4-2 xác định genotype D | ml | 0,0001 |
| 22 | Primer 5-1 xác định genotype E | ml | 0,0001 |
| 23 | Primer 5-2 xác định genotype E | ml | 0,0001 |
| 24 | Primer 6-1 xác định genotype F | ml | 0,0001 |
| 25 | Primer 6-2 xác định genotype F | ml | 0,0001 |
| 26 | Primer 7-1 xác định genotype G | ml | 0,0001 |
| 27 | Primer 7-2 xác định genotype G | ml | 0,0001 |
| 28 | Primer 8-1 xác định genotype H | ml | 0,0001 |
| 29 | Primer 8-2 xác định genotype H | ml | 0,0001 |
| 30 | Ống Eppendorf 1,5 ml | Tube | 3.000 |
| 31 | Ống Eppendorf 0,2 ml | Tube | 1,000 |
| 32 | Đầu côn 10 µl có lọc | Cái | 1,000 |
| 33 | Đầu côn 30 µl | Cái | 1,200 |
| 34 | Đầu côn 200 µl có lọc | Cái | 2,200 |
| 35 | Đầu côn 1 ml có lọc | Cái | 3,200 |
| 36 | Ethanol BDH | ml | 0,500 |
| 37 | Water-DEPC Treated | ml | 2,000 |
| 38 | Thạch | Gam | 0,075 |
| 39 | Ladder | ml | 0,0025 |
| 40 | Blue Juice Gel loading dye | ml | 0,003 |
| 41 | Ethidium Bromide | ml | 0,100 |
| 42 | TAE Buffer | ml | 0,100 |
| 43 | Giấy thấm | Cuộn | 0,100 |
| 44 | Giấy xét nghiệm | Tờ | 2,000 |
| 45 | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 46 | Bút viết kính | Cái | 0,020 |
| 47 | Bút bi | Cái | 0,010 |
| 48 | Mũ | Cái | 0,020 |
| 49 | Khẩu trang | Cái | 0,020 |
| 50 | Găng tay | Đôi | 0,100 |
| 51 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 52 | Quần áo bảo hộ | Bộ | 0,005 |
| 53 | Dung dịch nước rửa tay | ml | 8,000 |
| 54 | Cồn sát trùng tay nhanh | ml | 1,000 |
| 55 | Dung dịch khử trùng | ml | 10,000 |
| 56 | Khăn lau tay | cái | 0,010 |
* Ghi chú: Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) ) là 1/50 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 2 lần/1 năm).
3. Bệnh phẩm
Huyết thanh, huyết tương
4.Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu phiếu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
- Theo đúng quy định của chuyên ngành Vi sinh (xem phụ lục 3)
- Từ chối những bệnh phẩm không đạt yêu cầu (xem phụ lục 6).
2. Tiến hành kỹ thuật
2.1. Tách chiết DNA tổng số
2.2. Thực hiện PCR
2.3. Điện di kiểm tra sản phẩm
2.4. Đánh giá và kết luận
IV. NHẬN ĐỊNH KẾT QUẢ
Sản phẩm PCR phải có một băng đặc hiệu duy nhất, rõ nét và không bị đứt gẫy và có kích thước phù hợp tương ứng với thang DNA chuẩn.
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
Trong trường hợp không có sản phẩm PCR, cần phải kiểm tra lại quá trình tách chiết DNA tổng số, chất lượng primers và master mix, và thực hiện lại xét nghiệm.
95. HBV genotype Real-time PCR
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Xác định genotype của virus viêm gan B (HBV) trong máu.
2. Nguyên lý
Dựa trên nguyên lý của kỹ thuật Real-time PCR.
II. CHUẨN BỊ
1.Người thực hiện
- Người thực hiện Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: Cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2.Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1.Trang thiết bị
- Máy real-time PCR và hệ thống máy vi tính.
- Bộ lưu điện
- Máy ủ nhiệt
- Máy ly tâm dung cho tube 0,2 ml
- Máy ly tâm 25000 x g
- Tủ lạnh 2 oC - 8oC
- Tủ âm sâu (-20 oC) hoặc (-70 oC) (nếu có)
- Máy vortex
- Tủ an toàn sinh học
- Micropipettes các thể tích từ 5 ml - 1000 ml.
2.2. Dụng cụ, hóa chất và vật tư tiêu hao
Định mức sinh phẩm và vật tư tiêu hao cho 1 mẫu/lần thực hiện (VD)
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Bông | Kg | 0,001 |
| 2 | Dây garô | Cái | 0,001 |
| 3 | Cồn | ml | 1,000 |
| 4 | Bơm kim tiêm | Cái | 1,000 |
| 5 | Panh | Cái | 0,0001 |
| 6 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 7 | Hộp vận chuyển bệnh phẩm | Test | 0,001 |
| 8 | Tube đựng bệnh phẩm | Cái | 2,000 |
| 9 | Găng không có bột tal | Cái | 0,500 |
| 10 | Sinh phẩm chẩn đoán | Test | 1,000 |
| 11 | Khấu hao sinh phẩm cho chạy chứng | Test | 2,000 |
| 12 | Kít tách DNA | Test | 3,000 |
| 13 | Ngoại kiểm (nếu có)* |
| 0,020 |
| 14 | Ependoff 1,7ml | Tube | 3,000 |
| 15 | Ependoff 0,2ml | Tube | 3,000 |
| 16 | Đầu côn 10 µl có lọc | Cái | 3,000 |
| 17 | Đầu côn 30 µl | Cái | 1,200 |
| 18 | Đầu côn 200 µl có lọc | Cái | 5,200 |
| 19 | Đầu côn 1 ml có lọc | Cái | 3,000 |
| 20 | Ethanol BDH | ml | 2,000 |
| 21 | Water-DEPC Treated | ml | 2,000 |
| 22 | Giấy thấm | Cuộn | 0,100 |
| 23 | Giấy xét nghiệm | Tờ | 2,000 |
| 24 | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 25 | Bút viết kính | Cái | 0,020 |
| 26 | Bút bi | Cái | 0,010 |
| 27 | Mũ | Cái | 0,020 |
| 28 | Găng tay | Đôi | 0,100 |
| 29 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 30 | Quần áo bảo hộ | Bộ | 0,005 |
| 31 | Dung dịch nước rửa tay | ml | 8,000 |
| 32 | Cồn sát trùng tay nhanh | ml | 1,000 |
| 33 | Dung dịch khử trùng | ml | 10,000 |
| 34 | Khăn lau tay | Cái | 0,010 |
* Ghi chú: Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/50 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 2 lần/1 năm).
3. Bệnh phẩm
Huyết thanh, huyết tương hoặc máu toàn phần
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
- Theo đúng quy định của chuyên ngành Vi sinh (xem phụ lục 3)
- Từ chối những bệnh phẩm không đạt yêu cầu (xem phụ lục 6).
2. Tiến hành kỹ thuật: Bộ sinh phẩm HBV genotype
2.1. Tách chiết DNA
2.2. Thực hiện phản ứng real-time PCR
- Thực hiện bước này với các tube PCR mix được giữ trong khay lạnh hoặc đá đang tan.
- Chỉ lấy đủ số tube PCR mix cần. Trước và sau khi đặt phản ứng PCR phải ly tâm tube để tất cả dung dịch nằm dước đáy tube.
- Cho chứng +, chứng - hoặc dịch DNA tách chiết vào từng tube HBV Genotype A rPCR Mix, HBV Genotype B rPCR Mix và HBV Genotype C rPCR Mix
- Khởi động máy real-time PCR. Khởi động máy tính và chương trình real-time PCR.
- Cài đặt vị trí mẫu “Plate setup” trên phần mềm đúng với vị trí mẫu đã đặt trên máy real-time PCR.
- Chọn màu “FAM” cho tất cả các mẫu, chứng dương và chứng âm.
- Cài đặt chương trình “Protocol” cho máy real-time PCR hoạt động
- Lưu file dữ liệu vào máy tính.
- Cho máy real-time PCR chạy chương trình.
IV. NHẬN ĐỊNH KẾT QUẢ
1. Điều kiện của phản ứng
- Chứng dương có đường biểu diễn tín hiệu huỳnh quang màu FAM tuyến tính vượt quá tín hiệu nền với cả 3 genotype.
- Chứng âm có đường biểu diễn thẳng và không vượt qua tín hiệu nền.
2. Phân tích mẫu
- Mẫu có đường biểu diễn dương tính tại vị trí tương ứng với genotype nào thì kết luận mẫu nhiễm genotype đó. Một mẫu có thể đồng nhiễm nhiều genotype.
- Mẫu có đường biểu diễn âm tính với tất cả các genotype thì kết luận: “Mẫu nhiễm HBV genotype khác ngoài 3 genotype A, B, C” (vì mẫu đã được xác định dương tính với HBV trước đó).
3. In đồ thị kết quả
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
Tất cả các mẫu đều dương tính kể cả chứng âm.
- Nguyên nhân 1: Lô thí nghiệm bị ngoại nhiễm DNA hoặc sản phẩm PCR từ môi trường của khu vực thao tác hoặc nhiễm chéo giữa các mẫu.
Khắc phục: Chiếu UV và vệ sinh khu vực thao tác bằng nước Javel để khử nhiễm. Tiến hành lại thí nghiệm thật cẩn thận.
- Nguyên nhân 2: Kit bị ngoại nhiễm DNA hoặc sản phẩm PCR trong quá trình sử dụng.
Khắc phục: Thay kit mới và thực hiện quá trình như hướng dẫn ở nguyên nhân 1.
Trường hợp này không thể lấy kết quả, phải khắc phục và tiến hành lại thí nghiệm.
96. HBV genotype giải trình tự gene
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Xác định genotype HBV (virus viêm gan B)
2. Nguyên lý
Bằng kỹ thuật giải trình tự nucleotide của gen đặc trưng cho HBV.
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: Cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Tủ an toàn Sinh học cấp 2
- Máy PCR
- Máy đọc điện di
- Máy giải trình tự gen
- Máy ly tâm 25000 x g
- Máy ly tâm dùng cho tube 0,2 ml
- Máy ủ nhiệt
- Máy vortex
- Micropipette
- Bộ lưu điện
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
Định mức sinh phẩm và vật tư tiêu hao cho 3 mẫu/lần thực hiện (VD)
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Bông | kg | 0,001 |
| 2 | Cồn | ml | 1,000 |
| 3 | Bơm kim tiêm | Cái | 1,000 |
| 4 | Panh | Cái | 0,0001 |
| 5 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 6 | Hộp vận chuyển bệnh phẩm | Test | 0,001 |
| 7 | Tube đựng bệnh phẩm | Cái | 2,000 |
| 8 | Găng không có bột tal (DNase-RNase free) | Cái | 0,500 |
| 9 | Sinh phẩm chẩn đoán | Test | 1,000 |
| 10 | Khấu hao sinh phẩm cho kiểm tra lại | Test | 1,350 |
| 11 | Kit tách chiết DNA từ virus | Test | 2,350 |
| 12 | EQAS (nếu thực hiện) * |
| 0,020 |
| 13 | DNA marker | Bộ | 1,000 |
| 14 | Primer 1 (vòng 1) | ml | 0,0001 |
| 15 | Primer 2 (vòng 1) | ml | 0,0001 |
| 16 | Primer 3 (vòng 2) | ml | 0,0001 |
| 17 | Primer 4 (vòng 2) | ml | 0,0001 |
| 18 | Ống Eppendorf 1,5 ml | Tube | 3,000 |
| 19 | Ống Eppendorf 0,2 ml | Tube | 1,000 |
| 20 | Đầu côn 10 µl có lọc | Cái | 1,000 |
| 21 | Đầu côn 30 µl | Cái | 1,200 |
| 22 | Đầu côn 200 µl có lọc | Cái | 2,200 |
| 23 | Đầu côn 1 ml có lọc | Cái | 3,200 |
| 24 | Ethanol BDH | ml | 0,500 |
| 25 | Water-DEPC Treated | ml | 2,000 |
| 26 | Thạch | Gam | 0,075 |
| 27 | Ladder | ml | 0,0025 |
| 28 | Blue Juice Gel loading dye | ml | 0,003 |
| 29 | Ethidium Bromide | ml | 0,100 |
| 30 | TAE Buffer | ml | 0,100 |
| 31 | Giấy thấm | Cuộn | 0,100 |
| 32 | Giấy xét nghiệm | Tờ | 2,000 |
| 33 | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 34 | Bút viết kính | Cái | 0,020 |
| 35 | Bút bi | Cái | 0,010 |
| 36 | Mũ | Cái | 0,020 |
| 37 | Khẩu trang | Cái | 0,020 |
| 38 | Găng tay | Đôi | 0,100 |
| 39 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 40 | Quần áo bảo hộ | Bộ | 0,005 |
| 41 | Dung dịch nước rửa tay | ml | 8,000 |
| 42 | Cồn sát trùng tay nhanh | ml | 1,000 |
| 43 | Dung dịch khử trùng | ml | 10,000 |
| 44 | Khăn lau tay | cái | 0,010 |
* Ghi chú: Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/50 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 2 lần/1 năm).
3.Bệnh phẩm: Huyết tương, huyết thanh
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu phiếu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
Theo đúng quy định của chuyên ngành Vi sinh: lấy 3 ml máu vào ống lấy máu vô trùng có chất chống đông EDTA.
2. Tiến hành kỹ thuật
2.1. Tách chiết DNA tổng số
2.2. Thực hiện PCR
2.3. Điện di kiểm tra sản phẩm
2.4. Giải trình tự gen
2.5. Kiểm tra và so sánh trình tự gen của HBV trên ngân hàng dữ liệu gen quốc tế
IV. NHẬN ĐỊNH KẾT QUẢ
Sản phẩm PCR phải có một băng đặc hiệu duy nhất, rõ nét và không bị đứt gẫy. Trình tự DNA của gen đích phải có độ tương đồng ≥ 90 % mới có thể kết luận được genotype của HBV
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
- Trong trường hợp không có sản phẩm PCR, cần phải kiểm tra lại quá trình tách chiết DNA tổng số, chất lượng primers và master mix, và thực hiện lại xét nghiệm.
- Nếu trình tự DNA bị nhiễu cần phải kiểm tra lại độ đặc hiệu của sản phẩm PCR hoặc quá trình chạy PCR sequencing bị nhiễm chéo.
97. HBV kháng thuốc Real-time PCR (Cho 1 loại thuốc)
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Xác định các nucleotide bị thay đổi trên hệ gen của HBV có liên quan đến kháng thuốc.
2. Nguyên lý
Dựa trên nguyên lý của kỹ thuật Real-time PCR
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: Cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Tủ an toàn Sinh học cấp 2
- Máy Real-time PCR
- Máy in màu
- Máy ly tâm 25000 x g
- Máy ly tâm dùng cho tube 0,2 ml
- Máy ủ nhiệt
- Máy vortex
- Micropipette
- Bộ lưu điện
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
Định mức sinh phẩm và vật tư tiêu hao cho 2 mẫu/lần thực hiện (VD)
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Bông | kg | 0,001 |
| 2 | Cồn | ml | 1,000 |
| 3 | Bơm kim tiêm | Cái | 1,000 |
| 4 | Panh | Cái | 0,0001 |
| 5 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 6 | Hộp vận chuyển bệnh phẩm | Test | 0,001 |
| 7 | Tube đựng bệnh phẩm | Cái | 2,000 |
| 8 | Găng không có bột (DNase-RNase free) | Cái | 0,500 |
| 9 | Sinh phẩm chẩn đoán | Test | 1,000 |
| 10 | Khấu hao sinh phẩm cho kiểm tra chất lượng | Test | 1,350 |
| 11 | EQAS (nếu thực hiện) * |
| 0,020 |
| 12 | Kit tách chiết DNA từ virus | Test | 2,350 |
| 13 | DNA marker | Bộ | 1,000 |
| 14 | Primer 1 | ml | 0,0001 |
| 15 | Primer 2 | ml | 0,0001 |
| 16 | Probe | ml | 0,0001 |
| 17 | Ống Eppendorf 1,5 ml | Tube | 3,000 |
| 18 | Ống Eppendorf 0,2 ml | Tube | 1,000 |
| 19 | Đầu côn 10 µl có lọc | Cái | 1,000 |
| 20 | Đầu côn 30 µl | Cái | 1,200 |
| 21 | Đầu côn 200 µl có lọc | Cái | 2,200 |
| 22 | Đầu côn 1 ml có lọc | Cái | 3,200 |
| 23 | Ethanol BDH | ml | 0,500 |
| 24 | Water-DEPC Treated | ml | 2,000 |
| 25 | Giấy thấm | Cuộn | 0,100 |
| 26 | Giấy xét nghiệm | Tờ | 2,000 |
| 27 | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 28 | Bút viết kính | Cái | 0,020 |
| 29 | Bút bi | Cái | 0,010 |
| 30 | Mũ | Cái | 0,020 |
| 31 | Khẩu trang | Cái | 0,020 |
| 32 | Găng tay | Đôi | 0,100 |
| 33 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 34 | Quần áo bảo hộ | Bộ | 0,005 |
| 35 | Dung dịch nước rửa tay | ml | 8,000 |
| 36 | Cồn sát trùng tay nhanh | ml | 1,000 |
| 37 | Dung dịch khử trùng | ml | 10,000 |
| 38 | Khăn lau tay | cái | 0,010 |
* Ghi chú: Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/50 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 2 lần/1 năm).
3. Bệnh phẩm
Huyết thanh, huyết tương
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu phiếu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
- Theo đúng quy định của chuyên ngành Vi sinh (xem phụ lục 3)
- Từ chối những bệnh phẩm không đạt yêu cầu (xem phụ lục 6).
2. Tiến hành kỹ thuật
2.1. Tách chiết DNA tổng số
2.2. Thực hiện Real-time PCR
2.3. Phân tích và đánh giá kết quả
2.4. In và trả kết quả
IV. NHẬN ĐỊNH KẾT QUẢ
Chứng Dương phải xuất hiện đồ thị huỳnh quang trên đường giới hạn cơ bản, chứng Âm phải không có bất kỳ đường đồ thị huỳnh quang nào xuất hiện. Đường đồ thị huỳnh quang của mẫu có thể xuất hiện hoặc không xuất hiện trên đường giới hạn cơ bản, căn cứ vào đó để kết luận kết quả.
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
- Trong trường positive control (PC) và negative control (NC) xuất hiện không đúng với diễn giải ở phần IV thì phải kiểm tra lại Master mix và chứng dương và quá trình tách DNA tổng số, và thực hiện lại xét nghiệm.
- Nếu đường đồ thị huỳnh quang của mẫu xuất hiện ở ngoài chu kỳ thứ 40 thì phải cẩn thận kiểm tra và đánh giá lại mẫu.
98. HBV kháng thuốc giải trình tự gene
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Xác định sự thay đổi trình tự nucleotide trên hệ gen của HBV có liên quan đến kháng thuốc.
2. Nguyên lý
Dựa trên nguyên lý của kỹ thuật giải trình tự nucleotide.
II. CHUẨN BỊ
1.Người thực hiện
- Người thực hiện: Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: Cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2.Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Tủ an toàn Sinh học cấp 2
- Máy PCR
- Máy đọc điện di
- Máy giải trình tự gen
- Máy ly tâm 25000 x g
- Máy ly tâm dùng cho tube 0,2 ml
- Máy ủ nhiệt
- Máy vortex
- Micropipette
- Bộ lưu điện
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
Định mức sinh phẩm và vật tư tiêu hao cho 3 mẫu/lần thực hiện (VD)
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Bông | kg | 0,001 |
| 2 | Cồn | ml | 1,000 |
| 3 | Bơm kim tiêm | Cái | 1,000 |
| 4 | Panh | Cái | 0,0001 |
| 5 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 6 | Hộp vận chuyển bệnh phẩm | Test | 0,001 |
| 7 | Tube đựng bệnh phẩm | Cái | 2,000 |
| 8 | Găng không có bột | Cái | 0,500 |
| 9 | Sinh phẩm chẩn đoán | Test | 1,000 |
| 10 | Khấu hao sinh phẩm cho kiểm tra chất lượng | Test | 1,350 |
| 11 | EQAS (nếu thực hiện) * |
| 0,020 |
| 12 | Kit tách chiết DNA từ virus | Test | 2,350 |
| 13 | DNA marker | Bộ | 1,000 |
| 14 | Primer 1 (bộ primer đặc hiệu) | ml | 0,0001 |
| 15 | Primer 2 (bộ primer đặc hiệu) | ml | 0,0001 |
| 16 | Primer 3 (bộ primer đặc hiệu) | ml | 0,0001 |
| 17 | Primer 4 (bộ primer đặc hiệu) | ml | 0,0001 |
| 18 | Ống Eppendorf 1,5 ml | Tube | 3,000 |
| 19 | Ống Eppendorf 0,2 ml | Tube | 1,000 |
| 20 | Đầu côn 10 µl có lọc | Cái | 1,000 |
| 21 | Đầu côn 30 µl | Cái | 1,200 |
| 22 | Đầu côn 200 µl có lọc | Cái | 2,200 |
| 23 | Đầu côn 1 ml có lọc | Cái | 3,200 |
| 24 | Ethanol BDH | ml | 0,500 |
| 25 | Water-DEPC Treated | ml | 2,000 |
| 26 | Thạch | Gam | 0,075 |
| 27 | Ladder | ml | 0,0025 |
| 28 | Blue Juice Gel loading dye | ml | 0,003 |
| 29 | Ethidium Bromide | ml | 0,100 |
| 30 | TAE Buffer | ml | 0,100 |
| 31 | Giấy thấm | Cuộn | 0,100 |
| 32 | Giấy xét nghiệm | Tờ | 2,000 |
| 33 | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 34 | Bút viết kính | Cái | 0,020 |
| 35 | Bút bi | Cái | 0,010 |
| 36 | Mũ | Cái | 0,020 |
| 37 | Khẩu trang | Cái | 0,020 |
| 38 | Găng tay | Đôi | 0,100 |
| 39 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 40 | Quần áo bảo hộ | Bộ | 0,005 |
| 41 | Dung dịch nước rửa tay | ml | 8,000 |
| 42 | Cồn sát trùng tay nhanh | ml | 1,000 |
| 43 | Dung dịch khử trùng | ml | 10,000 |
| 44 | Khăn lau tay | cái | 0,010 |
* Ghi chú: Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/50 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 2 lần/1 năm).
3. Bệnh phẩm
Huyết thanh, tổ chức sinh thiết.
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu phiếu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
Theo đúng quy định của chuyên ngành Vi sinh: lấy 3 ml máu vào ống lấy máu vô trùng có chất chống đông EDTA.
2. Tiến hành kỹ thuật
2.1. Tách chiết DNA tổng số
2.2. Thực hiện PCR
2.3. Điện di kiểm tra sản phẩm
2.4. Giải trình tự gen
2.5. Kiểm tra và phân tích trình tự gen kháng thuốc của HBV trên ngân hàng dữ liệu gen quốc tế
IV. NHẬN ĐỊNH KẾT QUẢ
Sản phẩm PCR phải có một băng đặc hiệu duy nhất, rõ nét và không bị đứt gẫy. Trình tự DNA của gen không bị nhiễu và phải cho thấy có sự thay đổi một số vị trí nucleotide trên gen tương ứng với các loại thuốc điều trị HBV
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
- Trong trường hợp không có sản phẩm PCR, cần phải kiểm tra lại quá trình tách chiết DNA tổng số, chất lượng primers và master mix, và thực hiện lịa xét nghiệm.
- Nếu trình tự DNA bị nhiễu cần phải kiểm tra lại độ đặc hiệu của sản phẩm PCR hoặc quá trình chạy PCR sequencing bị nhiễm chéo.
99. HCV Ab miễn dịch bán tự động
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Phát hiện kháng thể HCV Ab trong máu
2. Nguyên lý
Dựa trên nguyên lý của kỹ thuật ELISA (miễn dịch gắn enzym) (VD).
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: Cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Dàn máy ELISA.
- Máy ly tâm thường.
- Tủ âm sâu (-20 oC) (nếu có).
- Tủ lạnh 2 oC - 8oC
- Micropipet 100µ, 1000 µl.
- Giá đựng ống máu
- Bộ pipetman 8 kênh (nếu có).
- Ống đong có vạch dung tích 25ml, 100ml, 1000ml
2.2.Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
Định mức sinh phẩm và vật tư tiêu hao cho 25 mẫu/lần thực hiện (VD)
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Bông | Kg | 0,001 |
| 2 | Dây garô | Cái | 0,001 |
| 3 | Tube đựng bệnh phẩm | Cái | 1,000 |
| 4 | Sinh phẩm chẩn đoán | Test | 1,000 |
| 5 | Khấu hao sinh phẩm cho chạy chứng, kiểm tra chất lượng | Test | 0,200 |
| 6 | Chứng ngoại kiểm âm (nếu có) | ml | 0,030 |
| 7 | Chứng ngoại kiểm dương (nếu có) | ml | 0,030 |
| 8 | Ngoại kiểm (nếu có)* |
| 0,020 |
| 9 | Nước cất | ml | 2,000 |
| 10 | Đầu côn 1000 µl | Cái | 1,000 |
| 11 | Đầu côn 200 µl | Cái | 1,050 |
| 12 | Giấy thấm | Cuộn | 0,100 |
| 13 | Giấy xét nghiệm | Tờ | 2,000 |
| 14 | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 15 | Bút viết kính | Cái | 0,020 |
| 16 | Bút bi | Cái | 0,010 |
| 17 | Mũ | Cái | 0,020 |
| 18 | Khẩu trang | Cái | 0,020 |
| 19 | Găng tay | Đôi | 0,100 |
| 20 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 21 | Quần áo bảo hộ | Bộ | 0,005 |
| 22 | Dung dịch nước rửa tay | ml | 8,000 |
| 23 | Cồn sát trùng tay nhanh | ml | 1,000 |
| 24 | Dung dịch khử trùng | ml | 10,000 |
| 25 | Khăn lau tay | Cái | 0,010 |
* Ghi chú: Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/50 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 2 lần/1 năm).
3. Bệnh phẩm
Huyết thanh hoặc huyết tương của người bệnh
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu phiếu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
- Theo đúng quy định của chuyên ngành Vi sinh (xem phụ lục 2)
- Từ chối những bệnh phẩm không đạt yêu cầu (xem phụ lục 6).
2. Tiến hành kỹ thuật
Bộ sinh phẩm MONOLISA Anti - HCV PLUS Bio-Rad (VD)
| Các bước | Xét nghiệm định tính Anti HCV |
| 1 | Chuẩn bị sinh phẩm, sơ đồ nhỏ mẫu |
| 2 | Nhỏ dung dịch pha loãng |
| 3 | Nhỏ chứng và bệnh phẩm theo thứ tự hướng dẫn |
| 4 | Đậy tấm phản ứng và ủ ở nhiệt độ và trong thời gian quy định theo quy trình hướng dẫn của nhà sản xuất |
| 5 | Rửa tấm phản ứng bằng chương trình theo quy trình hướng dẫn của nhà sản xuất |
| 6 | Nhỏ dung dịch cộng hợp vào các giếng |
| 7 | ủ ở nhiệt độ phòng (180C - 300C) theo hướng dẫn. |
| 8 | Rửa phiến nhựa và làm khô |
| 9 | Pha dung dịch cơ chất và nhỏ vào mỗi giếng. Để tấm phản ứng trong tối theo quy trình ở nhiệt độ phòng (18 oC - 30 oC) như hướng dẫn của nhà sản xuất. |
| 10 | Dừng phản ứng |
| 11 | Đọc KQ ở bước sóng 450/620 -700 nm bằng máy đo mật độ quang. |
IV. NHẬN ĐỊNH KẾT QUẢ
1. Điều kiện
PC: Độ hấp phụ của chứng dương (R4)
PCx: Giá trị OD trung bình của chứng dương
CO: Giá trị ngưỡng
| PCx = | Tổng số OD của chứng dương |
| 3 |
1.000 ≤ PC ≤ 2.400
NC < 0,15
Loại chứng dương PC có giá trị cao hơn 30% so với giá trị PCx. Tiếp tục tính kết quả theo 2 chứng dương còn lại.
| CO = | PCx |
| 5 |
3. Nhận định, trả lời kết quả
- Mẫu huyết thanh:
Mẫu huyết thanh có OD < CO được coi là âm tính.
Cần thận trọng trong trường hợp mẫu huyết thanh có CO -10% < OD<CO.
Trường hợp này phải được xét nghiệm lại .
Mẫu huyết thanh có OD≥ CO cần được xét nghiệm lại.
+ Nếu lần 2 hoặc lần 3 có OD≥ CO, mẫu được coi là dương tính.
+ Nếu 2 lần đều có OD < CO, mẫu được coi là âm tính
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
1. Sai sót
Có thể xảy ra hiện tượng âm tính giả hoặc dương tính giả, thông thường do:
- Thực hiện sai các bước trong quy trình hướng dẫn.
- Chứng âm và những mẫu bệnh phẩm âm tính bị nhiễm chéo bởi huyết thanh/ huyết tương có nồng độ kháng thể cao.
- Cơ chất bị nhiễm bởi các tác nhân oxy hoá (thuốc tẩy, ion kim loại v.v…) ,
- Dung dịch dừng phản ứng bị nhiễm bẩn.
2. Xử trí
- Tuân thủ đúng các bước quy trình hướng dẫn của nhà sản xuất và hướng dẫn về độ ổn định hóa chất xét nghiệm trong bộ sinh phẩm sử dụng.
- Kiểm tra và vệ sinh máy rửa thường xuyên trước và sau khi làm xét nghiệm
- Chia hóa chất (chất cộng hợp, dung dịch hiện màu và dừng phản ứng) vào ống nghiệm sạch trước mỗi lần nhỏ.
100. HCV Ab miễn dịch tự động
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Phát hiện kháng thể HCV Ab trong máu.
2. Nguyên lý
Dựa trên nguyên lý của kỹ thuật CLIA (miễn dịch điện hóa phát quang) (VD).
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: Cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Hệ thống máy miễn dịch tự động.
- Bộ lưu điện
- Máy ly tâm thường.
- Tủ âm sâu (-20 oC) (nếu có).
- Tủ lạnh 2 oC - 8 oC
- Micropipet thể tích 50 µl - 200 µl
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
Định mức sinh phẩm và vật tư tiêu hao cho 15 mẫu/lần thực hiện (VD)
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Bông | Kg | 0,001 |
| 2 | Dây garô | Cái | 0,001 |
| 3 | Cồn | ml | 1,000 |
| 4 | Bơm kim tiêm | Cái | 1,000 |
| 5 | Panh | Cái | 0,0001 |
| 6 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 7 | Hộp vận chuyển bệnh phẩm | Cái | 0,001 |
| 8 | Tube đựng bệnh phẩm | Cái | 1,000 |
| 9 | Sinh phẩm chẩn đoán | Test | 1,000 |
| 10 | Khấu hao sinh phẩm cho chạy chuẩn | Test | 0,100 |
| 11 | Khấu hao sinh phẩm cho chạy chứng, kiểm tra chất lượng | Test | 0,150 |
| 12 | Chứng ngoại kiểm âm (nếu có) | ml | 0,010 |
| 13 | Chứng ngoại kiểm dương (nếu có) | ml | 0,010 |
| 14 | Chứng nội kiểm | Test | 0,100 |
| 15 | Ngoại kiểm (nếu có)* | ml | 0,020 |
| 16 | Cleancell M | ml | 3,000 |
| 17 | Procell M | ml | 3,000 |
| 18 | Probe Wash M | ml | 2,000 |
| 19 | Preclean M | ml | 2,000 |
| 20 | Assay Tip/Cup E170 | Chiếc | 3,000 |
| 21 | ISE Cleaning Solution F. HIT | ml | 0,500 |
| 22 | Nước cất | ml | 5,000 |
| 23 | Sample cup | Chiếc | 1,000 |
| 24 | Giấy thấm | Cuộn | 0,100 |
| 25 | Giấy xét nghiệm | Tờ | 2,000 |
| 26 | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 27 | Bút viết kính | Cái | 0,020 |
| 28 | Bút bi | Cái | 0,010 |
| 29 | Mũ | Cái | 0,020 |
| 30 | Khẩu trang | Cái | 0,020 |
| 31 | Găng tay | Đôi | 0,100 |
| 32 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 33 | Quần áo bảo hộ | Bộ | 0,005 |
| 34 | Dung dịch nước rửa tay | ml | 8,000 |
| 35 | Cồn sát trùng tay nhanh | ml | 1,000 |
| 36 | Dung dịch khử trùng | ml | 10,000 |
| 37 | Khăn lau tay | Cái | 0,010 |
* Ghi chú: Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) mà là 1/50 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 2 lần/1 năm).
3. Bệnh phẩm
Huyết thanh hoặc huyết tương của người bệnh
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu phiếu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
- Theo đúng quy định của chuyên ngành Vi sinh (xem phụ lục 2)
- Từ chối những bệnh phẩm không đạt yêu cầu (xem phụ lục 6).
2. Tiến hành kỹ thuật
Bộ sinh phẩm Elecsys Anti-HCV - Roche (VD)
| Các bước | Xét nghiệm xác định Anti-HCV |
| 1 | Pha thuốc thử trước khi sử dụng, tránh tạo bọt |
| 2 | Ủ lọ thuốc thử đã được hồi chỉnh trong thời gian quy định ở thích hợp theo hướng dẫn và kết thúc quá trình hồi chỉnh. Có thể lưu lọ thuốc thử đã hồi chỉnh qua đêm ở nhiệt độ thích hợp theo hướng dẫn của nhà sản xuất. |
| 3 | Nạp thuốc thử vào khay chứa thuốc thử |
| 4 | Vào Reagent để kiểm tra số lượng tests |
| 5 | Vào Calibration → Status để kiểm tra hiệu chuẩn |
| 6 | Chạy chứng |
| Chạy mẫu không dùng barcode | |
| 1 | Đánh số sample cup theo mã số bệnh phẩm. Hút mẫu và chứng ngoại kiểm (nếu có) vào sample cup tương ứng |
| 2 | Vào màn hình Workplace → Test Selection |
| 3 | Nhập mã bệnh phẩm và ngày thực hiện xét nghiệm |
| 4 | Chọn tên test là anti-HCV |
| 5 | Vào Barcode Read Error |
| 6 | Nhập số rack và vị trí mẫu → Add → OK → Save |
| 7 | Đặt mẫu huyết thanh người bệnh cần chạy vào Sample Cup lên Rack đúng vị trí đưa vào khu nạp giá mẫu. |
| 8 | Chọn Start → Chọn START ở màn hình Start Conditions |
| Chạy mẫu có barcode | |
| 1 | Nhập chỉ định xét nghiệm vào hệ thống LIS |
| 2 | Đặt ống máu dán barcode vào rack đưa vào khu nạp giá mẫu |
| 3 | Chọn Start → Chọn START ở màn hình Start Conditions |
IV. NHẬN ĐỊNH KẾT QUẢ
1. Đánh giá theo tiêu chuẩn nhà sản xuất
- Chạy kiểm tra chứng 1 và chứng 2 trên tất cả các điện cực dùng để chạy xét nghiệm.
- Giá trị chứng đạt được phải nằm trong khoảng giới hạn xác định.
2. Đánh giá theo tiêu chuẩn phòng xét nghiệm
Chứng nội kiểm, ngoại kiểm (nếu có)
3. Kết quả và báo cáo
- Mẫu huyết thanh: Máy sẽ tự động tính toán giá trị ngưỡng dựa trên số đo của Cal1 và Cal2. Kết quả của mẫu bệnh phẩm sẽ được thông báo là dương tính hoặc âm tính cùng với chỉ số ngưỡng (COI).
Kết quả được diễn giải như sau:
- Nếu COI < 0.90: mẫu bệnh phẩm được coi là âm tính với anti-HCV.
- Nếu 0.90 ≤ COI ≤ 1.0: mẫu bệnh phẩm này nằm trong giới hạn nghi ngờ, cần phải kiểm tra lại.
- Nếu COI > 1.0: mẫu bệnh phẩm được coi là dương tính với anti-HCV.
- Đối với những mẫu được kiểm tra lại lần 2:
+ Nếu COI < 0.90 thì kết luận âm tính.
+ Nếu COI ≥ 0.90 giống như lần đầu thì kết luận dương tính.
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
- Máy sẽ báo sample short (bệnh phẩm đông hoặc không đủ) →. Chú ý ly tâm mẫu thật kỹ ngay từ đầu hoặc hút mẫu ra cup (thực hiện theo đúng yêu cầu của lấy mẫu xét nghiệm Vi sinh)
- Không sử dụng thuốc thử đã quá hạn sử dụng.
- Tránh tạo bọt ở lọ thuốc thử và các loại mẫu (bệnh phẩm, calibration và chứng).
- Tham khảo thêm hướng dẫn của nhà sản xuất.
101. HCV Ag/Ab miễn dịch bán tự động
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Phát hiện kháng nguyên, kháng thể HCV Ag/Ab trong máu.
2. Nguyên lý
Dựa trên nguyên lý của kỹ thuật ELISA (miễn dịch gắn enzym) (VD).
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện: Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: Cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1.Trang thiết bị
- Dàn máy ELISA.
- Máy ly tâm thường.
- Tủ âm sâu (-20oC) (nếu có).
- Tủ lạnh 2 oC - 8 oC
- Micropipet vi lượng 100µl, 1000 µl.
- Giá đựng ống máu
- Bộ pipetman 8 kênh (nếu có).
- Ống đong có vạch dung tích 25ml, 100ml, 1000ml
2.2.Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
Định mức sinh phẩm và vật tư tiêu hao cho 20 mẫu/lần thực hiện (VD)
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Bông | Kg | 0,001 |
| 2 | Dây garô | Cái | 0,001 |
| 3 | Tube đựng bệnh phẩm | Cái | 1,000 |
| 4 | Sinh phẩm chẩn đoán | Test | 1,000 |
| 5 | Khấu hao sinh phẩm cho chạy chứng, kiểm tra chất lượng | Test | 0,200 |
| 6 | Chứng ngoại kiểm âm (nếu có) | ml | 0,030 |
| 7 | Chứng ngoại kiểm dương (nếu có) | ml | 0,030 |
| 8 | Ngoại kiểm (nếu có)* |
| 0,020 |
| 9 | Nước cất | ml | 2,000 |
| 10 | Đầu côn 1000 µl | Cái | 1,000 |
| 11 | Đầu côn 200 µl | Cái | 1,050 |
| 12 | Giấy thấm | Cuộn | 0,100 |
| 13 | Giấy xét nghiệm | Tờ | 2,000 |
| 14 | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 15 | Bút viết kính | Cái | 0,020 |
| 16 | Bút bi | Cái | 0,010 |
| 17 | Mũ | Cái | 0,020 |
| 18 | Khẩu trang | Cái | 0,020 |
| 19 | Găng tay | Đôi | 0,100 |
| 20 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 21 | Quần áo bảo hộ | Bộ | 0,005 |
| 22 | Dung dịch nước rửa tay | ml | 8,000 |
| 23 | Cồn sát trùng tay nhanh | ml | 1,000 |
| 24 | Dung dịch khử trùng | ml | 10,000 |
| 25 | Khăn lau tay | Cái | 0,010 |
* Ghi chú: Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/50 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 2 lần/1 năm).
3. Bệnh phẩm
Huyết thanh hoặc huyết tương của người bệnh
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu phiếu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
- Theo đúng quy định của chuyên ngành Vi sinh (xem phụ lục 2 )
- Từ chối những bệnh phẩm không đạt yêu cầu (xem phụ lục 6).
2. Tiến hành kỹ thuật
Bộ sinh phẩm MONOLISA HCV Ag-Ab ULTRA Bio-Rad (VD)
| Các bước | Xét nghiệm định tính Anti HCV |
| 1 | Chuẩn bị sinh phẩm, sơ đồ nhỏ mẫu |
| 2 | Nhỏ dung dịch cộng hợp 1 |
| 3 | Nhỏ chứng và bệnh phẩm hoặc mẫu ngoại kiểm (nếu có) theo thứ tự hướng dẫn. |
| 4 | Đậy tấm phản ứng và ủ ở nhiệt độ và trong thời gian quy định theo quy trình hướng dẫn của nhà sản xuất |
| 5 | Rửa tấm phản ứng bằng chương trình theo quy trình hướng dẫn của nhà sản xuất |
| 6 | Nhỏ dung dịch cộng hợp 2 vào các giếng theo hướng dẫn. |
| 7 | ủ ở nhiệt độ và thời gian theo hướng dẫn. |
| 8 | Rửa phiến nhựa và làm khô |
| 9 | Pha dung dịch cơ chất và nhỏ vào mỗi giếng. Để tấm phản ứng trong tối theo quy trình ở nhiệt độ phòng (18 oC - 30 oC) trong thời gian như hướng dẫn của nhà sản xuất. |
| 10 | Dừng phản ứng |
| 11 | Đọc KQ ở bước sóng 450/620 -700 nm bằng máy đo mật độ quang. |
IV. NHẬN ĐỊNH KẾT QUẢ
1. Điều kiện
PC Ab: Độ hấp phụ của chứng dương Ab
PC Ag: Độ hấp phụ của chứng dương Ag
PCx: Giá trị OD trung bình của chứng dương Ab
CO: Giá trị ngưỡng
| PCx = | Tổng số OD của chứng dương |
| 3 |
NC < 0,6 x CO
0.800 ≤ PC Ab ≤ 2.400
PC Ag > 0,500
Loại chứng dương PC có giá trị cao hơn 30% so với giá trị PCx. Tiếp tục tính kết quả theo 2 chứng dương còn lại.
| CO = | PCx |
| 4 |
2. Nhận định, trả lời kết quả
Mẫu huyết thanh:
Mẫu huyết thanh có OD < CO được coi là âm tính.
Cần thận trọng trong trường hợp mẫu huyết thanh có CO -10% < OD<CO. Trường hợp này phải được xét nghiệm lại.
Mẫu huyết thanh có OD ≥ CO cần được xét nghiệm lại.
+ Nếu lần 2 hoặc lần 3 có OD ≥ CO, mẫu được coi là dương tính.
+ Nếu 2 lần đều có OD < CO, mẫu được coi là âm tính
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
1. Sai sót
Có thể xảy ra hiện tượng âm tính giả hoặc dương tính giả, thông thường do:
- Thực hiện sai các bước trong quy trình hướng dẫn.
- Chứng âm và những mẫu bệnh phẩm âm tính bị nhiễm chéo bởi huyết thanh/ huyết tương có nồng độ kháng thể cao.
- Cơ chất bị nhiễm bởi các tác nhân oxy hoá (thuốc tẩy, ion kim loại v.v…) ,
- Dung dịch dừng phản ứng bị nhiễm bẩn.
2. Xử trí
- Tuân thủ đúng các bước quy trình hướng dẫn của nhà sản xuất và hướng dẫn về độ ổn định hóa chất xét nghiệm trong bộ sinh phẩm sử dụng.
- Kiểm tra và vệ sinh máy rửa thường xuyên trước và sau khi làm xét nghiệm
- Chia hóa chất (chất cộng hợp, dung dịch hiện màu và dừng phản ứng) vào ống nghiệm sạch trước mỗi lần nhỏ.
102. HCV Core Ag miễn dịch tự động
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Phát hiện và định lượng HCV Core Ag trong máu.
2. Nguyên lý
Dựa trên nguyên lý của kỹ thuật CMIA (phản ứng hóa phát quang được tính bằng đơn vị ánh sáng tương đương RLU) với quy trình xét nghiệm linh hoạt Chemiflex.
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện: Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: Cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1.Trang thiết bị
- Hệ thống máy miễn dịch tự động.
- Bộ lưu điện
- Máy ly tâm thường.
- Tủ âm sâu (-20 oC) (nếu có).
- Tủ lạnh 2 oC - 8oC
- Micropipet thể tích 50 µl - 200 µl
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
Định mức sinh phẩm và vật tư tiêu hao cho 15 mẫu/lần thực hiện (VD)
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Bông | Kg | 0,001 |
| 2 | Dây garô | Cái | 0,001 |
| 3 | Cồn | ml | 1,000 |
| 4 | Bơm kim tiêm | Cái | 1,000 |
| 5 | Panh | Cái | 0,0001 |
| 6 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 7 | Hộp vận chuyển bệnh phẩm | Cái | 0,001 |
| 8 | Tube đựng bệnh phẩm | Cái | 1,000 |
| 9 | Sinh phẩm chẩn đoán | Test | 1,000 |
| 10 | Khấu hao sinh phẩm cho chạy chuẩn | Test | 0,100 |
| 11 | Khấu hao sinh phẩm cho chạy chứng, kiểm tra chất lượng | Test | 0,150 |
| 12 | Chứng ngoại kiểm âm (nếu có) | ml | 0,010 |
| 13 | Chứng ngoại kiểm dương (nếu có) | ml | 0,010 |
| 14 | HCV Ag Calibrators | ml | 0,050 |
| 15 | HCV Ag Controls | ml | 0,200 |
| 17 | Ngoại kiểm (nếu có)* |
| 0,020 |
| 18 | Pre-trigger solution | ml | 3,000 |
| 19 | Trigger solution | ml | 3,000 |
| 20 | Wash Buffer | ml | 2,000 |
| 21 | Reaction Vessel | Cái | 1,000 |
| 22 | Sample Cup | Cái | 1,000 |
| 23 | Septum | Cái | 0,050 |
| 24 | Replacement Cap | Cái | 0,001 |
| 25 | Nước cất 2 lần | ml | 5,000 |
| 26 | Giấy thấm | Cuộn | 0,100 |
| 27 | Giấy xét nghiệm | Tờ | 2,000 |
| 28 | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 29 | Bút viết kính | Cái | 0,020 |
| 30 | Bút bi | Cái | 0,010 |
| 31 | Mũ | Cái | 0,020 |
| 32 | Khẩu trang | Cái | 0,020 |
| 33 | Găng tay | Đôi | 0,100 |
| 34 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 35 | Quần áo bảo hộ | Bộ | 0,005 |
| 36 | Dung dịch nước rửa tay | ml | 8,000 |
| 37 | Cồn sát trùng tay nhanh | ml | 1,000 |
| 38 | Dung dịch khử trùng | ml | 10,000 |
| 39 | Khăn lau tay | Cái | 0,010 |
* Ghi chú: Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/50 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 2 lần/1 năm).
3. Bệnh phẩm
Huyết thanh hoặc huyết tương của người bệnh
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu phiếu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
- Theo đúng quy định của chuyên ngành Vi sinh (xem phụ lục 2)
- Từ chối những bệnh phẩm không đạt yêu cầu (xem phụ lục 6).
2. Tiến hành kỹ thuật
Bộ sinh phẩm ARCHITECT HCV Ag - Abbott (VD)
| Các bước | Xét nghiệm xác định HCV Core Ag |
| 1 | Máy ở chế độ READY Nạp bộ thuốc thử ARCHITECT HCV Ag vào hệ thống (lắc chai Vi hạt để phân tán các vi hạt có thể bị lắng trong quá trình vận chuyển). • Lắc đảo ngược chai vi hạt để được phân tán hoàn toàn. • Đặt septum lên chai. Nạp thuốc thử vào khay, chai thuốc thử đã mở nắp đều có septum đậy lại |
| 2 | Vào màn hình chính, chọn Reagent à Reagent Status kiểm tra số lượng tests. Kiểm tra Cal Status của hộp thuốc thử ở chế độ Active. |
| 3 | Vào Supply à Supply Status kiểm tra các vật tư tiêu hao và dung dịch chạy máy. |
| 4 | Chuyển máy sang chế độ RUNNING |
| 5 | Tiến hành chạy mẫu chứng (control). Tham khảo quy trình chạy mẫu chứng |
| 6 | Chạy mẫu bệnh phẩm theo các bước sau: Ly tâm máu người bệnh 3000 vòng trong 10 phút. |
| Chạy mẫu không dùng barcode | |
| 1 | Cho trực tiếp ống máu vào Sample Carrier |
| 2 | Vào màn hình Order à Patient Order |
| 3 | Nhập mã Carrier, mã bệnh phẩm |
| 4 | Chọn Test HCV Ag |
| 5 | Chọn Add Order |
| 6 | Đưa Carrier vào bộ phận nạp mẫu trên máy |
| Chạy mẫu dùng barcode | |
| 1 | Nhập chỉ định định xét nghiệm trên máy tính (hệ thống LIS) |
| 2 | Đặt ống máu đã được dán barcode vào Carrier, quay mặt barcode ra phía ngoài rồi đưa vào bộ phận nạp mẫu |
IV. NHẬN ĐỊNH KẾT QUẢ
1. Đánh giá theo tiêu chuẩn nhà sản xuất
- Chạy mẫu chứng mỗi khi mở một hộp kit mới, ít nhất 24 giờ một lần trước khi chạy test và sau mỗi lần chạy chuẩn.
- Giá trị chứng đạt được phải nằm trong khoảng giới hạn xác định. Giới hạn này được qui định trong bộ chứng và có thể có sự thay đổi về giới hạn chứng. Vì vậy khi nhận một lô control mới, cần kiểm tra “Bảng giá trị” của nhà sản xuất xem có phải thay đổi lại giá trị chứng hay không. Nếu cần thì phải nhập lại số liệu bằng tay để cập nhật giá trị chứng mới.
2. Đánh giá theo tiêu chuẩn phòng xét nghiệm
Chứng nội kiểm, ngoại kiểm (nếu có)
3. Kết quả và báo cáo
- Xét nghiệm ARCHITECT HCV Ag sử dụng phương pháp rút giảm số liệu cho phù hợp với đường cong Logistic 4 Thông số (gọi tắt là 4PLC, theo trục Y) để vẽ đường cong hiệu chuẩn.
- Mẫu có nồng độ < 3.00 fmol/L được xem là không phản ứng với HCV Ag.
+ Mẫu có nồng độ ≥ 3.00 fmol/L được xem là có phản ứng với HCV Ag.
+ Mẫu có nồng độ ≥ 3.00 fmol/L và < 10.00 fmol/L nên được làm lại 2 lần.
+ Nếu cả hai lần chạy lại xét nghiệm đều cho kết quả không phản ứng, mẫu được xem là không phản ứng với HCV Ag.
+ Nếu một trong hai kết quả xét nghiệm chạy lại ≥ 3.00 fmol/L, mẫu được xem là phản ứng lặp lại với HCV Ag, là kết quả định lượng ban đầu được sử dụng làm kết quả báo cáo cuối cùng.
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
- Máy sẽ báo sample short (bệnh phẩm đông hoặc không đủ) →. Chú ý ly tâm mẫu thật kỹ ngay từ đầu hoặc hút mẫu ra cup (thực hiện theo đúng yêu cầu của lấy mẫu xét nghiệm Vi sinh)
- Không sử dụng thuốc thử đã quá hạn sử dụng.
- Tránh tạo bọt ở lọ thuốc thử và các loại mẫu (bệnh phẩm, calibration và chứng).
- Trước khi nạp bộ thuốc thử ARCHITECT HCV Ag vào hệ thống lần đầu tiên, lắc chai Vi hạt để phân tán các vi hạt có thể bị lắng trong quá trình vận chuyển.
- Các màng ngăn PHẢI được dùng để tránh sự bay hơi và nhiễm chéo nhằm đảm bảo tính đồng nhất của thuốc thử. Nếu không, độ tin cậy của kết quả xét nghiệm sẽ không được đảm bảo.
- Để tránh nhiễm chéo, cần mang găng tay sạch khi đặt màng ngăn lên chai thuốc thử đã mở nắp.
- Tham khảo thêm hướng dẫn của nhà sản xuất.
103. HCV PCR
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Xác định sự có mặt gen đặc trưng của HCV (virus viêm gan C)
2. Nguyên lý
Dựa trên nguyên lý kỹ thuật RT-PCR
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện: Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: Cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2.Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Tủ an toàn sinh học cấp 2
- Máy PCR
- Bể điện di
- Máy đọc điện di
- Máy ly tâm 25000 x g
- Máy ly tâm dùng cho tube 0,2 ml
- Máy ủ nhiệt
- Máy vortex
- Micropipette
- Bộ lưu điện
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
Định mức sinh phẩm và vật tư tiêu hao cho 2 mẫu/lần thực hiện (VD)
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Bông | kg | 0,001 |
| 2 | Cồn | ml | 1,000 |
| 3 | Bơm kim tiêm | Cái | 1,000 |
| 4 | Panh | Cái | 0,0001 |
| 5 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 6 | Hộp vận chuyển bệnh phẩm | Test | 0,001 |
| 7 | Tube đựng bệnh phẩm | Cái | 2,000 |
| 8 | Găng không có bột | Cái | 0,500 |
| 9 | Sinh phẩm chẩn đoán | Test | 1,000 |
| 10 | Khấu hao sinh phẩm cho kiểm tra chất lượng | Test | 1,350 |
| 11 | EQAS (nếu thực hiện) * |
| 0,020 |
| 12 | Kit tách ARN từ virus | Test | 2,350 |
| 13 | DNA marker | Bộ | 1,000 |
| 14 | Primer 1-1 (primer đặc hiệu) | ml | 0,0001 |
| 15 | Primer 1-2 (primer đặc hiệu) | ml | 0,0001 |
| 16 | Primer 2-1 (primer đặc hiệu) | ml | 0,0001 |
| 17 | Primer 2-2 (primer đặc hiệu) | ml | 0,0001 |
| 18 | Ống Eppendorf 1,5 ml | Tube | 3,000 |
| 19 | Ống Eppendorf 0,2 ml | Tube | 1,000 |
| 20 | Đầu côn 10 µl có lọc | Cái | 1,000 |
| 21 | Đầu côn 30 µl | Cái | 1,200 |
| 22 | Đầu côn 200 µl có lọc | Cái | 2,200 |
| 23 | Đầu côn 1 ml có lọc | Cái | 3,200 |
| 24 | Ethanol BDH | ml | 0,500 |
| 25 | Water-DEPC Treated | ml | 2,000 |
| 26 | Thạch | Gam | 0,075 |
| 27 | Ladder | ml | 0,0025 |
| 28 | Blue Juice Gel loading dye | ml | 0,003 |
| 29 | Ethidium Bromide | ml | 0,100 |
| 30 | TAE Buffer | ml | 0,100 |
| 31 | Giấy thấm | Cuộn | 0,100 |
| 32 | Giấy xét nghiệm | Tờ | 2,000 |
| 33 | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 34 | Bút viết kính | Cái | 0,020 |
| 35 | Bút bi | Cái | 0,010 |
| 36 | Mũ | Cái | 0,020 |
| 37 | Khẩu trang | Cái | 0,020 |
| 38 | Găng tay | Đôi | 0,100 |
| 39 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 40 | Quần áo bảo hộ | Bộ | 0,005 |
| 41 | Dung dịch nước rửa tay | ml | 8,000 |
| 42 | Cồn sát trùng tay nhanh | ml | 1,000 |
| 43 | Dung dịch khử trùng | ml | 10,000 |
| 44 | Khăn lau tay | cái | 0,010 |
* Ghi chú: Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/50 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 2 lần/1 năm).
3. Bệnh phẩm
Huyết thanh, huyết tương, tổ chức sinh thiết
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu phiếu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1.Lấy bệnh phẩm
- Theo đúng quy định của chuyên ngành Vi sinh (xem phụ lục 3)
- Từ chối những bệnh phẩm không đạt yêu cầu (xem phụ lục 6).
2. Tiến hành kỹ thuật
2.1. Tách chiết ARN tổng số
2.2. Thực hiện RT-PCR
2.3. Điện di kiểm tra sản phẩm
2.4. Đánh giá và kết luận
IV. NHẬN ĐỊNH KẾT QUẢ
Sản phẩm PCR phải có một băng đặc hiệu duy nhất, rõ nét và không bị đứt gẫy và có kích thước tương ứng với thang DNA chuẩn.
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
Trong trường hợp không có sản phẩm PCR, cần phải kiểm tra lại quá trình tách chiết ARN tổng số, chất lượng primers và master mix, và thực hiện lại xét nghiệm.
104. HCV đo tải lượng Real-time PCR
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Xác định số lượng bản sao của virus viêm gan C (HCV) trong một đơn vị thể tích máu (copies/ml).
2. Nguyên lý
Dựa trên nguyên lý của kỹ thuật Real-time RT-PCR.
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: Cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Máy real-time PCR và hệ thống máy vi tính.
- Bộ lưu điện
- Máy ủ nhiệt
- Máy ly tâm dung cho tube 0,2 ml
- Máy ly tâm 25000 x g
- Tủ lạnh 2 oC - 8 oC
- Tủ âm sâu (- 20 oC) hoặc (-70 oC) (nếu có)
- Máy vortex
- Tủ an toàn sinh học
- Micropipettes các thể tích từ 5 ml - 1000 ml.
2.2. Dụng cụ, hóa chất và vật tư tiêu hao
Định mức sinh phẩm và vật tư tiêu hao cho 8 mẫu/lần thực hiện (VD)
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Bông | Kg | 0,001 |
| 2 | Dây garô | Cái | 0,001 |
| 3 | Cồn | ml | 1,000 |
| 4 | Bơm kim tiêm | Cái | 1,000 |
| 5 | Panh | Cái | 0,0001 |
| 6 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 7 | Hộp vận chuyển bệnh phẩm | Test | 0,001 |
| 8 | Tube đựng bệnh phẩm | Cái | 2,000 |
| 9 | Găng không có bột tal | Cái | 0,500 |
| 10 | Sinh phẩm chẩn đoán | Test | 1,000 |
| 11 | Khấu hao sinh phẩm cho chạy chứng, kiểm tra chất lượng | Test | 0,400 |
| 12 | Kít tách ARN | Test | 1,400 |
| 13 | cDNA | Test | 1,400 |
| 14 | HCV Standard | Bộ | 0,200 |
| 15 | Ngoại kiểm (nếu có)* |
| 0,020 |
| 16 | Ependoff 1,7ml | Tube | 2,000 |
| 17 | Ependoff 0,2ml | Tube | 1,000 |
| 18 | Đầu côn 10 µl có lọc | Cái | 1,100 |
| 19 | Đầu côn 30 µl | Cái | 1,100 |
| 20 | Đầu côn 200 µl có lọc | Cái | 2,200 |
| 21 | Đầu côn 1 ml có lọc | Cái | 2,200 |
| 22 | Ethanol BDH | ml | 0,250 |
| 23 | Water-DEPC Treated | ml | 2,000 |
| 24 | Giấy thấm | Cuộn | 0,100 |
| 25 | Giấy xét nghiệm | Tờ | 2,000 |
| 26 | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 27 | Bút viết kính | Cái | 0,020 |
| 28 | Bút bi | Cái | 0,010 |
| 29 | Mũ | Cái | 0,020 |
| 30 | Khẩu trang | Cái | 0,020 |
| 31 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 32 | Quần áo bảo hộ | Bộ | 0,005 |
| 33 | Dung dịch nước rửa tay | ml | 8,000 |
| 34 | Cồn sát trùng tay nhanh | ml | 1,000 |
| 35 | Dung dịch khử trùng | ml | 10,000 |
| 36 | Khăn lau tay | Cái | 0,010 |
* Ghi chú: Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/50 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 2 lần/1 năm).
3. Bệnh phẩm
Huyết thanh, huyết tương hoặc máu toàn phần
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1.Lấy bệnh phẩm
- Theo đúng quy định của chuyên ngành Vi sinh (xem phụ lục 3)
- Từ chối những bệnh phẩm không đạt yêu cầu (xem phụ lục 6).
2. Tiến hành kỹ thuật: Bộ sinh phẩm HCV qPCR (VD)
2.1. Tách chiết RNA
2.2. Thực hiện phản ứng RT-PCR
Thực hiện bước này với các tube RT-Mix được giữ trong khay lạnh hoặc đá đang tan.
- Cho chứng +, chứng - hoặc dịch RNA tách chiết vào tube.
- Lập chương trình cho máy PCR hoạt động
- Sản phẩm cDNA được dùng để thực hiện phản ứng PCR.
- Nếu chưa thực hiện phản ứng PCR ngay, phải bảo quản cDNA ở -20oC.
2.3. Thực hiện phản ứng real-time PCR
- Thực hiện bước này với các tube PCR mix được giữ trong khay lạnh hoặc đá đang tan.
- Chỉ lấy đủ số tube PCR mix cần. Trước và sau khi đặt phản ứng PCR phải ly tâm tube để tất cả dung dịch nằm dước đáy tube.
- Cho cDNA từ phản ứng RT ở trên vào từng tube HCV qPCR Mix. Sau đó đặt các tube vào máy real-time PCR cùng với 1 bộ standard.
- Khởi động máy real-time PCR. Khởi động máy tính và chương trình real-time PCR.
- Cài đặt vị trí mẫu “Plate setup” trên phần mềm đúng với vị trí mẫu đã đặt trên máy real-time PCR.
- Chọn màu “FAM” cho standard. Màu “FAM” và “HEX” cho mẫu, chứng dương và chứng âm.
- Cài đặt chương trình “Protocol” cho máy real-time PCR hoạt động
- Lưu file dữ liệu vào máy tính.
- Cho máy real-time PCR chạy chương trình.
IV. NHẬN ĐỊNH KẾT QUẢ
1. Điều kiện của phản ứng
- Chứng dương có đường biểu diễn tín hiệu huỳnh quang màu FAM dương tính và đường biểu diễn tín hiệu huỳnh quang màu HEX dương tính hoặc âm tính.
- Chứng âm có đường biểu diễn tín hiệu huỳnh quang màu FAM âm tính và đường biểu diễn tín hiệu huỳnh quang màu HEX dương tính
2. Phân tích standard
- Hệ số tuyến tính (R2) phải nằm trong khoảng 0.960-1.000, tốt nhất 0.990-1.000.
- Hiệu suất nhân bản (PCR efficiency) phải nằm trong khoảng 90-115%, tốt nhất 95-110%.
- Hệ số dốc (Slope) phải nằm trong khoảng -3 đến -4, tốt nhất -3.3 đến -3.6.
3. Phân tích mẫu
- Ngưỡng phát hiện của bộ kit là 3x102 copies/ml
- Những mẫu dương tính chỉ cần chọn màu FAM để phân tích
Các kết quả dương tính được nhân với hệ số pha loãng sẽ thu được kết quả hàm lượng virus/ml máu (copies/ml), do đó kết quả sau khi nhân:
+ Nếu ≥ 3x102 thì kết luận “Mẫu dương tính: a copies/ml”
+ Nếu < 3x102 thì kết luận “Mẫu dương tính dưới ngưỡng định lượng”.
- Những mẫu âm tính, chứng nội phải dương tính thì mới kết luận mẫu âm tính thật sự.
4. In đồ thị kết quả.
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
Có mẫu và chứng nội cũng đều âm tính. Chứng bình thường, có mẫu dương, mẫu âm thật sự.
1. Nguyên nhân: Có thể mẫu âm thực sự, có thể phản ứng PCR bị ức chế.
2. Khắc phục
- Pha loãng mẫu từ 10-100 lần, thực hiện lại toàn bộ thí nghiệm từ bước tách chiết. Sau khi có kết quả phải nhân thêm với hệ số pha loãng mẫu. Nếu vẫn gặp sự cố trên, lấy lại mẫu theo đúng yêu cầu.
- Trừ những mẫu sự cố, tất cả các mẫu bình thường đều có thể lấy kết quả.
105. HCV đo tải lượng hệ thống tự động
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Đếm số lượng bản copies của HCV RNA trong một đơn vị thể tích huyết thanh hoặc huyết tương (ml).
2. Nguyên lý
Dựa trên nguyên lý của kỹ thuật Real-time RT PCR.
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện: Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: Cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.2 .Trang thiết bị
- Máy ly tâm thường.
- Tủ lạnh 2 oC - 8 oC
- Tủ âm sâu (-20 oC) hoặc (-70 oC) (nếu có)
- Tủ an toàn sinh học cấp 2
- Máy vortex
- Hệ thống máy tách chiết tự động (RNA, DNA) và định lượng COBAS®AmpliPrep/COBAS® TaqMan 48 Analyzer (Roche) (VD)
- Bộ lưu điện
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
Định mức sinh phẩm và vật tư tiêu hao cho 10 mẫu/lần thực hiện (VD)
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Bông | Kg | 0,001 |
| 2 | Dây garô | Cái | 0,001 |
| 3 | Cồn | ml | 1,000 |
| 4 | Bơm kim tiêm | Cái | 1,000 |
| 5 | Panh | Cái | 0,0001 |
| 6 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 7 | Hộp vận chuyển bệnh phẩm | Cái | 0,001 |
| 8 | Tube đựng bệnh phẩm | Cái | 3,000 |
| 9 | Sinh phẩm chẩn đoán | Test | 1,000 |
| 10 | Khấu hao sinh phẩm cho chạy chứng, kiểm tra chất lượng. | Test | 0,300 |
| 11 | SPU | Cái | 1,300 |
| 12 | Tube-S | Cái | 1,300 |
| 13 | Tube-K | Cái | 1,300 |
| 14 | Tip-K | Cái | 1,300 |
| 15 | Kit CAP-G/CTM Wash Reagent 5.1 L | ml | 1,300 |
| 16 | Ngoại kiểm (nếu có)* |
| 0,020 |
| 17 | Đầu côn 1000 µl | Cái | 1,000 |
| 18 | Đầu côn có lọc 1000 µl | Cái | 1,300 |
| 19 | Giấy thấm | Cuộn | 0,100 |
| 20 | Giấy xét nghiệm | Tờ | 3,000 |
| 21 | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 22 | Bút viết kính | Cái | 0,020 |
| 23 | Bút bi | Cái | 0,010 |
| 24 | Mũ | Cái | 0,020 |
| 25 | Khẩu trang | Cái | 0,020 |
| 26 | Găng không có bột tal (DNAase/ARNase free) | Đôi | 0,100 |
| 27 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 28 | Quần áo bảo hộ | Bộ | 0,005 |
| 29 | Dung dịch nước rửa tay | ml | 8,000 |
| 30 | Cồn sát trùng tay nhanh | ml | 1,000 |
| 31 | Dung dịch khử trùng | ml | 10,000 |
| 32 | Khăn lau tay | Cái | 0,010 |
* Ghi chú: Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/50 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 3 lần/1 năm).
3. Bệnh phẩm: Huyết tương hoặc huyết thanh của người bệnh
4. Phiếu xét nghiệm: Điền đầy đủ thông tin theo mẫu phiếu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
- Theo đúng quy định của chuyên ngành Vi sinh (xem phụ lục 3)
- Từ chối những bệnh phẩm không đạt yêu cầu (xem phụ lục 6).
2. Tiến hành kỹ thuật
Bộ sinh phẩm COBAS®Ampliprep/COBAS®TaqMan HCV Test (Roche Diagnostics GmbH) (VD)
2.1. Tách chiết RNA vận hành máy COBAS AmpliPrep
2.2. Phiên mã ngược RNA thành cDNA, khuyếch đại cDNA, đọc kết kết trên máy COBAS TaqMan 48
IV. NHẬN ĐỊNH KẾT QUẢ
1. Kiểm tra chất lượng
Giá trị định lượng chấp nhận được nếu:
Giá trị định lượng chấp nhận được nếu:
- Chứng âm là không phát hiện.
- Chứng nội cho giá trị Ct mong đợi.
Không nhận các kết quả của chứng không có giá trị khi xuất hiện thông báo lỗi:
- Chứng âm: Invalid
- Chứng dương thấp: Invalid, < 1.50E+01 IU/ml, > 6.90E+07 IU/ml, không phát hiện (Target not detected)
- Chứng dương cao: Invalid, < 1.50E+01 IU/ml, > 6.90E+07 IU/ml, không phát hiện (Target not detected)
2. Kết quả và báo cáo
Kết quả định lượng HCV RNA của máy COBAS TaqMan 48 được tính theo đơn vị quốc tế (IU), quy đổi ra số copies/ml theo công thức tính toán của máy đã được thiết lập dựa theo quy chuẩn của WHO.
1IU = 2,5copies
Giá trị tham số Ct (được định nghĩa là số chu kỳ ngưỡng tại đó huỳnh quang vượt ngưỡng cố định, để so sánh với chu kỳ ngưỡng của mẫu chứng chuẩn từ đó suy ra số lượng RNA mẫu đưa vào phản ứng) cho HCV RNA và HCV QS RNA.
Các giá trị chứng của HCV có nồng độ trong giới hạn được thực hiện đồng thời với mẫu bệnh phẩm để thiết lập đường chuẩn, cho thấy mối tương quan giữa giá trị Ct và số log cp/ml.
| Giá trị trên máy | Trả lời kết quả |
| Target Not Detected | Không phát hiện thấy HCV RNA |
| <1.50E+01IU/ml | < 37 cp/ml) |
| > 1.50E+01IU/ml đến < 6.90E+07IU/ml | nhận những kết quả trong giới hạn này > 37 cp/ml đến < 1.70 x 108 cp/ml |
| >6.90E+07IU/ml | > 1.70 x 108 cp/ml |
| Invalid | Không giá trị, chạy lại mẫu bệnh phẩm |
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
Việc lấy mẫu máu, vận chuyển và bảo quản không đúng tiêu chuẩn có thể dẫn đến kết quả sai, cho dù phản ứng được thực hiện đúng.
Tham khảo thêm hướng dẫn của nhà sản xuất.
106. HCV genotype Real-time PCR
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Xác định genotype của virus viêm gan C
2. Nguyên lý
Dựa trên nguyên lý của kỹ thuật Real-time RT-PCR
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: Cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Máy real-time PCR và hệ thống máy vi tính.
- Bộ lưu điện
- Máy ủ nhiệt
- Máy ly tâm dùng cho tube 0,2ml
- Máy ly tâm 25000 x g
- Tủ lạnh 20C - 80C
- Tủ âm sâu (-20 oC) hoặc (-70 oC) (nếu có)
- Máy vortex
- Tủ an toàn sinh học
- Micropipettes các thể tích từ 5 ml - 1000 ml.
2.2. Dụng cụ, hóa chất và vật tư tiêu hao
Định mức sinh phẩm và vật tư tiêu hao cho 1 mẫu/lần thực hiện (VD)
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Bông | Kg | 0,001 |
| 2 | Dây garô | Cái | 0,001 |
| 3 | Cồn | ml | 1,000 |
| 4 | Bơm kim tiêm | Cái | 1,000 |
| 5 | Panh | Cái | 0,0001 |
| 6 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 7 | Hộp vận chuyển bệnh phẩm | Test | 0,001 |
| 8 | Tube đựng bệnh phẩm | Cái | 2,000 |
| 9 | Găng không có bột tal | Đôi | 0,500 |
| 10 | Sinh phẩm chẩn đoán | Test | 1,000 |
| 11 | Khấu hao sinh phẩm cho chạy chứng | Test | 1,000 |
| 12 | Kít tách ARN | Test | 2,000 |
| 13 | cDNA | Test | 2,000 |
| 15 | Ngoại kiểm (nếu có)* |
| 0,020 |
| 16 | Ependoff 1,7ml | Tube | 2,000 |
| 17 | Ependoff 0,2ml | Tube | 1,000 |
| 18 | Đầu côn 10 µl có lọc | Cái | 1,100 |
| 19 | Đầu côn 30 µl | Cái | 1,100 |
| 20 | Đầu côn 200 µl có lọc | Cái | 2,200 |
| 21 | Đầu côn 1 ml có lọc | Cái | 2,200 |
| 22 | Ethanol BDH | ml | 0,250 |
| 23 | Water-DEPC Treated | ml | 2,000 |
| 24 | Giấy thấm | Cuộn | 0,100 |
| 25 | Giấy xét nghiệm | Tờ | 2,000 |
| 26 | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 27 | Bút viết kính | Cái | 0,020 |
| 28 | Bút bi | Cái | 0,010 |
| 29 | Mũ | Cái | 0,020 |
| 30 | Khẩu trang | Cái | 0,020 |
| 31 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 32 | Quần áo bảo hộ | Bộ | 0,005 |
| 33 | Dung dịch nước rửa tay | ml | 8,000 |
| 34 | Cồn sát trùng tay nhanh | ml | 1,000 |
| 35 | Dung dịch khử trùng | ml | 10,000 |
| 36 | Khăn lau tay | Cái | 0,010 |
* Ghi chú: Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/50 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 2 lần/1 năm).
3. Bệnh phẩm
Huyết thanh, huyết tương hoặc máu toàn phần
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
- Theo đúng quy định của chuyên ngành Vi sinh (xem phụ lục 3)
- Từ chối những bệnh phẩm không đạt yêu cầu (xem phụ lục 6).
2. Tiến hành kỹ thuật: Bộ sinh phẩm HCV genotype (VD)
2.1. Tách chiết RNA
2.2. Thực hiện phản ứng RT-PCR
- Thực hiện bước này với các tube RT-Mix được giữ trong khay lạnh hoặc đá đang tan.
- Cho chứng +, chứng - hoặc dịch RNA tách chiết vào tube.
- Lập chương trình cho máy PCR hoạt động
- Sản phẩm cDNA được dùng để thực hiện phản ứng PCR.
- Nếu chưa thực hiện phản ứng PCR ngay, phải bảo quản cDNA ở (-20 oC).
2.3. Thực hiện phản ứng real-time PCR
- Thực hiện bước này với các tube PCR mix được giữ trong khay lạnh hoặc đá đang tan.
- Chỉ lấy đủ số tube PCR mix cần. Trước và sau khi đặt phản ứng PCR phải ly tâm tube để tất cả dung dịch nằm dước đáy tube.
- Cho cDNA từ phản ứng RT ở trên (hoặc cDNA của mẫu dương tính trước đó) vào từng tube HCV Genotype 1-6 rPCR Mix và HCV Genotype 2-3 rPCR. Xong, đặt các tube vào máy real-time PCR.
- Khởi động máy real-time PCR. Khởi động máy tính và chương trình real-time PCR.
- Cài đặt vị trí mẫu “Plate setup” trên phần mềm đúng với vị trí mẫu đã đặt trên máy real-time PCR.
- Chọn màu “FAM” và “HEX” cho tất cả các mẫu, chứng dương và chứng âm.
- Cài đặt chương trình “Protocol” cho máy real-time PCR hoạt động.
- Lưu file dữ liệu vào máy tính.
- Cho máy real-time PCR chạy chương trình.
IV. NHẬN ĐỊNH KẾT QUẢ
1. Điều kiện của phản ứng
- Chứng dương có đường biểu diễn dương tính của màu FAM với genotype 2-6 và màu HEX với genotype 1-3.
- Chứng âm có đường biểu âm tính với cả 2 màu.
2. Phân tích mẫu
- Trong tube HCV Genotype 1-6 rPCR Mix, probe phát hiện genotype 1 được đánh dấu với màu HEX, probe phát hiện genotype 6 được đánh dấu với màu FAM. Trong tube HCV Genotype 2-3 rPCR Mix, probe phát hiện genotype 2 được đánh dấu với màu FAM, probe phát hiện genotype 3 được đánh dấu với màu HEX.
- Chọn cả màu FAM và HEX. Mẫu có đường biểu diễn dương tính tương ứng với genotype nào thì kết luận mẫu nhiễm genotype đó. Một mẫu có thể đồng nhiễm nhiều genotype.
3. In đồ thị kết quả
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
Tất cả các mẫu đều dương tính kể cả chứng âm.
1. Nguyên nhân 1: Lô thí nghiệm bị ngoại nhiễm RNA hoặc sản phẩm PCR từ môi trường của khu vực thao tác hoặc nhiễm chéo giữa các mẫu.
Khắc phục: Chiếu UV và vệ sinh khu vực thao tác bằng nước Javel để khử nhiễm. Tiến hành lại thí nghiệm thật cẩn thận.
2. Nguyên nhân 2: Kit bị ngoại nhiễm RNA hoặc sản phẩm PCR trong quá trình sử dụng.
Khắc phục: Thay kit mới và thực hiện quá trình như hướng dẫn ở nguyên nhân Trường hợp này không thể lấy kết quả, phải khắc phục và tiến hành lại thí nghiệm.
107. HCV genotype giải trình tự gene
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Xác định genotype của HCV
2. Nguyên lý
Dựa trên nguyên lý của kỹ thuật giải trình tự nucleotide trên gen đặc trưng của virus viêm gan C.
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện: Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: Cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2.Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Tủ an toàn Sinh học cấp 2
- Máy PCR
- Máy đọc điện di
- Máy giải trình tự gen
- Máy ly tâm 25000 x g
- Máy ly tâm dùng cho tube 0,2 ml
- Máy ủ nhiệt
- Máy vortex
- Micropipette
- Bộ lưu điện
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
Định mức sinh phẩm và vật tư tiêu hao cho 3 mẫu/lần thực hiện (VD)
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Bông | kg | 0,001 |
| 2 | Cồn | ml | 1,000 |
| 3 | Bơm kim tiêm | Cái | 1,000 |
| 4 | Panh | Cái | 0,0001 |
| 5 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 6 | Hộp vận chuyển bệnh phẩm | Test | 0,001 |
| 7 | Tube đựng bệnh phẩm | Cái | 2,000 |
| 8 | Găng không có bột (DNase-RNase free) | Cái | 0,500 |
| 9 | Sinh phẩm chẩn đoán | Test | 1,000 |
| 10 | Khấu hao sinh phẩm cho kiểm tra chất lượng | Test | 1,350 |
| 11 | EQAS (nếu thực hiện) * |
| 0,020 |
| 12 | Kit tách chiết ARN từ virus | Test | 2,350 |
| 13 | DNA marker | Bộ | 1,000 |
| 14 | Primer 1 (primer đặc hiệu) | ml | 0,0001 |
| 15 | Primer 2 (primer đặc hiệu) | ml | 0,0001 |
| 16 | Primer 3 (primer đặc hiệu) | ml | 0,0001 |
| 17 | Primer 4 (primer đặc hiệu) | ml | 0,0001 |
| 18 | Ống Eppendorf 1,5 ml | Tube | 3,000 |
| 19 | Ống Eppendorf 0,2 ml | Tube | 1,000 |
| 20 | Đầu côn 10 µl có lọc | Cái | 1,000 |
| 21 | Đầu côn 30 µl | Cái | 1,200 |
| 22 | Đầu côn 200 µl có lọc | Cái | 2,200 |
| 23 | Đầu côn 1 ml có lọc | Cái | 3,200 |
| 24 | Ethanol BDH | ml | 0,500 |
| 25 | Water-DEPC Treated | ml | 2,000 |
| 26 | Thạch | Gam | 0,075 |
| 27 | Ladder | ml | 0,0025 |
| 28 | Blue Juice Gel loading dye | ml | 0,003 |
| 29 | Ethidium Bromide | ml | 0,100 |
| 30 | TAE Buffer | ml | 0,100 |
| 31 | Giấy thấm | Cuộn | 0,100 |
| 32 | Giấy xét nghiệm | Tờ | 2,000 |
| 33 | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 34 | Bút viết kính | Cái | 0,020 |
| 35 | Bút bi | Cái | 0,010 |
| 36 | Mũ | Cái | 0,020 |
| 37 | Khẩu trang | Cái | 0,020 |
| 38 | Găng tay | Đôi | 0,100 |
| 39 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 40 | Quần áo bảo hộ | Bộ | 0,005 |
| 41 | Dung dịch nước rửa tay | ml | 8,000 |
| 42 | Cồn sát trùng tay nhanh | ml | 1,000 |
| 43 | Dung dịch khử trùng | ml | 10,000 |
| 44 | Khăn lau tay | cái | 0,010 |
* Ghi chú: Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/50 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 2 lần/1 năm).
3. Bệnh phẩm
Huyết thanh, huyết tương hoặc tổ chức sinh thiết
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu phiếu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
- Theo đúng quy định của chuyên ngành Vi sinh (xem phụ lục 3)
- Từ chối những bệnh phẩm không đạt yêu cầu (xem phụ lục 6).
2. Tiến hành kỹ thuật
2.1. Tách chiết RNA tổng số
2.2. Thực hiện RT-PCR
2.3. Điện di kiểm tra sản phẩm
2.4. Giải trình tự gen
2.5. Kiểm tra và so sánh trình tự gen của HCV trên ngân hàng dữ liệu gen quốc tế
IV. NHẬN ĐỊNH KẾT QUẢ
Sản phẩm PCR phải có một băng đặc hiệu duy nhất, rõ nét và không bị đứt gẫy. Trình tự DNA của gen đích không bị nhiễu và phải có độ tương đồng ≥ 90 % mới có thể kết luận được genotype của HCV
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
- Trong trường hợp không có sản phẩm PCR, cần phải kiểm tra lại quá trình tách chiết RNA tổng số, chất lượng primers và master mix, và thực hiện lại xét nghiệm.
- Nếu trình tự DNA bị nhiễu cần phải kiểm tra lại độ đặc hiệu của sản phẩm PCR hoặc quá trình chạy PCR sequencing bị nhiễm chéo.
108. HAV IgM miễn dịch bán tự động
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Phát hiện kháng thể HAV IgM trong máu
2. Nguyên lý
Dựa trên nguyên lý của kỹ thuật ELISA (miễn dịch gắn enzym) (VD).
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện: Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: Cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1.Trang thiết bị
- Dàn máy ELISA.
- Máy ly tâm thường.
- Tủ âm sâu (-20 oC) (nếu có).
- Tủ lạnh 2 oC - 8 oC
- Micropipet 100 µl, 1000 µl.
- Giá đựng ống máu
- Bộ pipetman 8 kênh (nếu có).
- Ống đong có vạch dung tích 25ml, 100ml, 1000ml
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
Định mức sinh phẩm và vật tư tiêu hao cho 3 mẫu/lần thực hiện (VD)
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Bông | Kg | 0,001 |
| 2 | Dây garô | Cái | 0,001 |
| 3 | Tube đựng bệnh phẩm | Cái | 1,000 |
| 4 | Sinh phẩm chẩn đoán | Test | 1,000 |
| 5 | Khấu hao sinh phẩm cho chạy chứng, kiểm tra chất lượng | Test | 1,600 |
| 6 | Chứng ngoại kiểm âm (nếu có) | ml | 0,033 |
| 7 | Chứng ngoại kiểm dương (nếu có) | ml | 0,033 |
| 8 | Ngoại kiểm (nếu có)* |
| 0,020 |
| 9 | Nước cất | ml | 2,000 |
| 10 | Đầu côn 1000 µl | Cái | 1,000 |
| 11 | Đầu côn 200 µl | Cái | 3,000 |
| 12 | Giấy thấm | Cuộn | 0,100 |
| 13 | Giấy xét nghiệm | Tờ | 2,000 |
| 14 | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 15 | Bút viết kính | Cái | 0,020 |
| 16 | Bút bi | Cái | 0,010 |
| 17 | Mũ | Cái | 0,020 |
| 18 | Khẩu trang | Cái | 0,020 |
| 19 | Găng tay | Đôi | 0,100 |
| 20 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 21 | Quần áo bảo hộ | Bộ | 0,005 |
| 22 | Dung dịch nước rửa tay | ml | 8,000 |
| 23 | Cồn sát trùng tay nhanh | ml | 1,000 |
| 24 | Dung dịch khử trùng | ml | 10,000 |
| 25 | Khăn lau tay | Cái | 0,010 |
* Ghi chú: Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/50 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 2 lần/1 năm).
3. Bệnh phẩm
Huyết thanh hoặc huyết tương của người bệnh
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu phiếu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
- Theo đúng quy định của chuyên ngành Vi sinh (xem phụ lục 2)
- Từ chối những bệnh phẩm không đạt yêu cầu (xem phụ lục 6).
2. Tiến hành kỹ thuật
Bộ sinh phẩm ETI - HA - IGMK PLUS DiaSorin (VD)
| Các bước | Xét nghiệm định tính HAV IgM |
| 1 | Chuẩn bị sinh phẩm, sơ đồ nhỏ mẫu Chuẩn bị dung dịch rửa |
| 2 | Pha loãng bệnh phẩm trong dung dịch pha loãng bệnh phẩm theo quy trình hướng dẫn của nhà sản xuất. |
| 3 | Nhỏ chứng và bệnh phẩm theo thứ tự hướng dẫn |
| 4 | Ủ tấm phản ứng ở nhiệt độ và trong thời gian theo hướng dẫn của nhà sản xuất. |
| 5 | Chuẩn bị dung dịch cộng hợp theo hướng dẫn |
| 6 | Rửa khay phản ứng bằng chương trình theo quy trình hướng dẫn của nhà sản xuất. |
| 7 | Nhỏ dung dịch cộng hợp vào các giếng theo hướng dẫn |
| 8 | Ủ ở nhiệt độ và trong thời gian theo hướng dẫn của nhà sản xuất. |
| 9 | Rửa tấm phản ứng bằng chương trình theo quy trình hướng dẫn |
| 10 | Pha dung dịch cơ chất và nhỏ vào mỗi giếng. Để ở nhiệt độ phòng (150C -300C) tránh ánh sáng theo hướng dẫn của nhà sản xuất. |
| 11 | Dừng phản ứng |
| 12 | Đọc KQ ở bước sóng 450/630 nm bằng máy đo mật độ quang. |
IV. NHẬN ĐỊNH KẾT QUẢ
1. Điều kiện
- Giếng trắng (Blank): 0.000 £ BLK £ 0.150
- Giá trị trung bình của Cal: -0.020 < Cal![]() <0.120
<0.120
- Giá trị của Cal: -0.020 < Cal <0.120
- Giá trị chứng âm (NC): -0.020 < NC <0.120
- Giá trị chứng dương (PC): 0.5 < PC <2.5
PC - NC >0.380
2. Kết quả và báo cáo
- Tính giá trị ngưỡng Cut-off value (CO)
CO = Cal![]() + 0.100
+ 0.100
- Giá trị của thử nghiệm:
Tính tỉ số mẫu:
Tỉ số mẫu = OD mẫu/CO
Giải thích kết quả
- Các mẫu có tỉ số mẫu nhỏ hơn 0,8 được coi là âm tính với HAV IgM.
- Các mẫu có tỉ số mẫu > 1.2 được coi là dương tính với HAV IgM.
- Các mẫu nằm trong khoảng từ 0.8 đến 1.2 so với giá trị của CO phải được kiểm tra lại.
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
1. Sai sót
Có thể xảy ra hiện tượng âm tính giả hoặc dương tính giả, thông thường do:
- Thực hiện sai các bước trong quy trình hướng dẫn.
- Chứng âm và những mẫu bệnh phẩm âm tính bị nhiễm chéo bởi huyết thanh/ huyết tương có nồng độ kháng thể cao.
- Cơ chất bị nhiễm bởi các tác nhân oxy hoá (thuốc tẩy, ion kim loại v.v…),
- Dung dịch dừng phản ứng bị nhiễm bẩn.
2. Xử trí
- Tuân thủ đúng các bước quy trình hướng dẫn của nhà sản xuất và hướng dẫn về độ ổn định hóa chất xét nghiệm trong bộ sinh phẩm sử dụng.
- Kiểm tra và vệ sinh máy rửa thường xuyên trước và sau khi làm xét nghiệm
- Chia hóa chất (chất cộng hợp, dung dịch hiện màu và dừng phản ứng) vào ống nghiệm sạch trước mỗi lần nhỏ.
109. HAV IgM miễn dịch tự động
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Phát hiện kháng thể HAV IgM trong máu.
2. Nguyên lý
Dựa trên nguyên lý của kỹ thuật CLIA (miễn dịch điện hóa phát quang) (VD)
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện: Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: Cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1.Trang thiết bị
- Hệ thống máy miễn dịch tự động.
- Bộ lưu điện
- Máy ly tâm thường.
- Tủ âm sâu (-20 oC) (nếu có).
- Tủ lạnh 2 oC - 8 oC
- Micropipet có thể tích 50µl - 200 µl
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
Định mức sinh phẩm và vật tư tiêu hao cho 5 mẫu/lần thực hiện (VD)
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Bông | Kg | 0,001 |
| 2 | Dây garô | Cái | 0,001 |
| 3 | Cồn | ml | 1,000 |
| 4 | Bơm kim tiêm | Cái | 1,000 |
| 5 | Panh | Cái | 0,0001 |
| 6 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 7 | Hộp vận chuyển bệnh phẩm | Cái | 0,001 |
| 8 | Tube đựng bệnh phẩm | Cái | 1,000 |
| 9 | Sinh phẩm chẩn đoán | Test | 1,000 |
| 10 | Khấu hao sinh phẩm cho chạy chuẩn | Test | 0,100 |
| 11 | Khấu hao sinh phẩm cho chạy chứng, kiểm tra chất lượng | Test | 0,400 |
| 12 | Chứng ngoại kiểm âm (nếu có) | ml | 0,005 |
| 13 | Chứng ngoại kiểm dương (nếu có) | ml | 0,005 |
| 14 | Ngoại kiểm (nếu có)* |
| 0,020 |
| 15 | Cleancell M | ml | 3,000 |
| 16 | Procell M | ml | 3,000 |
| 17 | Probe Wash M | ml | 2,000 |
| 18 | Preclean M | ml | 2,000 |
| 19 | Assay Tip/Cup E170 | chiếc | 3,000 |
| 20 | ISE Cleaning Solution F. HIT | ml | 0,500 |
| 21 | Nước cất | ml | 5,000 |
| 22 | Control | Test | 0,100 |
| 23 | Sample cup | Chiếc | 1,000 |
| 24 | Giấy thấm | Cuộn | 0,100 |
| 25 | Giấy xét nghiệm | Tờ | 2,000 |
| 26 | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 27 | Bút viết kính | Cái | 0,020 |
| 28 | Bút bi | Cái | 0,010 |
| 29 | Mũ | Cái | 0,020 |
| 30 | Khẩu trang | Cái | 0,020 |
| 31 | Găng tay | Đôi | 0,100 |
| 32 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 33 | Quần áo bảo hộ | Bộ | 0,005 |
| 34 | Dung dịch nước rửa tay | ml | 8,000 |
| 35 | Cồn sát trùng tay nhanh | ml | 1,000 |
| 36 | Dung dịch khử trùng | ml | 10,000 |
| 37 | Khăn lau tay | Cái | 0,010 |
* Ghi chú: Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/50 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 2 lần/1 năm).
3. Bệnh phẩm
Huyết thanh hoặc huyết tương của người bệnh
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu phiếu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
- Theo đúng quy định của chuyên ngành Vi sinh (xem phụ lục 2)
- Từ chối những bệnh phẩm không đạt yêu cầu (xem phụ lục 6).
2. Tiến hành kỹ thuật
Bộ sinh phẩm Elecsys HAV IgM - Roche (VD)
| Các bước | Xét nghiệm định tính HAV IgM |
| 1 | Vào Reagent để kiểm tra số lượng tests |
| 2 | Vào Calibration → Status để kiểm tra hiệu chuẩn. |
| 3 | Chạy chứng |
| Chạy mẫu không dùng barcode | |
| 1 | Đánh số sample cup theo mã số bệnh phẩm. Hút mẫu và chứng ngoại kiểm (nếu có) vào sample cup tương ứng |
| 2 | Vào màn hình Workplace → Test Selection |
| 3 | Nhập mã bệnh phẩm và ngày thực hiện xét nghiệm |
| 4 | Chọn tên test là HAV IgM |
| 5 | Vào Barcode Read Error |
| 6 | Nhập số rack và vị trí mẫu → Add → OK → Save |
| 7 | Đặt mẫu huyết thanh người bệnh Sample Cup lên Rack đúng vị trí đưa vào khu nạp giá mẫu. |
| 8 | Chọn Start → Chọn START ở màn hình Start Conditions |
| Chạy mẫu có barcode | |
| 1 | Nhập chỉ định định vào hệ thống LIS |
| 2 | Đưa ống máu dán barcode vào rack vào khu nạp giá mẫu |
| 3 | Chọn Start → Chọn START ở màn hình Start Conditions |
IV. NHẬN ĐỊNH KẾT QUẢ
1. Đánh giá theo tiêu chuẩn nhà sản xuất
Chạy kiểm tra chứng 1 và chứng 2. Giá trị chứng đạt được phải nằm trong khoảng giới hạn xác định. Giới hạn này được qui định trong bộ chứng và trong mỗi lô hóa chất HAV IgM khác nhau có thể có sự thay đổi về giới hạn chứng
2. Đánh giá theo tiêu chuẩn phòng xét nghiệm
Chứng nội kiểm, ngoại kiểm (nếu có)
3. Kết quả và báo cáo
Máy sẽ tự động tính toán giá trị ngưỡng dựa trên số đo của Cal1 và Cal2. Kết quả của mẫu bệnh phẩm sẽ được thông báo là dương tính hoặc âm tính cùng với chỉ số ngưỡng (COI).
- Nếu COI ≥ 1.0: mẫu bệnh phẩm được coi là dương tính với HAV IgM.
- Nếu COI < 1.0: mẫu bệnh phẩm được coi là âm tính với HAV IgM.
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
- Máy sẽ báo sample short (bệnh phẩm đông hoặc không đủ) →. Chú ý ly tâm mẫu thật kỹ ngay từ đầu hoặc hút mẫu ra cup (thực hiện theo đúng yêu cầu của lấy mẫu xét nghiệm Vi sinh)
- Không sử dụng thuốc thử đã quá hạn sử dụng.
- Tránh tạo bọt ở lọ thuốc thử và các loại mẫu (bệnh phẩm, calibration và chứng).
- Tham khảo thêm hướng dẫn của nhà sản xuất.
110. HAV total miễn dịch bán tự động
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Phát hiện kháng thể HAV toàn phần trong máu kháng HAV(virus viêm gan A)
2. Nguyên lý
Dựa trên nguyên lý của kỹ thuật ELISA (miễn dịch gắn enzym) (VD).
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện: Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: Cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1.Trang thiết bị
- Dàn máy ELISA.
- Máy ly tâm thường.
- Tủ âm sâu (-20oC).
- Tủ lạnh 2oC - 8oC
- Micropipet 100 µl, 1000 µl.
- Giá đựng ống máu
- Bộ pipetman 8 kênh (nếu có).
- Ống đong có vạch dung tích 25ml, 100ml, 1000ml
2.2.Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
Định mức sinh phẩm và vật tư tiêu hao cho 3 mẫu/lần thực hiện (VD)
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Bông | Kg | 0,001 |
| 2 | Dây garô | Cái | 0,001 |
| 3 | Tube đựng bệnh phẩm | Cái | 1,000 |
| 4 | Sinh phẩm chẩn đoán | Test | 1,000 |
| 5 | Khấu hao sinh phẩm cho chạy chứng, kiểm tra chất lượng | Test | 1,600 |
| 6 | Chứng ngoại kiểm âm (nếu có) | ml | 0,033 |
| 7 | Chứng ngoại kiểm dương (nếu có) | ml | 0,033 |
| 8 | Ngoại kiểm (nếu có)* |
| 0,020 |
| 9 | Nước cất | ml | 2,000 |
| 10 | Đầu côn 1000 µl | Cái | 1,000 |
| 11 | Đầu côn 200 µl | Cái | 3,000 |
| 12 | Giấy thấm | Cuộn | 0,100 |
| 13 | Giấy xét nghiệm | Tờ | 2,000 |
| 14 | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 15 | Bút viết kính | Cái | 0,020 |
| 16 | Bút bi | Cái | 0,010 |
| 17 | Mũ | Cái | 0,020 |
| 18 | Khẩu trang | Cái | 0,020 |
| 19 | Găng tay | Đôi | 0,100 |
| 20 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 21 | Quần áo bảo hộ | Bộ | 0,005 |
| 22 | Dung dịch nước rửa tay | ml | 8,000 |
| 23 | Cồn sát trùng tay nhanh | ml | 1,000 |
| 24 | Dung dịch khử trùng | ml | 10,000 |
| 25 | Khăn lau tay | Cái | 0,010 |
* Ghi chú: Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/50 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 2 lần/1 năm).
3. Bệnh phẩm
Huyết thanh hoặc huyết tương của người bệnh
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu phiếu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
- Theo đúng quy định của chuyên ngành Vi sinh (xem phụ lục 2)
- Từ chối những bệnh phẩm không đạt yêu cầu (xem phụ lục 6).
2. Tiến hành kỹ thuật
Bộ sinh phẩm ETI - AB - HAVK PLUS DiaSorin (VD)
| Các bước | Xét nghiệm định tính HAV Ab |
| 1 | Chuẩn bị sinh phẩm, sơ đồ nhỏ mẫu. Chuẩn bị dung dịch rửa. |
| 2 | Nhỏ dung dịch pha loãng bệnh phẩm vào mỗi giếng phản ứng theo hướng dẫn. Nhỏ chứng, bệnh phẩm, dung dịch chuẩn, dung dịch liên kết theo thứ tự hướng dẫn của nhà sản xuất. |
| 3 | Ủ tấm phản ứng ở nhiệt độ và trong thời gian quy định theo quy trình hướng dẫn của nhà sản xuất. |
| 4 | Chuẩn bị dung dịch cộng hợp theo hướng dẫn. |
| 5 | Nhỏ dung dịch cộng hợp vào các giếng theo hướng dẫn |
| 6 | Rửa khay phản ứng bằng chương trình theo quy trình hướng dẫn của nhà sản xuất. |
| 7 | Nhỏ dung dịch cộng hợp vào các giếng theo hướng dẫn |
| 8 | Ủ ở nhiệt độ và trong thời gian quy định theo quy trình hướng dẫn của nhà sản xuất. |
| 9 | Rửa tấm phản ứng bằng chương trình theo quy trình hướng dẫn. |
| 10 | Pha dung dịch cơ chất và nhỏ vào mỗi giếng. Để ở nhiệt độ phòng (15 oC -30 oC) tránh ánh sáng theo quy trình hướng dẫn của nhà sản xuất. |
| 11 | Dừng phản ứng. |
| 12 | Đọc kết quả ở bước sóng 450/630 nm bằng máy đo mật độ quang. |
IV. NHẬN ĐỊNH KẾT QUẢ
1. Điều kiện
- Giếng trắng (Blank): 0.000 £ BLK £ 0.150
- Giá trị trung bình của Cal: PC < Cal![]() <0.6 NC
<0.6 NC
- Giá trị của Cal: PC < Cal <0.6 NC
- Giá trị chứng âm (NC): 0.5 < NC < 2.5
- Giá trị chứng dương (PC): 0.000 £ PC £ 0.250
NC - PC > 0.250
2. Kết quả và báo cáo
- Tính giá trị ngưỡng Cut-off value (CO)
CO = Cal![]()
- Giá trị của thử nghiệm:
Tính tỉ số mẫu:
Tỉ số mẫu = OD mẫu/CO
Giải thích kết quả
- Các mẫu có tỉ số mẫu nhỏ hơn 0,8 được coi là dương tính với HAV Ab
- Các mẫu có tỉ số mẫu > 1.2 được coi là âm tính với HAV Ab.
- Các mẫu nằm trong khoảng từ 0.8 đến 1.2 so với giá trị của CO phải được kiểm tra lại.
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
1. Sai sót
Có thể xảy ra hiện tượng âm tính giả hoặc dương tính giả, thông thường do:
- Thực hiện sai các bước trong quy trình hướng dẫn.
- Chứng âm và những mẫu bệnh phẩm âm tính bị nhiễm chéo bởi huyết thanh/ huyết tương có nồng độ kháng thể cao.
- Cơ chất bị nhiễm bởi các tác nhân oxy hoá (thuốc tẩy, ion kim loại v.v…) ,
- Dung dịch dừng phản ứng bị nhiễm bẩn.
2. Xử trí
- Tuân thủ đúng các bước quy trình hướng dẫn của nhà sản xuất và hướng dẫn về độ ổn định hóa chất xét nghiệm trong bộ sinh phẩm sử dụng.
- Kiểm tra và vệ sinh máy rửa thường xuyên trước và sau khi làm xét nghiệm
- Chia hóa chất (chất cộng hợp, dung dịch hiện màu và dừng phản ứng) vào ống nghiệm sạch trước mỗi lần nhỏ.
111. HAV total miễn dịch tự động
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Phát hiện kháng thể HAV toàn phần kháng virus viêm gan A (HAV total) trong huyết thanh hoặc huyết tương.
2. Nguyên lý
Phát hiện kháng thể HAV toàn phần dựa trên nguyên lý của kỹ thuật CLIA (miễn dịch điện hóa phát quang) (VD).
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện: Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: Cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Hệ thống máy miễn dịch tự động.
- Bộ lưu điện
- Máy ly tâm thường.
- Tủ lạnh 2oC - 8oC
- Tủ âm sâu (-20oC hoặc -70oC) (nếu có)
- Micropipette thể tích 50 µl - 200 µl
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
Thực hiện xét nghiệm 05 mẫu/lần.
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Bông | Kg | 0,001 |
| 2 | Dây garô | Cái | 0,001 |
| 3 | Cồn | ml | 1,000 |
| 4 | Bơm kim tiêm | Cái | 1,000 |
| 5 | Panh | Cái | 0,0001 |
| 6 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 7 | Hộp vận chuyển bệnh phẩm | Cái | 0,001 |
| 8 | Tube đựng bệnh phẩm | Cái | 1,000 |
| 9 | Sinh phẩm chẩn đoán | Test | 1,000 |
| 10 | Khấu hao sinh phẩm cho chạy chuẩn | Test | 0,100 |
| 11 | Khấu hao sinh phẩm cho chạy chứng, kiểm tra chất lượng | Test | 0,400 |
| 12 | Chứng ngoại kiểm âm (nếu có) | ml | 0,005 |
| 13 | Chứng ngoại kiểm dương (nếu có) | ml | 0,005 |
| 14 | Ngoại kiểm (nếu có)* |
| 0,02 |
| 15 | Cleancell M | ml | 3,000 |
| 16 | Procell M | ml | 3,000 |
| 17 | Probe Wash M | ml | 2,000 |
| 18 | Preclean M | ml | 2,000 |
| 19 | Assay Tip/Cup E170 | chiếc | 3,000 |
| 20 | ISE Cleaning Solution F. HIT | ml | 0,500 |
| 21 | Nước cất | ml | 5,000 |
| 22 | Control | Test | 0,100 |
| 23 | Sample cup | Chiếc | 1,000 |
| 24 | Giấy thấm | Cuộn | 0,100 |
| 25 | Giấy xét nghiệm | Tờ | 2,000 |
| 26 | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 27 | Bút viết kính | Cái | 0,020 |
| 28 | Bút bi | Cái | 0,010 |
| 29 | Mũ | Cái | 0,020 |
| 30 | Khẩu trang | Cái | 0,020 |
| 31 | Găng tay | Đôi | 0,100 |
| 32 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 33 | Quần áo bảo hộ | Bộ | 0,005 |
| 34 | Dung dịch nước rửa tay | ml | 8,000 |
| 35 | Cồn sát trùng tay nhanh | ml | 1,000 |
| 36 | Dung dịch khử trùng | ml | 10,000 |
| 37 | Khăn lau tay | Cái | 0,010 |
* Ghi chú: Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/50 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 2 lần/1 năm).
3. Bệnh phẩm
Huyết thanh hoặc huyết tương.
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu phiếu yêu cầu.
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
- Theo đúng quy định của chuyên ngành Vi sinh: xem chi tiết phụ lục 2
- Từ chối những bệnh phẩm không đạt yêu cầu: xem chi tiết phụ lục 6.
2. Tiến hành kỹ thuật
Bộ sinh phẩm Elecsys Anti-HAV 2 - Roche (VD)
| Các bước | Xét nghiệm định tính Anti-HAV Total |
| 1 | Vào Reagent để kiểm tra số lượng tests |
| 2 | Vào Calibration → Status để kiểm tra hiệu chuẩn. |
| 3 | Chạy chứng |
| Chạy mẫu không dùng barcode | |
| 1 | Đánh số sample cup theo mã số bệnh phẩm. Hút mẫu và chứng ngoại kiểm (nếu có) vào sample cup tương ứng |
| 2 | Vào màn hình Workplace → Test Selection |
| 3 | Nhập mã bệnh phẩm và ngày thực hiện xét nghiệm |
| 4 | Chọn tên test là anti-HBc |
| 5 | Vào Barcode Read Error |
| 6 | Nhập số rack và vị trí mẫu → Add → OK → Save |
| 7 | Đặt mẫu huyết thanh người bệnh Sample Cup lên Rack đúng vị trí đưa vào khu nạp giá mẫu. |
| 8 | Chọn Start → Chọn START ở màn hình Start Conditions |
| Chạy mẫu có barcode | |
| 1 | Nhập chỉ định định vào hệ thống LIS |
| 2 | Đưa ống máu dán barcode vào rack vào khu nạp giá mẫu |
| 3 | Chọn Start → Chọn START ở màn hình Start Conditions |
IV. NHẬN ĐỊNH KẾT QUẢ
1. Đánh giá theo tiêu chuẩn nhà sản xuất
Chạy kiểm tra chứng 1 và chứng 2. Giá trị chứng đạt được phải nằm trong khoảng giới hạn xác định. Giới hạn này được qui định trong bộ chứng và trong mỗi lô hóa chất Anti-HAV khác nhau có thể có sự thay đổi về giới hạn chứng.
2. Đánh giá theo tiêu chuẩn phòng xét nghiệm
Chứng nội kiểm, ngoại kiểm (nếu có).
3. Kết quả và báo cáo
Máy sẽ tự động tính toán giá trị ngưỡng dựa trên số đo của Cal1 và Cal2. Kết quả của mẫu bệnh phẩm sẽ được thông báo là dương tính hoặc âm tính cùng với chỉ số ngưỡng (COI).
- Nếu COI ≤ 1.0: mẫu bệnh phẩm được coi là dương tính với Anti-HAV Total.
- Nếu COI > 1.0: mẫu bệnh phẩm được coi là âm tính với Anti-HAV Total.
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
- Máy sẽ báo sample short (bệnh phẩm đông hoặc không đủ) → Chú ý ly tâm mẫu thật kỹ ngay từ đầu hoặc hút mẫu ra cup (thực hiện theo đúng yêu cầu của lấy mẫu xét nghiệm Vi sinh)
- Không sử dụng thuốc thử đã quá hạn sử dụng.
- Tránh tạo bọt ở lọ thuốc thử và các loại mẫu (bệnh phẩm, calibration và chứng).
- Tham khảo thêm hướng dẫn của nhà sản xuất.
112. HDV Ag miễn dịch bán tự động
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Phát hiện kháng nguyên của virus viêm gan D (HDV Ag) trong huyết thanh hoặc huyết tương.
2. Nguyên lý
Dựa trên nguyên lý của kỹ thuật ELISA (miễn dịch gắn enzyme) (VD).
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện: Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: Cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Dàn máy ELISA
- Máy ly tâm thường.
- Tủ lạnh 2oC - 8oC
- Tủ âm sâu (-20oC hoặc -70oC) (nếu có)
- Micropipette đơn kênh thể tích từ 10 µl đến 1000 µl .
- Bộ pipetman 8 kênh (nếu có)
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
Thực hiện xét nghiệm 02 mẫu/lần.
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Bông | Kg | 0,001 |
| 2 | Dây garô | Cái | 0,001 |
| 3 | Cồn | ml | 1,000 |
| 4 | Bơm kim tiêm | Cái | 1,000 |
| 5 | Panh | Cái | 0,0001 |
| 6 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 7 | Hộp vận chuyển bệnh phẩm | Cái | 0,001 |
| 8 | Tube đựng bệnh phẩm | Cái | 2,000 |
| 9 | Sinh phẩm chẩn đoán | Test | 1,000 |
| 10 | Khấu hao sinh phẩm cho chạy chứng, kiểm tra chất lượng | Test | 2,000 |
| 11 | Ngoại kiểm (nếu có)* |
| 0,02 |
| 12 | Nước cất | ml | 8,000 |
| 13 | Đầu côn 1000 µl | Cái | 2,000 |
| 14 | Đầu côn 200 µl | Cái | 5,000 |
| 15 | Giấy thấm | Cuộn | 0,100 |
| 16 | Giấy xét nghiệm | Tờ | 2,000 |
| 17 | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 18 | Bút viết kính | Cái | 0,020 |
| 19 | Bút bi | Cái | 0,010 |
| 20 | Mũ | Cái | 0,020 |
| 21 | Khẩu trang | Cái | 0,020 |
| 22 | Găng tay | Đôi | 0,100 |
| 23 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 24 | Quần áo bảo hộ | Bộ | 0,005 |
| 25 | Dung dịch nước rửa tay | ml | 8,000 |
| 26 | Cồn sát trùng tay nhanh | ml | 1,000 |
| 27 | Dung dịch khử trùng | ml | 10,000 |
| 28 | Khăn lau tay | Cái | 0,010 |
* Ghi chú: Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo chương trình ngoại kiểm (EQAS) là 1/50 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 2 lần/1 năm).
3. Bệnh phẩm
Huyết thanh hoặc huyết tương.
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
- Theo đúng quy định của chuyên ngành Vi sinh: xem chi tiết phụ lục 2
- Từ chối những bệnh phẩm không đạt yêu cầu: xem chi tiết phụ lục 6.
2. Tiến hành kỹ thuật: Bộ sinh phẩm ETI-DELTAK-2 - Diasorin (VD)
| Các bước | Xét nghiệm định tính HDV Ag |
| 2.1 | Để số lượng sinh phẩm cần dùng ở nhiệt độ phòng 30 phút trước khi làm xét nghiệm |
| 2.2 | Đánh số, sắp xếp bệnh phẩm và viết sơ đồ theo thứ tự. |
| 2.3 | Chuẩn bị dung dịch rửa |
| 2.4 | Lấy đủ số giếng cần dùng và đặt vào giá. |
| 2.5 | Nhỏ dung dịch Nonidet P-40 |
| 2.6 | Nhỏ chứng và mẫu huyết thanh người bệnh |
| 2.7 | Đậy tấm và ủ ở 37oC trong 45 phút |
| 2.8 | Chuẩn bị cộng hợp |
| 2.9 | Rửa phiến nhựa |
| 2.10 | Nhỏ chất cộng hợp vào mỗi giếng |
| 2.11 | Đậy tấm và ủ |
| 2.12 | Rửa phiến nhựa |
| 2.13 | Nhỏ dung dịch hiện màu |
| 2.14 | Ủ, không đậy tấm và tránh ánh sáng |
| 2.15 | Dừng phản ứng |
| 2.16 | Đọc kết quả ở bước sóng 450/630nm trong vòng 60 phút sau khi dừng phản ứng. |
IV. NHẬN ĐỊNH KẾT QUẢ
1. Tính giá trị ngưỡng
Cut-off (CO) = Giá trị trung bình chứng âm + 0 .100
1. Điều kiện của phản ứng
- OD của giếng trống ≤ 0.150.
- OD của trung bình chứng âm < 0.100
- OD của mỗi chứng âm < 0.110
- Trung bình chứng dương - trung bình chứng âm ≥ 0.5
3. Diễn giải kết quả
+ Dương tính: nếu OD của mẫu bệnh phẩm ≥ OD của cut-off
+ Nghi ngờ: nếu tỉ lệ nhỏ hơn hoặc lớn hơn 10 % OD của cut-off
+ Âm tính: nếu OD của mẫu bệnh phẩm < OD của cut-off
- Nếu kết quả nghi ngờ → làm lại xét nghiệm lần 2.
+ Nếu kết quả OD lần 2 > CO → kết luận dương tính
+ Nếu kết quả OD lần 2 < CO → kết luận âm tính
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
1. Sai sót
Có thể xảy ra hiện tượng âm tính giả hoặc dương tính giả, thông thường do:
- Thực hiện sai các bước trong quy trình hướng dẫn.
- Chứng âm và những mẫu bệnh phẩm âm tính bị nhiễm chéo bởi huyết thanh/ huyết tương có nồng độ kháng thể cao.
- Dung dịch cơ chất bị nhiễm bởi các tác nhân oxid hoá (thuốc tẩy, ion kim loại v.v…)
- Dung dịch dừng phản ứng bị nhiễm bẩn.
2. Xử trí
- Tuân thủ đúng các bước quy trình hướng dẫn của nhà sản xuất và hướng dẫn về độ ổn định hóa chất xét nghiệm trong bộ sinh phẩm sử dụng.
- Kiểm tra và vệ sinh máy rửa thường xuyên trước và sau khi làm xét nghiệm.
113. HDV IgM miễn dịch bán tự động
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Phát hiện kháng thể IgM kháng virus viêm gan D trong huyết thanh hoặc huyết tương.
2. Nguyên lý
Phát hiện kháng thể IgM kháng virus viêm gan D dựa trên nguyên lý của kỹ thuật ELISA (miễn dịch gắn enzym) (VD).
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: Cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Dàn máy ELISA
- Máy ly tâm thường.
- Tủ lạnh 2oC - 8oC
- Tủ âm sâu (-20oC hoặc -70oC) (nếu có)
- Micropipette đơn kênh thể tích từ 10 µl đến 1000 µl .
- Bộ pipetman 8 kênh (nếu có)
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
Thực hiện xét nghiệm 02 mẫu/lần.
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Bông | Kg | 0,001 |
| 2 | Dây garô | Cái | 0,001 |
| 3 | Cồn | ml | 1,000 |
| 4 | Bơm kim tiêm | Cái | 1,000 |
| 5 | Panh | Cái | 0,0001 |
| 6 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 7 | Hộp vận chuyển bệnh phẩm | Cái | 0,001 |
| 8 | Tube đựng bệnh phẩm | Cái | 2,000 |
| 9 | Sinh phẩm chẩn đoán | Test | 1,000 |
| 10 | Khấu hao sinh phẩm cho chạy chứng, kiểm tra chất lượng | Test | 2,000 |
| 11 | Ngoại kiểm (nếu có)* |
| 0,02 |
| 12 | Nước cất | ml | 8,000 |
| 13 | Đầu côn 1000 µl | Cái | 2,000 |
| 14 | Đầu côn 200 µl | Cái | 5,000 |
| 15 | Giấy thấm | Cuộn | 0,100 |
| 16 | Giấy xét nghiệm | Tờ | 2,000 |
| 17 | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 18 | Bút viết kính | Cái | 0,020 |
| 19 | Bút bi | Cái | 0,010 |
| 20 | Mũ | Cái | 0,020 |
| 21 | Khẩu trang | Cái | 0,020 |
| 22 | Găng tay | Đôi | 0,100 |
| 23 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 24 | Quần áo bảo hộ | Bộ | 0,005 |
| 25 | Dung dịch nước rửa tay | ml | 8,000 |
| 26 | Cồn sát trùng tay nhanh | ml | 1,000 |
| 27 | Dung dịch khử trùng | ml | 10,000 |
| 28 | Khăn lau tay | Cái | 0,010 |
* Ghi chú: Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo chương trình ngoại kiểm (EQAS) là 1/50 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 2 lần/1 năm).
3. Bệnh phẩm
Huyết thanh hoặc huyết tương.
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
- Theo đúng quy định của chuyên ngành Vi sinh: xem chi tiết phụ lục 2
- Từ chối những bệnh phẩm không đạt yêu cầu: xem chi tiết phụ lục 6.
2. Tiến hành kỹ thuật: Bộ sinh phẩm ETI - DELTA - IgMK-2 - Diasorin (VD)
| Các bước | Xét nghiệm định tính HDV IgM |
| 2.1 | Để số lượng sinh phẩm cần dùng ở nhiệt độ phòng 30 phút trước khi làm xét nghiệm |
| 2.2 | Đánh số, sắp xếp bệnh phẩm và viết sơ đồ theo thứ tự. |
| 2.3 | Chuẩn bị dung dịch rửa |
| 2.4 | Pha loãng bệnh phẩm |
| 2.5 | Lấy đủ số giếng cần dùng và đặt vào giá. |
| 2.6 | Nhỏ chứng và mẫu huyết thanh người bệnh |
| 2.7 | Đậy tấm và ủ |
| 2.8 | Rửa |
| 2.9 | Nhỏ dung dịch kháng nguyên |
| 2.10 | Đậy tấm và ủ |
| 2.11 | Chuẩn bị cộng hợp |
| 2.12 | Rửa |
| 2.13 | Nhỏ chất cộng hợp vào mỗi giếng |
| 2.14 | Đậy tấm và ủ |
| 2.15 | Rửa |
| 2.16 | Nhỏ dung dịch hiện màu |
| 2.17 | Ủ, không đậy tấm và tránh ánh sáng |
| 2.18 | Dừng phản ứng |
| 2.19 | Đọc kết quả ở bước sóng 450/630nm trong vòng 60 phút sau khi dừng phản ứng. |
IV. NHẬN ĐỊNH KẾT QUẢ
1. Tính giá trị ngưỡng
Cut-off (CO) = Giá trị trung bình chứng âm + 0.100
2. Điều kiện của phản ứng
- OD của giếng trống ≤ 0.150.
- OD của trung bình chứng âm < 0.100
- Trung bình chứng dương - trung bình chứng âm ≥ 0.300
3. Diễn giải kết quả
+ Dương tính: nếu OD của mẫu bệnh phẩm ≥ OD của cut-off
+ Nghi ngờ: nếu tỉ lệ nhỏ hơn hoặc lớn hơn 10 % OD của cut-off
+ Âm tính: nếu OD của mẫu bệnh phẩm < OD của cut-off
- Nếu kết quả nghi ngờ → làm lại xét nghiệm lần 2.
+ Nếu kết quả dương tính lặp lại → kết luận dương tính
+ Nếu kết quả lần 2 âm tính → kết luận âm tính
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
1. Sai sót
Có thể xảy ra hiện tượng âm tính giả hoặc dương tính giả, thông thường do:
- Thực hiện sai các bước trong quy trình hướng dẫn.
- Chứng âm và những mẫu bệnh phẩm âm tính bị nhiễm chéo bởi huyết thanh/ huyết tương có nồng độ kháng thể cao.
- Dung dịch cơ chất bị nhiễm bởi các tác nhân oxid hoá (thuốc tẩy, ion kim loại v.v…)
- Dung dịch dừng phản ứng bị nhiễm bẩn.
2. Xử trí
- Tuân thủ đúng các bước quy trình hướng dẫn của nhà sản xuất và hướng dẫn về độ ổn định hóa chất xét nghiệm trong bộ sinh phẩm sử dụng.
- Kiểm tra và vệ sinh máy rửa thường xuyên trước và sau khi làm xét nghiệm
114. HDV Ab miễn dịch bán tự động
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Phát hiện kháng thể kháng virus viêm gan D (HDV Ab) trong huyết thanh hoặc huyết tương.
2. Nguyên lý
Phát hiện kháng thể kháng virus viêm gan D dựa trên nguyên lý của kỹ thuật ELISA (miễn dịch gắn enzym) (VD).
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện: Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: Cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Dàn máy ELISA
- Máy ly tâm thường.
- Tủ lạnh 2oC - 8oC.
- Tủ âm sâu (-20oC hoặc -70oC) (nếu có).
- Micropipette đơn kênh thể tích từ 10 µl đến 1000 µl .
- Bộ pipetman 8 kênh (nếu có).
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
Thực hiện xét nghiệm 02 mẫu/lần.
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Bông | Kg | 0,001 |
| 2 | Dây garô | Cái | 0,001 |
| 3 | Cồn | ml | 1,000 |
| 4 | Bơm kim tiêm | Cái | 1,000 |
| 5 | Panh | Cái | 0,0001 |
| 6 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 7 | Hộp vận chuyển bệnh phẩm | Test | 0,001 |
| 8 | Tube đựng bệnh phẩm | Cái | 2,000 |
| 9 | Sinh phẩm chẩn đoán | Test | 1,000 |
| 10 | Khấu hao sinh phẩm cho chạy chứng, kiểm tra chất lượng | Test | 2,000 |
| 11 | Ngoại kiểm (nếu có)* |
| 0,02 |
| 12 | Nước cất | ml | 8,000 |
| 13 | Đầu côn 1000 µl | Cái | 2,000 |
| 14 | Đầu côn 200 µl | Cái | 5,000 |
| 15 | Giấy thấm | Cuộn | 0,100 |
| 16 | Giấy xét nghiệm | Tờ | 2,000 |
| 17 | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 18 | Bút viết kính | Cái | 0,020 |
| 19 | Bút bi | Cái | 0,010 |
| 20 | Mũ | Cái | 0,020 |
| 21 | Khẩu trang | Cái | 0,020 |
| 22 | Găng tay | Đôi | 0,100 |
| 23 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 24 | Quần áo bảo hộ | Bộ | 0,005 |
| 25 | Dung dịch nước rửa tay | ml | 8,000 |
| 26 | Cồn sát trùng tay nhanh | ml | 1,000 |
| 27 | Dung dịch khử trùng | ml | 10,000 |
| 28 | Khăn lau tay | Cái | 0,010 |
* Ghi chú: Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo chương trình ngoại kiểm (EQAS) là 1/50 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 2 lần/1 năm).
3. Bệnh phẩm: Huyết thanh hoặc huyết tương.
4. Phiếu xét nghiệm: Điền đầy đủ thông tin theo mẫu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
- Theo đúng quy định của chuyên ngành Vi sinh: xem chi tiết phụ lục 2
- Từ chối những bệnh phẩm không đạt yêu cầu: xem chi tiết phụ lục 6.
2.Tiến hành kỹ thuật: Bộ sinh phẩm ETI - AB - DELTAK-2 - Diasorin (VD)
| Các bước | Xét nghiệm định tính HDV Ab |
| 2.1 | Để số lượng sinh phẩm cần dùng ở nhiệt độ phòng 30 phút trước khi làm xét nghiệm |
| 2.2 | Đánh số, sắp xếp bệnh phẩm và viết sơ đồ theo thứ tự. |
| 2.3 | Chuẩn bị dung dịch rửa |
| 2.4 | Chuẩn bị cộng hợp |
| 2.5 | Lấy đủ số giếng cần dùng và đặt vào giá. |
| 2.6 | Nhỏ chứng và mẫu huyết thanh người bệnh |
| 2.7 | Nhỏ chất cộng hợp |
| 2.8 | Đậy tấm và ủ |
| 2.9 | Rửa |
| 2.10 | Nhỏ dung dịch hiện màu |
| 2.11 | Ủ, không đậy tấm và tránh ánh sáng |
| 2.12 | Dừng phản ứng |
| 2.13 | Đọc kết quả ở bước sóng 450/630nm trong vòng 60 phút sau khi dừng phản ứng. |
IV. NHẬN ĐỊNH KẾT QUẢ
1. Tính giá trị ngưỡng (cut-off CO)
CO = Giá trị TB chứng âm x 0 .5 + Giá trị TB chứng dương x 0 .5
2. Điều kiện của phản ứng
- OD của giếng trống ≤ 0.150.
- OD của trung bình chứng âm ≥ 0.600
- OD của trung bình chứng dương ≤ 0.800
- Trung bình chứng âm - trung bình chứng dương ≥ 0.500
3. Diễn giải kết quả
+ Dương tính: nếu OD của mẫu bệnh phẩm ≤ OD của cut-off
+ Nghi ngờ: nếu tỉ lệ nhỏ hơn hoặc lớn hơn 10 % OD của cut-off
+ Âm tính: nếu OD của mẫu bệnh phẩm ≥ OD của cut-off
- Nếu kết quả nghi ngờ → làm lại xét nghiệm lần 2.
+ Nếu kết quả dương tính lặp lại → kết luận dương tính
+ Nếu kết quả lần 2 âm tính → kết luận âm tính
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
1. Sai sót
Có thể xảy ra hiện tượng âm tính giả hoặc dương tính giả, thông thường do:
- Thực hiện sai các bước trong quy trình hướng dẫn.
- Chứng âm và những mẫu bệnh phẩm âm tính bị nhiễm chéo bởi huyết thanh/ huyết tương có nồng độ kháng thể cao.
- Dung dịch cơ chất bị nhiễm bẩn bởi các tác nhân oxid hoá (thuốc tẩy, ion kim loại v.v…)
- Dung dịch dừng phản ứng bị nhiễm bẩn.
2. Xử trí
- Tuân thủ đúng các bước quy trình hướng dẫn của nhà sản xuất và hướng dẫn về độ ổn định hóa chất xét nghiệm trong bộ sinh phẩm sử dụng.
- Kiểm tra và vệ sinh máy rửa thường xuyên trước và sau khi làm xét nghiệm.
115. HEV IgM test nhanh
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Phát hiện kháng thể IgM kháng virus viêm gan E (HEV) trong huyết thanh hoặc huyết tương.
2. Nguyên lý
Phát hiện kháng thể IgM kháng virus viêm gan E dựa trên nguyên lý của kỹ thuật sắc ký miễn dịch.
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện: Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: Cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Micropipette 50 µl -100 µl.
- Máy ly tâm thường.
- Đồng hồ bấm giây.
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
Thực hiện xét nghiệm 01 mẫu/lần.
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Bông | Kg | 0,001 |
| 2 | Dây garô | Cái | 0,001 |
| 3 | Tube đựng bệnh phẩm | Cái | 1,000 |
| 4 | Sinh phẩm chẩn đoán | Test | 1,000 |
| 5 | Khấu hao sinh phẩm cho chạy chứng, kiểm tra chất lượng | Test | 0,200 |
| 6 | Ngoại kiểm chứng (nếu có)* |
| 0,02 |
| 7 | Đầu côn 200 µl | Cái | 1,200 |
| 8 | Giấy thấm | Cuộn | 0,100 |
| 9 | Giấy xét nghiệm | Tờ | 2,000 |
| 10 | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 11 | Bút viết kính | Cái | 0,020 |
| 12 | Bút bi | Cái | 0,010 |
| 13 | Mũ | Cái | 0,020 |
| 14 | Khẩu trang | Cái | 0,020 |
| 15 | Găng tay | Đôi | 0,100 |
| 16 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 17 | Quần áo bảo hộ | Bộ | 0,005 |
| 18 | Dung dịch nước rửa tay | ml | 8,000 |
| 19 | Cồn sát trùng tay nhanh | ml | 1,000 |
| 20 | Dung dịch khử trùng | ml | 10,000 |
| 21 | Khăn lau tay | Cái | 0,010 |
* Ghi chú: Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/50 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 2 lần/1 năm).
3. Bệnh phẩm
Huyết thanh hoặc huyết tương của người bệnh
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu phiếu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
- Theo đúng quy định của chuyên ngành Vi sinh: xem chi tiết phụ lục 2
- Từ chối những bệnh phẩm không đạt yêu cầu: xem chi tiết phụ lục 6.
2. Tiến hành kỹ thuật
Bộ sinh phẩm HEV IgM Rapid test (VD).
| Các bước | Xét nghiệm phát hiện HEV IgM nhanh |
| 1 | Lấy số lượng thanh thử cần thiết. Ghi mã bệnh phẩm tương ứng |
| 2 | Nhỏ huyết thanh hoặc huyết tương vào vùng nhỏ bệnh phẩm theo hướng dẫn. |
| 3 | Nhỏ dung dịch đệm phản ứng vào giếng (2) theo hướng dẫn. |
| 4 | Nhỏ dung dịch đệm vào giếng (3) theo hướng dẫn. |
| 5 | Chờ 15 phút đọc kết quả. |
IV. NHẬN ĐỊNH KẾT QUẢ
- Dương tính: Xuất hiện 2 vạch đỏ ở phần chứng và phần bệnh phẩm.
- Âm tính: Chỉ có 1 vạch đỏ ở phần chứng.
- Không xác định:
+ Chỉ có 1 vạch đỏ ở phần bệnh phẩm.
+ Không có vạch đỏ nào xuất hiện ở phần chứng và phần bệnh phẩm.
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
- Thời gian đọc KQ à ghi lại thời gian làm xét nghiệm và thời gian đọc kết quả để tránh dương tính giả và âm tính giả.
- Chất lượng bệnh phẩm: những mẫu bệnh phẩm tan huyết sẽ ảnh hưởng đến chất lượng và kết quả xét nghiệm.
116. HEV IgM miễn dịch bán tự động
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Phát hiện kháng thể IgM kháng virus viêm gan E trong huyết thanh hoặc huyết tương.
2. Nguyên lý
Phát hiện kháng thể IgM kháng virus viêm gan E dựa trên nguyên lý của kỹ thuật ELISA (miễn dịch gắn enzym) (VD).
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện: Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: Cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Dàn máy ELISA
- Máy ly tâm thường.
- Tủ lạnh 2oC - 8oC
- Tủ âm sâu (-20oC hoặc -70oC) (nếu có)
- Micropipette đơn kênh thể tích từ 10 µl đến 1000 µl .
- Bộ pipetman 8 kênh (nếu có)
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
Thực hiện xét nghiệm 04 mẫu/lần.
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Bông | Kg | 0,001 |
| 2 | Dây garô | Cái | 0,001 |
| 3 | Cồn | ml | 1,000 |
| 4 | Bơm kim tiêm | Cái | 1,000 |
| 5 | Panh | Cái | 0,0001 |
| 6 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 7 | Hộp vận chuyển bệnh phẩm | Test | 0,001 |
| 8 | Tube đựng bệnh phẩm | Cái | 2,000 |
| 9 | Sinh phẩm chẩn đoán | Test | 1,000 |
| 10 | Khấu hao sinh phẩm cho chạy chứng, kiểm tra chất lượng | Test | 1,200 |
| 11 | Ngoại kiểm (nếu có)* |
| 0,02 |
| 12 | Nước cất | ml | 8,000 |
| 13 | Đầu côn 1000 µl | Cái | 2,000 |
| 14 | Đầu côn 200 µl | Cái | 5,000 |
| 15 | Giấy thấm | Cuộn | 0,100 |
| 16 | Giấy xét nghiệm | Tờ | 2,000 |
| 17 | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 18 | Bút viết kính | Cái | 0,020 |
| 19 | Bút bi | Cái | 0,010 |
| 20 | Mũ | Cái | 0,020 |
| 21 | Khẩu trang | Cái | 0,020 |
| 22 | Găng tay | Đôi | 0,100 |
| 23 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 24 | Quần áo bảo hộ | Bộ | 0,005 |
| 25 | Dung dịch nước rửa tay | ml | 8,000 |
| 26 | Cồn sát trùng tay nhanh | ml | 1,000 |
| 27 | Dung dịch khử trùng | ml | 10,000 |
| 28 | Khăn lau tay | Cái | 0,010 |
* Ghi chú: Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo chương trình ngoại kiểm (EQAS) là 1/50 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 2 lần/1 năm).
3. Bệnh phẩm: Huyết thanh hoặc huyết tương.
4. Phiếu xét nghiệm: Điền đầy đủ thông tin theo mẫu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
- Theo đúng quy định của chuyên ngành Vi sinh: xem chi tiết phụ lục 2
- Từ chối những bệnh phẩm không đạt yêu cầu: xem chi tiết phụ lục 6.
2.Tiến hành kỹ thuật: Bộ sinh phẩm HEV IgM ELISA - DRG (VD)
| Các bước | Xét nghiệm định tính HEV IgM |
| 2.1 | Để số lượng sinh phẩm cần dùng ở nhiệt độ phòng 30 phút trước khi làm xét nghiệm |
| 2.2 | Đánh số, sắp xếp bệnh phẩm và viết sơ đồ theo thứ tự. |
| 2.3 | Chuẩn bị dung dịch rửa |
| 2.4 | Pha loãng bệnh phẩm |
| 2.5 | Lấy đủ số giếng cần dùng và đặt vào giá. |
| 2.6 | Nhỏ dung dịch trung hòa vào những giếng nhỏ bệnh phẩm |
| 2.7 | Nhỏ chứng và mẫu huyết thanh người bệnh đã pha loãng |
| 2.8 | Đậy tấm và ủ |
| 2.9 | Rửa |
| 2.10 | Nhỏ chất cộng hợp vào mỗi giếng |
| 2.11 | Đậy tấm và ủ |
| 2.12 | Rửa |
| 2.13 | Nhỏ dung dịch hiện màu |
| 2.14 | Ủ, không đậy tấm và tránh ánh sáng |
| 2.15 | Dừng phản ứng |
| 2.16 | Đọc kết quả ở bước sóng 450/630nm trong vòng 60 phút sau khi dừng phản ứng. |
IV. NHẬN ĐỊNH KẾT QUẢ
1. Điều kiện của phản ứng
- OD của giếng trống ≤ 0,100
- OD của chứng âm < 0,100
- OD của chứng dương > 0,500
2. Tính giá trị ngưỡng
- Cut-off (CO) = Giá trị trung bình chứng âm + 0 .25
3. Diễn giải kết quả
Tính tỷ số Bệnh phẩm/CO (R)
+ Dương tính: R > 1,2
+ Nghi ngờ: 1 < R ≤ 1,2 → làm lại xét nghiệm lần 2 sau 1 - 2 tuần
+ Âm tính: R < 1
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
1. Sai sót
Có thể xảy ra hiện tượng âm tính giả hoặc dương tính giả, thông thường do:
- Thực hiện sai các bước trong quy trình hướng dẫn.
- Chứng âm và những mẫu bệnh phẩm âm tính bị nhiễm chéo bởi huyết thanh/ huyết tương có nồng độ kháng thể cao.
- Dung dịch cơ chất bị nhiễm bởi các tác nhân oxid hoá (thuốc tẩy, ion kim loại v.v…)
- Dung dịch dừng phản ứng bị nhiễm bẩn.
2. Xử trí
- Tuân thủ đúng các bước quy trình hướng dẫn của nhà sản xuất và hướng dẫn về độ ổn định hóa chất xét nghiệm trong bộ sinh phẩm sử dụng.
- Kiểm tra và vệ sinh máy rửa thường xuyên trước và sau khi làm xét nghiệm
117. HIV Ab test nhanh
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Phát hiện kháng thể kháng HIV trong huyết thanh hoặc huyết tương.
2. Nguyên lý
Phát hiện kháng thể kháng HIV dựa trên nguyên lý của kỹ thuật sắc ký miễn dịch.
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện: Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh đồng thời được đào tạo và có chứng chỉ về xét nghiệm HIV theo qui định của Bộ Y tế.
- Người nhận định và phê duyệt kết quả: Cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh đồng thời được đào tạo và có chứng chỉ về xét nghiệm HIV theo qui định của Bộ Y tế.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Máy ly tâm thường.
- Micropipette 50 µl -100 µl.
- Đồng hồ bấm giây
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
Thực hiện xét nghiệm 01 mẫu/lần.
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Bông | Kg | 0,001 |
| 2 | Dây garô | Cái | 0,001 |
| 3 | Cồn | ml | 1,000 |
| 4 | Bơm kim tiêm | Cái | 1,000 |
| 5 | Panh | Cái | 0,0001 |
| 6 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 7 | Hộp vận chuyển bệnh phẩm | Cái | 0,001 |
| 8 | Tube đựng bệnh phẩm | Cái | 1,000 |
| 9 | Sinh phẩm chẩn đoán | Test | 1,000 |
| 10 | Khấu hao sinh phẩm cho chạy chứng | Test | 0,200 |
| 11 | EQAS (nếu thực hiện) * |
| 0,02 |
| 12 | Đầu côn 200 µl | Cái | 2,000 |
| 13 | Giấy thấm | Cuộn | 0,100 |
| 14 | Giấy xét nghiệm | Tờ | 2,000 |
| 15 | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 16 | Bút viết kính | Cái | 0,020 |
| 17 | Bút bi | Cái | 0,010 |
| 18 | Mũ | Cái | 0,020 |
| 19 | Khẩu trang | Cái | 0,020 |
| 20 | Găng tay | Đôi | 0,100 |
| 21 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 22 | Quần áo bảo hộ | Bộ | 0,005 |
| 23 | Dung dịch nước rửa tay | ml | 8,000 |
| 24 | Cồn sát trùng tay nhanh | ml | 1,000 |
| 25 | Dung dịch khử trùng | ml | 10,000 |
| 26 | Khăn lau tay | Cái | 0,010 |
* Ghi chú: Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/50 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 2 lần/1 năm).
3. Bệnh phẩm
Huyết thanh, huyết tương của người bệnh
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu phiếu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
- Theo đúng quy định của chuyên ngành Vi sinh: xem chi tiết phụ lục 2
- Từ chối những bệnh phẩm không đạt yêu cầu: xem chi tiết phụ lục 6.
2. Tiến hành kỹ thuật
Bộ sinh phẩm Determine HIV ½ Ab.(VD).
| Các bước | Xét nghiệm phát hiện kháng thể HIV nhanh |
| 1 | Tách rời từng thanh xét nghiệm rồi bóc vỏ Ghi mã bệnh phẩm xét nghiệm tương ứng |
| 2 | Nhỏ 50 µl huyết thanh, huyết tương hoặc máu toàn phần vào vùng nhỏ bệnh phẩm |
| 3 | Chờ 15 phút đọc kết quả |
IV. NHẬN ĐỊNH KẾT QUẢ (Kết quả sơ bộ)
- Dương tính: Xuất hiện 2 vạch đỏ ở phần chứng và phần bệnh phẩm.
- Âm tính: Chỉ có 1 vạch đỏ ở phần chứng.
- Không xác định:
+ Chỉ có 1 vạch đỏ ở phần bệnh phẩm.
+ Không có vạch đỏ nào xuất hiện ở phần chứng và phần bệnh phẩm.
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
- Thời gian đọc KQ à ghi lại thời gian làm xét nghiệm và thời gian đọc kết quả để tránh dương tính giả và âm tính giả.
- Chất lượng bệnh phẩm: những mẫu bệnh phẩm tan huyết sẽ ảnh hưởng đến chất lượng và kết quả xét nghiệm.
118. HIV Ag/Ab test nhanh
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Phát hiện kháng nguyên p24 và kháng thể kháng HIV-1 và HIV-2 trong huyết thanh hoặc huyết tương.
2. Nguyên lý
Phát hiện kháng nguyên p24 và kháng thể kháng HIV-1 và HIV-2 dựa trên nguyên lý của kỹ thuật sắc ký miễn dịch.
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện: Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh đồng thời được đào tạo và có chứng chỉ về xét nghiệm HIV theo qui định của Bộ Y tế.
- Người nhận định và phê duyệt kết quả: Cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh đồng thời được đào tạo và có chứng chỉ về xét nghiệm HIV theo qui định của Bộ Y tế.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Micropipette 50 µl - 100 µl.
- Máy ly tâm thường.
- Đồng hồ bấm giây.
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
Thực hiện xét nghiệm 01 mẫu/lần.
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Bông | Kg | 0,001 |
| 2 | Dây garô | Cái | 0,001 |
| 3 | Cồn | ml | 1,000 |
| 4 | Bơm kim tiêm | Cái | 1,000 |
| 5 | Panh | Cái | 0,0001 |
| 6 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 7 | Hộp vận chuyển bệnh phẩm | Cái | 0,001 |
| 8 | Tube đựng bệnh phẩm | Cái | 1,000 |
| 9 | Sinh phẩm chẩn đoán | Test | 1,000 |
| 10 | Khấu hao sinh phẩm cho chạy chứng và kiểm tra chất lượng | Test | 0,200 |
| 11 | EQAS (nếu thực hiện) * |
| 0,02 |
| 12 | Đầu côn 200 µl | Cái | 2,000 |
| 13 | Giấy thấm | Cuộn | 0,100 |
| 14 | Giấy xét nghiệm | Tờ | 2,000 |
| 15 | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 16 | Bút viết kính | Cái | 0,020 |
| 17 | Bút bi | Cái | 0,010 |
| 18 | Mũ | Cái | 0,020 |
| 19 | Khẩu trang | Cái | 0,020 |
| 20 | Găng tay | Đôi | 0,100 |
| 21 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 22 | Quần áo bảo hộ | Bộ | 0,005 |
| 23 | Dung dịch nước rửa tay | ml | 8,000 |
| 24 | Cồn sát trùng tay nhanh | ml | 1,000 |
| 25 | Dung dịch khử trùng | ml | 10,000 |
| 26 | Khăn lau tay | Cái | 0,010 |
* Ghi chú: Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/50 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 2 lần/1 năm).
3. Bệnh phẩm
Huyết thanh, huyết tương hoặc máu toàn phần của người bệnh
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu phiếu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
- Theo đúng quy định của chuyên ngành Vi sinh: xem chi tiết phụ lục 2
- Từ chối những bệnh phẩm không đạt yêu cầu: xem chi tiết phụ lục 6.
2. Tiến hành kỹ thuật
Bộ sinh phẩm Alere Determine HIV ½ Ag/Ab Combo - Alere (VD)
| Các bước | Xét nghiệm phát hiện kháng nguyên-kháng thể HIV |
| Đối với huyết thanh/huyết tương | |
| 1 | Tách rời từng thanh xét nghiệm rồi xé bao bảo vệ thanh xét nghiệm. Ghi mã bệnh phẩm xét nghiệm tương ứng |
| 2 | Nhỏ 50 µl huyết thanh hoặc huyết tương vào vùng nhỏ bệnh phẩm |
| 3 | Chờ 20 phút đọc kết quả |
| Đối với máu toàn phần | |
| 1 | Tách rời từng thanh xét nghiệm rồi bóc vỏ |
|
| Ghi mã bệnh phẩm xét nghiệm tương ứng |
| 2 | Nhỏ 50 µl huyết thanh hoặc huyết tương vào vùng nhỏ bệnh phẩm |
| 3 | Đợi một phút, sau đó cho một giọt dung dịch đệm Chase vào vùng nhỏ mẫu bệnh phẩm |
| 4 | Chờ 20 phút đọc kết quả |
| Lưu ý (đối với cả huyết thanh, huyết tương và máu toàn phần): Không đọc kết quả sau quá 30 phút | |
IV. NHẬN ĐỊNH KẾT QUẢ
1. Điều kiện của phản ứng:
- Vạch chứng phải chuyển màu đỏ khi xét nghiệm hoàn tất.
- Nếu vạch chứng không xuất hiện thì kết quả xét nghiệm không có giá trị và mẫu phẩm cần phải được thử lại.
2. Nhận định kết quả
- Có phản ứng với kháng thể: Xuất hiện 2 vạch đỏ ở vùng chứng và vùng kháng thể.
- Có phản ứng với kháng nguyên (p24): Xuất hiện 2 vạch đỏ ở vùng chứng và vùng kháng nguyên.
- Có phản ứng với kháng thể và kháng nguyên (p24): Xuất hiện 3 vạch đỏ ở vùng chứng, vùng kháng thể và vùng kháng nguyên.
- Âm tính: Chỉ có 1 vạch đỏ ở phần chứng.
- Không xác định:
+ Chỉ có 1 vạch đỏ ở phần bệnh phẩm.
+ Không có vạch đỏ nào xuất hiện ở phần chứng và phần bệnh phẩm → cần phải thử lại mẫu phẩm.
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
Đọc kết quả sau quá 30 phút dễ gây phản ứng dương tính giả → Nên có đồng hồ đặt giờ để đọc kết quả đúng giờ qui định.
119. HIV Ab miễn dịch bán tự động
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Phát hiện kháng thể kháng HIV trong huyết thanh hoặc huyết tương.
2. Nguyên lý
Phát hiện kháng thể kháng HIV dựa trên nguyên lý của kỹ thuật ELISA (miễn dịch gắn enzym) (VD).
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh đồng thời được đào tạo và có chứng chỉ về xét nghiệm HIV theo qui định của Bộ Y tế.
- Người nhận định và phê duyệt kết quả: Cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh đồng thời được đào tạo và có chứng chỉ về xét nghiệm HIV theo qui định của Bộ Y tế.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Dàn máy ELISA.
- Máy ly tâm thường.
- Tủ âm sâu (-20oC hoặc -70oC) (nếu có).
- Tủ lạnh 2oC - 8oC
- Micropipette 100 µl, 1000 µl.
- Bộ pipetman 8 kênh (nếu có).
- Ống đong có vạch dung tích 25ml, 100ml, 1000ml
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
Thực hiện xét nghiệm 10 mẫu/lần.
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Bông | Kg | 0,001 |
| 2 | Dây garô | Cái | 0,001 |
| 3 | Tube đựng bệnh phẩm | Cái | 1,000 |
| 4 | Tube lưu mẫu dương tính | Cái | 0,200 |
| 5 | Sinh phẩm chẩn đoán | Test | 1,000 |
| 6 | Khấu hao sinh phẩm cho chạy chứng, kiểm tra chất lượng | Test | 0,300 |
| 7 | Chứng ngoại kiểm âm (nếu có) | ml | 0,030 |
| 8 | Chứng ngoại kiểm dương (nếu có) | ml | 0,030 |
| 9 | Ngoại kiểm (nếu có)* |
| 0,02 |
| 10 | Nước cất | ml | 8,000 |
| 11 | Đầu côn 1000 µl | Cái | 2,000 |
| 12 | Đầu côn 200 µl | Cái | 2,000 |
| 13 | Giấy thấm | Cuộn | 0,100 |
| 14 | Giấy xét nghiệm | Tờ | 2,000 |
| 15 | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 16 | Bút viết kính | Cái | 0,020 |
| 17 | Bút bi | Cái | 0,010 |
| 18 | Mũ | Cái | 0,020 |
| 19 | Khẩu trang | Cái | 0,020 |
| 20 | Găng tay | Đôi | 0,100 |
| 21 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 22 | Quần áo bảo hộ | Bộ | 0,005 |
| 23 | Dung dịch nước rửa tay | ml | 8,000 |
| 24 | Cồn sát trùng tay nhanh | ml | 1,000 |
| 25 | Dung dịch khử trùng | ml | 10,000 |
| 26 | Khăn lau tay | Cái | 0,010 |
* Ghi chú: Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/50 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 2 lần/1 năm).
3. Bệnh phẩm
Huyết thanh của người bệnh
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu phiếu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
- Theo đúng quy định của chuyên ngành Vi sinh: xem chi tiết phụ lục 2
- Từ chối những bệnh phẩm không đạt yêu cầu: xem chi tiết phụ lục 6.
2. Tiến hành kỹ thuật
Bộ sinh phẩm GENSCREENTM HIV ½ version 2 Bio-Rad (VD)
| Các bước | Xét nghiệm định tính HIV Ab |
| 1 | Lấy sinh phẩm cần dùng ở nhiệt độ phòng 30 phút trước khi làm xét nghiệm. Lập sơ đồ phân phối mẫu |
| 2 | Chuẩn bị chất cộng hợp theo hướng dẫn của nhà sản xuất |
| 3 | Lấy phiến nhựa và các thanh giếng. Nhỏ dung dịch pha loãng bệnh phẩm vào mỗi giếng phản ứng theo hướng dẫn. |
| 4 | Nhỏ chứng âm (R3); Cut-off (R4); Chứng dương (R5), mẫu EQC (nếu có), mẫu bệnh phẩm vào các giếng tiếp theo như hướng dẫn của nhà sản xuất. |
| 5 | Đậy và ủ ở nhiệt độ và trong thời gian theo quy trình hướng dẫn của nhà sản xuất. |
| 6 | Rửa phiến phản ứng bằng máy rửa theo chương trình hướng dẫn |
| 7 | Nhỏ cộng hợp theo hướng dẫn. |
| 8 | Đậy phiến phản ứng và ủ nhiệt độ và trong thời gian theo quy trình hướng dẫn của nhà sản xuất. |
| 9 | Rửa phiến phản ứng bằng máy rửa theo chương trình hướng dẫn của nhà sản xuất |
| 10 | Nhỏ hiện màu cơ chất theo hướng dẫn |
| 11 | Để tối nhiệt độ phòng (18oC - 30oC) và tránh ánh sáng theo hướng dẫn. |
| 12 | Dừng phản ứng. Đọc KQ ở bước sóng 450/620 -700 nm |
IV. NHẬN ĐỊNH KẾT QUẢ Kiểm tra và báo cáo kết quả
Tính giá trị trung bình của cut-off: ![]()
Tính giá trị cut-off: C.O = ![]() : 10
: 10
- Điều kiện thỏa mãn:
+ OD của Chứng âm < 0.7 x C.O
+ ![]() > 0.8
> 0.8
+ ODR5/![]() ³ 1.3
³ 1.3
Sự có mặt hay không có mặt KT HIV1 và/hoặc HIV2 được xác định bằng cách đo so sánh mật độ quang của mỗi mẫu thử với giá trị ngưỡng.
Biện luận kết quả
- Kết quả âm tính: Mẫu thử có OD < C.O được coi như âm tính với GENSCREENTM HIV ½ version 2
- Kết quả dương tính: Mẫu thử có OD ³ C.O được coi như dương tính với GENSCREENTM HIV ½ version 2
Những mẫu dương tính cần phải được kiểm tra lại bằng hai bộ sinh phẩm khác có nguyên lý chuẩn bị kháng nguyên khác nhau để khẳng định mẫu đó là dương tính với HIV theo qui định.
- Mẫu có OD nằm trong khoảng C.O - 10%<OD<C.O cần thận trọng và nên được kiểm tra lại.
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
1. Sai sót
Có thể xảy ra hiện tượng âm tính giả hoặc dương tính giả, thông thường do:
- Thực hiện sai các bước trong quy trình hướng dẫn.
- Chứng âm và những mẫu bệnh phẩm âm tính bị nhiễm chéo bởi huyết thanh có nồng độ kháng thể cao.
- Cơ chất bị nhiễm bởi các tác nhân oxy hoá (thuốc tẩy, ion kim loại v.v…)
- Dung dịch dừng phản ứng bị nhiễm bẩn.
2. Xử trí
- Tuân thủ đúng các bước quy trình hướng dẫn của nhà sản xuất và hướng dẫn về độ ổn định hóa chất xét nghiệm trong bộ sinh phẩm sử dụng.
- Kiểm tra và vệ sinh máy rửa thường xuyên trước và sau khi làm xét nghiệm
- Chia hóa chất (chất cộng hợp, dung dịch hiện màu và dừng phản ứng) vào ống nghiệm sạch trước mỗi lần nhỏ.
120. HIV Ag/Ab miễn dịch bán tự động
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Phát hiện kháng nguyên, kháng thể HIV Ag/Ab trong huyết thanh hoặc huyết tương.
2. Nguyên lý
Phát hiện kháng nguyên, kháng thể HIV Ag/Ab dựa trên nguyên lý của kỹ thuật ELISA (miễn dịch gắn enzym) (VD).
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện: Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh đồng thời được đào tạo và có chứng chỉ về xét nghiệm HIV theo qui định của Bộ Y tế.
- Người nhận định và phê duyệt kết quả: Cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh đồng thời được đào tạo và có chứng chỉ về xét nghiệm HIV theo qui định của Bộ Y tế.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương
2.1. Trang thiết bị
- Dàn máy ELISA.
- Máy ly tâm thường.
- Tủ lạnh 2oC - 8oC
- Tủ âm sâu (-20oC hoặc -70oC ) (nếu có).
- Micropipette 100 µl, 1000 µl.
- Giá đựng ống máu
- Bộ pipetman 8 kênh (nếu có).
- Ống đong có vạch dung tích 25ml, 100ml, 1000ml
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
Thực hiện xét nghiệm 10 mẫu/lần.
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Bông | Kg | 0,001 |
| 2 | Dây garô | Cái | 0,001 |
| 3 | Tube đựng bệnh phẩm | Cái | 1,000 |
| 4 | Tube lưu mẫu dương tính | Cái | 0,200 |
| 5 | Sinh phẩm chẩn đoán | Test | 1,000 |
| 6 | Khấu hao sinh phẩm cho chạy chứng, kiểm tra chất lượng | Test | 0,300 |
| 7 | Chứng ngoại kiểm âm (nếu có) | ml | 0,030 |
| 8 | Chứng ngoại kiểm dương (nếu có) | ml | 0,030 |
| 9 | Ngoại kiểm (nếu có)* |
| 0,02 |
| 10 | Nước cất | ml | 8,000 |
| 11 | Đầu côn 1000 µl | Cái | 2,000 |
| 12 | Đầu côn 200 µl | Cái | 2,000 |
| 13 | Giấy thấm | Cuộn | 0,100 |
| 14 | Giấy xét nghiệm | Tờ | 2,000 |
| 15 | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 16 | Bút viết kính | Cái | 0,020 |
| 17 | Bút bi | Cái | 0,010 |
| 18 | Mũ | Cái | 0,020 |
| 19 | Khẩu trang | Cái | 0,020 |
| 20 | Găng tay | Đôi | 0,100 |
| 21 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 22 | Quần áo bảo hộ | Bộ | 0,005 |
| 23 | Dung dịch nước rửa tay | ml | 8,000 |
| 24 | Cồn sát trùng tay nhanh | ml | 1,000 |
| 25 | Dung dịch khử trùng | ml | 10,000 |
| 26 | Khăn lau tay | Cái | 0,010 |
* Ghi chú: Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/50 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 2 lần/1 năm).
3. Bệnh phẩm
Huyết thanh của người bệnh
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu phiếu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
- Theo đúng quy định của chuyên ngành Vi sinh: xem chi tiết phụ lục 2
- Từ chối những bệnh phẩm không đạt yêu cầu: xem chi tiết phụ lục 6.
2. Tiến hành kỹ thuật
Bộ sinh phẩm GENSCREENTM ULTRA HIV Ag-Ab. Bio-Rad (VD)
| Các bước | Xét nghiệm định tính HIV Ag/Ab |
| 1 | Lấy sinh phẩm cần dùng ở nhiệt độ phòng 30 phút trước khi làm xét nghiệm. Lập sơ đồ phân phối mẫu |
| 2 | Chuẩn bị dung dịch rửa pha loãng, chuẩn bị chất cộng hợp theo hướng dẫn của nhà sản xuất |
| 3 | Lấy phiến nhựa và các thanh giếng. Nhỏ chất cộng hợp 1 vào mỗi giếng phản ứng. |
| 4 | Nhỏ chứng dương HIV Ag (R5);Chứng dương HIV Ab (R4); Chứng âm (R3), mẫu EQC (nếu có), mẫu bệnh phẩm vào các giếng tiếp theo như hướng dẫn của nhà sản xuất. |
| 5 | Đậy và ủ phiến phản ứng ở nhiệt độ thích hợp trong thời gian quy định theo hướng dẫn của nhà sản xuất. |
| 6 | Rửa phiến phản ứng bằng máy rửa theo chương trình hướng dẫn |
| 7 | Nhỏ cộng hợp 2 |
| 8 | Đậy phiến phản ứng và ủ ở nhiệt độ phòng (18oC - 30oC) trong thời gian quy định theo hướng dẫn của nhà sản xuất. |
| 9 | Rửa phiến phản ứng bằng máy rửa theo chương trình hướng dẫn |
| 10 | Nhỏ hiện màu |
| 11 | Để ở nhiệt độ phòng (18oC - 30oC) và tránh ánh sáng theo hướng dẫn. |
| 12 | Dừng phản ứng. Đọc KQ ở bước sóng 450/620 -700 nm |
IV. NHẬN ĐỊNH KẾT QUẢ
1. Kiểm tra chất lượng
- Độ hấp phụ của mỗi chứng âm phải nhỏ hơn 0,170: OD R3 < 0,170 .
Nếu một chứng âm OD > 0.17 thì bỏ đi và tính trung bình hai kết quả còn lại. Đến đây chỉ một trong hai trị số bị bỏ đi mà thôi .
- Độ hấp phụ trung bình của các chứng âm ![]() phải nhỏ hơn 0,150: OD R3 < 0,150.
phải nhỏ hơn 0,150: OD R3 < 0,150.
- Độ hấp phụ của chứng dương HIV Ab (R4)phải lớn hơn 0,9: OD R4 > 0,9
- Độ hấp phụ của chứng dương HIV Ag (R5)phải lớn hơn 0,9: OD R5 > 0,9
2. Kết quả và báo cáo
- Tính độ hấp thụ trung bình của chứng âm (OD R3)
![]()
- Tính giá trị ngưỡng (C.O)
Giá trị ngưỡng được tính theo công thức:
C.O = ![]() + 0,200
+ 0,200
Biện luận kết quả
- Kết quả âm tính: Mẫu thử có OD<C.O được coi như âm tính với GENSCREENTM ULTRA HIV Ag-Ab
- Kết quả dương tính: Mẫu thử có OD < C.O được coi như dương tính với GENSCREENTM ULTRA HIV Ag-Ab
Những mẫu dương tính cần phải được kiểm tra lại bằng hai bộ sinh phẩm khác có nguyên lý chuẩn bị kháng nguyên khác nhau để khẳng định mẫu đó là dương tính với HIV theo qui định.
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
1. Sai sót
Có thể xảy ra hiện tượng âm tính giả hoặc dương tính giả, thông thường do:
- Thực hiện sai các bước trong quy trình hướng dẫn.
- Chứng âm và những mẫu bệnh phẩm âm tính bị nhiễm chéo bởi huyết thanh/ huyết tương có nồng độ kháng thể cao.
- Cơ chất bị nhiễm bởi các tác nhân oxy hoá (thuốc tẩy, ion kim loại v.v…)
- Dung dịch dừng phản ứng bị nhiễm bẩn.
2. Xử trí
- Tuân thủ đúng các bước quy trình hướng dẫn của nhà sản xuất và hướng dẫn về độ ổn định hóa chất xét nghiệm trong bộ sinh phẩm sử dụng.
- Kiểm tra và vệ sinh máy rửa thường xuyên trước và sau khi làm xét nghiệm
- Chia hóa chất (chất cộng hợp, dung dịch hiện màu và dừng phản ứng) vào ống nghiệm sạch trước mỗi lần nhỏ.
121. HIV Ag/Ab miễn dịch tự động
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Phát hiện kháng nguyên, kháng thể HIV Ag/Ab trong huyết thanh, huyết tương.
2. Nguyên lý
Dựa trên nguyên lý của kỹ thuật CLIA (miễn dịch điện hóa phát quang) (VD).
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện: Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh đồng thời được đào tạo và có chứng chỉ về xét nghiệm HIV theo qui định của Bộ Y tế.
- Người nhận định và phê duyệt kết quả: Cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh đồng thời được đào tạo và có chứng chỉ về xét nghiệm HIV theo qui định của Bộ Y tế.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Hệ thống máy miễn dịch tự động.
- Bộ lưu điện
- Máy ly tâm thường.
- Tủ lạnh 2oC - 8oC
- Tủ âm sâu (-20oC hoặc -70oC) (nếu có).
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
Thực hiện xét nghiệm 80 mẫu/lần.
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Bông | Kg | 0,001 |
| 2 | Dây garô | Cái | 0,001 |
| 3 | Cồn | ml | 1,000 |
| 4 | Bơm kim tiêm | Cái | 1,000 |
| 5 | Panh | Cái | 0,0001 |
| 6 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 7 | Hộp vận chuyển bệnh phẩm | Cái | 0,001 |
| 8 | Tube đựng bệnh phẩm | Cái | 1,000 |
| 9 | Tube lưu mẫu dương tính | Cái | 0,200 |
| 10 | Sinh phẩm chẩn đoán | Test | 1,000 |
| 11 | Khấu hao sinh phẩm cho chạy chuẩn | Test | 0,010 |
| 12 | Khấu hao sinh phẩm cho chạy chứng, kiểm tra chất lượng | Test | 0,050 |
| 13 | Chứng ngoại kiểm âm (nếu có) | ml | 0,010 |
| 14 | Chứng ngoại kiểm dương (nếu có) | ml | 0,010 |
| 15 | Chứng nội kiểm | ml | 0,500 |
| 16 | Ngoại kiểm (nếu có)* |
| 0,02 |
| 17 | Cleancell M | ml | 3,000 |
| 18 | Procell M | ml | 3,000 |
| 19 | Probe Wash M | ml | 2,000 |
| 20 | Preclean M | ml | 2,000 |
| 21 | Assay Tip/Cup E170 | Chiếc | 3,000 |
| 22 | ISE Cleaning Solution F. HIT | ml | 0,500 |
| 23 | Nước cất | ml | 5,000 |
| 24 | Sample cup | Cái | 1,000 |
| 25 | Giấy thấm | Cuộn | 0,100 |
| 26 | Giấy xét nghiệm | Tờ | 2,000 |
| 27 | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 28 | Bút viết kính | Cái | 0,020 |
| 29 | Bút bi | Cái | 0,010 |
| 30 | Mũ | Cái | 0,020 |
| 31 | Khẩu trang | Cái | 0,020 |
| 32 | Găng tay | Đôi | 0,100 |
| 33 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 34 | Quần áo bảo hộ | Bộ | 0,005 |
| 35 | Dung dịch nước rửa tay | ml | 8,000 |
| 36 | Cồn sát trùng tay nhanh | ml | 1,000 |
| 37 | Dung dịch khử trùng | ml | 10,000 |
| 38 | Khăn lau tay | Cái | 0,010 |
* Ghi chú: Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/50 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 2 lần/1 năm).
3. Bệnh phẩm
Huyết thanh hoặc huyết tương của người bệnh
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu phiếu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
- Theo đúng quy định của chuyên ngành Vi sinh: xem chi tiết phụ lục 2
- Từ chối những bệnh phẩm không đạt yêu cầu: xem chi tiết phụ lục 6.
2. Tiến hành kỹ thuật
Bộ sinh phẩm Elecsys HIV Combi - Roche (VD)
| Các bước | Xét nghiệm định tính HIV |
| 1 | Vào Reagent để kiểm tra số lượng tests |
| 2 | Vào Calibration → Status để kiểm tra hiệu chuẩn. |
| 3 | Chạy chứng |
| Chạy mẫu không dùng barcode | |
| 1 | Đánh số sample cup theo mã số bệnh phẩm. Hút mẫu và chứng vào sample cup tương ứng |
| 2 | Vào màn hình Workplace → Test Selection |
| 3 | Nhập mã bệnh phẩm và ngày thực hiện xét nghiệm |
| 4 | Chọn tên test là HIV |
| 5 | Vào Barcode Read Error |
| 6 | Nhập số rack và vị trí mẫu → Add → OK → Save |
| 7 | Đặt mẫu huyết thanh người bệnh Sample Cup lên Rack đúng vị trí đưa vào khu nạp giá mẫu. |
| 8 | Chọn Start → Chọn START ở màn hình Start Conditions |
| Chạy mẫu có barcode | |
| 1 | Nhập chỉ định định vào hệ thống LIS |
| 2 | Đưa ống máu dán barcode vào rack vào khu nạp giá mẫu |
| 3 | Chọn Start → Chọn START ở màn hình Start Conditions |
IV. NHẬN ĐỊNH KẾT QUẢ
1. Đánh giá theo tiêu chuẩn nhà sản xuất
- Chạy kiểm tra chứng 1 và chứng 2 trên tất cả các điện cực dùng để chạy xét nghiệm.
- Giá trị chứng đạt được phải nằm trong khoảng giới hạn xác định.
2. Đánh giá theo tiêu chuẩn phòng xét nghiệm
Chứng nội kiểm, ngoại kiểm.
3. Kết quả và báo cáo
- Mẫu huyết thanh: Máy sẽ tự động tính toán giá trị ngưỡng dựa trên số đo của Cal1 và Cal2. Kết quả của mẫu bệnh phẩm sẽ được thông báo là dương tính hoặc âm tính cùng với chỉ số ngưỡng (COI).
Kết quả được diễn giải như sau:
- Nếu COI < 0.90: mẫu bệnh phẩm được coi là âm tính với HIV.
- Nếu 0.90 ≤ COI ≤ 1.0: mẫu bệnh phẩm này nằm ở giới hạn ngưỡng và cần kiểm tra lại.
- Nếu COI > 1.0: mẫu bệnh phẩm được coi là dương tính với thử nghiệm HIV combi.
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
- Máy sẽ báo sample short (bệnh phẩm đông hoặc không đủ) →. Chú ý ly tâm mẫu thật kỹ ngay từ đầu hoặc hút mẫu ra cup (thực hiện theo đúng yêu cầu của lấy mẫu xét nghiệm Vi sinh)
- Không sử dụng thuốc thử đã quá hạn sử dụng.
- Tránh tạo bọt ở lọ thuốc thử và các loại mẫu (bệnh phẩm, calibration và chứng).
- Tham khảo thêm hướng dẫn của nhà sản xuất.
122. HIV khẳng định
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Khẳng định chẩn đoán nhiễm HIV ở người trên 18 tháng tuổi.
2. Nguyên lý
Sử dụng chiến lược III áp dụng cho các trường hợp nhiễm HIV ở những người trên 18 tháng tuổi bằng ba loại sinh phẩm với nguyên lý hoặc chuẩn bị kháng nguyên khác nhau.
II. CHUẨN BỊ
1. Người thực hiện
- Đáp ứng Khoản 1 Điều 5 thông tư 15/2013/TT-BYT
- Có kinh nghiệm làm xét nghiệm HIV ít nhất 01 năm.
- Có hiểu biết cơ bản về HIV và kỹ thuật xét nghiệm HIV đồng thời có khả năng phân tích và biện giải kết quả xét nghiệm
- Có hiểu biết về các văn bản quy phạm pháp luật liên quan đến xét nghiệm HIV.
- Người phụ trách và nhân viên của phòng xét nghiệm khẳng định HIV phải đáp ứng điều kiện quy định tại khoản 3 Điều 5 Nghị định số 92/2010/NĐ- CP
- Người thực hiện Cán bộ xét nghiệm đã được đào tạo và có chứng nhận đã qua đào tạo về xét nghiệm HIV.
- Người nhận định và phê duyệt kết quả: Cán bộ xét nghiệm có trình độ đại học hoặc sau đại học đã được đào tạo và có chứng nhận đã qua đào tạo về xét nghiệm HIV.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
Đáp ứng các điều kiện quy định tại Điều 8 thông tư 15/2013/TT-BYT
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
Thực hiện xét nghiệm 10 mẫu/lần.
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Bông | Kg | 0,001 |
| 2 | Dây garô | Cái | 0,001 |
| 3 | Cồn | ml | 1,000 |
| 4 | Bơm kim tiêm | Cái | 1,000 |
| 5 | Panh | Cái | 0,0001 |
| 6 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 7 | Hộp vận chuyển bệnh phẩm | Cái | 0,001 |
| 8 | Tube đựng bệnh phẩm | Cái | 2,000 |
| 9 | Tube lưu mẫu dương tính | Cái | 0,200 |
| 10 | Sinh phẩm chẩn đoán 1 | Test | 1,000 |
| 11 | Khấu hao sinh phẩm cho chạy chứng, kiểm tra chất lượng 1 | Test | 0,430 |
| 12 | Sinh phẩm chẩn đoán 2 | Test | 1,000 |
| 13 | Khấu hao sinh phẩm cho chạy chứng, kiểm tra chất lượng 2 | Test | 0,430 |
| 14 | Sinh phẩm chẩn đoán 3 | Test | 1,000 |
| 15 | Khấu hao sinh phẩm cho chạy chứng, kiểm tra chất lượng 3 | Test | 0,330 |
| 16 | Chứng ngoại kiểm âm (nếu có) | ml | 0,030 |
| 17 | Chứng ngoại kiểm dương (nếu có) | ml | 0,030 |
| 18 | Ngoại kiểm (nếu có)* |
| 0,02 |
| 19 | Nước cất | ml | 8,000 |
| 20 | Đầu côn 1000 µl | Cái | 2,000 |
| 21 | Đầu côn 200 µl | Cái | 2,000 |
| 22 | Giấy thấm | Cuộn | 0,100 |
| 23 | Giấy xét nghiệm | Tờ | 3,000 |
| 24 | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 25 | Bút viết kính | Cái | 0,020 |
| 26 | Bút bi | Cái | 0,010 |
| 27 | Mũ | Cái | 0,020 |
| 28 | Khẩu trang | Cái | 0,020 |
| 29 | Găng tay | Đôi | 0,100 |
| 30 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 31 | Quần áo bảo hộ | Bộ | 0,005 |
| 32 | Dung dịch nước rửa tay | ml | 8,000 |
| 33 | Cồn sát trùng tay nhanh | ml | 1,000 |
| 34 | Dung dịch khử trùng | ml | 10,000 |
| 35 | Khăn lau tay | Cái | 0,010 |
* Ghi chú: Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/50 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 2 lần/1 năm).
3. Bệnh phẩm
Huyết thanh hoặc huyết tương.
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu phiếu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
- Theo đúng quy định của chuyên ngành Vi sinh: xem chi tiết phụ lục 2
- Từ chối những bệnh phẩm không đạt yêu cầu: xem chi tiết phụ lục 6.
2. Tiến hành kỹ thuật
| Bước | Mô tả |
| 1. | Xét nghiệm |
| 1.1. | Xét nghiệm sử dụng sinh phẩm 1 có độ nhạy cao phát hiện được cả kháng nguyên và kháng thể HIV để sàng lọc (XN SP1) Nếu xét nghiệm SP1 âm tính tiếp tục thực hiện bước 2.1 Nếu xét nghiệm SP1 dương tính, thực hiện bước 1.2 |
| 1.2 | Xét nghiệm sử dụng sinh phẩm thứ 2 có độ đặc hiệu cao (XN SP2) Nếu xét nghiệm SP2 âm tính, thực hiện bước 1.3 Nếu xét nghiệm SP2 dương tính, thực hiện bước 1.4 |
| 1.3 | Xét nghiệm lại với sinh phẩm 1 (SP1) và sinh phẩm 2 (SP2) Nếu cả 2 xét nghiệm âm tính, thực hiện bước 2.1 Nếu cả 2 xét nghiệm dương tính, thực hiện bước 1.4 Nếu xét nghiệm SP1 dương tính, SP2 âm tính thực hiện bước 1.4 |
| 1.4 | Xét nghiệm sử dụng sinh phẩm thứ 3 có độ đặc hiệu cao (XN SP3) Nếu xét nghiệm SP3 âm tính, SP1 và SP2 dương tính thực hiện bước 2.2 Nếu xét nghiệm SP3 âm tính, SP1 dương tính và SP2 âm tính tính thực hiện bước 2.2 Nếu xét nghiệm SP3 dương tính, SP1 dương tính và SP2 âm tính tính thực hiện bước 2.2 Nếu cả 3 xét nghiệm SP1, SP2 v à SP3 dương tính thực hiện bước 2.3 |
| 2. | Biện luận trả kết quả |
| 2.1. | Trả kết quả: âm tính |
| 2.2. | Trả kết quả: không xác định và hẹn xét nghiệm lại sau 2 tuần. |
| 2.3. | Trả kết quả: dương tính. |
IV. NHẬN ĐỊNH KẾT QUẢ
1. Đánh giá theo tiêu chuẩn nhà sản xuất
2. Giá trị chứng đạt được phải nằm trong khoảng giới hạn xác định.
2. Đánh giá theo tiêu chuẩn phòng xét nghiệm
Chứng nội kiểm, ngoại kiểm (nếu có).
3. Kết quả và báo cáo
- Âm tính: Không có kháng thể kháng HIV trong mẫu xét nghiệm.
- Dương tính: Khẳng định tình trạng nhiễm HIV.
- Không xác định: Trường hợp nghi ngờ không kết luận âm tính hoặc dương tính. Cần xét nghiệm lại sau 2 tuần. Sau 2 tuần nếu :
+ Kết quả âm tính kết luận là âm tính.
+ Kết quả dương tính theo chiến lược 3, kết luận là dương tính.
+ Kết quả lần 2 không có sự thay đổi về mức độ phản ứng giữa hai lần xét nghiệm, người bệnh không thuộc đối tượng có hành vi nguy cơ cao thì kết luận là âm tính.
+ Kết quả lần 2 có sự thay đổi hoặc nghi ngờ chuyển đổi huyết thanh, xét nghiệm lại lần 3 sau 2 tuần. Nếu kết quả lần 3 vẫn không xác định thì kết luận là âm tính.
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
Thực hiện đúng theo Hướng dẫn Quốc gia về xét nghiệm huyết thanh học HIV (Ban hành kèm theo Quyết định số 1098/QĐ-BYT ngày 04 tháng 4 năm 2013).
123. HIV đo tải lượng Real-time PCR
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Xác định số lượng HIV trong một đơn vị thể tích (1ml) huyết tương.
2. Nguyên lý
Dựa trên nguyên lý của kỹ thuật Real-time RT-PCR
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện: Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: Cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Tủ an toàn sinh học cấp 2.
- Máy Real-time PCR và hệ thống máy tính.
- Máy ly tâm 25000 x g
- Máy ly tâm dùng cho tube 0,2 ml
- Máy ủ nhiệt
- Máy vortex
- Tủ lạnh 2 oC - 8 oC
- Tủ âm sâu (-20 oC hoặc -70 oC)
- Micropipette
- Bộ lưu điện
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
Thực hiện xét nghiệm 02 mẫu/lần.
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Bông | kg | 0,001 |
| 2 | Cồn | ml | 1,000 |
| 3 | Bơm kim tiêm | Cái | 1,000 |
| 4 | Panh | Cái | 0,0001 |
| 5 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 6 | Hộp vận chuyển bệnh phẩm | Test | 0,001 |
| 7 | Tube đựng bệnh phẩm | Cái | 2,000 |
| 8 | Găng không có bột | Cái | 0,500 |
| 9 | Sinh phẩm chẩn đoán | Test | 1,000 |
| 10 | Khấu hao sinh phẩm cho chứng và QC kiểm tra chất lượng, standard các loại | Test | 1,350 |
| 11 | Ngoại kiểm (nếu có)* |
| 0,02 |
| 12 | Kit tách chiết RNA từ virus | Test | 2,350 |
| 13 | Primer 1 | ml | 0,0001 |
| 14 | Primer 2 | ml | 0,0001 |
| 15 | Probe | ml | 0,0001 |
| 16 | Ống Eppendorf 1,5 ml | Tube | 3,000 |
| 17 | Ống Eppendorf 0,2 ml | Tube | 1,000 |
| 18 | Đầu côn 10 µl có lọc | Cái | 1,000 |
| 19 | Đầu côn 30 µl | Cái | 1,200 |
| 20 | Đầu côn 200 µl có lọc | Cái | 2,200 |
| 21 | Đầu côn 1 ml có lọc | Cái | 3,200 |
| 22 | Ethanol BDH | ml | 0,500 |
| 23 | Water-DEPC Treated | ml | 2,000 |
| 24 | Giấy thấm | Cuộn | 0,100 |
| 25 | Giấy xét nghiệm | Tờ | 2,000 |
| 26 | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 27 | Bút viết kính | Cái | 0,020 |
| 28 | Bút bi | Cái | 0,010 |
| 29 | Mũ | Cái | 0,020 |
| 30 | Khẩu trang | Cái | 0,020 |
| 31 | Găng tay | Đôi | 0,100 |
| 32 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 33 | Quần áo bảo hộ | Bộ | 0,005 |
| 34 | Dung dịch nước rửa tay | ml | 8,000 |
| 35 | Cồn sát trùng tay nhanh | ml | 1,000 |
| 36 | Dung dịch khử trùng | ml | 10,000 |
| 37 | Khăn lau tay | cái | 0,010 |
* Ghi chú: Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/50 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 2 lần/1 năm).
3. Bệnh phẩm
Huyết tương, huyết thanh
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu phiếu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
- Theo đúng quy định của chuyên ngành Vi sinh: xem chi tiết phụ lục 3
- Từ chối những bệnh phẩm không đạt yêu cầu: xem chi tiết phụ lục 6.
2. Tiến hành kỹ thuật
2.1. Tách chiết RNA tổng số
2.2. Thực hiện Real-time RT-PCR
2.3. Phân tích và đánh giá kết quả
2.4. In và trả kết quả
IV. NHẬN ĐỊNH KẾT QUẢ
Chứng dương phải xuất hiện đồ thị huỳnh quang trên đường giới hạn cơ bản, chứng âm không có bất kỳ đường đồ thị huỳnh quang nào xuất hiện dưới đường cơ bản. Các mẫu chứng dương chuẩn phải có đường đồ thị huỳnh quang xuất hiện tương ứng với nồng độ biết trước. Tải lượng virus (copies/ml) sẽ được tính toán dựa trên đường đồ thị của các mẫu chuẩn.
- Dương tính: kết quả trả số copies/ml
- Dưới ngưỡng phát hiện
- Ngưỡng phát hiện theo hướng dẫn của bộ sinh phẩm
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
- Trong trường hợp chứng Dương và chứng Âm xuất hiện không đúng với diễn giải ở phần IV thì phải kiểm tra lại Master mix và chứng Dương và quá trình tách RNA tổng số và làm lại xét nghiệm.
- Nếu đường đồ thị huỳnh quang của mẫu xuất hiện ở ngoài chu kỳ thứ 40 thì phải cẩn thận kiểm tra và đánh giá lại mẫu
124. HIV đo tải lượng hệ thống tự động
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Đếm số lượng HIV trong một đơn vị thể tích (ml) huyết tương.
2. Nguyên lý
Đếm số lượng HIV trong một đơn vị thể tích (ml) huyết tương dựa trên nguyên lý của kỹ thuật Real-time RT-PCR.
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện: Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: Cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Hệ thống máy tách chiết tự động (RNA, DNA) và định lượng COBAS®AmpliPrep/COBAS® TaqMan 48 Analyzer (Roche) (VD)
- Bộ lưu điện.
- Tủ an toàn sinh học cấp 2
- Máy ly tâm thường.
- Máy vortex
- Tủ lạnh 2 oC - 8 oC
- Tủ âm sâu (-20 oC hoặc -70 oC)
- Micropipette 1000 µl
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
Thực hiện xét nghiệm 10 mẫu/lần.
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Bông | Kg | 0,001 |
| 2 | Dây garô | Cái | 0,001 |
| 3 | Cồn | ml | 1,000 |
| 4 | Bơm kim tiêm | Cái | 1,000 |
| 5 | Panh | Cái | 0,0001 |
| 6 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 7 | Hộp vận chuyển bệnh phẩm | Cái | 0,001 |
| 8 | Tube đựng bệnh phẩm | Cái | 3,000 |
| 9 | Sinh phẩm chẩn đoán | Test | 1,000 |
| 10 | Khấu hao sinh phẩm cho chạy chứng, kiểm tra chất lượng | Test | 0,300 |
| 11 | SPU | Cái | 1,300 |
| 12 | Tube-S | Cái | 1,300 |
| 13 | Tube-K | Cái | 1,300 |
| 14 | Tip-K | Cái | 1,300 |
| 15 | Kit CAP-G/CTM Wash Reagent 5.1 L | test | 1,300 |
| 16 | Ngoại kiểm (nếu có)* |
| 0,02 |
| 17 | Đầu côn 1000 µl | Cái | 1,000 |
| 18 | Đầu côn có lọc 1000 µl (DNAase- RNAase free) | Cái | 1,300 |
| 19 | Giấy thấm | Cuộn | 0,100 |
| 20 | Giấy xét nghiệm | Tờ | 3,000 |
| 21 | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 22 | Bút viết kính | Cái | 0,020 |
| 23 | Bút bi | Cái | 0,010 |
| 24 | Mũ | Cái | 0,020 |
| 25 | Khẩu trang | Cái | 0,020 |
| 26 | Găng không có bột tal (DNAase/RNAase free) | Đôi | 0,100 |
| 27 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 28 | Quần áo bảo hộ | Bộ | 0,005 |
| 29 | Dung dịch nước rửa tay | ml | 8,000 |
| 30 | Cồn sát trùng tay nhanh | ml | 1,000 |
| 31 | Dung dịch khử trùng | ml | 10,000 |
| 32 | Khăn lau tay | Cái | 0,010 |
* Ghi chú: Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/50 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 3 lần/1 năm).
3. Bệnh phẩm
Huyết tương từ máu có chất chống đông EDTA.
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu phiếu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
- Theo đúng quy định của chuyên ngành Vi sinh: xem chi tiết phụ lục 3.
- Từ chối những bệnh phẩm không đạt yêu cầu: xem chi tiết phụ lục 6.
2. Tiến hành kỹ thuật
Bộ sinh phẩm COBAS®Ampliprep/COBAS®TaqMan HIV Test (Roche Diagnostics GmbH) (VD)
2.1. Tách chiết RNA vận hành máy COBAS AmpliPrep
2.2. Phiên mã ngược RNA thành cDNA, khuyếch đại cDNA, đọc kết kết trên máy COBAS TaqMan 48
IV. NHẬN ĐỊNH KẾT QUẢ
1. Kiểm tra chất lượng
Giá trị định lượng chấp nhận được nếu:
- Chứng âm là không phát hiện.
- Chứng nội cho giá trị Ct mong đợi.
Không nhận các kết quả của chứng không có giá trị khi xuất hiện thông báo lỗi:
- Chứng âm: Invalid
- Chứng dương thấp: Invalid, <4.00E+01 cp/ml, >1.00E+07 cp/ml, không phát hiện (Target Not Detected)
- Chứng dương cao: Invalid, <4.00E+01 cp/ml, >1.00E+07 cp/ml, không phát hiện (Target Not Detected)
2. Kết quả và báo cáo
Kết quả định lượng HIV RNA của máy COBAS TaqMan 48 được tính trực tiếp ra số copies/ml quy đổi tương ứng theo đơn vị quốc tế IU/ml là 0.6 cp/IU (1.7 IU/cp) cho HIV-1 RNA theo hệ thống quy chuẩn của WHO (tổ chức y tế thế giới).
Giá trị tham số Ct (được định nghĩa là số chu kỳ ngưỡng tại đó tín hiệu huỳnh quang vượt ngưỡng cố định, để so sánh với chu kỳ ngưỡng của mẫu chứng chuẩn từ đó suy ra số lượng RNA mẫu đưa vào phản ứng) cho HIV-1 RNA và HIV-1QS RNA.
Các giá trị chứng của HIV-1 có nồng độ trong giới hạn được thực hiện đồng thời với mẫu bệnh phẩm để thiết lập đường chuẩn, cho thấy mối tương quan giữa giá trị Ct và số log cp/ml.
| Giá trị trên máy | Trả lời kết quả |
| Target Not Detected | Không phát hiện thấy HIV RNA |
| <4.00E+01 cp/ml | < 40 cp/ml |
| > 4.00E+01cp/ml đến < 1.00E+07cp/ml | nhận những kết quả trong giới hạn này > 40 cp/ml đến < 1.00 x 107cp/ml |
| >1.00E+07cp/ml | > 1.00 x 107cp/ml |
| Invalid | Không giá trị, chạy lại mẫu bệnh phẩm |
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
- Việc lấy mẫu máu, vận chuyển và bảo quản không đúng tiêu chuẩn có thể dẫn đến kết quả sai, cho dù phản ứng được thực hiện đúng.
- Quy trình này chỉ áp dụng cho phát hiện và định lượng HIV-RNA 1 nhóm M, O, N, không áp dụng cho HIV 2.
- Tham khảo thêm hướng dẫn của nhà sản xuất.
125. HIV genotype giải trình tự gene
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Xác định genotype của virus gây suy giảm miễn dịch ở người (Human Immmunodeficiency Virus - HIV).
2. Nguyên lý
Xác định genotype của HIV bằng kỹ thuật giải trình tự nucleotide trên gen đặc trưng.
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện: Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: Cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Tủ an toàn sinh học cấp 2
- Máy PCR
- Máy điện di
- Máy đọc điện di
- Máy giải trình tự gen
- Máy ly tâm 25000 x g
- Máy ly tâm cho tube 0,2 ml
- Máy ủ nhiệt
- Máy vortex
- Bộ lưu điện
- Tủ lạnh 2 oC - 8 oC
- Tủ âm sâu (-20 oC hoặc -70 oC)
- Micropipette
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
Thực hiện xét nghiệm 02 mẫu/lần.
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Bông | kg | 0,001 |
| 2 | Cồn | ml | 1,000 |
| 3 | Bơm kim tiêm | Cái | 1,000 |
| 4 | Panh | Cái | 0,0001 |
| 5 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 6 | Hộp vận chuyển bệnh phẩm | Test | 0,001 |
| 7 | Tube đựng bệnh phẩm | Cái | 2,000 |
| 8 | Găng không có bột tal | Đôi | 0,500 |
| 9 | Sinh phẩm chẩn đoán | Test | 1,000 |
| 10 | Khấu hao sinh phẩm cho chạy chứng và kiểm tra chất lượng | Test | 1,350 |
| 11 | Kit tách chiết RNA từ virus | Test | 2,350 |
| 12 | Primer 1 (primer đặc hiệu) | ml | 0,0001 |
| 13 | Primer 2 (primer đặc hiệu) | ml | 0,0001 |
| 14 | Primer 3 (primer đặc hiệu) | ml | 0,0001 |
| 15 | Primer 4 (primer đặc hiệu) | ml | 0,0001 |
| 16 | Ống Eppendorf 1,5 ml | Tube | 3,000 |
| 17 | Ống Eppendorf 0,2 ml | Tube | 1,000 |
| 18 | Đầu côn 10 µl có lọc | Cái | 1,000 |
| 19 | Đầu côn 30 µl | Cái | 1,200 |
| 20 | Đầu côn 200 µl có lọc | Cái | 2,200 |
| 21 | Đầu côn 1 ml có lọc | Cái | 3,200 |
| 22 | Ethanol BDH | ml | 0,500 |
| 23 | Water-DEPC Treated | ml | 2,000 |
| 24 | Thạch | Gam | 0,075 |
| 25 | Ladder | ml | 0.0025 |
| 26 | Blue Juice Gel loading dye | ml | 0.003 |
| 27 | Ethidium Bromide | ml | 0.100 |
| 28 | TAE Buffer | ml | 0.100 |
| 29 | Giấy thấm | Cuộn | 0,100 |
| 30 | Giấy xét nghiệm | Tờ | 2,000 |
| 31 | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 32 | Bút viết kính | Cái | 0,020 |
| 33 | Bút bi | Cái | 0,010 |
| 34 | Mũ | Cái | 0,020 |
| 35 | Khẩu trang | Cái | 0,020 |
| 36 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 37 | Quần áo bảo hộ | Bộ | 0,005 |
| 38 | Dung dịch nước rửa tay | ml | 8,000 |
| 39 | Cồn sát trùng tay nhanh | ml | 1,000 |
| 40 | Dung dịch khử trùng | ml | 10,000 |
| 41 | Khăn lau tay | cái | 0,010 |
| 42 | Ngoại kiểm (nếu có)* |
| 0,020 |
* Ghi chú: Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/50 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 3 lần/1 năm).
3. Bệnh phẩm
Huyết thanh hoặc huyết tương.
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu phiếu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
- Theo đúng quy định của chuyên ngành Vi sinh: xem chi tiết phụ lục 3.
- Từ chối những bệnh phẩm không đạt yêu cầu: xem chi tiết phụ lục 6.
2. Tiến hành kỹ thuật
2.1. Tách chiết RNA tổng số
2.2. Thực hiện phản ứng RT-PCR
2.3. Điện di kiểm tra sản phẩm
2.4. Giải trình tự gen
2.5. Kiểm tra và so sánh trình tự gen của HIV trên ngân hàng dữ liệu gen quốc tế
IV. NHẬN ĐỊNH KẾT QUẢ
Sản phẩm PCR phải có một băng đặc hiệu duy nhất, rõ nét và không bị đứt gẫy. Trình tự DNA của gen đích không bị nhiễu và phải có độ tương đồng ≥ 90 % mới có thể kết luận được genotype của HIV
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
- Trong trường hợp không có sản phẩm PCR, cần phải kiểm tra lại quá trình tách chiết RNA tổng số, chất lượng primers và master mix, và thực hiện lại xét nghiệm.
- Nếu trình tự DNA bị nhiễu cần phải kiểm tra lại độ đặc hiệu của sản phẩm PCR hoặc quá trình chạy PCR sequencing bị nhiễm chéo.
126. HIV kháng thuốc giải trình tự gene
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Phát hiện sự thay đổi trình tự nucleotide liên quan đến kháng thuốc của virus gây suy giảm miễn dịch ở người (Human Immmunodeficiency Virus - HIV) trong huyết thanh hoặc huyết tương.
2. Nguyên lý
Xác định sự thay đổi trình tự nucleotide liên quan đến kháng thuốc của HIV bằng kỹ thuật giải trình tự gen.
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện: Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: Cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Tủ an toàn sinh học cấp 2.
- Máy PCR
- Máy điện di
- Máy đọc điện di
- Máy giải trình tự gen
- Máy ly tâm 25000 x g
- Máy ly tâm cho tube 0,2 ml
- Máy ủ nhiệt
- Máy vortex
- Bộ lưu điện
- Tủ lạnh 2 oC - 8 oC
- Tủ âm sâu (-20 oC hoặc -70 oC)
- Micropipette
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
Thực hiện xét nghiệm 02 mẫu/lần.
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Bông | kg | 0,001 |
| 2 | Cồn | ml | 1,000 |
| 3 | Bơm kim tiêm | Cái | 1,000 |
| 4 | Panh | Cái | 0,0001 |
| 5 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 6 | Hộp vận chuyển bệnh phẩm | Test | 0,001 |
| 7 | Tube đựng bệnh phẩm | Cái | 2,000 |
| 8 | Găng không có bột | Cái | 0,500 |
| 9 | Sinh phẩm chẩn đoán | Test | 1,000 |
| 10 | Khấu hao sinh phẩm cho chạy chứng và kiểm tra chất lượng | Test | 1,350 |
| 11 | Kit tách chiết RNA từ virus | Test | 2,350 |
| 12 | Primer 1 (primer đặc hiệu) | ml | 0,0001 |
| 13 | Primer 2 (primer đặc hiệu) | ml | 0,0001 |
| 14 | Primer 3 (primer đặc hiệu) | ml | 0,0001 |
| 15 | Primer 4 (primer đặc hiệu) | ml | 0,0001 |
| 16 | Ống Eppendorf 1,5 ml | Tube | 3,000 |
| 17 | Ống Eppendorf 0,2 ml | Tube | 1,000 |
| 18 | Đầu côn 10 µl có lọc | Cái | 1,000 |
| 19 | Đầu côn 30 µl | Cái | 1,200 |
| 20 | Đầu côn 200 µl có lọc | Cái | 2,200 |
| 21 | Đầu côn 1 ml có lọc | Cái | 3,200 |
| 22 | Ethanol BDH | ml | 0,500 |
| 23 | Water-DEPC Treated | ml | 2,000 |
| 24 | Thạch | Gam | 0,075 |
| 25 | Ladder | ml | 0.0025 |
| 26 | Blue Juice Gel loading dye | ml | 0.003 |
| 27 | Ethidium Bromide | ml | 0.100 |
| 28 | TAE Buffer | ml | 0.100 |
| 29 | Giấy thấm | Cuộn | 0,100 |
| 30 | Giấy xét nghiệm | Tờ | 2,000 |
| 31 | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 32 | Bút viết kính | Cái | 0,020 |
| 33 | Bút bi | Cái | 0,010 |
| 34 | Mũ | Cái | 0,020 |
| 35 | Khẩu trang | Cái | 0,020 |
| 36 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 37 | Quần áo bảo hộ | Bộ | 0,005 |
| 38 | Dung dịch nước rửa tay | ml | 8,000 |
| 39 | Cồn sát trùng tay nhanh | ml | 1,000 |
| 40 | Dung dịch khử trùng | ml | 10,000 |
| 41 | Khăn lau tay | cái | 0,010 |
| 42 | Ngoại kiểm (nếu có)* |
| 0,020 |
* Ghi chú: Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/50 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 3 lần/1 năm).
3. Bệnh phẩm
Huyết thanh, huyết tương
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu phiếu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
- Theo đúng quy định của chuyên ngành Vi sinh: xem chi tiết phụ lục 3.
- Từ chối những bệnh phẩm không đạt yêu cầu: xem chi tiết phụ lục 6.
2. Tiến hành kỹ thuật
2.1. Tách chiết RNA tổng số
2.2. Thực hiện RT-PCR
2.3. Điện di kiểm tra sản phẩm
2.4. Giải trình tự gen
2.5. Kiểm tra và phân tích trình tự gen kháng thuốc của HIV trên ngân hàng dữ liệu gen quốc tế
IV. NHẬN ĐỊNH KẾT QUẢ
Sản phẩm PCR phải có một băng đặc hiệu duy nhất, rõ nét và không bị đứt gẫy. Trình tự DNA của gen đích không bị nhiễu và phải cho thấy có sự thay đổi một số vị trí nucleotide trên gen tương ứng với các loại thuốc điều trị HIV
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
- Trong trường hợp không có sản phẩm PCR, cần phải kiểm tra lại quá trình tách chiết RNA tổng số, chất lượng primers và master mix, và thực hiện lại xét nghiệm.
- Nếu trình tự DNA bị nhiễu cần phải kiểm tra lại độ đặc hiệu của sản phẩm PCR hoặc quá trình chạy PCR sequencing bị nhiễm chéo.
127. Dengue virus NS1Ag test nhanh
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Phát hiện kháng nguyên NS1 của virus dengue trong huyết thanh hoặc huyết tương.
2. Nguyên lý
Phát hiện kháng nguyên NS1 của virus dengue dựa trên nguyên lý của kỹ thuật sắc ký miễn dịch.
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: Cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Máy ly tâm thường
- Pipet vi lượng 5 µl đến 100 µl.
- Đồng hồ bấm giây.
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
Thực hiện xét nghiệm 01 mẫu/lần.
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Bông | Kg | 0,001 |
| 2 | Dây garô | Cái | 0,001 |
| 3 | Cồn | ml | 1,000 |
| 4 | Bơm kim tiêm | Cái | 1,000 |
| 5 | Panh | Cái | 0,0001 |
| 6 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 7 | Hộp vận chuyển bệnh phẩm | Test | 0,001 |
| 8 | Tube đựng bệnh phẩm | Cái | 1,000 |
| 9 | Sinh phẩm chẩn đoán | Test | 1,000 |
| 10 | Khấu hao sinh phẩm cho kiểm tra chất lượng | Test | 0,200 |
| 11 | Đầu côn 200 µl | Cái | 2,000 |
| 12 | Giấy thấm | Cuộn | 0,100 |
| 13 | Giấy xét nghiệm | Tờ | 2,000 |
| 14 | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 15 | Bút viết kính | Cái | 0,020 |
| 16 | Bút bi | Cái | 0,010 |
| 17 | Mũ | Cái | 0,020 |
| 18 | Khẩu trang | Cái | 0,020 |
| 19 | Găng tay | Đôi | 0,100 |
| 20 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 21 | Quần áo bảo hộ | Bộ | 0,005 |
| 22 | Dung dịch nước rửa tay | ml | 8,000 |
| 23 | Cồn sát trùng tay nhanh | ml | 1,000 |
| 24 | Dung dịch khử trùng | ml | 10,000 |
| 25 | Khăn lau tay | Cái | 0,010 |
3. Bệnh phẩm
Huyết thanh hoặc huyết tương
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
- Theo đúng quy định của chuyên ngành Vi sinh: xem chi tiết phụ lục 2.
- Từ chối những bệnh phẩm không đạt yêu cầu: xem chi tiết phụ lục 6.
2.Tiến hành kỹ thuật
Bộ sinh phẩm Dengue NS1Ag Strip - BioRad (VD)
| Các bước | Xét nghiệm định tính Dengue NS1 Ag |
| 2.1 | Để Số lượng sinh phẩm cần dùng ở nhiệt độ phòng 30 phút trước khi làm xét nghiệm |
| 2.2 | Sử dụng ống nghiệm bằng nhựa hoặc thủy tinh có chiều cao > 45 mm và đường kính nhỏ hơn 15 mm. Ghi số bệnh phẩm lên ống nghiệm. |
| 2.3 | Hút huyết thanh/huyết tương vào trong ống nghiệm. |
| 2.4 | Nhỏ thêm 1 giọt dung dịch di chuyển (migration buffer) vào ống nghiệm. Lắc nhẹ nhàng để trộn đều. |
| 2.5 | Đặt thanh thử theo phương thẳng đứng vào trong ống nghiệm, hướng chiều mũi tên xuống dưới. Kiểm tra để đảm bảo thanh thử đã được nhúng vào dung dịch bệnh phẩm đã pha loãng. |
| 2.6 | Đọc kết quả sau 15 phút |
IV. NHẬN ĐỊNH KẾT QUẢ
- Âm tính: Chỉ 1 một đường màu xuất hiện ở vùng chứng.
- Dương tính: 2 đường màu xuất hiện ở vùng chứng và vùng thử nghiệm
- Không có giá trị: Không thấy xuất hiện đường màu nào. Phải tiến hành làm lại xét nghiệm với một thanh thử khác.
Lưu ý: Đối với những mẫu huyết thanh/huyết tương kép và những mẫu âm tính thì để nguyên thanh thử trong ống nghiệm và đọc lại kết quả sau 15 phút nữa.
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
Không thấy sự di chuyển của bệnh phẩm trên màng sắc ký Kiểm tra để đảm bảo thanh thử đã được nhúng vào dung dịch bệnh phẩm đã pha loãng.
128. Dengue virus NS1Ag/IgM/IgG test nhanh
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Phát hiện kháng nguyên NS1 và kháng thể IgM/IgG kháng virus dengue trong huyết thanh, huyết tương hoặc máu toàn phần..
2. Nguyên lý
Phát hiện kháng nguyên NS1 của virus dengue và kháng thể IgM/IgG kháng virus dengue dựa trên nguyên lý của kỹ thuật sắc ký miễn dịch.
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện: Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: Cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Máy ly tâm thường
- Micropipette 5 µl đến 100 µl.
- Đồng hồ bấm giây
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
Thực hiện xét nghiệm 01 mẫu/lần.
| TT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Bông | Kg | 0,001 |
| 2 | Dây garô | Cái | 0,001 |
| 3 | Cồn | ml | 1,000 |
| 4 | Bơm kim tiêm | Cái | 1,000 |
| 5 | Panh | Cái | 0,0001 |
| 6 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 7 | Hộp vận chuyển bệnh phẩm | Test | 0,001 |
| 8 | Tube đựng bệnh phẩm | Cái | 1,000 |
| 9 | Sinh phẩm chẩn đoán | Test | 1,000 |
| 10 | Khấu hao sinh phẩm cho kiểm tra chất lượng | Test | 0,300 |
| 11 | Đầu côn 200 µl | Cái | 2,000 |
| 12 | Giấy thấm | Cuộn | 0,100 |
| 13 | Giấy xét nghiệm | Tờ | 2,000 |
| 14 | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 15 | Bút viết kính | Cái | 0,020 |
| 16 | Bút bi | Cái | 0,010 |
| 17 | Mũ | Cái | 0,020 |
| 18 | Khẩu trang | Cái | 0,020 |
| 19 | Găng tay | Đôi | 0,100 |
| 20 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 21 | Quần áo bảo hộ | Bộ | 0,005 |
| 22 | Dung dịch nước rửa tay | ml | 8,000 |
| 23 | Cồn sát trùng tay nhanh | ml | 1,000 |
| 24 | Dung dịch khử trùng | ml | 10,000 |
| 25 | Khăn lau tay | Cái | 0,010 |
3. Bệnh phẩm
Huyết thanh, huyết tương hoặc máu toàn phần
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
- Theo đúng quy định của chuyên ngành Vi sinh: xem chi tiết phụ lục 2.
- Từ chối những bệnh phẩm không đạt yêu cầu: xem chi tiết phụ lục 6.
2. Tiến hành kỹ thuật: Bộ sinh phẩm SD Bioline Dengue Duo - SD (VD)
| Các bước | Xét nghiệm định tính Dengue NS1 Ag & Dengue IgM/IgG |
| 2.1 | Để Số lượng sinh phẩm cần dùng ở nhiệt độ phòng 30 phút trước khi làm xét nghiệm |
| 2.2 | Bóc vỏ nhôm lấy thanh thử đặt lên bề mặt phẳng |
|
| Dengue NS1 Ag |
| 2.3 | Dùng pipet nhựa to có sẵn trong hộp nhỏ 3 giọt (tương đương 100 ml) bệnh phẩm vào giếng nhỏ bệnh phẩm (S) |
| 2.4 | Đọc kết quả sau 15 phút - 20 phút |
|
| Dengue IgM/IgG |
| 2.5 | Dùng pipet nhựa nhỏ có sẵn trong hộp hút huyết thanh/huyết tương đến vạch màu xanh (tương đương 10 ml), nhỏ bệnh phẩm vào giếng nhỏ bệnh phẩm (S) |
| 2.6 | Nhỏ 4 giọt dung dịch pha loãng vào giếng hình tròn ở phần đầu của thanh thử |
| 2.7 | Đọc kết quả sau 15 phút - 20 phút |
IV. NHẬN ĐỊNH KẾT QUẢ
1. Dengue NS1 Ag
- Âm tính: Chỉ 1 một đường màu xuất hiện ở vùng chứng.
- Dương tính: 2 đường màu xuất hiện ở vùng chứng và vùng thử nghiệm.
- Không có giá trị: Không thấy xuất hiện đường màu nào. Phải tiến hành làm lại xét nghiệm với một thanh thử khác.
2. Dengue IgM/IgG
Việc đánh giá kết quả cần dựa vào kết quả phối hợp của vạch thử nghiệm IgM, IgG và vạch chứng.
* Nhiễm trùng tiên phát
Vạch màu hồng xuất hiện ở vùng IgM và vùng chứng → Thử nghiệm dương tính với kháng thể IgM và gợi ý tới một nhiễm trùng dengue tiên phát.
* Nhiễm trùng thứ phát
- Vạch mầu hồng xuất hiện ở vùng IgM, IgG và vùng chứng → Kháng thể IgM và IgG dương tính và gợi ý tới một nhiễm trùng dengue thứ phát.
- Vạch mầu hồng xuất hiện ở vùng IgG và vùng chứng → Kháng thể IgG dương tính và gợi ý tới một nhiễm trùng dengue thứ phát.
* Âm tính
Vạch mầu hồng chỉ xuất hiện ở vùng chứng → Không phát hiện được kháng thể IgM và IgG kháng dengue. Kiểm tra lại sau 3 - 4 ngày nếu nghi ngờ có nhiễm virus dengue.
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
Đọc kết quả sau quá 20 phút dễ gây phản ứng dương tính giả → Nên có đồng hồ đặt giờ để đọc kết quả đúng giờ qui định.
129. Dengue virus IgM/IgG test nhanh
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Phát hiện kháng thể IgM/IgG kháng virus dengue trong huyết thanh, huyết tương hoặc máu toàn phần.
2. Nguyên lý
Phát hiện kháng thể IgM/IgG kháng virus dengue dựa trên nguyên lý của kỹ thuật sắc ký miễn dịch.
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện: Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: Cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Máy ly tâm thường
- Micropipette 5 µl đến 100 µl.
- Đồng hồ bấm giây
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
Thực hiện xét nghiệm 01 mẫu/lần.
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Bông | Kg | 0,001 |
| 2 | Dây garô | Cái | 0,001 |
| 3 | Cồn | ml | 1,000 |
| 4 | Bơm kim tiêm | Cái | 1,000 |
| 5 | Panh | Cái | 0,0001 |
| 6 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 7 | Hộp vận chuyển bệnh phẩm | Test | 0,001 |
| 8 | Tube đựng bệnh phẩm | Cái | 1,000 |
| 9 | Sinh phẩm chẩn đoán | Test | 1,000 |
| 10 | Khấu hao sinh phẩm cho kiểm tra chất lượng | Test | 0,300 |
| 11 | Đầu côn 200 µl | Cái | 2,000 |
| 12 | Giấy thấm | Cuộn | 0,100 |
| 13 | Giấy xét nghiệm | Tờ | 2,000 |
| 14 | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 15 | Bút viết kính | Cái | 0,020 |
| 16 | Bút bi | Cái | 0,010 |
| 17 | Mũ | Cái | 0,020 |
| 18 | Khẩu trang | Cái | 0,020 |
| 19 | Găng tay | Đôi | 0,100 |
| 20 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 21 | Quần áo bảo hộ | Bộ | 0,005 |
| 22 | Dung dịch nước rửa tay | ml | 8,000 |
| 23 | Cồn sát trùng tay nhanh | ml | 1,000 |
| 24 | Dung dịch khử trùng | ml | 10,000 |
| 25 | Khăn lau tay | Cái | 0,010 |
3. Bệnh phẩm
Huyết thanh, huyết tương hoặc máu toàn phần
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
- Theo đúng quy định của chuyên ngành Vi sinh: xem chi tiết phụ lục 2.
- Từ chối những bệnh phẩm không đạt yêu cầu: xem chi tiết phụ lục 6.
2. Tiến hành kỹ thuật
Bộ sinh phẩm SD Bioline Dengue Rapid Test - SD (VD)
| Các bước | Xét nghiệm định tính Dengue IgM/IgG |
| 2.1 | Để Số lượng sinh phẩm cần dùng ở nhiệt độ phòng 30 phút trước khi làm xét nghiệm |
| 2.2 | Bóc vỏ nhôm lấy thanh thử đặt lên bề mặt phẳng |
| 2.3 | Nhỏ bệnh phẩm vào giếng nhỏ bệnh phẩm hình tròn (S). Chờ cho huyết thanh thấm hút hết vào phần thấm bệnh phẩm ở giếng tròn. |
| 2.4 | Giữ cho lọ buffer thẳng đứng và cao hơn giếng hình chữ nhật khoảng 1 cm, nhỏ 2 giọt buffer vào giếng hình chữ nhật ở phần đầu của thanh thử. |
| 2.5 | Đọc kết quả sau 15 phút - 20 phút Lưu ý: Mọi kết quả đọc sau quá 20 phút đều không có giá trị và phải thử nghiệm lại. |
IV. NHẬN ĐỊNH KẾT QUẢ
Việc đánh giá kết quả cần dựa vào kết quả phối hợp của vạch thử nghiệm IgM, IgG và vạch chứng.
* Nhiễm trùng tiên phát
Vạch màu hồng xuất hiện ở vùng IgM và vùng chứng → Thử nghiệm dương tính với kháng thể IgM và gợi ý tới một nhiễm trùng dengue tiên phát.
* Nhiễm trùng thứ phát
- Vạch mầu hồng xuất hiện ở vùng IgM, IgG và vùng chứng → Kháng thể IgM và IgG dương tính và gợi ý tới một nhiễm trùng dengue thứ phát.
- Vạch mầu hồng xuất hiện ở vùng IgG và vùng chứng → Kháng thể IgG dương tính và gợi ý tới một nhiễm trùng dengue thứ phát.
* Âm tính
Vạch mầu hồng chỉ xuất hiện ở vùng chứng → Không phát hiện được kháng thể IgM và IgG kháng dengue. Kiểm tra lại sau 3 - 4 ngày nếu nghi ngờ có nhiễm virus dengue.
* Không có giá trị
Không thấy vạch mầu hồng xuất hiện ở vùng chứng → Thử nghiệm không có giá trị và cần phải làm lại.
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
Đọc kết quả sau quá 20 phút dễ gây phản ứng dương tính giả → Nên có đồng hồ đặt giờ để đọc kết quả đúng giờ qui định.
130. Dengue virus IgM miễn dịch bán tự động
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Phát hiện kháng thể IgM kháng virus dengue trong huyết thanh hoặc huyết tương.
2. Nguyên lý
Phát hiện kháng thể IgM đặc hiệu kháng virus dengue dựa trên nguyên lý của kỹ thuật ELISA (miễn dịch gắn enzyme) (VD).
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện: Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: Cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Dàn máy ELISA
- Máy ly tâm
- Tủ lạnh 2 oC - 8 oC
- Tủ âm sâu (- 20 oC hoặc - 70 oC) (nếu có)
- Micropipette đơn kênh thể tích từ 10 µl đến 1000 µl.
- Bộ pipetman 8 kênh (nếu có)
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
Thực hiện xét nghiệm 01 mẫu/lần.
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Bông | Kg | 0,001 |
| 2 | Dây garô | Cái | 0,001 |
| 3 | Tube đựng bệnh phẩm | Cái | 1,000 |
| 4 | Sinh phẩm chẩn đoán** | Test | 16,000 |
| 5 | Chứng ngoại kiểm âm (nếu có) | ml | 0,100 |
| 6 | Chứng ngoại kiểm dương (nếu có) | ml | 0,100 |
| 7 | Ngoại kiểm (nếu có)* |
| 0.020 |
| 8 | Đầu côn 1000 µl | Cái | 3,000 |
| 9 | Đầu côn 200 µl | Cái | 5,000 |
| 10 | Giấy thấm | Cuộn | 0,100 |
| 11 | Giấy xét nghiệm | Tờ | 2,000 |
| 12 | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 13 | Bút viết kính | Cái | 0,020 |
| 14 | Bút bi | Cái | 0,010 |
| 15 | Mũ | Cái | 0,020 |
| 16 | Khẩu trang | Cái | 0,020 |
| 17 | Găng tay | Đôi | 0,100 |
| 18 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 19 | Quần áo bảo hộ | Bộ | 0,005 |
| 20 | Dung dịch nước rửa tay | ml | 8,000 |
| 21 | Dung dịch nước rửa tay | ml | 1,000 |
| 22 | Dung dịch khử trùng | ml | 10,000 |
| 23 | Khăn lau tay | Cái | 0,010 |
Ghi chú:
* Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/50 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 3 lần/1 năm).
** Nếu chỉ làm 01 mẫu vẫn phải mở 01 lọ kháng nguyên đủ cho 16 giếng bao gồm 11 mẫu bệnh phẩm + 5 mẫu chứng. Vì vậy nếu làm đơn lẻ 01 mẫu thì 01 bệnh phẩm phải chịu chi phí cho 15 giếng còn lại
3. Bệnh phẩm
Huyết thanh hoặc huyết tương.
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên
1. Lấy bệnh phẩm
- Theo đúng quy định của chuyên ngành Vi sinh: xem chi tiết phụ lục 2.
- Từ chối những bệnh phẩm không đạt yêu cầu: xem chi tiết phụ lục 6.
2. Tiến hành kỹ thuật
Bộ sinh phẩm Dengue Duo IgM capture ELISA - Pan Bio (VD)
| Các bước | Xét nghiệm định tính dengue IgM |
| 2.1 | Để Số lượng sinh phẩm cần dùng ở nhiệt độ phòng 30 phút trước khi làm xét nghiệm |
| 2.2 | Đánh số, sắp xếp bệnh phẩm và viết sơ đồ theo thứ tự. |
| 2.3 | Chuẩn bị dung dịch rửa |
| 2.4 | Pha loãng kháng nguyên |
| 2.5 | Pha loãng huyết thanh người bệnh, chứng âm, chứng dương và chứng cut-off |
| 2.6 | Trộn đều lượng kháng nguyên đã được pha loãng với một lượng tương đương Mab Tracer. Phức hợp Antigen - Mab Tracer để ở nhiệt độ phòng trong 1 giờ |
| 2.7 | Cho chứng âm, chứng dương, chứng cut-off và bệnh phẩm đã pha loãng vào các giếng của phiến nhựa theo thứ tự hướng dẫn của quy trình |
| 2.8 | Đậy phiến nhựa và ủ |
| 2.9 | Rửa phiến nhựa |
| 2.10 | Lắc nhẹ phức hợp Antigen - Mab Tracer. Nhỏ phức hợp này vào mỗi giếng |
| 2.11 | Đậy phiến nhựa và ủ |
| 2.12 | Rửa phiến nhựa |
| 2.13 | Nhỏ dung dịch hiện màu vào mỗi giếng |
| 2.14 | Ủphiến nhựa, không đậy và tránh ánh sáng |
| 2.15 | Nhỏ dung dịch dừng phản ứng. |
| 2.16 | Đọc độ kết quả ở bước sóng 450 và 620nm trong vòng 30 phút sau khi dừng phản ứng. |
IV. NHẬN ĐỊNH KẾT QUẢ
Kết quả được tính theo Đơn vị PanBio như sau:
- Tính giá trị trung bình của ngưỡng (calibrator) rồi nhân với yếu tố ngưỡng (calibration factor = 0,62). Đây chính là giá trị ngưỡng:
![]()
| - Đơn vị Panbio = 10 x | OD bệnh phẩm |
| OD giá trị ngưỡng |
ﻣ Đơn vị PanBio < 9: mẫu thử âm tính, trong huyết thanh không có kháng thể IgM.
ﻣ Đơn vị PanBio = 9 - 11: mẫu thử phải xét nghiệm lại
ﻣ Đơn vị PanBio > 11: mẫu thử dương tính, trong huyết thanh người bệnh có kháng thể IgM.
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
1. Sai sót
Có thể xảy ra hiện tượng âm tính giả hoặc dương tính giả, thông thường do:
- Thực hiện sai các bước trong quy trình hướng dẫn.
- Chứng âm và những mẫu bệnh phẩm âm tính bị nhiễm chéo bởi huyết thanh/ huyết tương có nồng độ kháng thể cao.
- Dung dịch cơ chất bị nhiễm bởi các tác nhân oxid hoá (thuốc tẩy, ion kim loại v.v…)
- Dung dịch dừng phản ứng bị nhiễm bẩn.
2. Xử trí
- Tuân thủ đúng các bước quy trình hướng dẫn của nhà sản xuất và hướng dẫn về độ ổn định hóa chất xét nghiệm trong bộ sinh phẩm sử dụng.
- Kiểm tra và vệ sinh máy rửa thường xuyên trước và sau khi làm xét nghiệm
- Chia hóa chất (chất cộng hợp, dung dịch hiện màu và dừng phản ứng) vào ống nghiệm sạch trước mỗi lần nhỏ.
131. Dengue virus IgG miễn dịch bán tự động
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Phát hiện kháng thể IgG kháng virus dengue trong huyết thanh hoặc huyết tương.
2. Nguyên lý
Phát hiện kháng thể IgG kháng virus dengue dựa trên nguyên lý của kỹ thuật ELISA (miễn dịch gắn enzyme) (VD).
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: Cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Dàn máy ELISA
- Máy ly tâm thường.
- Tủ lạnh 2 oC - 8 oC
- Tủ âm sâu (- 20 oC hoặc - 70 oC) (nếu có)
- Micropipette đơn kênh thể tích từ 10 µl đến 1000 µl.
- Bộ pipetman 8 kênh (nếu có)
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
Thực hiện xét nghiệm 01 mẫu/lần.
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Bông | Kg | 0,001 |
| 2 | Dây garô | Cái | 0,001 |
| 3 | Tube đựng bệnh phẩm | Cái | 1,000 |
| 4 | Sinh phẩm chẩn đoán** | Test | 16,000 |
| 5 | Chứng ngoại kiểm âm | ml | 0,100 |
| 6 | Chứng ngoại kiểm dương | ml | 0,100 |
| 7 | Ngoại kiểm (nếu có)* |
| 0.020 |
| 8 | Đầu côn 1000 µl | Cái | 3,000 |
| 9 | Đầu côn 200 µl | Cái | 5,000 |
| 10 | Giấy thấm | Cuộn | 0,100 |
| 11 | Giấy xét nghiệm | Tờ | 2,000 |
| 12 | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 13 | Bút viết kính | Cái | 0,020 |
| 14 | Bút bi | Cái | 0,010 |
| 15 | Mũ | Cái | 0,020 |
| 16 | Khẩu trang | Cái | 0,020 |
| 17 | Găng tay | Đôi | 0,100 |
| 18 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 19 | Quần áo bảo hộ | Bộ | 0,005 |
| 20 | Dung dịch nước rửa tay | ml | 8,000 |
| 21 | Dung dịch nước rửa tay | ml | 1,000 |
| 22 | Dung dịch khử trùng | ml | 10,000 |
| 23 | Khăn lau tay | Cái | 0,010 |
Ghi chú:
* Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/50 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 3 lần/1 năm).
** Nếu chỉ làm 01 mẫu vẫn phải mở 01 lọ kháng nguyên đủ cho 16 giếng bao gồm 11 mẫu bệnh phẩm + 5 mẫu chứng. Vì vậy nếu làm đơn lẻ 01 mẫu thì 01 bệnh phẩm phải chịu chi phí cho 15 giếng còn lại
3. Bệnh phẩm
Huyết thanh hoặc huyết tương.
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
- Theo đúng quy định của chuyên ngành Vi sinh: xem chi tiết phụ lục 2.
- Từ chối những bệnh phẩm không đạt yêu cầu: xem chi tiết phụ lục 6.
2. Tiến hành kỹ thuật
Bộ sinh phẩm Dengue Duo IgG capture ELISA - Pan Bio (VD)
| Các bước | Xét nghiệm định tính dengue IgG |
| 2.1 | Để Số lượng sinh phẩm cần dùng ở nhiệt độ phòng 30 phút trước khi làm xét nghiệm |
| 2.2 | Đánh số, sắp xếp bệnh phẩm và viết sơ đồ theo thứ tự. |
| 2.3 | Chuẩn bị dung dịch rửa |
| 2.4 | Pha loãng kháng nguyên |
| 2.5 | Pha loãng huyết thanh người bệnh, chứng âm, chứng dương và chứng cut-off |
| 2.6 | Trộn đều lượng kháng nguyên đã được pha loãng với một lượng tương đương Mab Tracer. Phức hợp Antigen - Mab Tracer để ở nhiệt độ phòng trong 1 giờ |
| 2.7 | Cho chứng âm, chứng dương, chứng cut-off và bệnh phẩm đã pha loãng vào các giếng của phiến nhựa theo thứ tự hướng dẫn của quy trình |
| 2.8 | Đậy phiến nhựa và ủ |
| 2.9 | Rửa phiến nhựa. |
| 2.10 | Lắc nhẹ phức hợp Antigen - Mab Tracer. Nhỏ phức hợp này vào mỗi giếng |
| 2.11 | Đậy phiến nhựa và ủ |
| 2.12 | Rửa phiến nhựa |
| 2.13 | Nhỏ dung dịch hiện màu vào mỗi giếng |
| 2.14 | Ủ phiến nhựa, không đậy và tránh ánh sáng |
| 2.15 | Nhỏ dung dịch dừng phản ứng. |
| 2.16 | Đọc kết quả ở bước sóng 450 và 620nm. trong vòng 30 phút sau khi dừng phản ứng. |
IV. NHẬN ĐỊNH KẾT QUẢ
Kết quả được tính theo Đơn vị PanBio như sau:
- Tính giá trị trung bình của giá trị ngưỡng (cut-off)
![]()
| - Đơn vị Pan Bio = 10 x | OD bệnh phẩm |
|
|
ﻣ Đơn vị Pan Bio < 18: mẫu thử âm tính, trong huyết thanh không có kháng thể IgG.
ﻣ Đơn vị Pan Bio = 18 - 22: mẫu thử phải xét nghiệm lại lần 2.
ﻣ Đơn vị Pan Bio > 22: mẫu thử dương tính, trong huyết thanh có kháng thể IgG.
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
1. Sai sót
Có thể xảy ra hiện tượng âm tính giả hoặc dương tính giả, thông thường do:
- Thực hiện sai các bước trong quy trình hướng dẫn.
- Chứng âm và những mẫu bệnh phẩm âm tính bị nhiễm chéo bởi huyết thanh/ huyết tương có nồng độ kháng thể cao.
- Dung dịch cơ chất bị nhiễm bởi các tác nhân oxid hoá (thuốc tẩy, ion kim loại v.v…)
- Dung dịch dừng phản ứng bị nhiễm bẩn.
2. Xử trí
- Tuân thủ đúng các bước quy trình hướng dẫn của nhà sản xuất và hướng dẫn về độ ổn định hóa chất xét nghiệm trong bộ sinh phẩm sử dụng.
- Kiểm tra và vệ sinh máy rửa thường xuyên trước và sau khi làm xét nghiệm
- Chia hóa chất (chất cộng hợp, dung dịch hiện màu và dừng phản ứng) vào ống nghiệm sạch trước mỗi lần nhỏ.
132. Dengue virus PCR
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Phát hiện gen đặc trưng của virus dengue trong huyết thanh hoặc huyết tương.
2. Nguyên lý
Sử dụng cặp mồi đặc hiệu để xác định sự có mặt gen đặc trưng của virus dengue bằng kỹ thuật PCR.
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: Cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Tủ an toàn sinh học cấp 2
- Máy PCR
- Máy điện di
- Máy đọc điện di
- Máy ly tâm 25000 x g
- Máy ly tâm dùng cho tube 0,2 ml
- Máy ủ nhiệt
- Máy vortex
- Bộ lưu điện
- Tủ lạnh 2 oC - 8 oC
- Tủ âm sâu (-20 oC hoặc -70 oC)
- Micropipette
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
Thực hiện xét nghiệm 02 mẫu/lần.
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Bông | kg | 0,001 |
| 2 | Cồn | ml | 1,000 |
| 3 | Bơm kim tiêm | Cái | 1,000 |
| 4 | Panh | Cái | 0,0001 |
| 5 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 6 | Hộp vận chuyển bệnh phẩm | Test | 0,001 |
| 7 | Tube đựng bệnh phẩm | Cái | 2,000 |
| 8 | Găng không có bột | Đôi | 0,500 |
| 9 | Sinh phẩm chẩn đoán | Test | 1,000 |
| 10 | Khấu hao sinh phẩm cho chạy chứng và kiểm tra chất lượng | Test | 1,350 |
| 11 | Kit tách RNA từ virus | Test | 2,350 |
| 12 | DNA marker | Bộ | 1,000 |
| 13 | Primer 1 | ml | 0,0001 |
| 14 | Primer 2 | ml | 0,0001 |
| 15 | Ống Eppendorf 1,5 ml | Tube | 3,000 |
| 16 | Ống Eppendorf 0,2 ml | Tube | 1,000 |
| 17 | Đầu côn 10 µl có lọc | Cái | 1,000 |
| 18 | Đầu côn 30 µl | Cái | 1,200 |
| 19 | Đầu côn 200 µl có lọc | Cái | 2,200 |
| 20 | Đầu côn 1 ml có lọc | Cái | 3,200 |
| 21 | Ethanol BDH | ml | 0,500 |
| 22 | Water-DEPC Treated | ml | 2,000 |
| 23 | Thạch | Gam | 0.075 |
| 24 | Ladder | ml | 0.0025 |
| 25 | Blue Juice Gel loading dye | ml | 0.003 |
| 26 | Ethidium Bromide | ml | 0.100 |
| 27 | TAE Buffer | ml | 0.100 |
| 28 | Giấy thấm | Cuộn | 0,100 |
| 29 | Giấy xét nghiệm | Tờ | 2,000 |
| 30 | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 31 | Bút viết kính | Cái | 0,020 |
| 32 | Bút bi | Cái | 0,010 |
| 33 | Mũ | Cái | 0,020 |
| 34 | Khẩu trang | Cái | 0,020 |
| 36 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 37 | Quần áo bảo hộ | Bộ | 0,005 |
| 38 | Dung dịch nước rửa tay | ml | 8,000 |
| 39 | Cồn sát trùng tay nhanh | ml | 1,000 |
| 40 | Dung dịch khử trùng | ml | 10,000 |
| 41 | Khăn lau tay | cái | 0,010 |
| 42 | Ngoại kiểm (nếu có)* |
| 0,020 |
* Ghi chú: Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/50 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 3 lần/1 năm).
3. Bệnh phẩm
Huyết thanh
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu phiếu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
- Theo đúng quy định của chuyên ngành Vi sinh: xem chi tiết phụ lục 3.
- Từ chối những bệnh phẩm không đạt yêu cầu: xem chi tiết phụ lục 6.
2. Tiến hành kỹ thuật
2.1. Tách chiết RNA tổng số
2.2. Thực hiện phản ứng RT-PCR
2.3. Thực hiện phản ứng PCR
2.4. Điện di kiểm tra sản phẩm
2.5. Đánh giá và kết luận
IV. NHẬN ĐỊNH KẾT QUẢ
Sản phẩm PCR phải có một băng đặc hiệu duy nhất, rõ nét và không bị đứt gẫy và có kích thước tương ứng với thang DNA chuẩn.
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
Trong trường hợp không có sản phẩm PCR, cần phải kiểm tra lại quá trình tách chiết RNA tổng số, chất lượng primers và master mix và thực hiện lại xét nghiệm.
133. Dengue virus serotype PCR
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Phát hiện DNA đặc trưng của virus dengue trong huyết thanh hoặc huyết tương ở người
2. Nguyên lý
Xác định serotype của virus dengue dựa trên nguyên lý của kỹ thuật one- step RT-PCR.
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: Cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Máy PCR
- Bộ lưu điện
- Tủ an toàn sinh học cấp 2
- Máy ly tâm dùng cho tube 0,2ml
- Máy ly tâm 25000 x g
- Máy ủ nhiệt
- Máy vortex
- Tủ lạnh 2 oC - 8 oC
- Tủ âm sâu (- 20 oC hoặc -70 oC)
- Micropipette các thể tích từ 5 ml - 1000 ml.
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
Thực hiện xét nghiệm 02 mẫu/lần.
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Bông | Kg | 0.001 |
| 2 | Dây garô | Cái | 0.001 |
| 3 | Cồn | ml | 1.000 |
| 4 | Bơm kim tiêm | Cái | 1.000 |
| 5 | Panh | Cái | 0.0001 |
| 6 | Khay đựng bệnh phẩm | Cái | 0.0001 |
| 7 | Hộp vận chuyển bệnh phẩm | Cái | 0.001 |
| 8 | Tube đựng bệnh phẩm | Cái | 1.000 |
| 9 | Sinh phẩm chẩn đoán | Test | 1.000 |
| 10 | Khấu hao sinh phẩm cho chạy chứng, kiểm tra chất lượng | Test | 1.000 |
| 11 | Kit tách RNA | Test | 2.000 |
| 12 | ống Falcol 50 ml | Cái | 0.010 |
| 13 | Eppendorf 1,7 ml | Tube | 2.000 |
| 14 | Eppendorf 0,2 ml | Tube | 2.000 |
| 15 | Đầu côn 10 µl có lọc | Cái | 2.000 |
| 16 | Đầu côn 30 µl | Cái | 1.200 |
| 17 | Đầu côn 200 µl có lọc | Cái | 5.200 |
| 18 | Đầu côn 1 ml có lọc | Cái | 3.200 |
| 19 | Ethanol BDH | ml | 2.000 |
| 20 | Water-DEPC Treated | ml | 1.000 |
| 21 | Thạch | Gam | 0.075 |
| 22 | Ladder | ml | 0.0025 |
| 23 | Blue Juice Gel loading dye | ml | 0.003 |
| 24 | Ethidium Bromide | ml | 0.1 |
| 25 | TAE Buffer | ml | 0.1 |
| 26 | Giấy thấm | Cuộn | 0.100 |
| 27 | Giấy xét nghiệm | Tờ | 2.000 |
| 28 | Sổ lưu kết quả xét nghiệm | Tờ | 0.001 |
| 29 | Bút viết kính | Cái | 0.020 |
| 30 | Bút bi | Cái | 0.010 |
| 31 | Mũ | Cái | 0.020 |
| 32 | Khẩu trang | Cái | 0.020 |
| 33 | Găng không có bột tal | Đôi | 0.500 |
| 34 | Găng tay xử lý dụng cụ | Đôi | 0.020 |
| 35 | Quần áo bảo hộ | Bộ | 0.005 |
| 36 | Dung dịch nước rửa tay | ml | 8.000 |
| 37 | Cồn sát trùng tay nhanh | ml | 1.000 |
| 38 | Dung dịch khử trùng | ml | 10.000 |
| 39 | Khăn lau tay | Cái | 0.010 |
* Ghi chú: Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/50 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 3 lần/1 năm)..
3. Bệnh phẩm
Huyết thanh hoặc huyết tương chống đông EDTA.
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
- Theo đúng quy định của chuyên ngành Vi sinh: xem chi tiết phụ lục 2.
- Từ chối những bệnh phẩm không đạt yêu cầu: xem chi tiết phụ lục 6.
2. Tiến hành kỹ thuật: Bộ kit one-step RT-PCR định type virus dengue (VD)
2.1. Tách chiết RNA tổng số
2.2. Thực hiện phản ứng RT-PCR
2.3. Điện di và phát hiện sản phẩm
IV. NHẬN ĐỊNH KẾT QUẢ
1. Điều kiện của phản ứng
- Chứng dương có ít nhất một trong các vạch sản phẩm tương ứng với các type của virus dengue như sau:
- Virus Dengue type 1: 482 cặp bazơ - Virus Dengue type 2: 119 cặp bazơ
- Virus Dengue type 3: 290 cặp bazơ - Virus Dengue type 4: 392 cặp bazơ
- Chứng âm không có các vạch sản phẩm trên.
2. Phân tích mẫu
- Dựa vào độ dài dải băng để kết luận type virus dengue gây bệnh: những mẫu có vạch sản phẩm PCR tương ứng với 1 trong 4 type trên thì kết luận dương tính với virus dengue type đó.
- Những mẫu không có vạch sản phẩm nào thì kết luận không tìm thấy virus dengue.
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
Trong trường hợp không có sản phẩm PCR, chứng nội cũng không lên cần phải kiểm tra lại quá trình tách chiết RNA tổng số, chất lượng sinh phẩm, và thực hiện lại toàn bộ xét nghiệm.
134. CMV IgM miễn dịch bán tự động
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Phát hiện kháng thể IgM kháng cytomegalose virus trong huyết thanh hoặc huyết tương.
2. Nguyên lý
Phát hiện kháng thể IgM kháng cytomegalose virus dựa trên nguyên lý của kỹ thuật ELISA (miễn dịch gắn enzym) (VD).
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: Cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Dàn máy ELISA
- Máy ly tâm thường.
- Tủ lạnh 2 oC - 8 oC
- Tủ âm sâu (- 20 oC hoặc - 70 oC) (nếu có)
- Micropipette đơn kênh thể tích từ 10µl đến 1000µl.
- Bộ pipetman 8 kênh (nếu có)
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
Thực hiện xét nghiệm 04 mẫu/lần.
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Bông | Lọ | 0,001 |
| 2 | Dây garô | Cái | 0,001 |
| 3 | Cồn | ml | 1,000 |
| 4 | Bơm kim tiêm | Cái | 1,000 |
| 5 | Panh | Cái | 0,0001 |
| 6 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 7 | Hộp vận chuyển bệnh phẩm | Cái | 0,001 |
| 8 | Tube đựng bệnh phẩm | Cái | 2,000 |
| 9 | Sinh phẩm chẩn đoán | Test | 1,000 |
| 10 | Khấu hao sinh phẩm cho chạy chứng và kiểm tra chất lượng | Test | 1,000 |
| 11 | Chứng ngoại kiểm âm (nếu có) | ml | 0,030 |
| 12 | Chứng ngoại kiểm dương (nếu có) | ml | 0,030 |
| 13 | Ngoại kiểm (nếu có)* |
| 0,020 |
| 14 | Nước cất | ml | 8,000 |
| 15 | Đầu côn 1000 µl | Kg | 1,050 |
| 16 | Đầu côn 200 µl | ml | 3,000 |
| 17 | Giấy thấm | Cái | 0,100 |
| 18 | Giấy xét nghiệm | Cái | 2,000 |
| 19 | Sổ lưu kết quả xét nghiệm | Cái | 0,001 |
| 20 | Bút viết kính | Cái | 0,020 |
| 21 | Bút bi | Cái | 0,010 |
| 22 | Mũ | Cái | 0,020 |
| 23 | Khẩu trang | Đôi | 0,020 |
| 24 | Găng tay | Đôi | 0,100 |
| 25 | Găng tay xử lý dụng cụ | Bộ | 0,020 |
| 26 | Quần áo bảo hộ | ml | 0,005 |
| 27 | Dung dịch nước rửa tay | Ống | 8,000 |
| 28 | Cồn sát trùng tay nhanh | Cái | 1,000 |
| 29 | Dung dịch khử trùng | Cái | 10,000 |
| 30 | Khăn lau tay | Cái | 0,010 |
* Ghi chú: Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/50 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 3 lần/1 năm).
3. Bệnh phẩm
Huyết thanh hoặc huyết tương.
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
- Theo đúng quy định của chuyên ngành Vi sinh: xem chi tiết phụ lục 2.
- Từ chối những bệnh phẩm không đạt yêu cầu: xem chi tiết phụ lục 6.
2. Tiến hành kỹ thuật: Bộ sinh phẩm Platelia CMV IgM - BioRad (VD)
| Các bước | Xét nghiệm định tính CMV IgM |
| 2.1 | Để sinh phẩm cần dùng ở nhiệt độ phòng 30 phút trước khi làm xét nghiệm |
| 2.2 | Đánh số, sắp xếp bệnh phẩm và viết sơ đồ theo thứ tự. |
| 2.3 | Chuẩn bị dung dịch rửa |
| 2.4 | Chuẩn bị phức hợp miễn dịch |
| 2.5 | Lấy đủ số giếng cần dùng và đặt vào giá. |
| 2.6 | Pha loãng bệnh phẩm |
| 2.7 | Nhỏ chứng và mẫu huyết thanh người bệnh đã pha loãng |
| 2.8 | Đậy tấm và ủ ở 37 oC trong 45 phút |
| 2.9 | Rửa phiến nhựa theo hướng dẫn của quy trình. |
| 2.10 | Nhỏ chất cộng hợp vào mỗi giếng |
| 2.11 | Đậy tấm và ủ ở 37 oC trong 45 phút |
| 2.12 | Rửa phiến nhựa |
| 2.13 | Nhỏ dung dịch hiện màu vào mỗi giếng |
| 2.14 | Ủ, không đậy tấm và tránh ánh sáng |
| 2.15 | Dừng phản ứng. |
| 2.16 | Đọc kết quả ở bước sóng 450 và 620nm. |
IV. NHẬN ĐỊNH KẾT QUẢ
1. Điều kiện của phản ứng
- OD của giếng trống £ 0.150.
- OD của mỗi cut-o ff luôn luôn trong khoảng 25% giá trị trung bình cut-off. Loại bỏ những giá trị không nằm trong khoảng này và tính toán lại giá trị trung bình.
- OD của chứng dương ≥ 1,5 x OD cut-o ff
- Tỉ lệ OD chứng âm: OD cut-off < 0.6.
- OD cut-off ≥ 0.16.
2. Đánh giá theo tiêu chuẩn phòng xét nghiệm
- Chứng nội kiểm, ngoại kiểm: Đánh giá kết quả dựa trên biểu đồ Levey-Jenning (nếu có)
3. Diễn giải kết quả
- Nếu OD của mẫu bệnh phẩm > OD của cut-off: mẫu bệnh phẩm dương tính với CMV-IgM.
- Tính toán tỉ lệ giữa giá trị OD mẫu và OD cut-off.
+ Dương tính: nếu tỉ lệ > 1.2
+ Nghi ngờ: nếu tỉ lệ nhỏ hơn hoặc lớn hơn 20% OD của cut-off
+ Âm tính: nếu tỉ lệ < 0.8
- Nếu kết quả nghi ngờ → làm lại xét nghiệm. Nếu vẫn nghi ngờ → yêu cầu lấy mẫu huyết thanh mới sau 2 - 3 tuần.
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
1. Sai sót
Có thể xảy ra hiện tượng âm tính giả hoặc dương tính giả, thông thường do:
- Thực hiện sai các bước trong quy trình hướng dẫn.
- Chứng âm và những mẫu bệnh phẩm âm tính bị nhiễm chéo bởi huyết thanh/ huyết tương có nồng độ kháng thể cao.
- Dung dịch cơ chất bị nhiễm bởi các tác nhân oxid hoá (thuốc tẩy, ion kim loại v.v…).
- Dung dịch dừng phản ứng bị nhiễm bẩn.
2. Xử trí
- Tuân thủ đúng các bước quy trình hướng dẫn của nhà sản xuất và hướng dẫn về độ ổn định hóa chất xét nghiệm trong bộ sinh phẩm sử dụng.
- Kiểm tra và vệ sinh máy rửa thường xuyên trước và sau khi làm xét nghiệm
- Chia hóa chất (chất cộng hợp, dung dịch hiện màu và dừng phản ứng) vào ống nghiệm sạch trước mỗi lần nhỏ.
135. CMV IgM miễn dịch tự động
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Phát hiện kháng thể IgM kháng cytomegalose virus trong huyết thanh hoặc huyết tương.
2. Nguyên lý
Phát hiện kháng thể IgM kháng cytomegalose virus dựa trên nguyên lý của kỹ thuật CLIA (miễn dịch điện hóa phát quang) (VD).
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện: Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: Cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Hệ thống máy miễn dịch tự động
- Bộ lưu điện
- Máy ly tâm thường.
- Tủ lạnh 2 oC - 8 oC
- Tủ âm sâu (- 20 oC hoặc - 70 oC) (nếu có)
- Micropipet đơn kênh thể tích từ 50 µl đến 200 µl.
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
Thực hiện xét nghiệm 02 mẫu/lần.
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Bông | Kg | 0,001 |
| 2 | Dây garô | Cái | 0,001 |
| 3 | Cồn | ml | 1,000 |
| 4 | Bơm kim tiêm | Cái | 1,000 |
| 5 | Panh | Cái | 0,0001 |
| 6 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 7 | Hộp vận chuyển bệnh phẩm | Test | 0,001 |
| 8 | Tube đựng bệnh phẩm | Cái | 1,000 |
| 9 | Sinh phẩm chẩn đoán | Test | 1,000 |
| 10 | Khấu hao sinh phẩm cho chạy chuẩn | Test | 0,100 |
| 11 | Khấu hao sinh phẩm cho chạy chứng, kiểm tra chất lượng | Test | 2,000 |
| 12 | Control | Test | 0,100 |
| 13 | Chứng ngoại kiểm âm (nếu có) | ml | 0,150 |
| 14 | Chứng ngoại kiểm dương (nếu có) | ml | 0,150 |
| 15 | Ngoại kiểm (nếu có)* |
| 0,02 |
| 16 | Cleancell M | ml | 3,000 |
| 17 | Procell M | ml | 3,000 |
| 18 | Probe Wash M | ml | 2,000 |
| 19 | Preclean M | ml | 2,000 |
| 20 | Assay Tip/Cup E170 | Cái | 3,000 |
| 21 | ISE Cleaning Solution F. HIT | ml | 0,500 |
| 22 | Nước cất | ml | 5,000 |
| 23 | Sample cup | Cuộn | 1,000 |
| 24 | Giấy thấm | Cuộn | 0,100 |
| 25 | Giấy xét nghiệm | Tờ | 2,000 |
| 26 | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 27 | Bút viết kính | Cái | 0,020 |
| 28 | Bút bi | Cái | 0,010 |
| 29 | Mũ | Cái | 0,020 |
| 30 | Khẩu trang | Cái | 0,020 |
| 31 | Găng tay | Đôi | 0,100 |
| 32 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 33 | Quần áo bảo hộ | Bộ | 0,005 |
| 34 | Dung dịch nước rửa tay | ml | 8,000 |
| 35 | Cồn sát trùng tay nhanh | ml | 1,000 |
| 36 | Dung dịch khử trùng | ml | 10,000 |
| 37 | Khăn lau tay | Cái | 0,010 |
* Ghi chú: Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/50 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 3 lần/1 năm).
3. Bệnh phẩm
Huyết thanh hoặc huyết tương
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
- Theo đúng quy định của chuyên ngành Vi sinh: xem chi tiết phụ lục 2.
- Từ chối những bệnh phẩm không đạt yêu cầu: xem chi tiết phụ lục 6.
2. Tiến hành kỹ thuật: Bộ sinh phẩm CMV IgM Elecsys - Roche (VD)
| Các bước | Xét nghiệm định tính CMV IgM |
| 2.1 | Vào Reagent để kiểm tra Số lượng tests. |
| 2.2 | Vào Calibration → Status để kiểm tra hiệu chuẩn |
| 2.3 | Chạy chứng |
| Chạy mẫu không dùng barcode | |
| 1 | Đánh số sample cup theo mã số bệnh phẩm. Hút huyết thanh/huyết tương và chứng ngoại kiểm (nếu có) vào sample cup tương ứng. |
| 2 | Vào màn hình Workplace → Test Selection |
| 3 | Nhập mã bệnh phẩm |
| 4 | Chọn tên test là CMV IgM |
| 5 | Vào Barcode Read Error |
| 6 | Nhập số rack và vị trí mẫu → Add → OK → Save |
| 7 | Đặt mẫu đã được hút vào Sample Cup lên Rack màu xám đúng vị trí đã chỉ định rồi đưa vào khu nạp giá mẫu. |
| 8 | Chọn Start → Chọn START ở màn hình Start Conditions |
| Chạy mẫu có barcode | |
| 1 | Nhập chỉ định xét nghiệm trên máy tính bằng phần mềm LIS |
| 2 | Đặt ống máu đã được dán barcode vào rack màu xám, quay mặt barcode ra phía ngoài rồi đưa vào khu nạp giá mẫu |
| 3 | Chọn Start → Chọn START ở màn hình Start Conditions |
IV. NHẬN ĐỊNH KẾT QUẢ
1. Đánh giá theo tiêu chuẩn nhà sản xuất
- Chạy kiểm tra chứng 1 và chứng 2 trên tất cả các điện cực dùng để chạy xét nghiệm.
- Giá trị chứng đạt được phải nằm trong khoảng giới hạn xác định.
2. Đánh giá theo tiêu chuẩn phòng xét nghiệm
Chứng nội kiểm, ngoại kiểm: Đánh giá kết quả dựa trên biểu đồ Levey-Jenning (nếu có).
3. Kết quả và báo cáo
- Âm tính: Nếu COI < 0,7
- Nghi ngờ: Nếu 0,7 ≤ COI < 1.0
- Dương tính: Nếu COI ≥ 1.0
Những mẫu nghi ngờ cần kiểm tra lại lần 2. Nếu vẫn lặp lại kết quả lần đầu thì nên xét nghiệm lại với mẫu bệnh phẩm thứ hai sau 2 - 3 tuần.
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
- Máy báo sample short (do bệnh phẩm bị đông hoặc không đủ) → Chú ý ly tâm mẫu thật kỹ ngay từ đầu hoặc hút mẫu ra cup.
- Không sử dụng thuốc thử đã quá hạn sử dụng.
- Tránh tạo bọt ở lọ thuốc thử và các loại mẫu (bệnh phẩm, calibration và chứng).
136. CMV IgG miễn dịch bán tự động
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Phát hiện kháng thể IgG kháng cytomegalose virus trong huyết thanh hoặc huyết tương.
2. Nguyên lý
Phát hiện kháng thể IgG kháng cytomegalose virus dựa trên nguyên lý của kỹ thuật ELISA (miễn dịch gắn enzyme) (VD).
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: Cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Dàn máy ELISA
- Máy ly tâm thường.
- Tủ lạnh 2 oC - 8 oC
- Tủ âm sâu (- 20 oC hoặc - 70 oC) (nếu có)
- Micropipette đơn kênh thể tích từ 10µl đến 1000µl.
- Bộ pipetman 8 kênh (nếu có)
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
Thực hiện xét nghiệm 04 mẫu/lần.
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Bông | Lọ | 0,001 |
| 2 | Dây garô | Cái | 0,001 |
| 3 | Cồn | ml | 1,000 |
| 4 | Bơm kim tiêm | Cái | 1,000 |
| 5 | Panh | Cái | 0,0001 |
| 6 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 7 | Hộp vận chuyển bệnh phẩm | Cái | 0,001 |
| 3 | Tube đựng bệnh phẩm | Cái | 2,000 |
| 4 | Sinh phẩm chẩn đoán | Test | 1,000 |
| 5 | Khấu hao sinh phẩm cho chạy chứng và kiểm tra chất lượng | Test | 1,000 |
| 6 | Chứng ngoại kiểm âm (nếu có) | ml | 0,030 |
| 7 | Chứng ngoại kiểm dương (nếu có) | ml | 0,030 |
| 8 | Ngoại kiểm (nếu có)* |
| 0,020 |
| 9 | Nước cất | ml | 8,000 |
| 10 | Đầu côn 1000 µl | Cái | 1,050 |
| 11 | Đầu côn 200 µl | Cái | 3,000 |
| 12 | Giấy thấm | Cuộn | 0,100 |
| 13 | Giấy xét nghiệm | Tờ | 2,000 |
| 14 | Sổ lưu kết quả xét nghiệm | Quyển | 0,001 |
| 15 | Bút viết kính | Cái | 0,020 |
| 16 | Bút bi | Cái | 0,010 |
| 17 | Mũ | Cái | 0,020 |
| 18 | Khẩu trang | Cái | 0,020 |
| 19 | Găng tay | Đôi | 0,100 |
| 20 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 21 | Quần áo bảo hộ | Bộ | 0,005 |
| 22 | Dung dịch nước rửa tay | ml | 8,000 |
| 23 | Cồn sát trùng tay nhanh | ml | 1,000 |
| 24 | Dung dịch khử trùng | ml | 10,000 |
| 25 | Khăn lau tay | Cái | 0,010 |
* Ghi chú: Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/50 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 3 lần/1 năm).
3. Bệnh phẩm
Huyết thanh hoặc huyết tương.
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
1. Lấy bệnh phẩm
- Theo đúng quy định của chuyên ngành Vi sinh: xem chi tiết phụ lục 2.
- Từ chối những bệnh phẩm không đạt yêu cầu: xem chi tiết phụ lục 6.
2. Tiến hành kỹ thuật
Bộ sinh phẩm PlateliaTM CMV IgG - BioRad (VD)
| Các bước | Xét nghiệm định tính CMV IgG |
| 2.1 | Để Số lượng sinh phẩm cần dùng ở nhiệt độ phòng 30 phút trước khi làm xét nghiệm |
| 2.2 | Đánh số, sắp xếp bệnh phẩm và viết sơ đồ theo thứ tự. |
| 2.3 | Chuẩn bị dung dịch rửa |
| 2.4 | Lấy đủ số giếng cần dùng và đặt vào giá. |
| 2.5 | Pha loãng bệnh phẩm với dung dịch pha loãng theo tỷ lệ 1:101 |
| 2.6 | Nhỏ chứng và mẫu huyết thanh người bệnh đã pha loãng |
| 2.7 | Đậy tấm và ủ |
| 2.8 | Rửa phiến nhựa. |
| 2.9 | Nhỏ chất cộng hợp vào mỗi giếng |
| 2.10 | Đậy tấm và ủ |
| 2.11 | Rửa phiến nhựa |
| 2.12 | Nhỏ dung dịch hiện màu vào mỗi giếng |
| 2.13 | Ủ, không đậy tấm và tránh ánh sáng |
| 2.14 | Dừng phản ứng. |
| 2.15 | Đọc kết quả ở bước sóng 450 và 620nm. trong vòng 30 phút sau khi dừng phản ứng. |
IV. NHẬN ĐỊNH KẾT QUẢ
1. Điều kiện của phản ứng
- OD của chứng âm < 0.6
- OD của calibrator 2 ≥ 0.16
- OD của calibrator 5 ≥ 1,2
- OD củ a g iếng trống ≤ 0 ,15
- Tỉ lệ OD chứng âm : OD cut-o ff < 0.6.
- OD cut -off ≥ 0.16.
2. Đánh giá theo tiêu chuẩn phòng xét nghiệm
Chứng nội kiểm, ngoại kiểm: Đánh giá kết quả dựa trên biểu đồ Levey-Jenning (nếu có)
3. Diễn giải kết quả
Tính tỷ lệ giữa OD của mẫu bệnh phẩm: OD của calibrator 2
+ Dương tính: nếu tỉ lệ > 1.2
+ Nghi ngờ: nếu 0,8 ≤ tỉ lệ ≤ 1.2
+ Âm tính: nếu tỉ lệ < 0.8
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
1. Sai sót
Có thể xảy ra hiện tượng âm tính giả hoặc dương tính giả, thông thường do:
- Thực hiện sai các bước trong quy trình hướng dẫn.
- Chứng âm và những mẫu bệnh phẩm âm tính bị nhiễm chéo bởi huyết thanh/ huyết tương có nồng độ kháng thể cao.
- Dung dịch cơ chất bị nhiễm bởi các tác nhân oxid hoá (thuốc tẩy, ion kim loại v.v…)
- Dung dịch dừng phản ứng bị nhiễm bẩn.
2. Xử trí
- Tuân thủ đúng các bước quy trình hướng dẫn của nhà sản xuất và hướng dẫn về độ ổn định hóa chất xét nghiệm trong bộ sinh phẩm sử dụng.
- Kiểm tra và vệ sinh máy rửa thường xuyên trước và sau khi làm xét nghiệm
- Chia hóa chất (chất cộng hợp, dung dịch hiện màu và dừng phản ứng) vào ống nghiệm sạch trước mỗi lần nhỏ.
137. CMV IgG miễn dịch tự động
I. MỤC ĐỊCH VÀ NGUYÊN LÝ
1. Mục đích
Phát hiện kháng thể IgG kháng cytomegalose virus trong huyết thanh hoặc huyết tương.
2. Nguyên lý
Xác định nồng độ kháng thể IgG kháng cytomegalose virus dựa trên nguyên lý của kỹ thuật CLIA (miễn dịch điện hóa phát quang) (VD).
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: Cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Hệ thống máy miễn dịch tự động
- Bộ lưu điện
- Máy ly tâm thường.
- Tủ lạnh 2 oC - 8 oC
- Tủ âm sâu (- 20 oC hoặc - 70 oC) (nếu có)
- Micropipette đơn kênh thể tích từ 50 µl đến 200 µl.
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
Thực hiện xét nghiệm 02 mẫu/lần.
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Bông | Kg | 0,001 |
| 2 | Dây garô | Cái | 0,001 |
| 3 | Cồn | ml | 1,000 |
| 4 | Bơm kim tiêm | Cái | 1,000 |
| 5 | Panh | Cái | 0,0001 |
| 6 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 7 | Hộp vận chuyển bệnh phẩm | Test | 0,001 |
| 8 | Tube đựng bệnh phẩm | Cái | 1,000 |
| 9 | Sinh phẩm chẩn đoán | Test | 1,000 |
| 10 | Khấu hao sinh phẩm cho chạy chuẩn | Test | 0,100 |
| 11 | Khấu hao sinh phẩm cho chạy chứng, kiểm tra chất lượng | Test | 2,000 |
| 12 | Control | Test | 0,100 |
| 13 | Chứng ngoại kiểm âm (nếu có) | ml | 0,150 |
| 14 | Chứng ngoại kiểm dương (nếu có) | ml | 0,150 |
| 15 | Ngoại kiểm (nếu có)* |
| 0,020 |
| 16 | Cleancell M | ml | 3,000 |
| 17 | Procell M | ml | 3,000 |
| 18 | Probe Wash M | ml | 2,000 |
| 19 | Preclean M | ml | 2,000 |
| 20 | Assay Tip/Cup E170 | Cái | 3,000 |
| 21 | ISE Cleaning Solution F. HIT | ml | 0,500 |
| 22 | Nước cất | ml | 5,000 |
| 23 | Sample cup | Cái | 1,000 |
| 24 | Giấy thấm | Cuộn | 0,100 |
| 25 | Giấy xét nghiệm | Tờ | 2,000 |
| 26 | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 27 | Bút viết kính | Cái | 0,020 |
| 28 | Bút bi | Cái | 0,010 |
| 29 | Mũ | Cái | 0,020 |
| 30 | Khẩu trang | Cái | 0,020 |
| 31 | Găng tay | Đôi | 0,100 |
| 32 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 33 | Quần áo bảo hộ | Bộ | 0,005 |
| 34 | Dung dịch nước rửa tay | ml | 8,000 |
| 35 | Cồn sát trùng tay nhanh | ml | 1,000 |
| 36 | Dung dịch khử trùng | ml | 10,000 |
| 37 | Khăn lau tay | Cái | 0,010 |
* Ghi chú: Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/50 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 3 lần/1 năm).
3. Bệnh phẩm
Huyết thanh hoặc huyết tương
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
1. Lấy bệnh phẩm
- Theo đúng quy định của chuyên ngành Vi sinh: xem chi tiết phụ lục 2.
- Từ chối những bệnh phẩm không đạt yêu cầu: xem chi tiết phụ lục 6.
2. Tiến hành kỹ thuật
Bộ sinh phẩm CMV IgM Elecsys - Roche (VD)
| Các bước | Xét nghiệm định lượng CMV IgG |
| 2.1 | Vào Reagent để kiểm tra Số lượng tests. |
| 2.2 | Vào Calibration → Status để kiểm tra hiệu chuẩn |
| 2.3 | Chạy chứng |
| Chạy mẫu không dùng barcode | |
| 1 | Đánh số sample cup theo mã số bệnh phẩm. Hút huyết thanh/huyết tương và chứng ngoại kiểm (nếu có) vào sample cup tương ứng. |
| 2 | Vào màn hình Workplace → Test Selection |
| 3 | Nhập mã bệnh phẩm |
| 4 | Chọn tên test là CMV IgG |
| 5 | Vào Barcode Read Error |
| 6 | Nhập số rack và vị trí mẫu → Add → OK → Save |
| 7 | Đặt mẫu đã được hút vào Sample Cup lên Rack màu xám đúng vị trí đã order rồi đưa vào khu nạp giá mẫu. |
| 8 | Chọn Start → Chọn START ở màn hình Start Conditions |
| Chạy mẫu có barcode | |
| 1 | Nhập chỉ định xét nghiệm trên máy tính bằng phần mềm LIS |
| 2 | Đặt ống máu đã được dán barcode vào rack màu xám, quay mặt barcode ra phía ngoài rồi đưa vào khu nạp giá mẫu |
| 3 | Chọn Start → Chọn START ở màn hình Start Conditions |
IV. NHẬN ĐỊNH KẾT QUẢ
1. Đánh giá theo tiêu chuẩn nhà sản xuất
- Chạy kiểm tra chứng 1 và chứng 2 trên tất cả các điện cực dùng để chạy xét nghiệm.
- Giá trị chứng đạt được phải nằm trong khoảng giới hạn xác định.
2. Đánh giá theo tiêu chuẩn phòng xét nghiệm
Chứng nội kiểm, ngoại kiểm: Đánh giá kết quả dựa trên biểu đồ Levey-Jenning (nếu có)
3. Kết quả và báo cáo
- Âm tính: Nếu COI < 0,5 U/ml
- Nghi ngờ: Nếu 0,5 ≤ COI < 1.0 U/ml → Kiểm tra lại. Nếu kết quả vẫn nghi ngờ thì 2 tuần sau lấy một mẫu bệnh phẩm mới để xét nghiệm lại.
- Dương tính: Nếu COI ≥ 1.0 U/ml
* Dải định lượng: 0,25 - 500 U/ml
* Ngưỡng phát hiện: 0,25 U/ml
* Những mẫu có giá trị lớn hơn dải định lượng thì máy sẽ báo > 500 U/ml hoặc > 1000 U/ml đối với mẫu pha loãng 1:20
- Những mẫu có giá trị lớn hơn dải định lượng thì pha loãng mẫu với tỷ lệ 1:20.
+ Nếu pha loãng bằng tay:
Kết quả cuối cùng (U/ml) = giá trị đo được x độ pha loãng (20)
+ Nếu pha loãng trên máy: Máy sẽ tự động tính toán kết quả.
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
- Máy báo sample short (do bệnh phẩm bị đông hoặc không đủ) → Chú ý ly tâm mẫu thật kỹ ngay từ đầu hoặc hút mẫu ra cup.
- Không sử dụng thuốc thử đã quá hạn sử dụng.
- Tránh tạo bọt ở lọ thuốc thử và các loại mẫu (bệnh phẩm, calibration và chứng).
138. CMV PCR
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Phát hiện gen đặc trưng của Cytomegalovirus (CMV) trong huyết thanh, huyết tương, dịch não tủy…
2. Nguyên lý
Sử dụng cặp mồi đặc hiệu để xác định sự có mặt gen đặc trưng của Cytomegalovirus bằng kỹ thuật PCR.
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: Cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Tủ an toàn sinh học cấp 2
- Máy PCR
- Máy điện di
- Máy đọc điện di
- Máy ly tâm 25000 x g
- Máy ly tâm dùng cho tube 0,2 ml
- Máy ủ nhiệt
- Máy vortex
- Bộ lưu điện
- Tủ lạnh 2 oC - 8 oC
- Tủ âm sâu (-20 oC hoặc -70 oC)
- Micropipette
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
Thực hiện xét nghiệm 02 mẫu/lần.
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Bông | kg | 0,001 |
| 2 | Cồn | ml | 1,000 |
| 3 | Bơm kim tiêm | Cái | 1,000 |
| 4 | Panh | Cái | 0,0001 |
| 5 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 6 | Hộp vận chuyển bệnh phẩm | Test | 0,001 |
| 7 | Tube đựng bệnh phẩm | Cái | 2,000 |
| 8 | Găng không có bột | Đôi | 0,500 |
| 9 | Sinh phẩm chẩn đoán | Test | 1,000 |
| 10 | Khấu hao sinh phẩm cho chạy chứng và kiểm tra chất lượng | Test | 1,350 |
| 11 | Kit tách chiết DNA từ virus | Test | 2,350 |
| 12 | Primer 1 | ml | 0,0001 |
| 13 | Primer 2 | ml | 0,0001 |
| 14 | Ống Eppendorf 1,5 ml | Tube | 3,000 |
| 15 | Ống Eppendorf 0,2 ml | Tube | 1,000 |
| 16 | Đầu côn 10 µl có lọc | Cái | 1,000 |
| 17 | Đầu côn 30 µl | Cái | 1,200 |
| 18 | Đầu côn 200 µl có lọc | Cái | 2,200 |
| 19 | Đầu côn 1 ml có lọc | Cái | 3,200 |
| 20 | Ethanol BDH | ml | 0,500 |
| 21 | Water-DEPC Treated | ml | 2,000 |
| 22 | Thạch | Gam | 0.075 |
| 23 | Ladder | ml | 0.0025 |
| 24 | Blue Juice Gel loading dye | ml | 0.003 |
| 25 | Ethidium Bromide | ml | 0.100 |
| 26 | TAE Buffer | ml | 0.100 |
| 27 | Giấy thấm | Cuộn | 0,100 |
| 28 | Giấy xét nghiệm | Tờ | 2,000 |
| 29 | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 31 | Bút viết kính | Cái | 0,020 |
| 32 | Bút bi | Cái | 0,010 |
| 33 | Mũ | Cái | 0,020 |
| 34 | Khẩu trang | Cái | 0,020 |
| 35 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 36 | Quần áo bảo hộ | Bộ | 0,005 |
| 37 | Dung dịch nước rửa tay | ml | 8,000 |
| 38 | Cồn sát trùng tay nhanh | ml | 1,000 |
| 39 | Dung dịch khử trùng | ml | 10,000 |
| 40 | Khăn lau tay | cái | 0,010 |
| 41 | Ngoại kiểm (nếu có)* |
| 0,020 |
* Ghi chú: Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/50 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 3 lần/1 năm).
3. Bệnh phẩm
Máu, dịch não tủy, các loại dịch khác, …
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu phiếu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
- Theo đúng quy định của chuyên ngành Vi sinh: xem chi tiết phụ lục 3.
- Từ chối những bệnh phẩm không đạt yêu cầu: xem chi tiết phụ lục 6.
2. Tiến hành kỹ thuật
2.1. Tách chiết DNA tổng số
2.2. Thực hiện phản ứng PCR
2.3. Điện di kiểm tra sản phẩm
2.4. Đánh giá và kết luận
IV. NHẬN ĐỊNH KẾT QUẢ
Sản phẩm PCR phải có một băng đặc hiệu duy nhất, rõ nét và không bị đứt gẫy và có kích thước tương ứng với thang DNA chuẩn.
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
Trong trường hợp không có sản phẩm PCR, cần phải kiểm tra lại quá trình tách chiết DNA tổng số, chất lượng của primers và master mix, và thực hiện lại toàn bộ xét nghiệm.
139. CMV Real-time PCR
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Phát hiện gen đặc trưng của Cytomegalovirus (CMV) trong huyết thanh, huyết tương, dịch não tủy….
2. Nguyên lý
Sử dụng cặp mồi đặc hiệu để xác định sự có mặt của gen đặc trưng cho Cytomegalovirus bằng kỹ thuật Real time PCR.
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện: Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: Cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Tủ an toàn sinh học cấp 2
- Máy Real-time PCR và hệ thống máy tính
- Máy ly tâm 25000 x g
- Máy ly tâm dùng cho tube 0,2 ml
- Máy ủ nhiệt
- Máy vortex
- Bộ lưu điện
- Tủ lạnh 2 oC - 8 oC
- Tủ âm sâu (-20 oC hoặc -70 oC)
- Micropipette
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
Thực hiện xét nghiệm 02 mẫu/lần.
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Bông | kg | 0,001 |
| 2 | Cồn | ml | 1,000 |
| 3 | Bơm kim tiêm | Cái | 1,000 |
| 4 | Panh | Cái | 0,0001 |
| 5 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 6 | Hộp vận chuyển bệnh phẩm | Test | 0,001 |
| 7 | Tube đựng bệnh phẩm | Cái | 2,000 |
| 8 | Găng không có bột | Đôi | 0,500 |
| 9 | Sinh phẩm chẩn đoán | Test | 1,000 |
| 10 | Khấu hao sinh phẩm cho chạy chứng và kiểm tra chất lượng | Test | 1,350 |
| 11 | Kit tách chiết DNA từ virus | Test | 2,350 |
| 12 | Primer 1 | ml | 0,0001 |
| 13 | Primer 2 | ml | 0,0001 |
| 14 | Probe | ml | 0,0001 |
| 15 | Ống Eppendorf 1,5 ml | Tube | 3,000 |
| 16 | Ống Eppendorf 0,2 ml | Tube | 1,000 |
| 17 | Đầu côn 10 ul có lọc | Cái | 1,000 |
| 18 | Đầu côn 30 ul | Cái | 1,200 |
| 19 | Đầu côn 200 ul có lọc | Cái | 2,200 |
| 20 | Đầu côn 1 ml có lọc | Cái | 3,200 |
| 21 | Ethanol BDH | ml | 0,500 |
| 22 | Water-DEPC Treated | ml | 2,000 |
| 23 | Giấy thấm | Cuộn | 0,100 |
| 24 | Giấy xét nghiệm | Tờ | 2,000 |
| 25 | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 26 | Bút viết kính | Cái | 0,020 |
| 27 | Bút bi | Cái | 0,010 |
| 28 | Mũ | Cái | 0,020 |
| 29 | Khẩu trang | Cái | 0,020 |
| 30 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 31 | Quần áo bảo hộ | Bộ | 0,005 |
| 32 | Dung dịch nước rửa tay | ml | 8,000 |
| 33 | Cồn sát trùng tay nhanh | ml | 1,000 |
| 34 | Dung dịch khử trùng | ml | 10,000 |
| 35 | Khăn lau tay | cái | 0,010 |
| 36 | Ngoại kiểm (nếu có)* |
| 0,020 |
* Ghi chú: Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/50 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 3 lần/1 năm).
3. Bệnh phẩm
Máu, dịch não tủy, các loại dịch khác…
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu phiếu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
- Theo đúng quy định của chuyên ngành Vi sinh: xem chi tiết phụ lục 3.
- Từ chối những bệnh phẩm không đạt yêu cầu: xem chi tiết phụ lục 6.
2. Tiến hành kỹ thuật
2.1. Tách chiết DNA tổng số
2.2. Thực hiện phản ứng Real-time PCR
2.3. Phân tích và đánh giá kết quả
2.4. In và trả kết quả
IV. NHẬN ĐỊNH KẾT QUẢ
Chứng dương phải xuất hiện đồ thị huỳnh quang trên đường giới hạn cơ bản, chứng âm không có bất kỳ đường đồ thị huỳnh quang nào xuất hiện. Đường đồ thị huỳnh quang của mẫu có thể xuất hiện hoặc không xuất hiện trên đường giới hạn cơ bản, căn cứ vào đó để kết luận kết quả.
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
- Trong trường hợp chứng dương và chứng âm xuất hiện không đúng với diễn giải ở phần IV thì phải kiểm tra lại Master mix và chứng dương và quá trình tách DNA tổng số, sau đó làm lại toàn bộ xét nghiệm.
- Nếu đường đồ thị huỳnh quang của mẫu xuất hiện ở ngoài chu kỳ thứ 40 thì phải cẩn thận kiểm tra và đánh giá lại mẫu
140. CMV đo tải lượng hệ thống tự động
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Đếm số lượng bản sao của CMV DNA trong một đơn vị thể tích huyết tương.
2. Nguyên lý
Đếm số lượng bản sao của CMV DNA trong một đơn vị thể tích huyết tương (copies/ml) dựa trên nguyên lý của kỹ thuật Real-time PCR.
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện: Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: Cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Máy ly tâm thường.
- Tủ lạnh 2 oC - 8 oC
- Tủ âm sâu (-20 oC hoặc -70 oC)
- Tủ an toàn sinh học cấp 2
- Máy vortex
- Bộ lưu điện
- Hệ thống máy tách chiết tự động (RNA, DNA) và định lượng COBAS®AmpliPrep/COBAS® TaqMan 48 Analyzer (Roche) (VD)
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
Thực hiện xét nghiệm 10 mẫu/lần.
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Bông | Kg | 0,001 |
| 2 | Dây garô | Cái | 0,001 |
| 3 | Cồn | ml | 1,000 |
| 4 | Bơm kim tiêm | Cái | 1,000 |
| 5 | Panh | Cái | 0,0001 |
| 6 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 7 | Hộp vận chuyển bệnh phẩm | Cái | 0,001 |
| 8 | Tube đựng bệnh phẩm | Cái | 3,000 |
| 9 | Sinh phẩm chẩn đoán | Test | 1,000 |
| 10 | Khấu hao sinh phẩm cho chạy chứng, kiểm tra chất lượng | Test | 0,340 |
| 11 | Ngoại kiểm (nếu có)* |
| 0,020 |
| 12 | SPU | Cái | 1,300 |
| 13 | Tube-S | Cái | 1,300 |
| 14 | Tube-K | Cái | 1,300 |
| 15 | Tip-K | Cái | 1,300 |
| 16 | Kit CAP-G/CTM Wash Reagent 5.1 L | Test | 1,300 |
| 17 | Đầu côn 1000 µl | Cái | 1,000 |
| 18 | Đầu côn có lọc 1000 µl | Cái | 1,300 |
| 19 | Giấy thấm | Cuộn | 0,100 |
| 20 | Giấy xét nghiệm | Tờ | 3,000 |
| 21 | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 22 | Bút viết kính | Cái | 0,020 |
| 23 | Bút bi | Cái | 0,010 |
| 24 | Mũ | Cái | 0,020 |
| 25 | Khẩu trang | Cái | 0,020 |
| 26 | Găng không có bột tal | Đôi | 0,500 |
| 27 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 28 | Quần áo bảo hộ | Bộ | 0,005 |
| 29 | Dung dịch nước rửa tay | ml | 8,000 |
| 30 | Cồn sát trùng tay nhanh | ml | 1,000 |
| 31 | Dung dịch khử trùng | ml | 10,000 |
| 32 | Khăn lau tay | Cái | 0,010 |
* Ghi chú: Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/50 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 3 lần/1 năm).
3. Bệnh phẩm
Huyết tương từ máu chống đông bằng EDTA.
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu phiếu yêu cầu
III. CÁC BƯỚC THỰC HIỆN
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
- Theo đúng quy định của chuyên ngành Vi sinh: xem chi tiết phụ lục 2.
- Từ chối những bệnh phẩm không đạt yêu cầu: xem chi tiết phụ lục 6.
2. Tiến hành kỹ thuật
Bộ sinh phẩm COBAS®Ampliprep/COBAS®TaqMan CMV Test (Roche Diagnostics GmbH) (VD)
2.1. Tách chiết DNA vận hành máy COBAS® AmpliPrep
2.2. Khuyếch đại DNA, đọc kết quả trên máy COBAS® TaqMan 48
IV. NHẬN ĐỊNH KẾT QUẢ
1. Kiểm tra chất lượng
Giá trị định lượng chấp nhận được nếu:
- Chứng âm là không phát hiện.
- Chứng nội cho giá trị Ct mong đợi.
Không nhận các kết quả của chứng không có giá trị khi xuất hiện thông báo lỗi:
- Chứng âm: Invalid
- Chứng dương thấp: Invalid, <1.50E+02 cp/ml, >1.00E+07 cp/ml, không phát hiện (Target Not Detected)
- Chứng dương cao: Invalid, <1.50E+02 cp/ml, >1.00E+07 cp/ml, không phát hiện (Target Not Detected)
2. Kết quả và báo cáo
Kết quả định lượng CMV DNA của máy COBAS TaqMan 48 được tính theo Đơn vị số copies/ml.
Giá trị tham số Ct (được định nghĩa là số chu kỳ ngưỡng tại đó huỳnh quang vượt ngưỡng cố định, để so sánh với chu kỳ ngưỡng của mẫu chứng chuẩn từ đó suy ra Số lượng DNA mẫu đưa vào phản ứng) cho CMV DNA và CMV QS DNA.
Các giá trị chứng của CMV có nồng độ trong giới hạn được thực hiện đồng thời với mẫu bệnh phẩm để thiết lập đường chuẩn, cho thấy mối tương quan giữa giá trị Ct và số log cp/ml.
| Giá trị trên máy | Trả lời kết quả |
| Target Not Detected | Không phát hiện thấy CMV DNA |
| <1.50E+02 cp/ml | <1.50 x 102 cp/ml |
| ³ 1.50E+02 cp/ml đến £ 1.00E+07 cp/ml | nhận những kết quả trong giới hạn này ³ 1.50 x 102 cp/ml đến £ 1.00 x 107 cp/ml |
| >1.00E+07 cp/ml | >1.00 x 107 cp/ml |
| Invalid | Không giá trị , chạy lại mẫu |
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
Việc lấy mẫu máu, vận chuyển và bảo quản không đúng tiêu chuẩn có thể dẫn đến kết quả sai, cho dù phản ứng được thực hiện đúng.
Tham khảo thêm hướng dẫn của nhà sản xuất.
141. CMV Avidity
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Xác định ái tính của các kháng thể IgG kháng Cytomegalovirus trong huyết thanh và huyết tương.
2. Nguyên lý
Phát hiện kháng thể IgG kháng Cytomegalovirus bằng kỹ thuật miễn dịch điện hóa phát quang (CLIA) để xác định ái tính của các kháng thể IgG kháng Cytomegalovirus.
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện: Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: Cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Hệ thống máy miễn dịch tự động.
- Bộ lưu điện
- Máy ly tâm thường.
- Tủ lạnh 4 oC - 8 oC
- Tủ âm sâu (-20 oC hoặc -70 oC) (nếu có).
- Micropipette thể tích 50 µl - 200 µl
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
Thực hiện xét nghiệm 02 mẫu/lần
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Bông | Kg | 0,001 |
| 2 | Dây garô | Cái | 0,001 |
| 3 | Cồn | ml | 1,000 |
| 4 | Bơm kim tiêm | Cái | 1,000 |
| 5 | Panh | Cái | 0,0001 |
| 6 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 7 | Hộp vận chuyển bệnh phẩm | Cái | 0,001 |
| 3 | Tube đựng bệnh phẩm | Cái | 1,000 |
| 4 | Sinh phẩm chẩn đoán | Test | 1,000 |
| 5 | Khấu hao sinh phẩm cho chạy chuẩn | Test | 0,100 |
| 6 | Khấu hao sinh phẩm cho chạy chứng, kiểm tra chất lượng | Test | 1,000 |
| 7 | Chứng ngoại kiểm âm (nếu có) | ml | 0,010 |
| 8 | Chứng ngoại kiểm dương (nếu có) | ml | 0,010 |
| 9 | Chứng nội kiểm | Test | 0,100 |
| 10 | Ngoại kiểm (nếu có)* |
| 0,020 |
| 11 | Cleancell M | ml | 3,000 |
| 12 | Procell M | ml | 3,000 |
| 13 | Probe Wash M | ml | 2,000 |
| 14 | Preclean M | ml | 2,000 |
| 15 | Assay Tip/Cup E170 | Chiếc | 3,000 |
| 16 | ISE Cleaning Solution F. HIT | ml | 0,500 |
| 17 | Nước cất | ml | 5,000 |
| 18 | Sample cup | Cái | 1,000 |
| 19 | Giấy thấm | Cuộn | 0,100 |
| 20 | Giấy xét nghiệm | Tờ | 2,000 |
| 21 | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 22 | Bút viết kính | Cái | 0,020 |
| 23 | Bút bi | Cái | 0,010 |
| 24 | Mũ | Cái | 0,020 |
| 25 | Khẩu trang | Cái | 0,020 |
| 26 | Găng tay | Đôi | 0,100 |
| 27 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 28 | Quần áo bảo hộ | Bộ | 0,005 |
| 29 | Dung dịch nước rửa tay | ml | 8,000 |
| 30 | Cồn sát trùng tay nhanh | ml | 1,000 |
| 31 | Dung dịch khử trùng | ml | 10,000 |
| 32 | Khăn lau tay | Cái | 0,010 |
* Ghi chú: Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/50 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 3 lần/1 năm).
3. Bệnh phẩm
Huyết thanh hoặc huyết tương.
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu phiếu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
- Theo đúng quy định của chuyên ngành Vi sinh: xem chi tiết phụ lục 2.
- Từ chối những bệnh phẩm không đạt yêu cầu: xem chi tiết phụ lục 6.
2. Tiến hành kỹ thuật
Bộ sinh phẩm Elecsys CMV IgG Avidity (Roche) (VD)
| Các bước | Xét nghiệm xác định CMV IgG Avidity |
| 1 | Để Số lượng sinh phẩm cần dùng ở nhiệt độ phòng 30 phút trước khi làm xét nghiệm |
| 2 | Để tối ưu hiệu năng XN nên tuân theo tờ hướng dẫn kèm theo bộ thuốc thử |
| 3 | Tham khảo hướng dẫn vận hành cho từng XN đặc hiệu tương ứng |
| 4 | Thiết bị tự động trộn các vi hạt trước khi sử dụng |
| 5 | Máy đọc thông số đặc hiệu của XN trên mã vạch của thuốc thử, trong trường hợp ngoại lệ nếu máy không đọc được mã vạch hãy nhập chuỗi 15 con số vào |
| 6 | Đưa thuốc thử đang lạnh về nhiệt độ 200C và đặt vào khay thuốc thử trên máy phân tích, tránh tạo bọt, hệ thống sẽ tự động điều hòa nhiệt độ của thuốc thử và tự động đóng/mở nắp chai |
| 7 | Đặt mẫu chuẩn hoàn nguyên lên vùng đặt mẫu, máy phân tích tự động ghi nhận tất cả thông tin cần thiết cho việc chuẩn XN, sau khi hoàn thành chuẩn, lưu trữ cal1 và cal2 ở 2 oC - 8 oC hoặc loại bỏ chúng |
| 8 | Kiểm tra chất lượng: sử dụng Elecsys Precicontrol CMV IgG Avidity, chạy các mẫu chứng với nồng độ khác nhau ít nhất 1 lần cho mỗi 24 giờ khi XN vẫn đang sử dụng và sau mỗi lần chuẩn định |
IV. NHẬN ĐỊNH KẾT QUẢ
1. Đánh giá theo tiêu chuẩn nhà sản xuất
- Chạy kiểm tra chứng 1 và chứng 2 trên tất cả các điện cực dùng để chạy xét nghiệm.
- Giá trị chứng đạt được phải nằm trong khoảng giới hạn xác định.
2. Đánh giá theo tiêu chuẩn phòng xét nghiệm
Chứng nội kiểm, ngoại kiểm: Đánh giá kết quả dựa trên biểu đồ Levey-Jenning (nếu có).
3. Tính toán
- Máy phân tích tự động tính toán nồng độ chất phân tích trong mỗi mẫu đo dưới dạng U/ml
- Ái tính (Avi%) phải được tính toán thủ công:
Avi% = (kết quả đo xử lý DiLCMVAv (U/ml)/kết quả đo chứng (U/ml)) x 100%
Chỉ những mẫu cho phản ứng ở đo chứng (>= 1.0 U/ml) có thể dùng để xác định ái tính (Avi%)
Nếu kết quả đo xử lý DiLCMVAv cho giá trị < 0.3 U/ml hãy tính toán ái tính (Avi%) với 0.3 U/ml
2. Diễn giải kết quả
Kết quả thu được với XN Elecsys CMV IgG Avidity được diễn giải như sau:
| Ái tính | Diễn giải kết quả |
| < 45.0 Avi% | Ái tính thấp |
| 45.0-54.9 Avi% | Vùng xám |
| ≥ 55.0 Avi% | Ái tính cao |
- Nếu kết quả vùng xám, khuyến cáo lấy lại mẫu trong khoảng thời gian thích hợp (khoảng 2-4 tuần sau) → làm lại xét nghiệm.
Các kết quả Elecsys CMV IgG Avidity nên được sử dụng kết hợp với bệnh bệnh sử, thăm khám lâm sàng và các kết quả XN khác như CMV IgG, CMV IgM đặc hiệu.
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
- Máy sẽ báo sample short (bệnh phẩm đông hoặc không đủ). Chú ý ly tâm mẫu thật kỹ ngay từ đầu hoặc hút mẫu ra cup (thực hiện theo đúng yêu cầu của lấy mẫu xét nghiệm Vi sinh)
- Không sử dụng thuốc thử đã quá hạn sử dụng.
- Tránh tạo bọt ở lọ thuốc thử và các loại mẫu (bệnh phẩm, calibration và chứng).
- Các kết quả trên người bệnh HIV, người bệnh đang tham gia liệu pháp ức chế miễn dịch hay trên những người bệnh có các rối loạn khác dẫn đến ức chế miễn dịch thì nên thận trọng khi diễn giải kết quả
- Tham khảo thêm hướng dẫn của nhà sản xuất.
142. HSV 1 + 2 IgM miễn dịch bán tự động
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Phát hiện kháng thể IgM kháng herpes virus typ 1 và typ 2 trong huyết thanh hoặc huyết tương.
2. Nguyên lý
Phát hiện kháng thể IgM kháng herpes virus typ 1 và typ 2 dựa trên nguyên lý của kỹ thuật ELISA (miễn dịch gắn enzyme) (VD).
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: Cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2.Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Dàn máy ELISA
- Máy ly tâm thường
- Tủ lạnh 2 oC - 8 oC
- Tủ âm sâu (- 20 oC hoặc - 70 oC) (nếu có)
- Micropipette đơn kênh thể tích từ 10µl đến 1000µl.
- Bộ pipetman 8 kênh (nếu có)
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
Thực hiện xét nghiệm 04 mẫu/lần
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Bông | Kg | 0,001 |
| 2 | Dây garô | Cái | 0,001 |
| 3 | Cồn | ml | 1,000 |
| 4 | Bơm kim tiêm | Cái | 1,000 |
| 5 | Panh | Cái | 0,0001 |
| 6 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 7 | Hộp vận chuyển bệnh phẩm | Cái | 0,001 |
| 8 | Tube đựng bệnh phẩm | Cái | 2,000 |
| 9 | Sinh phẩm chẩn đoán | Test | 1,000 |
| 10 | Khấu hao sinh phẩm cho chạy chứng, kiểm tra chất lượng | Test | 1,000 |
| 11 | Chứng ngoại kiểm âm (nếu có) | ml | 0,030 |
| 12 | Chứng ngoại kiểm dương (nếu có) | ml | 0,030 |
| 13 | Ngoại kiểm (nếu có)* |
| 0,020 |
| 14 | Nước cất | ml | 8,000 |
| 15 | Đầu côn 1000 ml | Cái | 1,050 |
| 16 | Đầu côn 200 ml | Cái | 3,000 |
| 17 | Giấy thấm | Cuộn | 0,100 |
| 18 | Giấy xét nghiệm | Tờ | 2,000 |
| 19 | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 20 | Bút viết kính | Cái | 0,020 |
| 21 | Bút bi | Cái | 0,010 |
| 22 | Mũ | Cái | 0,020 |
| 23 | Khẩu trang | Cái | 0,020 |
| 24 | Găng tay | Đôi | 0,100 |
| 25 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 26 | Quần áo bảo hộ | Bộ | 0,005 |
| 27 | Dung dịch nước rửa tay | ml | 8,000 |
| 28 | Cồn sát trùng tay nhanh | ml | 1,000 |
| 29 | Dung dịch khử trùng | ml | 10,000 |
| 30 | Khăn lau tay | Cái | 0,010 |
* Ghi chú:
Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/50 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 3 lần/1 năm).
3. Bệnh phẩm
Huyết thanh hoặc huyết tương.
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
- Theo đúng quy định của chuyên ngành Vi sinh: xem chi tiết phụ lục 2.
- Từ chối những bệnh phẩm không đạt yêu cầu: xem chi tiết phụ lục 6.
2. Tiến hành kỹ thuật
Bộ sinh phẩm Platelia HSV 1 + 2 IgM - BioRad (VD)
| Các bước | Xét nghiệm định tính HSV IgM |
| 2.1 | Để Số lượng sinh phẩm cần dùng ở nhiệt độ phòng 30 phút trước khi làm xét nghiệm |
| 2.2 | Đánh số, sắp xếp bệnh phẩm và viết sơ đồ theo thứ tự. |
| 2.3 | Chuẩn bị dung dịch rửa |
| 2.4 | Chuẩn bị phức hợp miễ n dịch |
| 2.5 | Lấy đủ số giếng cần dùng và đặt vào giá. |
| 2.6 | Nhỏ chứng và mẫu huyết thanh người bệnh đã pha loãng |
| 2.7 | Đậy tấm và ủ |
| 2.8 | Rửa phiến nhựa. |
| 2.9 | Nhỏ chất cộng hợp vào mỗi giếng |
| 2.10 | Đậy tấm và ủ |
| 2.11 | Rửa phiến nhựa. |
| 2.12 | Nhỏ dung dịch hiện màu vào mỗi giếng |
| 2.13 | Ủ, không đậy tấm và tránh ánh sáng |
| 2.14 | Dừng phản ứng. |
| 2.15 | Đọc kết quả ở bước sóng 450 và 620nm. trong vòng 30 phút sau khi dừng phản ứng. |
IV. NHẬN ĐỊNH KẾT QUẢ
1. Điều kiện của phản ứng
- OD của giếng trống ≤ 0.150.
- OD của mỗi cut-off phải luôn trong khoảng 25% giá trị trung bình cut-off. Loại bỏ những giá trị bất thường và tính toán lại giá trị trung bình.
- OD của chứng dương ≥ 1,5 x OD cut-off
- Tỉ lệ OD chứng âm: OD cut-off < 0.6.
- OD cut-off ≥ 0.16 ở 450/620 nm.
2. Đánh giá theo tiêu chuẩn phòng xét nghiệm
Chứng nội kiểm, ngoại kiểm: Đánh giá kết quả dựa trên biểu đồ Levey-Jenning (nếu có)
3. Diễn giải kết quả
- Nếu OD của mẫu bệnh phẩm > OD của cut-off: mẫu bệnh phẩm dương tính với HSV-IgM.
- Tính toán tỉ lệ giữa giá trị OD mẫu và OD cut-off.
+ Dương tính: nếu tỉ lệ > 1.2
+ Nghi ngờ: nếu tỉ lệ nhỏ hơn hoặc lớn hơn 20% của cut-off
+ Âm tính: nếu tỉ lệ < 0.8
- Nếu kết quả nghi ngờ → làm lại xét nghiệm. Nếu vẫn nghi ngờ → yêu cầu lấy mẫu huyết thanh mới sau 2 - 3 tuần.
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
1. Sai sót
Có thể xảy ra hiện tượng âm tính giả hoặc dương tính giả, thông thường do:
- Thực hiện sai các bước trong quy trình hướng dẫn.
- Chứng âm và những mẫu bệnh phẩm âm tính bị nhiễm chéo bởi huyết thanh/ huyết tương có nồng độ kháng thể cao.
- Dung dịch cơ chất bị nhiễm bởi các tác nhân oxid hoá (thuốc tẩy, ion kim loại v.v…)
- Dung dịch dừng phản ứng bị nhiễm bẩn.
2. Xử trí
- Tuân thủ đúng các bước quy trình hướng dẫn của nhà sản xuất và hướng dẫn về độ ổn định hóa chất xét nghiệm trong bộ sinh phẩm sử dụng.
- Kiểm tra và vệ sinh máy rửa thường xuyên trước và sau khi làm xét nghiệm
- Chia hóa chất (chất cộng hợp, dung dịch hiện màu và dừng phản ứng) vào ống nghiệm sạch trước mỗi lần nhỏ.
143. HSV 1+ 2 IgG miễn dịch bán tự động
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Phát hiện kháng thể IgG kháng herpes virus typ 1 và typ 2 trong huyết thanh người.
2. Nguyên lý
Phát hiện kháng thể IgG kháng herpes virus typ 1 và typ 2 dựa trên nguyên lý của kỹ thuật ELISA (miễn dịch gắn enzyme) (VD).
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện: Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: Cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Dàn máy ELISA
- Máy ly tâm thường
- Tủ lạnh 2 oC - 8 oC
- Tủ âm sâu (- 20 oC hoặc - 70 oC) (nếu có)
- Micropipette đơn kênh thể tích từ 10µl đến 1000µl.
- Bộ pipetman 8 kênh (nếu có)
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
Thực hiện xét nghiệm 04 mẫu/lần
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Bông | Kg | 0,001 |
| 2 | Dây garô | Cái | 0,001 |
| 3 | Cồn | ml | 1,000 |
| 4 | Bơm kim tiêm | Cái | 1,000 |
| 5 | Panh | Cái | 0,0001 |
| 6 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 7 | Hộp vận chuyển bệnh phẩm | Cái | 0,001 |
| 8 | Tube đựng bệnh phẩm | Cái | 2,000 |
| 9 | Sinh phẩm chẩn đoán | Test | 1,000 |
| 10 | Khấu hao sinh phẩm cho chạy chứng, kiểm tra chất lượng | Test | 1,000 |
| 11 | Chứng ngoại kiểm âm (nếu có) | ml | 0,030 |
| 12 | Chứng ngoại kiểm dương (nếu có) | ml | 0,030 |
| 13 | Ngoại kiểm (nếu có)* |
| 0,020 |
| 14 | Nước cất | ml | 8,000 |
| 15 | Đầu côn 1000 µl | Cái | 1,050 |
| 16 | Đầu côn 200 µl | Cái | 3,000 |
| 17 | Giấy thấm | Cuộn | 0,100 |
| 18 | Giấy xét nghiệm | Tờ | 2,000 |
| 19 | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 20 | Bút viết kính | Cái | 0,020 |
| 21 | Bút bi | Cái | 0,010 |
| 22 | Mũ | Cái | 0,020 |
| 23 | Khẩu trang | Cái | 0,020 |
| 24 | Găng tay | Đôi | 0,100 |
| 25 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 26 | Quần áo bảo hộ | Bộ | 0,005 |
| 27 | Dung dịch nước rửa tay | ml | 8,000 |
| 28 | Cồn sát trùng tay nhanh | ml | 1,000 |
| 29 | Dung dịch khử trùng | ml | 10,000 |
| 30 | Khăn lau tay | Cái | 0,010 |
* Ghi chú: Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/50 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 3 lần/1 năm).
3. Bệnh phẩm
Huyết thanh hoặc huyết tương.
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
- Theo đúng quy định của chuyên ngành Vi sinh: xem chi tiết phụ lục 2.
- Từ chối những bệnh phẩm không đạt yêu cầu: xem chi tiết phụ lục 6.
2.Tiến hành kỹ thuật: Bộ sinh phẩm Platelia HSV 1 + 2 IgG - BioRad (VD)
| Các bước | Xét nghiệm định tính HSV IgG |
| 2.1 | Để Số lượng sinh phẩm cần dùng ở nhiệt độ phòng 30 phút trước khi làm xét nghiệm |
| 2.2 | Đánh số, sắp xếp bệnh phẩm và viết sơ đồ theo thứ tự. |
| 2.3 | Chuẩn bị dung dịch rửa |
| 2.4 | Chuẩn bị phức hợp miễn dịch. |
| 2.5 | Lấy đủ số giếng cần dùng và đặt vào giá. |
| 2.6 | Nhỏ chứng và mẫu huyết thanh người bệnh đã pha loãng |
| 2.7 | Đậy tấm và ủ |
| 2.8 | Rửa phiến nhựa |
| 2.9 | Nhỏ chất cộng hợp vào mỗi giếng |
| 2.10 | Đậy tấm và ủ |
| 2.11 | Rửa phiến nhựa. |
| 2.12 | Nhỏ dung dịch hiện màu vào mỗi giếng |
| 2.13 | Ủ, không đậy tấm và tránh ánh sáng |
| 2.14 | Dừng phản ứng. |
| 2.15 | Đọc kết quả ở bước sóng 450 và 620nm. trong vòng 30 phút sau khi dừng phản ứng. |
IV. NHẬN ĐỊNH KẾT QUẢ
1. Điều kiện của phản ứng
- OD của giếng trống ≤ 0.150.
- OD của mỗi cut-o ff phải luôn trong khoảng 25% giá trị trun g bình cut-off. Loại bỏ những giá trị bất thường và tính toán lại giá trị trung bình.
- OD của chứng dương ≥ 1,5 x OD cut-o ff
- Tỉ lệ giữa OD chứng âm và OD cut-off < 0.6.
- OD cut-off ≥ 0.16
2. Đánh giá theo tiêu chuẩn phòng xét nghiệm
Chứng nội kiểm, ngoại kiểm: Đánh giá kết quả dựa trên biểu đồ Levey-Jenning (nếu có)
3. Diễn giải kết quả
- Nếu OD của mẫu bệnh phẩm > OD của cut-off: mẫu bệnh phẩm dương tính với HSV IgG.
- Tính toán tỉ lệ giữa giá trị OD mẫu: OD cut-off.
+ Dương tính: nếu tỉ lệ > 1.2
+ Nghi ngờ: nếu tỉ lệ nhỏ hơn hoặc lớn hơn 20% của Cut-off
+ Âm tính: nếu tỉ lệ < 0.8
- Nếu kết quả nghi ngờ → làm lại xét nghiệm. Nếu vẫn nghi ngờ → yêu cầu lấy mẫu huyết thanh mới sau 2 - 3 tuần.
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
1. Sai sót
Có thể xảy ra hiện tượng âm tính giả hoặc dương tính giả, thông thường do:
- Thực hiện sai các bước trong quy trình hướng dẫn.
- Chứng âm và những mẫu bệnh phẩm âm tính bị nhiễm chéo bởi huyết thanh/ huyết tương có nồng độ kháng thể cao.
- Dung dịch cơ chất bị nhiễm bởi các tác nhân oxid hoá (thuốc tẩy, ion kim loại v.v…)
- Dung dịch dừng phản ứng bị nhiễm bẩn.
2. Xử trí
- Tuân thủ đúng các bước quy trình hướng dẫn của nhà sản xuất và hướng dẫn về độ ổn định hóa chất xét nghiệm trong bộ sinh phẩm sử dụng.
- Kiểm tra và vệ sinh máy rửa thường xuyên trước và sau khi làm xét nghiệm
- Chia hóa chất (chất cộng hợp, dung dịch hiện màu và dừng phản ứng) vào ống nghiệm sạch trước mỗi lần nhỏ.
144. HSV Real-time PCR
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Phát hiện DNA đặc trưng của virus herpes trong dịch não tủy, dịch vết loét hoặc mảnh sinh thiết.
2. Nguyên lý
Phát hiện DNA đặc trưng của virus herpes dựa trên nguyên lý của kỹ thuật real-time PCR.
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện: Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: Cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Máy real-time PCR và hệ thống máy vi tính.
- Bộ lưu điện
- Tủ an toàn sinh học cấp 2
- Máy ly tâm dùng cho tube 0,2ml
- Máy ly tâm 25000 x g
- Máy ủ nhiệt
- Máy vortex
- Tủ lạnh 2 oC - 8 oC
- Tủ âm sâu (- 20 oC hoặc -70 oC)
- Micropipette các thể tích từ 5 ml - 1000 ml.
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
Thực hiện xét nghiệm 02 mẫu/lần
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Bông | Kg | 0,001 |
| 2 | Bơm kim tiêm 10 ml | Cái | 1,000 |
| 3 | Lọ vô trùng | Cái | 1,000 |
| 4 | Cồn | ml | 1,000 |
| 5 | Panh | Cái | 0,0001 |
| 6 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 7 | Hộp vận chuyển bệnh phẩm | Cái | 0,001 |
| 8 | Găng không có bột tal | Đôi | 0,010 |
| 9 | Sinh phẩm chẩn đoán | Test | 1,000 |
| 10 | Khấu hao sinh phẩm cho chạy chứng, kiểm tra chất lượng | Test | 1,200 |
| 11 | Kit tách DNA | Test | 2,200 |
| 12 | Ngoại kiểm (nếu có)* |
| 0,020 |
| 13 | ống Falcol 50ml | Cái | 0,010 |
| 14 | Eppendorf 1,7ml | Tube | 2,200 |
| 15 | Eppendorf 0,2ml | Tube | 2,200 |
| 16 | Đầu côn 10 µl có lọc | Cái | 2,200 |
| 17 | Đầu côn 30 µl | Cái | 1,200 |
| 18 | Đầu côn 200 µl có lọc | Cái | 5,200 |
| 19 | Đầu côn 1 ml có lọc | Cái | 3,200 |
| 20 | Giấy thấm | Cuộn | 0,100 |
| 21 | Giấy xét nghiệm | Tờ | 2,000 |
| 22 | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 23 | Bút viết kính | Cái | 0,020 |
| 24 | Bút bi | Cái | 0,010 |
| 19 | Mũ | Cái | 0,020 |
| 21 | Khẩu trang | Cái | 0,020 |
| 22 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 23 | Quần áo bảo hộ | Bộ | 0,005 |
| 24 | Dung dịch nước rửa tay | ml | 8,000 |
| 25 | Cồn sát trùng tay nhanh | ml | 1,000 |
| 26 | Dung dịch khử trùng | ml | 10,000 |
| 27 | Khăn lau tay | Cái | 0,010 |
* Ghi chú: Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/50 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 3 lần/1 năm)..
3. Bệnh phẩm
Dịch não tủy, dịch vết loét, mảnh sinh thiết.
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
- Theo đúng quy định của chuyên ngành Vi sinh: xem chi tiết phụ lục 3.
- Từ chối những bệnh phẩm không đạt yêu cầu: xem chi tiết phụ lục 6.
2. Tiến hành kỹ thuật: Bộ sinh phẩm HSV rPCR Mix (VD)
2.1. Thu nhận và Xử lý mẫu
Phải đồng nhất và xử lý mẫu trước khi tách chiết DNA (nếu cần)
2.2. Tách chiết DNA
2.3. Thực hiện phản ứng real-time PCR
- Thực hiện bước này với các tube PCR mix được giữ trong khay lạnh hoặc đá đang tan.
- Chỉ lấy đủ số tube PCR mix cần
- Cho chứng +, chứng - hoặc dịch DNA tách chiết vào từng tube HSV rPCR Mix. Xong, đặt các tube vào máy real-time PCR.
- Khởi động máy real-time PCR. Khởi động máy tính và chương trình real- time PCR.
- Cài đặt vị trí mẫu “Plate setup” trên phần mềm đúng với vị trí mẫu đã đặt trên máy real-time PCR.
- Chọn màu “FAM” và “HEX” cho mẫu, chứng dương và chứng âm.
- Cài đặt chương trình “Protocol” cho máy real-time PCR hoạt động
- Lưu file dữ liệu vào máy tính
- Cho máy real-time PCR chạy chương trình.
IV. NHẬN ĐỊNH KẾT QUẢ
1. Điều kiện của phản ứng
- Chứng dương có đường biểu diễn tín hiệu huỳnh quang màu FAM tuyến tính vượt quá tín hiệu nền (đường biểu diễn dương tính) và đường biểu diễn tín hiệu huỳnh quang màu HEX dương tính hoặc thẳng và không vượt qua tín hiệu nền (đường biểu diễn âm tính).
- Chứng âm có đường biểu diễn tín hiệu huỳnh quang màu FAM âm tính và đường biểu diễn tín hiệu huỳnh quang màu HEX dương tính
2. Phân tích mẫu
- Mẫu dương tính: Mẫu có đường biểu diễn dương tính rõ ràng và bắt đầu từ chu kỳ 36 trở về trước.
- Mẫu nghi ngờ: Mẫu có đường biểu diễn dương tính và bắt đầu từ sau chu kỳ 36 → đề nghị lấy mẫu lại để thực hiện xét nghiệm hoặc thực hiện lại xét nghiệm sau 1-3 tháng.
- Mẫu âm tính: Mẫu có đường biểu diễn âm tính, chứng nội phải dương tính.
3. In đồ thị kết quả
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
Có mẫu và chứng nội cũng đều âm tính. Chứng bình thường, có mẫu dương, mẫu âm thật sự.
1. Nguyên nhân
Có thể mẫu âm thực sự, có thể phản ứng PCR bị ức chế.
2. Khắc phục
- Pha loãng mẫu từ 10-100 lần, thực hiện lại toàn bộ thí nghiệm từ bước tách chiết. Sau khi có kết quả phải nhân thêm với hệ số pha loãng mẫu. Nếu vẫn gặp sự cố trên, lấy lại mẫu theo đúng yêu cầu.
- Trừ những mẫu sự cố, tất cả các mẫu bình thường đều có thể lấy kết quả.
145. VZV Real-time PCR
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Xác định sự có mặt gen đặc trưng của Varicella zoster virus (VZV) trong dịch não tủy, dịch vết loét hoặc mảnh sinh thiết ở người.
2. Nguyên lý
Xác định gen đặc trưng của Varicella zoster virus (VZV) dựa trên nguyên lý của kỹ thuật real-time PCR.
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện: Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: Cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Máy real-time PCR và hệ thống máy vi tính.
- Bộ lưu điện
- Máy ủ nhiệt
- Máy ly tâm dùng cho tube 0,2ml
- Máy ly tâm 25000 x g
- Máy vortex
- Tủ an toàn sinh học cấp 2
- Tủ lạnh 2 oC - 8 oC
- Tủ âm sâu (- 20 oC hoặc -70 oC)
- Micropipette các thể tích từ 5 ml - 1000 ml.
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
Thực hiện xét nghiệm 02 mẫu/lần
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Tăm bông vô trùng | Cái | 1,000 |
| 2 | Tube đựng bệnh phẩm vô trùng | Cái | 1,000 |
| 3 | Găng không có bột tal | Đôi | 0,100 |
| 4 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 5 | Hộp vận chuyển bệnh phẩm | Cái | 0,001 |
| 6 | Sinh phẩm chẩn đoán | Test | 1,000 |
| 7 | Khấu hao sinh phẩm cho chạy chứng, kiểm tra chất lượng | Test | 1,200 |
| 8 | Kit tách DNA | Test | 2,200 |
| 9 | Ngoại kiểm (nếu có)* |
| 0,020 |
| 10 | ống Falcol 50 ml | Cái | 0,010 |
| 11 | Eppendorf 1,7 ml | Tube | 2,200 |
| 12 | Eppendorf 0,2 ml | Tube | 2,200 |
| 13 | Đầu côn 10 µl có lọc | Cái | 2,200 |
| 14 | Đầu côn 30 µl | Cái | 1,200 |
| 15 | Đầu côn 200 µl có lọc | Cái | 5,200 |
| 16 | Đầu côn 1 ml có lọc | Cái | 3,200 |
| 17 | Water-DEPC Treated | ml | 1,000 |
| 18 | Giấy thấm | Cuộn | 0,100 |
| 19 | Giấy xét nghiệm | Tờ | 2,000 |
| 20 | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 21 | Bút viết kính | Cái | 0,020 |
| 22 | Bút bi | Cái | 0,010 |
| 23 | Mũ | Cái | 0,020 |
| 24 | Khẩu trang | Cái | 0,020 |
| 25 | Găng tay không bột tal | Đôi | 0,100 |
| 26 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 27 | Quần áo bảo hộ | Bộ | 0,005 |
| 28 | Dung dịch nước rửa tay | ml | 8,000 |
| 29 | Cồn sát trùng tay nhanh | ml | 1,000 |
| 30 | Dung dịch khử trùng | ml | 10,000 |
| 31 | Khăn lau tay | Cái | 0,010 |
* Ghi chú: Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/50 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 2 lần/1 năm).
3. Bệnh phẩm
Dịch não tủy, dịch vết loét hoặc mảnh sinh thiết ...
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
- Theo đúng quy định của chuyên ngành Vi sinh: xem chi tiết phụ lục 3.
- Từ chối những bệnh phẩm không đạt yêu cầu: xem chi tiết phụ lục 6.
2. Tiến hành kỹ thuật
Bộ sinh phẩm Real-time PCR định tính Varicella zoster virus (VD)
2.1. Tách chiết DNA
Có thể dùng kit tách chiết DNA bằng hoá chất phenol/chloroform hoặc tách chiết bằng cột của các nhà sản xuất khác như Qiagen, Stratec, Roche...
2.2. Thực hiện phản ứng real-time PCR
- Thực hiện bước này với các tube PCR mix được giữ trong khay lạnh hoặc đá đang tan.
- Chỉ lấy đủ số tube PCR mix cần. Trước và sau khi đặt phản ứng PCR phải ly tâm tube để tất cả dung dịch nằm dước đáy tube.
- Cho chứng +, chứng - hoặc dịch DNA tách chiết vào từng tube VZV rPCR Mix. Xong, đặt các tube vào máy real-time PCR.
- Khởi động máy real-time PCR. Khởi động máy tính và chương trình real- time PCR.
- Cài đặt vị trí mẫu “Plate setup” trên phần mềm đúng với vị trí mẫu đã đặt trên máy real-time PCR.
- Chọn màu “CY5” và “HEX” cho mẫu, chứng dương và chứng âm.
- Cài đặt chương trình “Protocol” cho máy real-time PCR hoạt động
- Lưu file dữ liệu vào máy tính
- Cho máy real-time PCR chạy chương trình.
IV. NHẬN ĐỊNH KẾT QUẢ
1. Điều kiện của phản ứng
- Chứng dương có đường biểu diễn tín hiệu huỳnh quang màu CY5 dương tính và đường biểu diễn tín hiệu huỳnh quang màu HEX dương tính hoặc âm tính.
- Chứng âm có đường biểu diễn tín hiệu huỳnh quang màu CY5 âm tính và đường biểu diễn tín hiệu huỳnh quang màu HEX dương tính
2. Phân tích mẫu
- Những mẫu dương tính chỉ cần chọn màu CY5 để phân tích, không cần quan tâm đến chứng nội, chứng nội có thể dương hoặc âm.
- Những mẫu âm tính, chứng nội phải dương tính thì mới kết luận mẫu âm tính thật sự.
3. In đồ thị kết quả
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
Có mẫu và chứng nội cũng đều âm tính. Chứng bình thường, có mẫu dương, mẫu âm thật sự.
1. Nguyên nhân
Có thể mẫu âm thực sự, có thể phản ứng PCR bị ức chế.
2. Khắc phục
- Pha loãng mẫu từ 10-100 lần, thực hiện lại toàn bộ thí nghiệm từ bước tách chiết. Sau khi có kết quả phải nhân thêm với hệ số pha loãng mẫu. Nếu vẫn gặp sự cố trên, lấy lại mẫu theo đúng yêu cầu.
- Trừ những mẫu sự cố, tất cả các mẫu bình thường đều có thể lấy kết quả.
146. EBV-VCA IgM miễn dịch bán tự động
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Phát hiện kháng thể IgM kháng lại kháng nguyên vỏ capsid của Ebstein Barr Virus (Ebstein Barr Virus Viral Capsid Antigen - EBV VCA)
2. Nguyên lý
Phát hiện kháng thể IgM kháng EBV VCA dựa trên nguyên lý của kỹ thuật ELISA (miễn dịch gắn enzyme) (VD).
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: Cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Dàn máy ELISA
- Máy ly tâm thường
- Tủ lạnh 2 oC - 8 oC
- Tủ âm sâu (- 20 oC hoặc - 70 oC) (nếu có)
- Micropipette đơn kênh thể tích từ 10 µl đến 1000 µl.
- Bộ pipetman 8 kênh (nếu có)
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
Thực hiện xét nghiệm 02 mẫu/lần.
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Bông | Kg | 0,001 |
| 2 | Dây garô | Cái | 0,001 |
| 3 | Cồn | ml | 1,000 |
| 4 | Bơm kim tiêm | Cái | 1,000 |
| 5 | Panh | Cái | 0,0001 |
| 6 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 7 | Hộp vận chuyển bệnh phẩm | Cái | 0,001 |
| 8 | Tube đựng bệnh phẩm | Cái | 2,000 |
| 9 | Sinh phẩm chẩn đoán | Test | 1,000 |
| 10 | Khấu hao sinh phẩm cho chạy chứng, kiểm tra chất lượng | Test | 3,000 |
| 11 | Chứng ngoại kiểm âm (nếu có) | ml | 0,050 |
| 12 | Chứng ngoại kiểm dương (nếu có) | ml | 0,050 |
| 13 | Ngoại kiểm (nếu có)* |
| 0,020 |
| 14 | Nước cất | ml | 8,000 |
| 15 | Đầu côn 1000 µl | Cái | 2,000 |
| 16 | Đầu côn 200 µl | Cái | 6,000 |
| 17 | Giấy thấm | Cuộn | 0,100 |
| 18 | Giấy xét nghiệm | Tờ | 2,000 |
| 19 | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 20 | Bút viết kính | Cái | 0,020 |
| 21 | Bút bi | Cái | 0,010 |
| 22 | Mũ | Cái | 0,020 |
| 23 | Khẩu trang | Cái | 0,020 |
| 24 | Găng tay | Đôi | 0,100 |
| 25 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 26 | Quần áo bảo hộ | Bộ | 0,005 |
| 27 | Dung dịch nước rửa tay | ml | 8,000 |
| 28 | Cồn sát trùng tay nhanh | ml | 1,000 |
| 29 | Dung dịch khử trùng | ml | 10,000 |
| 30 | Khăn lau tay | Cái | 0,010 |
* Ghi chú: Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/50 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 3 lần/1 năm).
3. Bệnh phẩm
Huyết thanh hoặc huyết tương.
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
- Theo đúng quy định của chuyên ngành Vi sinh: xem chi tiết phụ lục 2.
- Từ chối những bệnh phẩm không đạt yêu cầu: xem chi tiết phụ lục 6.
2. Tiến hành kỹ thuật
Bộ sinh phẩm PlateliaTM EBV-VCA IgM - BioRad (VD)
| Các bước | Xét nghiệm định tính EBV VCA IgM |
| 2.1 | Để Số lượng sinh phẩm cần dùng ở nhiệt độ phòng 30 phút trước khi làm xét nghiệm |
| 2.2 | Đánh số, sắp xếp bệnh phẩm và viết sơ đồ theo thứ tự. |
| 2.3 | Chuẩn bị dung dịch rửa |
| 2.4 | Pha loãng chứng và mẫu bệnh phẩm |
| 2.5 | Lấy đủ số giếng cần dùng và đặt vào giá. |
| 2.6 | Nhỏ chứng và huyết thanh người bệnh đã pha loãng |
| 2.7 | Đậy tấm và ủ |
| 2.8 | Rửa |
| 2.9 | Nhỏ chất cộng hợp |
| 2.10 | Đậy tấm và ủ. |
| 2.11 | Rửa |
| 2.12 | Nhỏ dung dịch hiện màu |
| 2.13 | Ủ, không đậy tấm và tránh ánh sáng |
| 2.14 | Dừng phản ứng |
| 2.15 | Đọc kết quả ở bước sóng 450 và 620nm trong vòng 30 phút sau khi dừng phản ứng. |
IV. NHẬN ĐỊNH KẾT QUẢ
1. Tính độ hấp thụ trung bình
- Tính giá trị trung bình của các calibrator (CO trung bình). Loại bỏ những calibrator có giá trị lớn hơn giá trị trung bình 25 % và tính lại giá trị trung bình này.
- Yếu tố hiệu chính (Correction Factor-CF): Yếu tố này thay đổi ở mỗi lô hóa chất và được in trên lọ calibrator.
2. Giá trị ngưỡng (CO)
CO = CF x CO trung bình
3. Tính tỷ số tình trạng miễn dịch (Immune Status Ratio-ISR) cho mỗi bệnh phẩm
ISR = OD bệnh phẩm : OD CO
4. Điều kiện của phản ứng
- OD blank < 0,15
- OD chứng âm ≤ 0.25.
- OD calibrator ≥ 0,25
- OD chứng dương R4b ≥ 0 ,5
- ISR cho chứng âm, chứng dương I và chứng dương II phải nằm trong khoảng mong đợi của nhà sản xuất được in trên lọ hóa chất.
Nếu một trong các điều kiện trên không đạt, phải chạy lại xét nghiệm
5. Diễn giải kết quả
- Dương tính: nếu ISR ≥ 1.1
- Nghi ngờ: nếu 0.91 ≤ ISR ≤ 1.09 → làm lại xét nghiệm
- Âm tính: nếu ISR ≤ 0.90
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
1. Sai sót
Có thể xảy ra hiện tượng âm tính giả hoặc dương tính giả, thông thường do:
- Thực hiện sai các bước trong quy trình hướng dẫn.
- Chứng âm và những mẫu bệnh phẩm âm tính bị nhiễm chéo bởi huyết thanh/ huyết tương có nồng độ kháng thể cao.
- Dung dịch cơ chất bị nhiễm bởi các tác nhân oxid hoá (thuốc tẩy, ion kim loại v.v…)
- Dung dịch dừng phản ứng bị nhiễm bẩn.
2. Xử trí
- Tuân thủ đúng các bước quy trình hướng dẫn của nhà sản xuất và hướng dẫn về độ ổn định hóa chất xét nghiệm trong bộ sinh phẩm sử dụng.
- Kiểm tra và vệ sinh máy rửa thường xuyên trước và sau khi làm xét nghiệm
- Chia hóa chất (chất cộng hợp, dung dịch hiện màu và dừng phản ứng) vào ống nghiệm sạch trước mỗi lần nhỏ.
147. EBV-VCA IgG miễn dịch bán tự động
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Phát hiện kháng thể IgG kháng lại kháng nguyên vỏ capsid của Ebstein Barr Virus (Ebstein Barr Virus Viral Capsid Antigen - EBV VCA)
2. Nguyên lý
Phát hiện kháng thể IgG kháng EBV VCA dựa trên nguyên lý của kỹ thuật ELISA (miễn dịch gắn enzyme) (VD).
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: Cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Dàn máy ELISA
- Máy ly tâm thường
- Tủ lạnh 2 oC - 8 oC
- Tủ âm sâu (- 20 oC hoặc - 70 oC) (nếu có)
- Micropipette đơn kênh thể tích từ 10µl đến 1000µl.
- Bộ pipetman 8 kênh (nếu có)
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
Thực hiện xét nghiệm 02 mẫu/lần
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Bông | Kg | 0,001 |
| 2 | Dây garô | Cái | 0,001 |
| 3 | Cồn | ml | 1,000 |
| 4 | Bơm kim tiêm | Cái | 1,000 |
| 5 | Panh | Cái | 0,0001 |
| 6 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 7 | Hộp vận chuyển bệnh phẩm | Cái | 0,001 |
| 8 | Tube đựng bệnh phẩm | Cái | 2,000 |
| 9 | Sinh phẩm chẩn đoán | Test | 1,000 |
| 10 | Khấu hao sinh phẩm cho chạy chứng, kiểm tra chất lượng | Test | 3,000 |
| 11 | Chứng ngoại kiểm âm (nếu có) | ml | 0,050 |
| 12 | Chứng ngoại kiểm dương (nếu có) | ml | 0,050 |
| 13 | Ngoại kiểm (nếu có)* |
| 0,020 |
| 14 | Nước cất | ml | 8,000 |
| 15 | Đầu côn 1000 µl | Cái | 2,000 |
| 16 | Đầu côn 200 µl | Cái | 6,000 |
| 17 | Giấy thấm | Cuộn | 0,100 |
| 18 | Giấy xét nghiệm | Tờ | 2,000 |
| 19 | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 20 | Bút viết kính | Cái | 0,020 |
| 21 | Bút bi | Cái | 0,010 |
| 22 | Mũ | Cái | 0,020 |
| 23 | Khẩu trang | Cái | 0,020 |
| 24 | Găng tay | Đôi | 0,100 |
| 25 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 26 | Quần áo bảo hộ | Bộ | 0,005 |
| 27 | Dung dịch nước rửa tay | ml | 8,000 |
| 28 | Cồn sát trùng tay nhanh | ml | 1,000 |
| 29 | Dung dịch khử trùng | ml | 10,000 |
| 30 | Khăn lau tay | Cái | 0,010 |
* Ghi chú: Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/50 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 3 lần/1 năm).
3. Bệnh phẩm
Huyết thanh hoặc huyết tương.
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
Theo đúng quy định của chuyên ngành Vi sinh.
2. Tiến hành kỹ thuật: Bộ sinh phẩm PlateliaTM EBV-VCA IgG-BioRad (VD)
| Các bước | Xét nghiệm định tính EBV VCA IgG |
| 2.1 | Để Số lượng sinh phẩm cần dùng ở nhiệt độ phòng 30 phút trước khi làm xét nghiệm |
| 2.2 | Đánh số, sắp xếp bệnh phẩm và viết sơ đồ theo thứ tự. |
| 2.3 | Chuẩn bị dung dịch rửa |
| 2.4 | Pha loãng chứng và mẫu bệnh phẩm |
| 2.5 | Lấy đủ số giếng cần dùng và đặt vào giá. |
| 2.6 | Nhỏ chứng và mẫu huyết thanh người bệnh đã pha loãng |
| 2.7 | Đậy tấm và ủ |
| 2.8 | Rửa |
| 2.9 | Nhỏ chất cộng hợp |
| 2.10 | Đậy tấm và ủ |
| 2.11 | Rửa |
| 2.12 | Nhỏ dung dịch hiện màu |
| 2.13 | Ủ, không đậy tấm và tránh ánh sáng |
| 2.14 | Dừng phản ứng |
| 2.15 | Đọc kết quả ở bước sóng 450 và 620nm trong vòng 30 phút sau khi dừng phản ứng. |
IV. NHẬN ĐỊNH KẾT QUẢ
1. Tính độ hấp thụ trung bình
- Tính giá trị trung bình của các calibrator (CO trung bình). Loại bỏ những calibrator có giá trị lớn hơn giá trị trung bình 15 % và tính lại giá trị trung bình này.
- Yếu tố hiệu chính (Correction Factor -CF): Yếu tố này thay đổi ở mỗi lô hóa chất và được in trên lọ calibrator.
2. Giá trị ngưỡng (CO)
CO = CF x CO trung bình
3. Tính tỷ số tình trạng miễn dịch (Immune Status Ratio-ISR) cho mỗi bệnh phẩm
ISR = OD bệnh phẩm : OD CO
4. Điều kiện của phản ứng
- OD blank < 0,15
- OD chứng âm ≤ 0.25.
- OD calibrator ≥ 0,25
- OD chứng dương R4b ≥ 0 ,5
- ISR cho chứng âm, chứng dương I và chứng dương II phải nằm trong khoảng mong đợi của nhà sản xuất được in trên lọ hóa chất
Nếu một trong các điều kiện trên không đạt, phải chạy lại xét nghiệm
5. Diễn giải kết quả
- Dương tính: nếu ISR ≥ 1.1
- Nghi ngờ: nếu 0.91 ≤ ISR ≤ 1.09 → làm lại xét nghiệm.
- Âm tính: nếu ISR ≤ 0.90
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
1. Sai sót
Có thể xảy ra hiện tượng âm tính giả hoặc dương tính giả, thông thường do:
- Thực hiện sai các bước trong quy trình hướng dẫn.
- Chứng âm và những mẫu bệnh phẩm âm tính bị nhiễm chéo bởi huyết thanh/ huyết tương có nồng độ kháng thể cao.
- Dung dịch cơ chất bị nhiễm bởi các tác nhân oxid hoá (thuốc tẩy, ion kim loại v.v…)
- Dung dịch dừng phản ứng bị nhiễm bẩn.
2. Xử trí
- Tuân thủ đúng các bước quy trình hướng dẫn của nhà sản xuất và hướng dẫn về độ ổn định hóa chất xét nghiệm trong bộ sinh phẩm sử dụng.
- Kiểm tra và vệ sinh máy rửa thường xuyên trước và sau khi làm xét nghiệm
- Chia hóa chất (chất cộng hợp, dung dịch hiện màu và dừng phản ứng) vào ống nghiệm sạch trước mỗi lần nhỏ.
148. EBV EA-D IgG miễn dịch bán tự động
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Phát hiện kháng thể IgG kháng lại kháng nguyên sớm của Ebstein Barr Virus trong huyết thanh hoặc huyết tương người (Ebstein Barr Virus Early Antigen Diffuse - EBV EA-D)
2. Nguyên lý
Phát hiện kháng thể IgG kháng EBV EA-D dựa trên nguyên lý của kỹ thuật ELISA (miễn dịch gắn enzyme) (VD).
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện: Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: Cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Dàn máy ELISA
- Máy ly tâm thường
- Tủ lạnh 2 oC - 8 oC
- Tủ âm sâu (- 20 oC hoặc - 70 oC) (nếu có)
- Micropipette đơn kênh thể tích từ 10 µl đến 1000 µl.
- Bộ pipetman 8 kênh (nếu có)
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
Thực hiện xét nghiệm 02 mẫu/lần
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Bông | Kg | 0,001 |
| 2 | Dây garô | Cái | 0,001 |
| 3 | Cồn | ml | 1,000 |
| 4 | Bơm kim tiêm | Cái | 1,000 |
| 5 | Panh | Cái | 0,0001 |
| 6 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 7 | Hộp vận chuyển bệnh phẩm | Cái | 0,001 |
| 8 | Tube đựng bệnh phẩm | Cái | 2,000 |
| 9 | Sinh phẩm chẩn đoán | Test | 1,000 |
| 10 | Khấu hao sinh phẩm cho chạy chứng, kiểm tra chất lượng | Test | 3,000 |
| 11 | Chứng ngoại kiểm âm (nếu có) | ml | 0,050 |
| 12 | Chứng ngoại kiểm dương (nếu có) | ml | 0,050 |
| 13 | Ngoại kiểm (nếu có)* |
| 0,020 |
| 14 | Nước cất | ml | 8,000 |
| 15 | Đầu côn 1000 µl | Cái | 2,000 |
| 16 | Đầu côn 200 µl | Cái | 6,000 |
| 17 | Giấy thấm | Cuộn | 0,100 |
| 18 | Giấy xét nghiệm | Tờ | 2,000 |
| 19 | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 20 | Bút viết kính | Cái | 0,020 |
| 21 | Bút bi | Cái | 0,010 |
| 22 | Mũ | Cái | 0,020 |
| 23 | Khẩu trang | Cái | 0,020 |
| 24 | Găng tay | Đôi | 0,100 |
| 25 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 26 | Quần áo bảo hộ | Bộ | 0,005 |
| 27 | Dung dịch nước rửa tay | ml | 8,000 |
| 28 | Cồn sát trùng tay nhanh | ml | 1,000 |
| 29 | Dung dịch khử trùng | ml | 10,000 |
| 30 | Khăn lau tay | Cái | 0,001 |
* Ghi chú: Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/50 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 3 lần/1 năm).
3. Bệnh phẩm
Huyết thanh hoặc huyết tương.
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
- Theo đúng quy định của chuyên ngành Vi sinh: xem chi tiết phụ lục 2.
- Từ chối những bệnh phẩm không đạt yêu cầu: xem chi tiết phụ lục 6.
2. Tiến hành kỹ thuật: Bộ sinh phẩm PlateliaTM EBV EA-D IgG-BioRad (VD)
| Các bước | Xét nghiệm định tính EBV EA-D IgG |
| 2.1 | Để Số lượng sinh phẩm cần dùng ở nhiệt độ phòng 30 phút trước khi làm xét nghiệm |
| 2.2 | Đánh số, sắp xếp bệnh phẩm và viết sơ đồ theo thứ tự. |
| 2.3 | Chuẩn bị dung dịch rửa |
| 2.4 | Pha loãng chứng và mẫu bệnh phẩm |
| 2.5 | Lấy đủ số giếng cần dùng và đặt vào giá. |
| 2.6 | Nhỏ chứng và mẫu huyết thanh người bệnh đã pha loãng |
| 2.7 | Đậy tấm và ủ |
| 2.8 | Rửa |
| 2.9 | Nhỏ chất cộng hợp |
| 2.10 | Đậy tấm và ủ |
| 2.11 | Rửa |
| 2.12 | Nhỏ dung dịch hiện màu |
| 2.13 | Ủ, không đậy tấm và tránh ánh sáng |
| 2.14 | Nhỏ dung dịch dừng phản ứng |
| 2.15 | Đọc kết quả ở bước sóng 450 và 620nm trong vòng 30 phút sau khi dừng phản ứng. |
IV. NHẬN ĐỊNH KẾT QUẢ
1. Tính độ hấp thụ trung bình
- Tính giá trị trung bình của các calibrator (CO trung bình). Loại bỏ những calibrator có giá trị lớn hơn giá trị trung bình 15 % và tính lại giá trị trung bình này.
- Yếu tố hiệu chính (Correction Factor-CF): Yếu tố này thay đổi ở mỗi lô hóa chất và được in trên lọ calibrator.
2. Giá trị ngưỡng (CO)
CO = CF x CO trung bình
3. Tính tỷ số tình trạng miễn dịch (Immune Status Ratio-ISR) cho mỗi bệnh phẩm
ISR = OD bệnh phẩm: OD CO
4. Điều kiện của phản ứng
- OD blank < 0,15
- OD chứng âm ≤ 0.25.
- OD calibrator ≥ 0,25
- OD chứng dương R4b ≥ 0 ,5
- ISR cho chứng âm, chứng dương I và chứng dương II phải nằm trong khoảng mong đợi của nhà sản xuất được in trên lọ hóa chất
Nếu một trong các điều kiện trên không đạt, phải chạy lại xét nghiệm.
5. Diễn giải kết quả
- Dương tính: nếu ISR ≥ 1.1
- Nghi ngờ: nếu 0.91 ≤ ISR ≤ 1.09 → làm lại xét nghiệm.
- Âm tính: nếu ISR ≤ 0.90
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
1. Sai sót
Có thể xảy ra hiện tượng âm tính giả hoặc dương tính giả, thông thường do:
- Thực hiện sai các bước trong quy trình hướng dẫn.
- Chứng âm và những mẫu bệnh phẩm âm tính bị nhiễm chéo bởi huyết thanh/ huyết tương có nồng độ kháng thể cao.
- Dung dịch cơ chất bị nhiễm bởi các tác nhân oxid hoá (thuốc tẩy, ion kim loại v.v…)
- Dung dịch dừng phản ứng bị nhiễm bẩn.
2. Xử trí
- Tuân thủ đúng các bước quy trình hướng dẫn của nhà sản xuất và hướng dẫn về độ ổn định hóa chất xét nghiệm trong bộ sinh phẩm sử dụng.
- Kiểm tra và vệ sinh máy rửa thường xuyên trước và sau khi làm xét nghiệm
- Chia hóa chất (chất cộng hợp, dung dịch hiện màu và dừng phản ứng) vào ống nghiệm sạch trước mỗi lần nhỏ.
149. EBV EB-NA IgG miễn dịch bán tự động
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Phát hiện kháng thể IgG kháng lại kháng nguyên nhân của Ebstein-Barr virus trong huyết thanh hoặc huyết tương người (Ebstein-Barr Nuclear Antigen-1- EBV EB-NA-1)
2. Nguyên lý
Phát hiện kháng thể IgG kháng EBV EB-NA-1 dựa trên nguyên lý của kỹ thuật ELISA (miễn dịch gắn enzyme) (VD).
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện: Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: Cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Dàn máy ELISA
- Máy ly tâm thường
- Tủ lạnh 2 oC - 8 oC
- Tủ âm sâu (- 20 oC hoặc - 70 oC) (nếu có)
- Micropipette đơn kênh thể tích từ 10 µl đến 1000 µl.
- Bộ pipetman 8 kênh (nếu có)
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
Thực hiện xét nghiệm 01 mẫu/lần.
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Bông | Kg | 0,001 |
| 2 | Dây garô | Cái | 0,001 |
| 3 | Cồn | ml | 1,000 |
| 4 | Bơm kim tiêm | Cái | 1,000 |
| 5 | Panh | Cái | 0,0001 |
| 6 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 7 | Hộp vận chuyển bệnh phẩm | Cái | 0,001 |
| 8 | Tube đựng bệnh phẩm | Cái | 2,000 |
| 9 | Sinh phẩm chẩn đoán | Test | 1,000 |
| 10 | Khấu hao sinh phẩm cho chạy chứng, kiểm tra chất lượng | Test | 3,000 |
| 11 | Chứng ngoại kiểm âm (nếu có) | ml | 0,050 |
| 12 | Chứng ngoại kiểm dương (nếu có) | ml | 0,050 |
| 13 | Ngoại kiểm (nếu có)* |
| 0,020 |
| 14 | Nước cất | ml | 8,000 |
| 15 | Đầu côn 1000 µl | Cái | 2,000 |
| 16 | Đầu côn 200 µl | Cái | 6,000 |
| 17 | Giấy thấm | Cuộn | 0,100 |
| 18 | Giấy xét nghiệm | Tờ | 2,000 |
| 19 | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 20 | Bút viết kính | Cái | 0,020 |
| 21 | Bút bi | Cái | 0,010 |
| 22 | Mũ | Cái | 0,020 |
| 23 | Khẩu trang | Cái | 0,020 |
| 24 | Găng tay | Đôi | 0,100 |
| 25 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 26 | Quần áo bảo hộ | Bộ | 0,005 |
| 27 | Dung dịch nước rửa tay | ml | 8,000 |
| 28 | Cồn sát trùng tay nhanh | ml | 1,000 |
| 29 | Dung dịch khử trùng | ml | 10,000 |
| 30 | Khăn lau tay | Cái | 0,010 |
* Ghi chú: Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/50 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 3 lần/1 năm).
3. Bệnh phẩm
Huyết thanh hoặc huyết tương.
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
- Theo đúng quy định của chuyên ngành Vi sinh: xem chi tiết phụ lục 2.
- Từ chối những bệnh phẩm không đạt yêu cầu: xem chi tiết phụ lục 6.
2. Tiến hành kỹ thuật
Bộ sinh phẩm PlateliaTM EB-NA-1 IgG - BioRad (VD)
| Các bước | Xét nghiệm định tính EB-NA-1 IgG |
| 2.1 | Để Số lượng sinh phẩm cần dùng ở nhiệt độ phòng 30 phút trước khi làm xét nghiệm |
| 2.2 | Đánh số, sắp xếp bệnh phẩm và viết sơ đồ theo thứ tự. |
| 2.3 | Chuẩn bị dung dịch rửa |
| 2.4 | Pha loãng chứng và mẫu bệnh phẩm |
| 2.5 | Lấy đủ số giếng cần dùng và đặt vào giá. |
| 2.6 | Nhỏ chứng và mẫu huyết thanh người bệnh đã pha loãng |
| 2.7 | Đậy tấm và ủ |
| 2.8 | Rửa |
| 2.9 | Nhỏ chất cộng hợp |
| 2.10 | Đậy tấm và ủ |
| 2.11 | Rửa |
| 2.12 | Nhỏ dung dịch hiện màu |
| 2.13 | Ủ, không đậy tấm và tránh ánh sáng |
| 2.14 | Dừng phản ứng |
| 2.15 | Đọc kết quả ở bước sóng 450 và 620nm trong vòng 30 phút sau khi dừng phản ứng. |
IV. NHẬN ĐỊNH KẾT QUẢ
1. Tính độ hấp thụ trung bình
- Tính giá trị trung bình của các calibrator (CO trung bình). Loại bỏ những calibrator có giá trị lớn hơn giá trị trung bình 15 % và tính lại giá trị trung bình này.
- Yếu tố hiệu chính (Correction Factor-CF): Yếu tố này thay đổi ở mỗi lô hóa chất và được in trên lọ calibrator.
2. Giá trị ngưỡng (CO)
CO = CF x CO trung bình
3. Tính tỷ số tình trạng miễn dịch (Immune Status Ratio-ISR) cho mỗi bệnh phẩm
ISR = OD bệnh phẩm: OD CO
4. Điều kiện của phản ứng
- OD blank < 0,15
- OD chứng âm ≤ 0.25.
- OD calibrator ≥ 0,25
- OD chứng dương R4b ≥ 0 ,5
- ISR cho chứng âm, chứng dương I và chứng dương II phải nằm trong khoảng mong đợi của nhà sản xuất được in trên lọ hóa chất
Nếu một trong các điều kiện trên không đạt, phải chạy lại xét nghiệm
5. Diễn giải kết quả
+ Dương tính: nếu ISR ≥ 1.1
+ Nghi ngờ: nếu 0.91 ≤ ISR ≤ 1.09 → làm lại xét nghiệm
+ Âm tính: nếu ISR ≤ 0.90
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
1. Sai sót
Có thể xảy ra hiện tượng âm tính giả hoặc dương tính giả, thông thường do:
- Thực hiện sai các bước trong quy trình hướng dẫn.
- Chứng âm và những mẫu bệnh phẩm âm tính bị nhiễm chéo bởi huyết thanh/ huyết tương có nồng độ kháng thể cao.
- Dung dịch cơ chất bị nhiễm bởi các tác nhân oxid hoá (thuốc tẩy, ion kim loại v.v…)
- Dung dịch dừng phản ứng bị nhiễm bẩn.
2. Xử trí
- Tuân thủ đúng các bước quy trình hướng dẫn của nhà sản xuất và hướng dẫn về độ ổn định hóa chất xét nghiệm trong bộ sinh phẩm sử dụng.
- Kiểm tra và vệ sinh máy rửa thường xuyên trước và sau khi làm xét nghiệm
- Chia hóa chất (chất cộng hợp, dung dịch hiện màu và dừng phản ứng) vào ống nghiệm sạch trước mỗi lần nhỏ.
150. EBV PCR
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Phát hiện gen đặc trưng của Epstein-Barr virus trong máu, dịch não tủy và các loại dịch khác.
2. Nguyên lý
Xác định sự có mặt gen của gen đặc trưng cho Epstein-Barr virus (EBV) bằng kỹ thuật PCR.
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện: Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: Cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2. Phương tiện, hóa chất
2.1. Trang thiết bị
- Tủ an toàn sinh học cấp 2
- Máy PCR
- Bộ lưu điện
- Máy điện di
- Máy đọc điện di
- Máy ly tâm 25000 x g
- Máy ly tâm dùng cho tube 0,2 ml
- Máy ủ nhiệt
- Máy vortex
- Tủ lạnh 2 oC - 8 oC
- Tủ âm sâu (-20 oC hoặc -70 oC)
- Micropipette
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
Thực hiện xét nghiệm 02 mẫu/lần
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Bông | kg | 0,001 |
| 2 | Cồn | ml | 1,000 |
| 3 | Bơm kim tiêm | Cái | 1,000 |
| 4 | Panh | Cái | 0,0001 |
| 5 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 6 | Hộp vận chuyển bệnh phẩm | Test | 0,001 |
| 7 | Tube đựng bệnh phẩm | Cái | 2,000 |
| 8 | Găng không có bột | Đôi | 0,500 |
| 9 | Sinh phẩm chẩn đoán | Test | 1,000 |
| 10 | Khấu hao sinh phẩm cho chạy chứng và kiểm tra chất lượng | Test | 1,350 |
| 11 | Kit tách chiết DNA từ virus | Test | 2,350 |
| 12 | DNA marker | Bộ | 1,000 |
| 13 | Primer 1 | ml | 0,0001 |
| 14 | Primer 2 | ml | 0,0001 |
| 15 | Ống Eppendorf 1,5 ml | Tube | 3,000 |
| 16 | Ống Eppendorf 0,2 ml | Tube | 1,000 |
| 17 | Đầu côn 10 µl có lọc | Cái | 1,000 |
| 18 | Đầu côn 30 µl | Cái | 1,200 |
| 19 | Đầu côn 200 µl có lọc | Cái | 2,200 |
| 20 | Đầu côn 1 ml có lọc | Cái | 3,200 |
| 21 | Ethanol BDH | ml | 0,500 |
| 22 | Water-DEPC Treated | ml | 2,000 |
| 23 | Thạch | Gam | 0.075 |
| 24 | Ladder | ml | 0.0025 |
| 25 | Blue Juice Gel loading dye | ml | 0.003 |
| 26 | Ethidium Bromide | ml | 0.100 |
| 27 | TAE Buffer | ml | 0.100 |
| 28 | Giấy thấm | Cuộn | 0,100 |
| 29 | Giấy xét nghiệm | Tờ | 2,000 |
| 30 | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 31 | Bút viết kính | Cái | 0,020 |
| 32 | Bút bi | Cái | 0,010 |
| 33 | Mũ | Cái | 0,020 |
| 34 | Khẩu trang | Cái | 0,020 |
| 35 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 36 | Quần áo bảo hộ | Bộ | 0,005 |
| 37 | Dung dịch nước rửa tay | ml | 8,000 |
| 38 | Cồn sát trùng tay nhanh | ml | 1,000 |
| 39 | Dung dịch khử trùng | ml | 10,000 |
| 40 | Khăn lau tay | cái | 0,010 |
| 41 | Ngoại kiểm (nếu có)* |
| 0,020 |
* Ghi chú: Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/50 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 3 lần/1 năm).
3. Bệnh phẩm
Máu, dịch não tủy, các loại dịch khác, …
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu phiếu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
- Theo đúng quy định của chuyên ngành Vi sinh: xem chi tiết phụ lục 3.
- Từ chối những bệnh phẩm không đạt yêu cầu: xem chi tiết phụ lục 6.
2. Tiến hành kỹ thuật
2.1. Tách chiết DNA tổng số
2.2. Thực hiện phản ứng PCR
2.3. Điện di kiểm tra sản phẩm
2.4. Đánh giá và kết luận
IV. NHẬN ĐỊNH KẾT QUẢ
Sản phẩm PCR phải có một băng đặc hiệu duy nhất, rõ nét và không bị đứt gẫy và có kích thước tương ứng với thang DNA chuẩn.
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
Trong trường hợp không có sản phẩm PCR, cần phải kiểm tra lại quá trình tách chiết DNA tổng số, chất lượng primers và master mix và thực hiện lại toàn bộ xét nghiệm.
151. EBV Real-time PCR
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Phát hiện gen đặc trưng của Epstein-Barr virus (EBV) trong máu, dịch não tủy và các loại dịch khác.
2. Nguyên lý
Phát hiện gen đặc trưng của EBV dựa trên nguyên lý của kỹ thuật real time PCR.
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: Cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Máy real-time PCR và hệ thống máy vi tính.
- Bộ lưu điện
- Tủ an toàn sinh học cấp 2
- Máy ly tâm dùng cho tube 0,2ml
- Máy ly tâm 25000 x g
- Máy ủ nhiệt
- Máy vortex
- Tủ lạnh 2 oC - 8 oC
- Tủ âm sâu (- 20 oC hoặc -70 oC)
- Micropipette các thể tích từ 5 ml - 1000 ml.
2.2. Dụng cụ, hóa chất và vật tư tiêu hao
Thực hiện xét nghiệm 02 mẫu/lần.
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Bông | Kg | 0,001 |
| 2 | Dây garô | Cái | 0,001 |
| 3 | Cồn | ml | 1,000 |
| 4 | Bơm kim tiêm | Cái | 1,000 |
| 5 | Panh | Cái | 0,0001 |
| 6 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 7 | Hộp vận chuyển bệnh phẩm | Cái | 0,001 |
| 8 | Tube đựng bệnh phẩm | Cái | 1,000 |
| 9 | Găng không có bột tal | Đôi | 0,001 |
| 10 | Sinh phẩm chẩn đoán | Test | 1,000 |
| 11 | Khấu hao sinh phẩm cho chạy chứng, kiểm tra chất lượng | Test | 1,000 |
| 12 | Kit tách DNA | Test | 2,000 |
| 13 | Ngoại kiểm (nếu có)* |
| 0,020 |
| 14 | ống Falcol 50 ml | Cái | 0,010 |
| 15 | Eppendorf 1,7 ml | Tube | 2,200 |
| 16 | Eppendorf 0,2 ml | Tube | 2,200 |
| 17 | Đầu côn 10 µl có lọc | Cái | 2,200 |
| 18 | Đầu côn 30 µl | Cái | 1,200 |
| 19 | Đầu côn 200 µl có lọc | Cái | 5,200 |
| 20 | Đầu côn 1 ml có lọc | Cái | 3,200 |
| 25 | Ethanol BDH | ml | 2,000 |
| 26 | Water-DEPC Treated | ml | 1,000 |
| 27 | Giấy thấm | Cuộn | 0,100 |
| 28 | Giấy xét nghiệm | Tờ | 2,000 |
| 29 | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 30 | Bút viết kính | Cái | 0,020 |
| 31 | Bút bi | Cái | 0,010 |
| 32 | Mũ | Cái | 0,020 |
| 33 | Khẩu trang | Cái | 0,020 |
| 34 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 35 | Quần áo bảo hộ | Bộ | 0,005 |
| 36 | Dung dịch nước rửa tay | ml | 8,000 |
| 37 | Cồn sát trùng tay nhanh | ml | 1,000 |
| 38 | Dung dịch khử trùng | ml | 10,000 |
| 39 | Khăn lau tay | Cái | 0,010 |
* Ghi chú: Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/50 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 3 lần/1 năm).
3. Bệnh phẩm
Mảnh sinh thiết hoặc máu toàn phần chống đông EDTA, dịch não tủy, các loại dịch khác....
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
- Theo đúng quy định của chuyên ngành Vi sinh: xem chi tiết phụ lục 3.
- Từ chối những bệnh phẩm không đạt yêu cầu: xem chi tiết phụ lục 6.
2. Tiến hành kỹ thuật: Bộ sinh phẩm EBV Real-time PCR (VD)
2.1. Tách chiết DNA
2.2. Thực hiện phản ứng real-time PCR
- Thực hiện bước này với các tube PCR mix được giữ trong khay lạnh hoặc đá đang tan.
- Chỉ lấy đủ số tube PCR mix cầnTrước và sau khi đặt phản ứng PCR phải ly tâm tube để tất cả dung dịch nằm dước đáy tube.
- Cho chứng +, chứng - hoặc dịch DNA tách chiết vào từng tube EBV rPCR Mix. Xong, đặt các tube vào máy real-time PCR.
- Khởi động máy real-time PCR. Khởi động máy tính và chương trình real- time PCR.
- Cài đặt vị trí mẫu “Plate setup” trên phần mềm đúng với vị trí mẫu đã đặt trên máy real-time PCR.
- Chọn màu “FAM” và “HEX” cho mẫu, chứng dương và chứng âm.
- Cài đặt chương trình “Protocol” cho máy real-time PCR hoạt động
- Lưu file dữ liệu vào máy tính
- Cho máy real-time PCR chạy chương trình.
IV. NHẬN ĐỊNH KẾT QUẢ
1. Điều kiện của phản ứng
- Chứng dương có đường biểu diễn tín hiệu huỳnh quang màu FAM tuyến tính vượt quá tín hiệu nền (đường biểu diễn dương tính) và đường biểu diễn tín hiệu huỳnh quang màu HEX dương tính hoặc thẳng và không vượt qua tín hiệu nền (đường biểu diễn âm tính).
- Chứng âm có đường biểu diễn tín hiệu huỳnh quang màu FAM âm tính và đường biểu diễn tín hiệu huỳnh quang màu HEX dương tính
2. Phân tích mẫu
- Mẫu có đường biểu diễn dương tính rõ ràng và bắt đầu từ chu kỳ 36 trở về trước, kết luận “Mẫu dương tính”.
- Mẫu có đường biểu diễn dương tính và bắt đầu từ sau chu kỳ 36, kết luận “Mẫu nghi ngờ” và đề nghị lấy mẫu lại để thực hiện xét nghiệm hoặc thực hiện lại xét nghiệm sau 1-3 tháng.
- Mẫu có đường biểu diễn âm tính, kết luận “Không tìm thấy virus trong mẫu”. Những mẫu âm tính, chứng nội phải dương tính thì mới kết luận mẫu âm tính thật sự.
3. In đồ thị kết quả
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
Có mẫu và chứng nội cũng đều âm tính. Chứng bình thường, có mẫu dương, mẫu âm thật sự.
1. Nguyên nhân
Có thể mẫu âm thực sự, có thể phản ứng PCR bị ức chế.
2. Khắc phục
- Pha loãng mẫu từ 10-100 lần, thực hiện lại toàn bộ thí nghiệm từ bước tách chiết. Sau khi có kết quả phải nhân thêm với hệ số pha loãng mẫu. Nếu vẫn gặp sự cố trên, lấy lại mẫu theo đúng yêu cầu.
- Trừ những mẫu sự cố, tất cả các mẫu bình thường đều có thể lấy kết quả.
152. EV71 PCR
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Phát hiện gen đặc trưng của Enterovirus 71 (EV 71) trong các loại dịch tiết đường hô hấp, các loại dịch khác và phân.
2. Nguyên lý
Sử dụng cặp mồi đặc hiệu để xác định sự có mặt của gen đặc trưng cho Enterovirus 71 bằng kỹ thuật OneStep RT-PCR.
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: Cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Tủ an toàn sinh học cấp 2.
- Máy PCR
- Máy điện di
- Máy đọc điện di
- Máy ly tâm 25000 x g
- Máy ly tâm dùng cho tube 0,2 ml
- Máy ủ nhiệt
- Máy vortex
- Bộ lưu điện
- Tủ lạnh 2 oC - 8 oC
- Micropipette
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
Thực hiện xét nghiệm 02 mẫu/lần.
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Bông | kg | 0,001 |
| 2 | Cồn | ml | 1,000 |
| 3 | Bơm kim tiêm | Cái | 1,000 |
| 4 | Panh | Cái | 0,0001 |
| 5 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 6 | Hộp vận chuyển bệnh phẩm | Test | 0,001 |
| 7 | Tube đựng bệnh phẩm | Cái | 2,000 |
| 8 | Găng không có bột | Đôi | 0,500 |
| 9 | Sinh phẩm chẩn đoán | Test | 1,000 |
| 10 | Khấu hao sinh phẩm cho chạy chứng và kiểm tra chất lượng | Test | 1,350 |
| 11 | Kit tách chiết RNA từ virus | Test | 2,350 |
| 12 | Primer 1 | ml | 0,0001 |
| 13 | Primer 2 | ml | 0,0001 |
| 14 | Ống Eppendorf 1,5 ml | Tube | 3,000 |
| 15 | Ống Eppendorf 0,2 ml | Tube | 1,000 |
| 16 | Đầu côn 10 µl có lọc | Cái | 1,000 |
| 17 | Đầu côn 30 µl có lọc | Cái | 1,200 |
| 18 | Đầu côn 200 µl có lọc | Cái | 2,200 |
| 19 | Đầu côn 1 ml có lọc | Cái | 3,200 |
| 20 | Ethanol BDH | ml | 0,500 |
| 21 | Water-DEPC Treated | ml | 2,000 |
| 22 | Thạch | Gam | 0.075 |
| 23 | Ladder | ml | 0.0025 |
| 24 | Blue Juice Gel loading dye | ml | 0.003 |
| 25 | Ethidium Bromide | ml | 0.100 |
| 26 | TAE Buffer | ml | 0.100 |
| 27 | Giấy thấm | Cuộn | 0,100 |
| 28 | Giấy xét nghiệm | Tờ | 2,000 |
| 29 | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 30 | Bút viết kính | Cái | 0,020 |
| 31 | Bút bi | Cái | 0,010 |
| 32 | Mũ | Cái | 0,020 |
| 33 | Khẩu trang | Cái | 0,020 |
| 34 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 36 | Quần áo bảo hộ | Bộ | 0,005 |
| 37 | Dung dịch nước rửa tay | ml | 8,000 |
| 38 | Cồn sát trùng tay nhanh | ml | 1,000 |
| 39 | Dung dịch khử trùng | ml | 10,000 |
| 40 | Khăn lau tay | cái | 0,010oại |
| 41 | Ngoại kiểm (nếu có)* |
| 0,020 |
* Ghi chú: Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/50 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 3 lần/1 năm).
3. Bệnh phẩm
Dịch hầu họng, dịch đường hô hấp, phân, các loại dịch khác, …
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu phiếu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
- Theo đúng quy định của chuyên ngành Vi sinh: xem chi tiết phụ lục 3.
- Từ chối những bệnh phẩm không đạt yêu cầu: xem chi tiết phụ lục 6.
2. Tiến hành kỹ thuật
2.1. Tách chiết RNA tổng số
2.2. Thực hiện phản ứng RT-PCR
2.3. Thực hiện phản ứng PCR
2.4. Điện di kiểm tra sản phẩm
2.5. Đánh giá và kết luận
IV. NHẬN ĐỊNH KẾT QUẢ
Sản phẩm PCR phải có một băng đặc hiệu duy nhất, rõ nét và không bị đứt gẫy và có kích thước tương ứng với thang DNA chuẩn.
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
Trong trường hợp không có sản phẩm PCR, cần phải kiểm tra lại quá trình tách chiết RNA tổng số, chất lượng primers và master mix, và thực hiện lại toàn bộ xét nghiệm.
153. EV71 Real-time PCR
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Phát hiện gen đặc trưng của Enterovirus 71 (EV71) từ bệnh phẩm dịch não tủy, phết họng, phết trực tràng.
2. Nguyên lý
Phát hiện gen đặc trưng của Enterovirus 71 dựa trên nguyên lý của kỹ thuật real-time RT-PCR.
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện: Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: Cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2. Phương tiện, hóa chất
2.1. Trang thiết bị
- Máy realime PCR và hệ thống máy vi tính
- Bộ lưu điện
- Tủ an toàn sinh học cấp 2
- Máy ly tâm dùng cho tube 0,2ml
- Máy ly tâm 25000 x g
- Máy ủ nhiệt
- Máy vortex
- Tủ lạnh 2 oC - 8 oC
- Tủ âm sâu (-20 oC hoặc -70 oC)
- Micropipette các thể tích từ 5 µl -1000 µl
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
Thực hiện xét nghiệm 02 mẫu /lần.
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Tăm bông vô trùng | kg | 0,001 |
| 2 | Găng không bột tal | cái | 0,500 |
| 3 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 4 | Hộp vận chuyển bệnh phẩm | Test | 0,001 |
| 5 | Sinh phẩm chẩn đoán | Test | 1,000 |
| 6 | Khấu hao sinh phẩm cho chạy | Test | 1,200 |
|
| chứng, kiểm tra chất lượng |
|
|
| 7 | Kit tách chiết DNA | Test | 2,200 |
| 8 | Ngoại kiểm (nếu có)* |
| 0,020 |
| 9 | Ống Falcol 50 ml | Cái | 0,010 |
| 10 | Eppendorf 1,7 ml | Tube | 2,200 |
| 11 | Eppendorf 0,2 ml | Tube | 2,200 |
| 12 | Đầu côn 10 µl có lọc | Cái | 1,000 |
| 13 | Đầu côn 30 µl | Cái | 1,200 |
| 14 | Đầu côn 200 µl có lọc | Cái | 5,200 |
| 15 | Đầu côn 1ml có lọc | Cái | 3,200 |
| 16 | Water-DEPC treated | ml | 1,000 |
| 17 | Giấy thấm | Cuộn | 0,100 |
| 18 | Giấy xét nghiệm | Tờ | 2,000 |
| 19 | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 20 | Bút viết kính | Cái | 0,020 |
| 21 | Bút bi | Cái | 0,010 |
| 22 | Mũ | Cái | 0,020 |
| 23 | Khẩu trang | Cái | 0,020 |
| 24 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 25 | Quần áo bảo hộ | Bộ | 0,005 |
| 26 | Dung dịch nước rửa tay | ml | 8,000 |
| 27 | Cồn sát trùng tay nhanh | ml | 1,000 |
| 28 | Dung dịch khử trùng | ml | 10,000 |
| 29 | Khăn lau tay | Cái | 0,010 |
* Ghi chú:
Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/50 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 3 lần/1 năm).
3. Bệnh phẩm
Dịch não tủy, phết họng, phết trực tràng
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
1. Lấy bệnh phẩm
- Theo đúng quy định của chuyên ngành Vi sinh: xem chi tiết phụ lục 3.
- Từ chối những bệnh phẩm không đạt yêu cầu: xem chi tiết phụ lục 6.
2. Tiến hành kỹ thuật: Bộ sinh phẩm EV/EV71 RT TQ PCR Kit (VD)
2.1. Thu nhận mẫu
Thu nhận mẫu và lưu mẫu trước khi tách chiết theo quy định
2.2. Tách chiết RNA
Tách chiết RNA tổng số
2.3.Tổng hợp cDNA
Thực hiện phản ứng RT với mồi ngẫu nhiên phiên mã ngược RNA trong dịch tách chiết RNA
2.4. Thực hiện phản ứng real-time PCR
- Thực hiện bước này với các tube PCR mix được giữ trong khay đá lạnh hoặc đá đang tan.
- Chỉ lấy đủ số tube PCR mix cần. Trước và sau khi đặt phản ứng PCR phải ly tâm tube để tất cả dung dịch nằm dưới đáy tube.
- Cho chứng dương và chứng âm hoặc dịch DNA tách chiết vào từng tube EV/EV 71 rPCR mix. Xong đặt các tube vào máy real-time PCR.
- Khởi động máy real-time PCR. Khởi động máy tính và chương trình Real-time PCR.
- Cài đặt vị trí mẫu “Plate setup” trên phần mềm đúng với vị trí mẫu đạt trên máy real-time PCR
- Chọn màu “FAM” , “HEX” cho mẫu, chứng dương và chứng âm
- Cài đặt chương trình “Protocol” cho máy real-time PCR hoạt động.
- Lưu file dữ liệu vào máy tính
- Cho máy real-time PCR chạy chương trình
IV. NHẬN ĐỊNH KẾT QUẢ
1. Điều kiện của phản ứng
- Chứng dương có đường biểu diễn tín hiệu huỳnh quang màu FAM và màu HEX tuyến tính vượt quá tín hiệu nền (đường biểu diễn dương tính)
- Chứng âm có đường biểu diễn tín hiệu huỳnh quang màu FAM và màu HEX âm tính
- Chứng nội tại có đường biểu diễn tín hiệu huỳnh quang màu FAM dương tính
2. Phân tích mẫu
- Mẫu dương tính EV: Mẫu có đường biểu diễn dương tính rõ ràng với màu của từng tác nhân và bắt đầu từ chu kỳ 40 trở về trước.
- Mẫu nghi ngờ: Mẫu có đường biểu diễn dương tính và bắt đầu sau chu kỳ 40, đề nghị lấy mẫu lại để thực hiện xét nghiệm.
- Mẫu âm tính: Mẫu có đường biểu diễn âm tính, chứng nội phải dương tính.
4. In đồ thị kết quả
V. NHỮNG SAI SÓT CẦN XỬ TRÍ
Có mẫu và chứng nội cũng đều âm tính. Chứng bình thường, có mẫu dương, mẫu âm thật sự.
1. Nguyên nhân: Có thể mẫu âm thật sự, có thể phản ứng PCR bị ức chế
2. Khắc phục
- Pha loãng mẫu từ 10-100 lần, thực hiện lại toàn bộ thí nghiệm từ bước tách chiết. Sau khi có kết quả phải nhân thêm với hệ số pha loãng mẫu. Nếu vẫn gặp sự cố trên, lấy lại mẫu theo đúng yêu cầu.
- Trừ những mẫu sự cố, tất cả các mẫu bình thường đều có thể lấy kết quả.
154. EV71 genotype giải trình tự gene
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Xác định trình tự nucleotide đặc trưng cho từng genotype của Enterovirus 71 (EV 71) trong các loại dịch tiết đường hô hấp, các loại dịch khác và phân.
2. Nguyên lý
Xác định trình tự nucleotide đặc trưng cho từng genotype của EV71 bằng kỹ thuật giải trình tự gen.
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: Cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Tủ an toàn sinh học cấp 2
- Máy PCR
- Máy điện di
- Máy đọc điện di
- Máy giải trình tự gen
- Máy ly tâm 25000 x g
- Máy ly tâm dùng cho tube 0,2 ml
- Máy ủ nhiệt
- Máy vortex
- Bộ lưu điện
- Tủ lạnh 2 oC - 8 oC
- Tủ âm sâu (-20 oC hoặc -70 oC)
- Micropipette
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
Thực hiện xét nghiệm 02 mẫu/lần
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Bông | kg | 0,001 |
| 2 | Cồn | ml | 1,000 |
| 3 | Bơm kim tiêm | Cái | 1,000 |
| 4 | Panh | Cái | 0,0001 |
| 5 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 6 | Hộp vận chuyển bệnh phẩm | Test | 0,001 |
| 7 | Tube đựng bệnh phẩm | Cái | 2,000 |
| 8 | Găng không có bột | Cái | 0,500 |
| 9 | Sinh phẩm chẩn đoán | Test | 1,000 |
| 10 | Khấu hao sinh phẩm cho chạy chứng và kiểm tra chất lượng | Test | 1,350 |
| 11 | Kit tách chiết RNA từ virus | Test | 2,350 |
| 12 | DNA marker | Bộ | 1,000 |
| 13 | Primer 1 (primer đặc hiệu) | ml | 0,0001 |
| 14 | Primer 2 (primer đặc hiệu) | ml | 0,0001 |
| 15 | Primer 3 (primer đặc hiệu) | ml | 0,0001 |
| 16 | Primer 4 (primer đặc hiệu) | ml | 0,0001 |
| 17 | Ống Eppendorf 1,5 ml | Tube | 3,000 |
| 18 | Ống Eppendorf 0,2 ml | Tube | 1,000 |
| 19 | Đầu côn 10 µl có lọc | Cái | 1,000 |
| 20 | Đầu côn 30 µl | Cái | 1,200 |
| 21 | Đầu côn 200 µl có lọc | Cái | 2,200 |
| 22 | Đầu côn 1 ml có lọc | Cái | 3,200 |
| 23 | Ethanol BDH | ml | 0,500 |
| 24 | Water-DEPC Treated | ml | 2,000 |
| 25 | Thạch | Gam | 0.075 |
| 26 | Ladder | ml | 0.0025 |
| 27 | Blue Juice Gel loading dye | ml | 0.003 |
| 28 | Ethidium Bromide | ml | 0.100 |
| 29 | TAE Buffer | ml | 0.100 |
| 30 | Giấy thấm | Cuộn | 0,100 |
| 31 | Giấy xét nghiệm | Tờ | 2,000 |
| 32 | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 33 | Bút viết kính | Cái | 0,020 |
| 34 | Bút bi | Cái | 0,010 |
| 35 | Mũ | Cái | 0,020 |
| 36 | Khẩu trang | Cái | 0,020 |
| 37 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 38 | Quần áo bảo hộ | Bộ | 0,005 |
| 39 | Dung dịch nước rửa tay | ml | 8,000 |
| 40 | Cồn sát trùng tay nhanh | ml | 1,000 |
| 41 | Dung dịch khử trùng | ml | 10,000 |
| 42 | Khăn lau tay | cái | 0,010 |
| 43 | Ngoại kiểm (nếu có)* |
| 0,020 |
* Ghi chú: Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/50 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 3 lần/1 năm).
3. Bệnh phẩm
Dịch hầu họng, dịch đường hô hấp, phân, và các loại dịch khác…
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu phiếu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
- Theo đúng quy định của chuyên ngành Vi sinh: xem chi tiết phụ lục 3.
- Từ chối những bệnh phẩm không đạt yêu cầu: xem chi tiết phụ lục 6.
2. Tiến hành kỹ thuật
2.1. Tách chiết RNA tổng số
2.2. Thực hiện phản ứng RT-PCR
2.3. Thực hiện phản ứng PCR
2.4. Điện di kiểm tra sản phẩm
2.5. Giải trình tự gen
2.6. Kiểm tra và so sánh trình tự gen của EV71 trên ngân hàng dữ liệu gen quốc tế
IV. NHẬN ĐỊNH KẾT QUẢ
Sản phẩm PCR phải có một băng đặc hiệu duy nhất, rõ nét và không bị đứt gẫy. Trình tự DNA của gen đích không bị nhiễu và phải có độ tương đồng ≥ 90 % mới có thể kết luận được genotype của EV71
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
- Trong trường hợp không có sản phẩm PCR, cần phải kiểm tra lại quá trình tách chiết RNA tổng số, chất lượng primers và master mix, và thực hiện lại toàn bộ xét nghiệm.
- Nếu trình tự DNA bị nhiễu cần phải kiểm tra lại độ đặc hiệu của sản phẩm PCR hoặc quá trình chạy PCR sequencing bị nhiễm chéo.
155. Enterovirus PCR
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Phát hiện gen đặc trưng của Enterovirus trong các loại bệnh phẩm phân, đờm, dịch phế quản….
2. Nguyên lý
Sử dụng cặp mồi đặc hiệu để xác định sự có mặt gen đặc trưng của Enterovirus bằng kỹ thuật OneStep RT-PCR.
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Tủ an toàn sinh học cấp 2
- Máy PCR
- Máy điện di
- Máy đọc điện di
- Máy ly tâm 25000 x g
- Máy ly tâm dùng cho tube 0,2 ml
- Máy ủ nhiệt
- Máy vortex
- Bộ lưu điện
- Tủ lạnh 2 oC - 8 oC
- Tủ âm sâu (-20 oC hoặc -70 oC)
- Micropipette
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
Thực hiện xét nghiệm 02 mẫu/lần
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Bông | kg | 0,001 |
| 2 | Cồn | ml | 1,000 |
| 3 | Bơm kim tiêm | Cái | 1,000 |
| 4 | Panh | Cái | 0,0001 |
| 5 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 6 | Hộp vận chuyển bệnh phẩm | Test | 0,001 |
| 7 | Tube đựng bệnh phẩm | Cái | 2,000 |
| 8 | Găng không có bột | Đôi | 0,500 |
| 9 | Sinh phẩm chẩn đoán | Test | 1,000 |
| 10 | Khấu hao sinh phẩm cho chạy chứng và kiểm tra chất lượng | Test | 1,350 |
| 11 | Kit tách chiết RNA từ virus | Test | 2,350 |
| 12 | DNA marker | Bộ | 1,000 |
| 13 | Primer 1 | ml | 0,0001 |
| 14 | Primer 2 | ml | 0,0001 |
| 15 | Ống Eppendorf 1,5 ml | Tube | 3,000 |
| 16 | Ống Eppendorf 0,2 ml | Tube | 1,000 |
| 17 | Đầu côn 10 µl có lọc | Cái | 1,000 |
| 18 | Đầu côn 30 µl | Cái | 1,200 |
| 19 | Đầu côn 200 µl có lọc | Cái | 2,200 |
| 20 | Đầu côn 1 ml có lọc | Cái | 3,200 |
| 21 | Ethanol BDH | ml | 0,500 |
| 22 | Water-DEPC Treated | ml | 2,000 |
| 23 | Thạch | Gam | 0.075 |
| 24 | Ladder | ml | 0.0025 |
| 25 | Blue Juice Gel loading dye | ml | 0.003 |
| 26 | Ethidium Bromide | ml | 0.100 |
| 27 | TAE Buffer | ml | 0.100 |
| 28 | Giấy thấm | Cuộn | 0,100 |
| 29 | Giấy xét nghiệm | Tờ | 2,000 |
| 30 | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 31 | Bút viết kính | Cái | 0,020 |
| 32 | Bút bi | Cái | 0,010 |
| 33 | Mũ | Cái | 0,020 |
| 34 | Khẩu trang | Cái | 0,020 |
| 35 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 36 | Quần áo bảo hộ | Bộ | 0,005 |
| 37 | Dung dịch nước rửa tay | ml | 8,000 |
| 38 | Cồn sát trùng tay nhanh | ml | 1,000 |
| 39 | Dung dịch khử trùng | ml | 10,000 |
| 40 | Khăn lau tay | cái | 0,010 |
| 41 | Ngoại kiểm (nếu có)* |
| 0,020 |
* Ghi chú: Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/50 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 3 lần/1 năm).
3. Bệnh phẩm
Đờm, dịch phế quản, phân, mủ, dịch não tủy, các loại dịch khác, …
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu phiếu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
- Theo đúng quy định của chuyên ngành Vi sinh: xem chi tiết phụ lục 3.
- Từ chối những bệnh phẩm không đạt yêu cầu: xem chi tiết phụ lục 6.
2. Tiến hành kỹ thuật
2.1. Tách chiết RNA tổng số
2.2. Thực hiện RT-PCR và PCR
2.3. Điện di kiểm tra sản phẩm
2.4. Đánh giá và kết luận
IV. NHẬN ĐỊNH KẾT QUẢ
Sản phẩm PCR phải có một băng đặc hiệu duy nhất, rõ nét và không bị đứt gẫy và có kích thước tương ứng với thang DNA chuẩn.
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
Trong trường hợp không có sản phẩm PCR, cần phải kiểm tra lại quá trình tách chiết RNA tổng số, chất lượng của primers và master mix, và thực hiện lại xét nghiệm.
156. Entrovirus genotype giải trình tự gene
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Xác định trình tự nucleotide đặc trưng cho từng genotype của Enterovirus trong các loại dịch tiết đường hô hấp, các loại dịch khác và phân.
2. Nguyên lý
Xác định trình tự nucleotide đặc trưng với từng genotype của Enterovirus bằng kỹ thuật giải trình tự gen.
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện: Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: Cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Tủ an toàn sinh học cấp 2
- Máy PCR
- Máy điện di
- Máy đọc điện di
- Máy giải trình tự gen
- Máy ly tâm 25000 x g
- Máy ly tâm dùng cho tube 0,2 ml
- Máy ủ nhiệt
- Máy vortex
- Bộ lưu điện
- Tủ lạnh 20C - 80C
- Tủ âm sâu (-200C hoặc -700C)
- Micropipette
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
Thực hiện xét nghiệm 02 mẫu/lần.
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Bông | kg | 0,001 |
| 2 | Cồn | ml | 1,000 |
| 3 | Bơm kim tiêm | Cái | 1,000 |
| 4 | Panh | Cái | 0,0001 |
| 5 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 6 | Hộp vận chuyển bệnh phẩm | Test | 0,001 |
| 7 | Tube đựng bệnh phẩm | Cái | 2,000 |
| 8 | Găng không có bột | Đôi | 0,500 |
| 9 | Sinh phẩm chẩn đoán | Test | 1,000 |
| 10 | Khấu hao sinh phẩm cho kiểm tra lại | Test | 1,350 |
| 11 | Kit tách chiết RNA từ virus | Test | 2,350 |
| 12 | Primer 1 (primer đặc hiệu) | ml | 0,0001 |
| 13 | Primer 2 (primer đặc hiệu) | ml | 0,0001 |
| 14 | Primer 3 (primer đặc hiệu) | ml | 0,0001 |
| 15 | Primer 4 (primer đặc hiệu) | ml | 0,0001 |
| 16 | Ống Eppendorf 1,5 ml | Tube | 3,000 |
| 17 | Ống Eppendorf 0,2 ml | Tube | 1,000 |
| 18 | Đầu côn 10 µl có lọc | Cái | 1,000 |
| 19 | Đầu côn 30 µl | Cái | 1,200 |
| 20 | Đầu côn 200 µl có lọc | Cái | 2,200 |
| 21 | Đầu côn 1 ml có lọc | Cái | 3,200 |
| 22 | Ethanol BDH | ml | 0,500 |
| 23 | Water-DEPC Treated | ml | 2,000 |
| 24 | Thạch | Gam | 0.075 |
| 25 | Ladder | ml | 0.0025 |
| 26 | Blue Juice Gel loading dye | ml | 0.003 |
| 27 | Ethidium Bromide | ml | 0.100 |
| 28 | TAE Buffer | ml | 0.100 |
| 29 | Giấy thấm | Cuộn | 0,100 |
| 30 | Giấy xét nghiệm | Tờ | 2,000 |
| 31 | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 32 | Bút viết kính | Cái | 0,020 |
| 33 | Bút bi | Cái | 0,010 |
| 34 | Mũ | Cái | 0,020 |
| 35 | Khẩu trang | Cái | 0,020 |
| 36 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 37 | Quần áo bảo hộ | Bộ | 0,005 |
| 38 | Dung dịch nước rửa tay | ml | 8,000 |
| 39 | Cồn sát trùng tay nhanh | ml | 1,000 |
| 40 | Dung dịch khử trùng | ml | 10,000 |
| 41 | Khăn lau tay | cái | 0,010 |
| 42 | Ngoại kiểm (nếu có)* |
| 0,020 |
* Ghi chú: Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/50 tổng chi phí dụng cụ, hóa chất, vật tư tiu hao (với số lần ngoại kiểm trung bình 3 lần/1 năm).
3. Bệnh phẩm
Dịch hầu họng, dịch đường hô hấp, phân, và các loại dịch khác
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu phiếu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
- Theo đúng quy định của chuyên ngành Vi sinh: xem chi tiết phụ lục 3.
- Từ chối những bệnh phẩm không đạt yêu cầu: xem chi tiết phụ lục 6.
2. Tiến hành kỹ thuật
2.1. Tách chiết RNA tổng số
2.2. Thực hiện phản ứng RT-PCR
2.3. Thực hiện phản ứng PCR
2.4. Điện di kiểm tra sản phẩm
2.5. Giải trình tự gen
2.6. Kiểm tra và so sánh trình tự gen của EV trên ngân hàng dữ liệu gen quốc tế
IV. NHẬN ĐỊNH KẾT QUẢ
Sản phẩm PCR phải có một băng đặc hiệu duy nhất, rõ nét và không bị đứt gẫy. Trình tự DNA của gen đích không bị nhiễu và phải có độ tương đồng ≥ 90 % mới có thể kết luận được genotype của EV
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
- Trong trường hợp không có sản phẩm PCR, cần phải kiểm tra lại quá trình tách chiết RNA tổng số, chất lượng primers và master mix, và thực hiện lại toàn bộ xét nghiệm.
- Nếu trình tự DNA bị nhiễu cần phải kiểm tra lại độ đặc hiệu của sản phẩm PCR hoặc quá trình chạy PCR sequencing bị nhiễm chéo.
157. Adenovirus Real-time PCR
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Xác định sự có mặt gen đặc trưng của Adenovirus từ bệnh phẩm (dịch viêm kết mạc mắt, dịch đường hô hấp...)
2. Nguyên lý
Xác định gen đặc trưng của Adenovirus dựa trên nguyên lý của kỹ thuật real-time PCR.
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện: Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: Cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Máy real-time PCR và hệ thống máy vi tính.
- Bộ lưu điện
- Máy ủ nhiệt
- Máy ly tâm dùng cho tube 0,2ml
- Máy ly tâm 25000 x g
- Máy vortex
- Tủ an toàn sinh học cấp 2
- Tủ lạnh 2 oC - 8 oC
- Tủ âm sâu (- 20 oC hoặc -70 oC)
- Micropipettes các thể tích từ 5 l - 1000 l.
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
Thực hiện xét nghiệm 02 mẫu/lần.
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng | |
| 1 | Tăm bông vô trùng | Cái | 1,000 | |
| 2 | Găng không có bột tal | Đôi | 0,100 | |
| 3 | Khay đựng bệnh phẩm | Cái | 0,0001 | |
| 4 | Hộp vận chuyển bệnh phẩm | Cái | 0,001 | |
| 5 | Sinh phẩm chẩn đoán | Test | 1,000 |
| 6 | Khấu hao sinh phẩm cho chạy chứng, kiểm tra chất lượng | Test | 1,200 |
| 7 | Kit tách DNA | Test | 2,200 |
| 8 | Ngoại kiểm (nếu có)* |
| 0,020 |
| 9 | ống Falcol 50 ml | Cái | 0,010 |
| 10 | Eppendorf 1,7 ml | Tube | 2,200 |
| 11 | Eppendorf 0,2 ml | Tube | 2,200 |
| 12 | Đầu côn 10 µl có lọc | Cái | 2,200 |
| 13 | Đầu côn 30 µl | Cái | 1,200 |
| 14 | Đầu côn 200 µl có lọc | Cái | 5,200 |
| 15 | Đầu côn 1 ml có lọc | Cái | 3,200 |
| 16 | Water-DEPC Treated | ml | 1,000 |
| 17 | Giấy thấm | Cuộn | 0,100 |
| 18 | Giấy xét nghiệm | Tờ | 2,000 |
| 19 | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 20 | Bút viết kính | Cái | 0,020 |
| 21 | Bút bi | Cái | 0,010 |
| 22 | Mũ | Cái | 0,020 |
| 23 | Khẩu trang | Cái | 0,020 |
| 24 | Găng tay | Đôi | 0,100 |
| 25 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 26 | Quần áo bảo hộ | Bộ | 0,005 |
| 27 | Dung dịch nước rửa tay | ml | 8,000 |
| 28 | Cồn sát trùng tay nhanh | ml | 1,000 |
| 29 | Dung dịch khử trùng | ml | 10,000 |
| 30 | Khăn lau tay | Cái | 0,010 |
* Ghi chú: Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/50 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 2 lần/1 năm).
3. Bệnh phẩm
Dịch viêm kết mạc mắt, dịch đường hô hấp...
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
- Theo đúng quy định của chuyên ngành Vi sinh: xem chi tiết phụ lục 3.
- Từ chối những bệnh phẩm không đạt yêu cầu: xem chi tiết phụ lục 6.
2. Tiến hành kỹ thuật: Bộ sinh phẩm Real-time PCR định tính Adenovirrus
2.1. Tách chiết DNA
Có thể dùng kit tách chiết DNA bằng hoá chất phenol/chloroform hoặc tách chiết bằng cột của các nhà sản xuất khác như Qiagen, Stratec, Roche...
2.2. Thực hiện phản ứng real-time PCR
- Thực hiện bước này với các tube PCR mix được giữ trong khay lạnh hoặc đá đang tan.
- Chỉ lấy đủ số tube PCR mix cần. Trước và sau khi đặt phản ứng PCR phải ly tâm tube để tất cả dung dịch nằm dước đáy tube.
- Cho chứng +, chứng - hoặc dịch DNA tách chiết vào từng tube Adenovirrus rPCR Mix. Xong, đặt các tube vào máy real-time PCR.
- Khởi động máy real-time PCR. Khởi động máy tính và chương trình real- time PCR.
- Cài đặt vị trí mẫu “Plate setup” trên phần mềm đúng với vị trí mẫu đã đặt trên máy real-time PCR.
- Chọn màu “FAM” và “CY5” và cho mẫu, chứng dương và chứng âm.
- Cài đặt chương trình “Protocol” cho máy real-time PCR hoạt động
- Lưu file dữ liệu vào máy tính
- Cho máy real-time PCR chạy chương trình.
IV. NHẬN ĐỊNH KẾT QUẢ
1. Điều kiện của phản ứng
- Chứng dương có đường biểu diễn tín hiệu huỳnh quang màu FAM dương tính và đường biểu diễn tín hiệu huỳnh quang màu CY5 dương tính hoặc âm tính.
- Chứng âm có đường biểu diễn tín hiệu huỳnh quang màu FAM âm tính và đường biểu diễn tín hiệu huỳnh quang màu CY5 dương tính
2. Phân tích mẫu
- Những mẫu dương tính chỉ cần chọn màu FAM để phân tích, không cần quan tâm đến chứng nội, chứng nội có thể dương hoặc âm.
- Những mẫu âm tính, chứng nội phải dương tính thì mới kết luận mẫu âm tính thật sự.
3. In đồ thị kết quả
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
Có mẫu và chứng nội cũng đều âm tính. Chứng bình thường, có mẫu dương, mẫu âm thật sự.
1. Nguyên nhân: Có thể mẫu âm thực sự, có thể phản ứng PCR bị ức chế.
2. Khắc phục
- Pha loãng mẫu từ 10-100 lần, thực hiện lại toàn bộ thí nghiệm từ bước tách chiết. Sau khi có kết quả phải nhân thêm với hệ số pha loãng mẫu. Nếu vẫn gặp sự cố trên, lấy lại mẫu theo đúng yêu cầu.
- Trừ những mẫu sự cố, tất cả các mẫu bình thường đều có thể lấy kết quả.
158. BK/JC virus PCR
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Phát hiện JC/BK virus trong bệnh phẩm máu và dịch não tủy, nước tiểu.
2. Nguyên lý
Xác định định tính và định lượng gen đặc trưng virus JC/BK bằng kỹ thuật real-time PCR
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện: Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: Cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2. Phương tiện, hóa chất
2.1. Trang thiết bị
- Máy real-time PCR và hệ thống máy vi tính.
- Bộ lưu điện
- Tủ an toàn sinh học cấp 2
- Máy ly tâm 25000 x g
- Máy ly tâm dùng cho tube 0,2 ml
- Máy ủ nhiệt
- Máy vortex
- Tủ lạnh 2 oC - 8 oC
- Tủ âm sâu (- 20 oC hoặc -70 oC)
- Micropipette các thể tích từ 5 ml - 1000 ml.
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
Thực hiện xét nghiệm 02 mẫu/lần
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Bông | Kg | 0,001 |
| 2 | Dây garô | Cái | 0,001 |
| 3 | Cồn | ml | 1,000 |
| 4 | Bơm kim tiêm | Cái | 1,000 |
| 5 | Panh | Cái | 0,0001 |
| 6 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 7 | Hộp vận chuyển bệnh phẩm | Cái | 0,001 |
| 8 | Tube đựng bệnh phẩm | Cái | 1,000 |
| 9 | Găng không có bột tal | Đôi | 2,000 |
| 10 | Sinh phẩm chẩn đoán | Test | 1,000 |
| 11 | Khấu hao sinh phẩm cho chạy chứng, kiểm tra chất lượng | Test | 1,100 |
| 12 | Kit tách DNA | Test | 2,100 |
| 13 | Ngoại kiểm (nếu có)* |
| 0,020 |
| 14 | ống Falcol 50 ml | Cái | 0,010 |
| 15 | Eppendorf 1,7 ml | Tube | 2,100 |
| 16 | Eppendorf 0,2 ml | Tube | 2,100 |
| 17 | Đầu côn 10 µl có lọc | Cái | 6,000 |
| 18 | Đầu côn 200 µl có lọc | Cái | 12,000 |
| 19 | Đầu côn 1 ml có lọc | Cái | 6,000 |
| 20 | Ethanol BDH | ml | 2,000 |
| 21 | Water-DEPC Treated | ml | 1,000 |
| 22 | Giá đỡ PCR tube | Cái | 0,001 |
| 23 | Giấy thấm | Cuộn | 0,100 |
| 24 | Giấy xét nghiệm | Tờ | 2,000 |
| 25 | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 26 | Bút viết kính | Cái | 0,020 |
| 27 | Bút bi | Cái | 0,010 |
| 28 | Mũ | Cái | 0,020 |
| 29 | Khẩu trang | Cái | 0,020 |
| 30 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 31 | Quần áo bảo hộ | Bộ | 0,005 |
| 32 | Dung dịch nước rửa tay | ml | 8,000 |
| 33 | Cồn sát trùng tay nhanh | ml | 1,000 |
| 34 | Dung dịch khử trùng | ml | 10,000 |
| 35 | Khăn lau tay | Cái | 0,010 |
* Ghi chú: Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/50 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 3 lần/1 năm).
3. Bệnh phẩm
Máu, nước tiểu, huyết tương, dịch não tủy.
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu phiếu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
- Theo đúng quy định của chuyên ngành Vi sinh: xem chi tiết phụ lục 3.
- Từ chối những bệnh phẩm không đạt yêu cầu: xem chi tiết phụ lục 6.
2. Tiến hành kỹ thuật
Bộ sinh phẩm Geno-Sen JC/BK Virus (Rotor Gene) Real-time PCR (VD)
2.1. Tách chiết DNA
2.2. Thực hiện phản ứng real-time PCR
- Thực hiện bước này trong khay lạnh hoặc đá đang tan.
- Lấy đủ số tube 0,2 ml cần dùng.
- Chuẩn bị MasterMix (bao gồm JC/BK Mix, Mg. Sol JC/BK, IC) và phân phối vào các tube 0,2 ml.
- Cho Standards, chứng - hoặc dịch DNA tách chiết vào từng tube PCR Mix. Xong, đặt các tube vào máy real-time PCR.
- Khởi động máy real-time PCR. Khởi động máy tính và chương trình real- time PCR.
- Cài đặt vị trí mẫu “Plate setup” trên phần mềm đúng với vị trí mẫu đã đặt trên máy real-time PCR.
- Chọn màu “FAM” và “JOE” cho mẫu, Standards và chứng âm.
- Cài đặt chương trình “Protocol” cho máy real-time PCR hoạt động
- Lưu file dữ liệu vào máy tính
- Cho máy real-time PCR chạy chương trình.
IV. NHẬN ĐỊNH KẾT QUẢ
1. Điều kiện của phản ứng
- Các chứng chuẩn có đường biểu diễn tín hiệu huỳnh quang màu FAM dương tính và đường biểu diễn tín hiệu huỳnh quang màu JOE dương tính hoặc âm tính.
- Chứng âm có đường biểu diễn tín hiệu huỳnh quang màu FAM âm tính và đường biểu diễn tín hiệu huỳnh quang màu JOE dương tính.
2. Phân tích mẫu định tính
- Mẫu có đường biểu diễn dương tính rõ ràng và bắt đầu từ chu kỳ 36 trở về trước, kết luận “Mẫu dương tính”.
- Mẫu có đường biểu diễn dương tính và bắt đầu từ sau chu kỳ 36, kết luận “Mẫu nghi ngờ” và đề nghị lấy mẫu lại để thực hiện xét nghiệm.
- Mẫu có đường biểu diễn âm tính, kết luận “Không tìm thấy virus trong mẫu”. Những mẫu âm tính, chứng nội phải dương tính thì mới kết luận mẫu âm tính thật sự.
3. Phân tích mẫu định lượng
- Mẫu chuẩn (JC/BK Standard - S 1-5) để định lượng được cung cấp trong bộ kit đã biết trước nồng độ, được tính theo copies/ml và được xử lý cùng một phương pháp với mẫu bệnh phẩm.
● Standard 1: 105 copies/ml = 25.000.000 copies/ml
● Standard 2: 104 copies/ml = 2.500.000 copies/ml
● Standard 3: 103 copies/ml = 250.000 copies/ml
● Standard 4: 102 copies/ml = 25.000 copies/ml
● Standard 5: 101 copies/ml = 2.500 copies/ml
- Áp dụng công thức sau để qui đổi giá trị đã được xác định của mẫu bệnh phẩm sang copies/ml bằng cách sử dụng đường cong chuẩn:
| Kết quả (copies/ml) = | Kết quả đo được (copies/ml) x Thể tích mẫu tách chiết (µl) |
| Thể tích bệnh phẩm (ml) |
4. In đồ thị kết quả
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
- Ống giữ mẫu máu được gắn chất chống đông có thể ức thế phản ứng PCR
- Khi sử dụng phương pháp tách chiết trong đó có bước dùng buffer để loại bỏ ethanol, phải thực hiện thêm bước ly tâm trước khi tiến hành bước thôi rửa để loại bỏ ethanol còn sót lại. Điều này giúp ngăn ngừa sự ức chế phản ứng PCR.
- Để dựng thành đường chuẩn, phải sử dụng tất cả mẫu chuẩn (JC/BK S 1-5).
- Trước khi sử dụng, tất cả thuốc thử cần phải được rã đông hoàn toàn và hòa trộn với nhau ( pipet và vortex ngắn)
159. HPV PCR
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Xác định sự có mặt gen đặc trưng của Human papillomavirus (HPV) từ bệnh phẩm dịch đường sinh dục.
2. Nguyên lý
Sử dụng cặp mồi đặc hiệu để xác định sự có mặt gen đặc trưng của HPV bằng kỹ thuật PCR
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện: Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: Cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Tủ an toàn sinh học cấp 2
- Máy PCR
- Máy điện di
- Máy đọc điện di
- Máy ly tâm 25000 x g
- Máy ly tâm dùng cho tube 0,2 ml
- Máy ủ nhiệt
- Máy vortex
- Bộ lưu điện
- Tủ lạnh 2 oC - 8 oC
- Tủ âm sâu (- 20 oC hoặc -70 oC)
- Micropipette
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
Thực hiện xét nghiệm 02 mẫu/lần.
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Bông | kg | 0,001 |
| 2 | Cồn | ml | 1,000 |
| 3 | Bơm kim tiêm | Cái | 1,000 |
| 4 | Panh | Cái | 0,0001 |
| 5 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 6 | Hộp vận chuyển bệnh phẩm | Test | 0,001 |
| 7 | Tube đựng bệnh phẩm | Cái | 2,000 |
| 8 | Găng không có bột | Đôi | 0,500 |
| 9 | Sinh phẩm chẩn đoán | Test | 1,000 |
| 10 | Khấu hao sinh phẩm cho chạy chứng và kiểm tra lại | Test | 1,350 |
| 11 | Kit tách chiết DNA từ virus | Test | 2,350 |
| 12 | Primer 1 | ml | 0,0001 |
| 13 | Primer 2 | ml | 0,0001 |
| 14 | Eppendorf 1,7 ml | Tube | 3,000 |
| 15 | Eppendorf 0,2 ml | Tube | 1,000 |
| 16 | Đầu côn 10 µl có lọc | Cái | 1,000 |
| 17 | Đầu côn 30 µl | Cái | 1,200 |
| 18 | Đầu côn 200 µl có lọc | Cái | 2,200 |
| 19 | Đầu côn 1 ml có lọc | Cái | 3,200 |
| 20 | Ethanol BDH | ml | 0,500 |
| 21 | Water-DEPC Treated | ml | 2,000 |
| 22 | Thạch | Gam | 0.075 |
| 23 | Ladder | ml | 0.0025 |
| 24 | Blue Juice Gel loading dye | ml | 0.003 |
| 25 | Ethidium Bromide | ml | 0.100 |
| 26 | TAE Buffer | ml | 0.100 |
| 27 | Giấy thấm | Cuộn | 0,100 |
| 28 | Giấy xét nghiệm | Tờ | 2,000 |
| 29 | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 30 | Bút viết kính | Cái | 0,020 |
| 31 | Bút bi | Cái | 0,010 |
| 32 | Mũ | Cái | 0,020 |
| 33 | Khẩu trang | Cái | 0,020 |
| 34 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 35 | Quần áo bảo hộ | Bộ | 0,005 |
| 36 | Dung dịch nước rửa tay | ml | 8,000 |
| 37 | Cồn sát trùng tay nhanh | ml | 1,000 |
| 38 | Dung dịch khử trùng | ml | 10,000 |
| 39 | Khăn lau tay | cái | 0,010 |
| 40 | Ngoại kiểm (nếu có)* |
| 0,020 |
* Ghi chú: Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/50 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 3 lần/1 năm).
3. Bệnh phẩm
Dịch đường sinh dục, các loại dịch khác, …
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu phiếu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
- Theo đúng quy định của chuyên ngành Vi sinh: xem chi tiết phụ lục 3.
- Từ chối những bệnh phẩm không đạt yêu cầu: xem chi tiết phụ lục 6.
2. Tiến hành kỹ thuật
2.1. Tách chiết DNA tổng số
2.2. Thực hiện PCR
2.3. Điện di kiểm tra sản phẩm
2.4. Đánh giá và kết luận
IV. NHẬN ĐỊNH KẾT QUẢ
Sản phẩm PCR phải có một băng đặc hiệu duy nhất, rõ nét và không bị đứt gẫy và có kích thước tương ứng với thang DNA chuẩn.
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
Trong trường hợp không có sản phẩm PCR, cần phải kiểm tra lại quá trình tách chiết DNA tổng số, chất lượng primers và master mix, và thực hiện lại toàn bộ xét nghiệm.
160. HPV Real-time PCR
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Xác định sự có mặt gen đặc trưng của Human papillomavirus (HPV) từ bệnh phẩm đường sinh dục.
2. Nguyên lý
Xác định gen đặc trưng của HPV dựa trên nguyên lý của kỹ thuật real-time PCR.
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện: Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Máy real-time PCR và hệ thống máy vi tính.
- Bộ lưu điện
- Máy ủ nhiệt
- Máy ly tâm dùng cho tube 0,2 ml
- Máy ly tâm 25000 x g
- Máy vortex
- Tủ an toàn sinh học cấp 2
- Tủ lạnh 2 oC - 8 oC
- Tủ âm sâu (- 20 oC hoặc -70 oC)
- Micropipette các thể tích từ 5 ml - 1000 ml.
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
Thực hiện xét nghiệm 02 mẫu/lần.
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Tăm bông vô trùng | Kg | 0,001 |
| 2 | Găng không có bột tal | Đôi | 0,001 |
| 3 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 4 | Hộp vận chuyển bệnh phẩm | Cái | 0,001 |
| 5 | Sinh phẩm chẩn đoán | Test | 1,000 |
| 6 | Khấu hao sinh phẩm cho chạy chứng, kiểm tra chất lượng | Test | 1,200 |
| 7 | Kit tách DNA | Test | 2,200 |
| 8 | Ngoại kiểm (nếu có)* |
| 0,020 |
| 9 | ống Falcol 50 ml | Cái | 0,010 |
| 10 | Eppendorf 1,7 ml | Tube | 2,200 |
| 11 | Eppendorf 0,2 ml | Tube | 2,200 |
| 12 | Đầu côn 10 µl có lọc | Cái | 2,200 |
| 13 | Đầu côn 30 µl | Cái | 1,200 |
| 14 | Đầu côn 200 µl có lọc | Cái | 5,200 |
| 15 | Đầu côn 1 ml có lọc | Cái | 3,200 |
| 16 | Water-DEPC Treated | ml | 1,000 |
| 17 | Giấy thấm | Cuộn | 0,100 |
| 18 | Giấy xét nghiệm | Tờ | 2,000 |
| 19 | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 20 | Bút viết kính | Cái | 0,020 |
| 21 | Bút bi | Cái | 0,010 |
| 22 | Mũ | Cái | 0,020 |
| 23 | Khẩu trang | Cái | 0,020 |
| 24 | Găng tay | Đôi | 0,100 |
| 25 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 26 | Quần áo bảo hộ | Bộ | 0,005 |
| 27 | Dung dịch nước rửa tay | ml | 8,000 |
| 28 | Cồn sát trùng tay nhanh | ml | 1,000 |
| 29 | Dung dịch khử trùng | ml | 10,000 |
| 30 | Khăn lau tay | Cái | 0,010 |
* Ghi chú: Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/50 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 3 lần/1 năm).
3. Bệnh phẩm
Dịch quệt cổ tử cung, mảnh sinh thiết...
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
- Theo đúng quy định của chuyên ngành Vi sinh: xem chi tiết phụ lục 3.
- Từ chối những bệnh phẩm không đạt yêu cầu: xem chi tiết phụ lục 6.
2. Tiến hành kỹ thuật: Bộ sinh phẩm HPV Real-time PCR (VD)
2.1. Tách chiết DNA
Có thể dùng kit tách chiết DNA bằng hoá chất phenol/chloroform hoặc tách chiết bằng cột của các nhà sản xuất khác như Qiagen, Stratec, Roche...
2.2. Thực hiện phản ứng real-time PCR
- Thực hiện bước này với các tube PCR mix được giữ trong khay lạnh hoặc đá đang tan.
- Chỉ lấy đủ số tube PCR mix cần. Trước và sau khi đặt phản ứng PCR phải ly tâm tube để tất cả dung dịch nằm dước đáy tube.
- Cho chứng +, chứng - hoặc dịch DNA tách chiết vào từng tube HPV rPCR Mix. Xong, đặt các tube vào máy real-time PCR.
- Khởi động máy real-time PCR. Khởi động máy tính và chương trình real- time PCR.
- Cài đặt vị trí mẫu “Plate setup” trên phần mềm đúng với vị trí mẫu đã đặt trên máy real-time PCR.
- Chọn màu “FAM” và “HEX” cho mẫu, chứng dương và chứng âm.
- Cài đặt chương trình “Protocol” cho máy real-time PCR hoạt động
- Lưu file dữ liệu vào máy tính
- Cho máy real-time PCR chạy chương trình.
IV. NHẬN ĐỊNH KẾT QUẢ
1. Điều kiện của phản ứng
- Chứng dương có đường biểu diễn tín hiệu huỳnh quang màu FAM dương tính và đường biểu diễn tín hiệu huỳnh quang màu HEX dương tính hoặc âm tính.
- Chứng âm có đường biểu diễn tín hiệu huỳnh quang màu FAM âm tính và đường biểu diễn tín hiệu huỳnh quang màu HEX dương tính
2. Phân tích mẫu
- Những mẫu dương tính chỉ cần chọn màu FAM để phân tích, không cần quan tâm đến chứng nội, chứng nội có thể dương hoặc âm.
- Những mẫu âm tính, chứng nội phải dương tính thì mới kết luận mẫu âm tính thật sự.
3. In đồ thị kết quả
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
Có mẫu và chứng nội cũng đều âm tính. Chứng bình thường, có mẫu dương, mẫu âm thật sự.
1. Nguyên nhân
Có thể mẫu âm thực sự, có thể phản ứng PCR bị ức chế.
2. Khắc phục
- Pha loãng mẫu từ 10-100 lần, thực hiện lại toàn bộ thí nghiệm từ bước tách chiết. Sau khi có kết quả phải nhân thêm với hệ số pha loãng mẫu. Nếu vẫn gặp sự cố trên, lấy lại mẫu theo đúng yêu cầu.
- Trừ những mẫu sự cố, tất cả các mẫu bình thường đều có thể lấy kết quả.
161. HPV Genotype Real-time PCR
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Xác định genotype của Human Papillomavirrus (HPV) trong bệnh phẩm đường sinh dục.
2. Nguyên lý
Xác định genotype của HPV và dựa trên nguyên lý của kỹ thuật real-time PCR và reverse dot blot.
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: Cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Máy real-time PCR và hệ thống máy vi tính.
- Bộ lưu điện
- Máy ủ nhiệt
- Máy ly tâm dung cho tube 0,2 ml
- Máy ly tâm 25000 x g
- Tủ an toàn sinh học cấp 2
- Máy vortex
- Tủ lạnh 2 oC - 8 oC
- Tủ âm sâu (-20 oC) hoặc (-70 oC)
- Micropipette các thể tích từ 5 ml - 1000 ml.
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
Thực hiện xét nghiệm 02 mẫu/lần.
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Tăm bông vô trùng | Cái | 1,000 |
| 2 | Găng không có bột tal | Đôi | 0,100 |
| 3 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 4 | Hộp vận chuyển bệnh phẩm | Cái | 0,001 |
| 5 | Sinh phẩm chẩn đoán | Test | 1,000 |
| 6 | Khấu hao sinh phẩm cho chạy chứng, kiểm tra chất lượng | Test | 1,200 |
| 7 | Kit tách DNA | Test | 2,200 |
| 8 | Ngoại kiểm (nếu có)* |
| 0,020 |
| 9 | ống Falcol 50 ml | Cái | 0,010 |
| 10 | Eppendorf 1,7 ml | Tube | 2,200 |
| 11 | Eppendorf 0,2 ml | Tube | 2,200 |
| 12 | Đầu côn 10 µl có lọc | Cái | 2,200 |
| 13 | Đầu côn 30 µl | Cái | 1,200 |
| 14 | Đầu côn 200 µl có lọc | Cái | 5,200 |
| 15 | Đầu côn 1 ml có lọc | Cái | 3,200 |
| 16 | Water-DEPC Treated | ml | 1,000 |
| 17 | Giấy thấm | Cuộn | 0,100 |
| 18 | Giấy xét nghiệm | Tờ | 2,000 |
| 19 | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 20 | Bút viết kính | Cái | 0,020 |
| 21 | Bút bi | Cái | 0,010 |
| 22 | Mũ | Cái | 0,020 |
| 23 | Khẩu trang | Cái | 0,020 |
| 24 | Găng tay | Đôi | 0,100 |
| 25 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 26 | Quần áo bảo hộ | Bộ | 0,005 |
| 27 | Dung dịch nước rửa tay | ml | 8,000 |
| 28 | Cồn sát trùng tay nhanh | ml | 1,000 |
| 29 | Dung dịch khử trùng | ml | 10,000 |
| 30 | Khăn lau tay | Cái | 0,010 |
* Ghi chú: Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/50 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 2 lần/1 năm).
3. Bệnh phẩm
Dịch quệt cổ tử cung, mảnh sinh thiết...
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
- Theo đúng quy định của chuyên ngành Vi sinh: xem chi tiết phụ lục 3.
- Từ chối những bệnh phẩm không đạt yêu cầu: xem chi tiết phụ lục 6.
2. Tiến hành kỹ thuật: Bộ sinh phẩm HPV Genotype Real-time PCR (VD)
2.1. Tách chiết DNA
2.2. Thực hiện phản ứng real-time PCR
2.3. Thực hiện phản ứng reverse dlot blot: thực hiện với những mẫu dương tính ở bước 2.2
IV. NHẬN ĐỊNH KẾT QUẢ
1. Điều kiện của phản ứng
- Chứng dương: có tín hiệu tại vị trí chứng dương
- Những genotyp nguy cơ cao: 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 66, 68.
- Những genotyp nguy cơ thấp: 6, 11, 42, 43, 61, 81.
2. Nhận định kết quả
- Mẫu có tín hiệu tròn xanh xuất hiện tại vị trí tương ứng với genotype nào thì kết luận mẫu dương tính với genotype đó. Một mẫu có thể đồng nhiễm nhiều genotype.
- Mẫu không có tín hiệu màu thì kết luận: “Mẫu nhiễm HPV genotype khác ngoài genotype của bộ kit”.
3. In hình kết quả
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
1. Tất cả các mẫu đều dương tính kể cả chứng âm.
- Nguyên nhân 1: Lô thí nghiệm bị ngoại nhiễm DNA hoặc sản phẩm PCR từ môi trường của khu vực thao tác hoặc nhiễm chéo giữa các mẫu.
Khắc phục: Chiếu UV và vệ sinh khu vực thao tác bằng nước Javel để khử nhiễm. Tiến hành lại thí nghiệm thật cẩn thận.
- Nguyên nhân 2: Kit bị ngoại nhiễm DNA hoặc sản phẩm PCR trong quá trình sử dụng.
Khắc phục: Thay kit mới và thực hiện quá trình như hướng dẫn ở nguyên nhân 1.
Trường hợp này không thể lấy kết quả, phải khắc phục và tiến hành lại thí nghiệm.
2. Tín hiệu dương tính yếu, có thể do rửa nhiều và quá lâu làm cho tín hiệu dương tính nhạt hoặc màng lai không sạch vẫn còn màu xanh sẽ khó đọc kết quả.
Khắc phục: Phải tuân thủ đúng điều kiện rửa
162. HPV genotype PCR hệ thống tự động
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Xác định genotype của human papiloma virus (HPV) trong bệnh phẩm đường sinh dục.
2. Nguyên lý
Xác định genotype của HPV và dựa trên nguyên lý của kỹ thuật real-time PCR.
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện: Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: Cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Hệ thống máy tách chiết tự động, máy khuyếch đại và phát hiện tự động
- Hệ thống máy tính.
- Bộ lưu điện
- Máy vortex
- Tủ an toàn sinh học cấp 2
- Tủ lạnh 2 oC - 8 oC
- Tủ âm sâu (-20 oC) hoặc (-70 oC)
- Micropipette 1000 ml.
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
Thực hiện xét nghiệm 22 mẫu/lần.
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng | |
| 1 | Lọ vô trùng có chứa môi trường bảo quản | Cái | 1,000 | |
| 2 | Dụng cụ lấy bệnh phẩm quệt cổ tử cung | Cái | 1,000 | |
| 3 | Khay đựng bệnh phẩm | Cái | 0,0001 | |
| 4 | Hộp vận chuyển bệnh phẩm | Cái | 0,001 | |
| 5 | Sinh phẩm chẩn đoán | Test | 1,000 | |
| 6 | Khấu hao sinh phẩm cho chạy chứng, kiểm tra chất lượng | Test | 0,100 | |
| 7 | Kit tách DNA1 | Test | 1,100 |
| 8 | Kit tách DNA2 |
| 1,100 |
| 9 | Kit tách DNA3 | Cái | 1,100 |
| 10 | Ngoại kiểm (nếu có)* |
| 0,020 |
| 11 | Elution plate | Cái | 0,050 |
| 12 | Extraction plate | Cái | 0,050 |
| 13 | Máng đựng hóa chất to 200 ml | Cái | 0,050 |
| 14 | Máng đựng hóa chất nhỏ 50 ml | Cái | 0,200 |
| 15 | Ngoại kiểm (nếu có) |
|
|
| 16 | Tip CORE TIPS w. Filter 1 ml | Cái | 10,000 |
| 17 | Giấy thấm | Cuộn | 0,100 |
| 18 | Giấy xét nghiệm | Tờ | 2,000 |
| 19 | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 20 | Bút viết kính | Cái | 0,020 |
| 21 | Bút bi | Cái | 0,010 |
| 22 | Mũ | Cái | 0,020 |
| 23 | Khẩu trang | Cái | 0,020 |
| 24 | Găng không có bột tal | Đôi | 0,100 |
| 25 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 26 | Quần áo bảo hộ | Bộ | 0,005 |
| 27 | Dung dịch nước rửa tay | ml | 8,000 |
| 28 | Cồn sát trùng tay nhanh | ml | 1,000 |
| 29 | Dung dịch khử trùng | ml | 10,000 |
| 30 | Khăn lau tay | Cái | 0,010 |
* Ghi chú: Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/50 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 3 lần/1 năm).
3. Bệnh phẩm
Dịch sinh dục, mẫu quệt cổ tử cung, mảnh sinh thiết được chứa trong các dung dịch bảo quản mẫu.
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
- Theo đúng quy định của chuyên ngành Vi sinh: xem chi tiết phụ lục 3.
- Từ chối những bệnh phẩm không đạt yêu cầu: xem chi tiết phụ lục 6.
2. Tiến hành kỹ thuật: Bộ sinh phẩm COBAS 4800 HPV-Roche (VD)
2.1. Tách chiết DNA bằng máy tự động
2.2. Khuyếch đại HPV-DNA và đọc kết quả bằng máy tự động
IV. NHẬN ĐỊNH KẾT QUẢ
1. Điều kiện của phản ứng
- Giá trị định type chấp nhận được nếu :
- Chứng âm: Valid (Không phát hiện DNA ở bất kỳ kênh nào)
- Chứng dương: Valid (phát hiện DNA ở cả 4 kênh: kênh cho type 16, 18, nhóm nguy cơ cao và beta-globin)
- Không nhận kết quả nếu chứng âm hoặc chứng dương invalid
2. Phân tích mẫu
- Kết quả định type HPV sẽ cho ra cụ thể bị nhiễm HPV 16, HPV 18 hoặc bị nhiễm một trong 12 type nguy cơ cao 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 66, 68.
- Kết quả của mẫu bệnh phẩm được diễn giải như sau:
+ Khi chọn xét nghiệm là HPV High Risk Panel
| Cobas® 4800 HPV test | Diễn giải kết quả |
| HR HPV POS | High Risk HPV Positive Kết quả dương tính với một hoặc nhiều type HPV |
| HR HPV NEG | High Risk HPV Negative Kết quả HPV âm tính |
| Invalid | High Risk HPV Invalid Kết quả không có giá trị, mẫu cần xét nghiệm lại. |
+ Khi chọn xét nghiệm là HPV High Risk Panel Plus Genotyping
| Cobas® 4800 HPV Test | Kết quả báo cáo và diễn giải |
| Other HR HPV POS, HPV16 POS, HPV18 POS | Other High Risk HPV Positive, HPV16 Positive, HPV18 Positive. Mẫu dương tính với HPV type 16 và 18 và một hoặc nhiều loại HPV: 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 66, 68. |
| Other HR HPV POS, HPV16 POS, HPV18 NEG | Other High Risk HPV Positive, HPV 16 Positive, HPV 18 Negative Mẫu dương tính với HPV type 16 và một hoặc nhiều loại HPV: 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 66, 68. Không phát hiện HPV type 18 hoặc HPV type 18 dưới ngưỡng phát hiện |
| Other HR HPV POS, HPV16 NEG, HPV18 POS | Other High Risk HPV Positive, HPV16 Negative*, HPV18 Positive. Mẫu dương tính với HPV type 18 và một hoặc nhiều loại HPV: 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 66, 68. Không phát hiện HPV type 16 hoặc HPV type 16 dưới ngưỡng phát hiện |
| Other HR HPV POS, HPV16 NEG, HPV18 NEG | Other High Risk HPV Positive, HPV16 Negative*, HPV18 Negative. Mẫu dương tính với một hoặc nhiều loại HPV: 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 66, 68. Không phát hiện HPV type 16 và HPV type 18 hoặc HPV type 16 và HPV type 18 dưới ngưỡng phát hiện. |
IV. NHỮNG SAI SÓT VÀ XỬ TRÍ
Việc lấy mẫu, vận chuyển và bảo quản không đúng tiêu chuẩn có thể dẫn đến kết quả sai, cho dù phản ứng được thực hiện đúng.
163. HPV genotype giải trình tự gene
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Xác định genotype của Human papillomavirus (HPV) từ dịch đường sinh dục.
2. Nguyên lý
Xác định genotype của HPV bằng kỹ thuật giải trình tự nucleotide trên gen đặc trưng.
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện: Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: Cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Tủ an toàn sinh học cấp 2
- Máy PCR
- Máy điện di
- Máy đọc điện di
- Máy giải trình tự gen
- Máy vortex
- Máy ủ nhiệt
- Máy ly tâm 25000 x g
- Máy ly tâm dùng cho tube 0,2 ml
- Bộ lưu điện
- Tủ lạnh 2 oC - 8 oC
- Tủ âm sâu (-20 oC hoặc -70 oC)
- Micropipette
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
Thực hiện xét nghiệm 02 mẫu/lần.
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Bông | kg | 0,001 |
| 2 | Cồn | ml | 1,000 |
| 3 | Bơm kim tiêm | Cái | 1,000 |
| 4 | Panh | Cái | 0,0001 |
| 5 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 6 | Hộp vận chuyển bệnh phẩm | Test | 0,001 |
| 7 | Tube đựng bệnh phẩm | Cái | 2,000 |
| 8 | Găng không có bột tal | Đôi | 0,500 |
| 9 | Sinh phẩm chẩn đoán | Test | 1,000 |
| 10 | Khấu hao sinh phẩm cho chạy chứng và kiểm tra chất lượng | Test | 1,350 |
| 11 | Kit tách chiết DNA từ virus | Test | 2,350 |
| 12 | Primer 1 (primer đặc hiệu) | ml | 0,0001 |
| 13 | Primer 2 (primer đặc hiệu) | ml | 0,0001 |
| 14 | Primer 3 (primer đặc hiệu) | ml | 0,0001 |
| 15 | Primer 4 (primer đặc hiệu) | ml | 0,0001 |
| 16 | Ống Eppendorf 1,5 ml | Tube | 3,000 |
| 17 | Ống Eppendorf 0,2 ml | Tube | 1,000 |
| 18 | Đầu côn 10 µl có lọc | Cái | 1,000 |
| 19 | Đầu côn 30 µl | Cái | 1,200 |
| 20 | Đầu côn 200 µl có lọc | Cái | 2,200 |
| 21 | Đầu côn 1 ml có lọc | Cái | 3,200 |
| 22 | Ethanol BDH | ml | 0,500 |
| 23 | Water-DEPC Treated | ml | 2,000 |
| 24 | Thạch | Gam | 0.075 |
| 25 | Ladder | ml | 0.0025 |
| 26 | Blue Juice Gel loading dye | ml | 0.003 |
| 27 | Ethidium Bromide | ml | 0.100 |
| 28 | TAE Buffer | ml | 0.100 |
| 29 | Giấy thấm | Cuộn | 0,100 |
| 30 | Giấy xét nghiệm | Tờ | 2,000 |
| 31 | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 32 | Bút viết kính | Cái | 0,020 |
| 33 | Bút bi | Cái | 0,010 |
| 34 | Mũ | Cái | 0,020 |
| 35 | Khẩu trang | Cái | 0,020 |
| 36 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 37 | Quần áo bảo hộ | Bộ | 0,005 |
| 38 | Dung dịch nước rửa tay | ml | 8,000 |
| 39 | Cồn sát trùng tay nhanh | ml | 1,000 |
| 40 | Dung dịch khử trùng | ml | 10,000 |
| 41 | Khăn lau tay | cái | 0,010 |
| 42 | Ngoại kiểm (nếu có)* |
| 0,020 |
* Ghi chú: Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/50 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 3 lần/1 năm).
3. Bệnh phẩm
Dịch đường sinh dục, các loại dịch khác…
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu phiếu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
- Theo đúng quy định của chuyên ngành Vi sinh: xem chi tiết phụ lục 3.
- Từ chối những bệnh phẩm không đạt yêu cầu: xem chi tiết phụ lục 6.
2. Tiến hành kỹ thuật
2.1. Tách chiết DNA tổng số
2.2. Thực hiện phản ứng PCR
2.3. Điện di kiểm tra sản phẩm
2.4. Giải trình tự gen
2.5. Kiểm tra và so sánh trình tự gen của HPV trên ngân hàng dữ liệu gen quốc tế
IV. NHẬN ĐỊNH KẾT QUẢ
Sản phẩm PCR phải có một băng đặc hiệu duy nhất, rõ nét và không bị đứt gẫy. Trình tự DNA của gen đích không bị nhiễu và phải có độ tương đồng ≥ 90 % mới có thể kết luận được genotype của HPV
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
- Trong trường hợp không có sản phẩm PCR, cần phải kiểm tra lại quá trình tách chiết DNA tổng số, chất lượng primers và master mix.
- Nếu trình tự DNA bị nhiễu cần phải kiểm tra lại độ đặc hiệu của sản phẩm PCR hoặc quá trình chạy PCR sequencing bị nhiễm chéo.
164. Influenza virus A, B test nhanh
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Phát hiện virus cúm typ A và typ B trong bệnh phẩm đường hô hấp.
2. Nguyên lý
Phát hiện và phân biệt kháng nguyên của virus cúm typ A và typ B dựa trên nguyên lý của kỹ thuật sắc ký miễn dịch.
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: Cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Tủ an toàn sinh học cấp 2
- Đồng hồ bấm giây
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
Thực hiện xét nghiệm 01 mẫu/lần.
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Cồn 90 độ (vệ sinh dụng cụ) | ml | 10,000 |
| 2 | Panh | Cái | 0,0001 |
| 3 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 4 | Hộp vận chuyển bệnh phẩm | Cái | 0,0001 |
| 5 | Sinh phẩm chẩn đoán | Test | 1,000 |
| 6 | Khấu hao sinh phẩm cho chạy chứng và kiểm tra chất lượng | Test | 0,200 |
| 7 | Axít ngâm rửa | ml | 10,000 |
| 8 | Ống nghiệm thủy tinh | Ống | 1,000 |
| 9 | Mũ | Cái | 0,020 |
| 10 | Khẩu trang | Cái | 0,020 |
| 11 | Găng tay | Đôi | 2,000 |
| 12 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 13 | Quần áo bảo hộ | Bộ | 0,001 |
| 14 | Bút viết kính | Cái | 0,020 |
| 15 | Bút bi | Cái | 0,010 |
| 16 | Sổ lưu kết quả xét nghiệm | Quyển | 0,001 |
| 17 | Cồn sát trùng tay nhanh | ml | 1,000 |
| 18 | Dung dịch nước rửa tay | ml | 8,000 |
| 19 | Khăn lau tay | Cái | 0,010 |
| 20 | Giấy trả kết quả xét nghiệm | Tờ | 2,000 |
3. Bệnh phẩm
Dịch tỵ hầu, dịch họng của người bệnh
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu phiếu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
- Theo đúng quy định của chuyên ngành Vi sinh: xem chi tiết phụ lục 2.
- Từ chối những bệnh phẩm không đạt yêu cầu: xem chi tiết phụ lục 6.
2. Tiến hành kỹ thuật
Bộ sinh phẩm SD Bioline Influenza Antigen (VD)
2.1. Dùng que tăm bông lấy dịch tỵ hầu hoặc dịch họng
2.2. Đặt que lấy mẫu vào ống đựng mẫu, ghi mã bệnh phẩm tương ứng
2.2. Nhỏ dung dịch pha loãng vào ống đựng mẫu, trộn đều với bệnh phẩm
2.3. Đặt thanh xét nghiệm vào ống đựng mẫu theo đúng vạch quy định
2.4. Đọc kết quả sau 10 - 15 phút
IV. NHẬN ĐỊNH KẾT QUẢ
Kết quả được chấp nhận khi xuất hiện màu rõ ràng, sắc nét ở vạch chứng C
+ Dương tính cúm A: khi xuất hiện màu ở vạch C và vạch A
+ Dương tính cúm B: khi xuất hiện màu ở vạch C và vạch B
+ Âm tính: khi xuất hiện màu ở vạch chứng C và không xuất hiện màu ở các vạch còn lại.
+ Không có giá trị: vạch chứng C không xuất hiện sau 15-10 phút thì cần kiểm tra lại hóa chất, các bước thực hiện, làm lại test khác
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
- Đọc kết quả trước hoặc sau thời gian qui định có thể làm sai lệch kết quả.
- Test xét nghiệm cắm quá sâu, quá vạch qui định có thể làm kết quả sai lệch
- Tham khảo thêm hướng dẫn của nhà sản xuất
165. Influenza virus A, B Real-time PCR
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Phát hiện gen đặc trưng của virus cúm A và B trong bệnh phẩm đường hô hấp.
2. Nguyên lý
Xác định sự có mặt gen đặc trưng của virrus cúm A và B bằng kỹ thuật Real-time RT-PCR.
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: Cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Tủ an toàn sinh học cấp 2
- Máy Real-time PCR và hệ thống máy tính
- Máy ly tâm 25000 x g
- Máy ly tâm dùng cho tube 0,2 ml
- Máy ủ nhiệt
- Máy vortex
- Bộ lưu điện
- Tủ lạnh 2 oC - 8 oC
- Tủ âm sâu (-20 oC hoặc -70 oC)
- Micropipette
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
Thực hiện xét nghiệm 02 mẫu/lần
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Bông | Kg | 0,001 |
| 2 | Cồn | Ml | 1,000 |
| 3 | Bơm kim tiêm | Cái | 1,000 |
| 4 | Panh | Cái | 0,0001 |
| 5 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 6 | Hộp vận chuyển bệnh phẩm | Test | 0,001 |
| 7 | Tube đựng bệnh phẩm | Cái | 2,000 |
| 8 | Găng không có bột | Đôi | 0,500 |
| 9 | Sinh phẩm chẩn đoán | Test | 1,000 |
| 10 | Khấu hao sinh phẩm cho chạy chứng và kiểm tra chất lượng | Test | 1,350 |
| 11 | Kit tách chiết RNA từ virus | Test | 2,350 |
| 12 | Primer 1-1 (primer đặc hiệu) | ml | 0,0001 |
| 13 | Primer 1-2 (primer đặc hiệu) | ml | 0,0001 |
| 14 | Probe 1 | ml | 0,0001 |
| 15 | Primer 2-1(primer đặc hiệu) | ml | 0,0001 |
| 16 | Primer 2-2 (primer đặc hiệu) | ml | 0,0001 |
| 17 | Probe 2 | ml | 0,0001 |
| 18 | Ống Eppendorf 1,5 ml | Tube | 3,000 |
| 19 | Ống Eppendorf 0,2 ml | Tube | 1,000 |
| 20 | Đầu côn 10 µl có lọc | Cái | 1,000 |
| 21 | Đầu côn 30 µl | Cái | 1,200 |
| 22 | Đầu côn 200 µl có lọc | Cái | 2,200 |
| 23 | Đầu côn 1 ml có lọc | Cái | 3,200 |
| 24 | Ethanol BDH | ml | 0,500 |
| 25 | Water-DEPC Treated | ml | 2,000 |
| 26 | Giấy thấm | Cuộn | 0,100 |
| 27 | Giấy xét nghiệm | Tờ | 2,000 |
| 28 | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 29 | Bút viết kính | Cái | 0,020 |
| 30 | Bút bi | Cái | 0,010 |
| 31 | Mũ | Cái | 0,020 |
| 32 | Khẩu trang | Cái | 0,020 |
| 33 | Găng tay | Đôi | 0,100 |
| 34 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 35 | Quần áo bảo hộ | Bộ | 0,005 |
| 36 | Dung dịch nước rửa tay | ml | 8,000 |
| 37 | Cồn sát trùng tay nhanh | ml | 1,000 |
| 38 | Dung dịch khử trùng | ml | 10,000 |
| 39 | Khăn lau tay | cái | 0,010 |
| 40 | Ngoại kiểm (nếu có)* |
| 0,020 |
* Ghi chú: Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/50 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 3 lần/1 năm).
3. Bệnh phẩm
Dịch hầu họng, dịch tỵ hầu, dịch súc họng, các loại dịch đường hô hấp dưới.
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu phiếu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
- Theo đúng quy định của chuyên ngành Vi sinh: xem chi tiết phụ lục 3.
- Từ chối những bệnh phẩm không đạt yêu cầu: xem chi tiết phụ lục 6.
2. Tiến hành kỹ thuật
2.1. Tách chiết RNA tổng số
2.2. Thực hiện phản ứng Real-time RT-PCR
2.3. Phân tích và đánh giá kết quả
2.4. In và trả kết quả
IV. NHẬN ĐỊNH KẾT QUẢ
Chứng dương phải xuất hiện đồ thị huỳnh quang trên đường giới hạn cơ bản, chứng âm không có bất kỳ đường đồ thị huỳnh quang nào xuất hiện. Đường đồ thị huỳnh quang của mẫu có thể xuất hiện hoặc không xuất hiện trên đường giới hạn cơ bản, căn cứ vào đó để kết luận kết quả.
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
- Trong trường hợp positive control (PC) và negative (NC) xuất hiện không đúng với diễn giải ở phần IV thì phải kiểm tra lại Master mix, chứng dương và quá trình tách RNA tổng số, và thực hiện lại toàn bộ xét nghiệm.
- Nếu đường đồ thị huỳnh quang của mẫu xuất hiện ở ngoài chu kỳ thứ 40 thì phải cẩn thận kiểm tra và đánh giá lại mẫu
166. Influenza virus A, B giải trình tự gene
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Phát hiện gen đặc trưng của influenza virus A và B trong bệnh phẩm đường hô hấp.
2. Nguyên lý
Xác định influenza virus A và B bằng kỹ thuật giải trình tự nucleotide của gen đặc trưng.
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: Cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Tủ an toàn sinh học cấp 2
- Máy PCR
- Máy đọc điện di
- Máy giải trình tự gen
- Máy ly tâm 25000 x g
- Máy ly tâm dùng cho tube 0,2 ml
- Máy ủ nhiệt
- Máy vortex
- Bộ lưu điện
- Tủ lạnh 2 oC - 8 oC
- Tủ âm sâu (-20 oC hoặc -70 oC)
- Micropipette
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
Thực hiện xét nghiệm 02 mẫu/lần.
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Bông | kg | 0,001 |
| 2 | Cồn | ml | 1,000 |
| 3 | Bơm kim tiêm | Cái | 1,000 |
| 4 | Panh | Cái | 0,0001 |
| 5 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 6 | Hộp vận chuyển bệnh phẩm | Test | 0,001 |
| 7 | Tube đựng bệnh phẩm | Cái | 2,000 |
| 8 | Găng không có bột | Đôi | 0,500 |
| 9 | Sinh phẩm chẩn đoán | Test | 1,000 |
| 10 | Khấu hao sinh phẩm cho chạy chứng và kiểm tra chất lượng | Test | 1,350 |
| 11 | Kit tách chiết RNA từ virus | Test | 2,350 |
| 12 | Primer 1 (primer đặc hiệu) | ml | 0,0001 |
| 13 | Primer 2 (primer đặc hiệu) | ml | 0,0001 |
| 14 | Primer 3 (primer đặc hiệu) | ml | 0,0001 |
| 15 | Primer 4 (primer đặc hiệu) | ml | 0,0001 |
| 16 | Ống Eppendorf 1,5 ml | Tube | 3,000 |
| 17 | Ống Eppendorf 0,2 ml | Tube | 1,000 |
| 18 | Đầu côn 10 µl có lọc | Cái | 1,000 |
| 19 | Đầu côn 30 µl | Cái | 1,200 |
| 20 | Đầu côn 200 µl có lọc | Cái | 2,200 |
| 21 | Đầu côn 1 ml có lọc | Cái | 3,200 |
| 22 | Ethanol BDH | ml | 0,500 |
| 23 | Water-DEPC Treated | ml | 2,000 |
| 24 | Thạch | Gam | 0.075 |
| 25 | Ladder | ml | 0.0025 |
| 26 | Blue Juice Gel loading dye | ml | 0.003 |
| 27 | Ethidium Bromide | ml | 0.100 |
| 28 | TAE Buffer | ml | 0.100 |
| 29 | Giấy thấm | Cuộn | 0,100 |
| 30 | Giấy xét nghiệm | Tờ | 2,000 |
| 31 | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 32 | Bút viết kính | Cái | 0,020 |
| 33 | Bút bi | Cái | 0,010 |
| 34 | Mũ | Cái | 0,020 |
| 35 | Khẩu trang | Cái | 0,020 |
| 36 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 37 | Quần áo bảo hộ | Bộ | 0,005 |
| 38 | Dung dịch nước rửa tay | ml | 8,000 |
| 39 | Cồn sát trùng tay nhanh | ml | 1,000 |
| 40 | Dung dịch khử trùng | ml | 10,000 |
| 41 | Khăn lau tay | cái | 0,010 |
| 42 | Ngoại kiểm (nếu có)* |
| 0,020 |
* Ghi chú: Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/50 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 3 lần/1 năm).
3. Bệnh phẩm
Dịch hầu họng, dịch tỵ hầu, dịch súc họng, các loại dịch đường hô hấp dưới.
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu phiếu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
- Theo đúng quy định của chuyên ngành Vi sinh: xem chi tiết phụ lục 2.
- Từ chối những bệnh phẩm không đạt yêu cầu: xem chi tiết phụ lục 6.
2. Tiến hành kỹ thuật
2.1. Tách chiết RNA tổng số
2.2. Thực hiện phản ứng RT-PCR
2.3. Thực hiện phản ứng PCR
2.4. Điện di kiểm tra sản phẩm
2.5. Giải trình tự gen
2.6. Kiểm tra và so sánh trình tự gen của Influenza virus A, B trên ngân hàng dữ liệu gen quốc tế
IV. NHẬN ĐỊNH KẾT QUẢ
Sản phẩm PCR phải có một băng đặc hiệu duy nhất, rõ nét và không bị đứt gẫy. Trình tự DNA của gen đích không bị nhiễu và phải có độ tương đồng ≥ 90 % mới có thể kết luận được Influenza virus A, B
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
- Trong trường hợp không có sản phẩm PCR, cần phải kiểm tra lại quá trình tách chiết RNA tổng số, chất lượng primers và master mix, và thực hiện lại toàn bộ xét nghiệm.
- Nếu trình tự DNA bị nhiễu cần phải kiểm tra lại độ đặc hiệu của sản phẩm PCR hoặc quá trình chạy PCR sequencing bị nhiễm chéo.
167. JEV IgM miễn dịch bán tự động
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Phát hiện kháng thể IgM đặc hiệu với virus Viêm não Nhật Bản (Japanese encephalitis virus - JEV) trong huyết thanh, huyết tương hoặc dịch não tủy.
2. Nguyên lý
Phát hiện kháng thể IgM đặc hiệu với JEV bằng kỹ thuật ELISA (miễn dịch gắn enzyme).
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện: Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Dàn máy ELISA
- Tủ lạnh 2o - 8 oC
- Micropipette các loại
- Đồng hồ bấm giây
- Máy ly tâm thường
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
Thực hiện xét nghiệm 10 mẫu/lần.
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Ống lấy bệnh phẩm | Ống | 1,000 |
| 2 | Bơm tiêm | Cái | 1,000 |
| 3 | Bông | Kg | 0,001 |
| 4 | Cồn 90 độ (vệ sinh dụng cụ) | ml | 10,000 |
| 5 | Panh | Cái | 0,0001 |
| 6 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 7 | Hộp vận chuyển bệnh phẩm | Cái | 0,0001 |
| 8 | Sinh phẩm chẩn đoán | Test | 1,000 |
| 9 | Khấu hao sinh phẩm cho chạy chứng và kiểm tra chất lượng | Test | 0,500 |
| 10 | Đầu côn 1ml | cái | 2,000 |
| 11 | Đầu côn 100µl - 200 µl | Cái | 3,000 |
| 12 | Axít ngâm rửa | ml | 10,000 |
| 13 | Nước cất | ml | 250,000 |
| 14 | Ống nghiệm thủy tinh | Ống | 2,000 |
| 15 | Mũ | Cái | 0,020 |
| 16 | Khẩu trang | Cái | 0,020 |
| 17 | Găng tay | Đôi | 2,000 |
| 18 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 19 | Quần áo bảo hộ | Bộ | 0,001 |
| 20 | Bút viết kính | Cái | 0,020 |
| 21 | Bút bi | Cái | 0,010 |
| 22 | Sổ lưu kết quả xét nghiệm | Quyển | 0,001 |
| 23 | Cồn sát trùng tay nhanh | ml | 1,000 |
| 24 | Dung dịch nước rửa tay | ml | 8,000 |
| 25 | Khăn lau tay | Cái | 0,010 |
| 26 | Giấy trả kết quả xét nghiệm | Tờ | 2,000 |
| 27 | Ngoại kiểm (nếu có)* |
| 0,020 |
* Ghi chú: Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/50 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 3 lần/1 năm).
3. Bệnh phẩm
Huyết thanh, huyết tương, dịch não tủy.
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu phiếu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
- Theo đúng quy định của chuyên ngành Vi sinh: xem chi tiết phụ lục 2.
- Từ chối những bệnh phẩm không đạt yêu cầu: xem chi tiết phụ lục 6.
2. Tiến hành kỹ thuật
Bộ sinh phẩm MAC-ELISA chẩn đoán viêm não nhật bản (Viện VSDT)
2.1. Chuẩn bị huyết thanh hoặc huyết tương hoặc dịch não tủy người bệnh theo hướng dẫn của nhà sản xuất
2.2. Chuẩn bị hóa chất: pha dung dịch rửa, chứng âm, chứng dương…
2.3. Viết sơ đồ mẫu
2.4. Nhỏ mẫu, chứng theo sơ đồ vào các giếng
2.5. Ủ mẫu
2.6. Rửa giếng, thêm kháng nguyên, ủ mẫu.
2.7. Rửa giếng, thêm cộng hợp, ủ mẫu
2.8. Rửa giếng, thêm cơ chất, ủ tránh ánh sáng
2.9. Thêm chất dừng phản ứng, đọc kết quả bằng máy đo quang
IV. NHẬN ĐỊNH KẾT QUẢ
Kết quả được chấp nhận khi giá trị OD của các giếng chứng đạt đủ điều kiện theo hướng dẫn của nhà sản xuất.
+ Dương tính khi:
OD mẫu xét nghiệm/OD chứng âm ≥ 2
+ Mẫu cần kiểm tra lại khi:
3 x OD chứng âm < OD mẫu xét nghiệm < 5 x OD chứng âm
+ Âm tính khi:
OD mẫu xét nghiệm ≤ 3 x OD chứng âm
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
1. Sai sót
Có thể xảy ra hiện tượng âm tính giả hoặc dương tính giả, thường do:
- Chứng âm và những mẫu bệnh phẩm âm tính bị nhiễm chéo bởi huyết thanh/huyết tương có nồng độ kháng thể cao.
- Hóa chất bị nhiễm bẩn.
- Đọc kết quả quá thời gian qui định sau khi dừng phản ứng.
2. Xử trí
- Tuân thủ đúng các bước quy trình hướng dẫn của nhà sản xuất và hướng dẫn về độ ổn định hóa chất xét nghiệm trong bộ sinh phẩm sử dụng.
- Kiểm tra và vệ sinh máy rửa thường xuyên trước và sau khi làm xét nghiệm.
- Chia hóa chất (chất cộng hợp, dung dịch hiện màu và dừng phản ứng) vào ống nghiệm sạch trước mỗi lần nhỏ.
168. Measle virus Ab miễn dịch bán tự động
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Phát hiện kháng thể IgM kháng virus sởi trong huyết thanh hoặc huyết tương.
2. Nguyên lý
Phát hiện kháng thể IgM kháng virus sởi dựa trên nguyên lý của kỹ thuật ELISA (miễn dịch gắn enzyme) (VD)
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: Cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Hệ thống máy ELISA
- Máy ly tâm thường
- Tủ lạnh 2 oC - 8 oC
- Micropipette các loại
- Đồng hồ bấm giây
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
Thực hiện xét nghiệm 10 mẫu/lần
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Ống lấy bệnh phẩm | Ống | 1,000 |
| 2 | Bơm tiêm | Cái | 1,000 |
| 3 | Bông | Kg | 0,001 |
| 4 | Cồn 90 độ (vệ sinh dụng cụ) | ml | 10,000 |
| 5 | Panh | Cái | 0,0001 |
| 6 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 7 | Hộp vận chuyển bệnh phẩm | Cái | 0,0001 |
| 8 | Sinh phẩm chẩn đoán | Test | 1,000 |
| 9 | Khấu hao sinh phẩm cho chạy chứng và kiểm tra chất lượng | Test | 0,500 |
| 10 | Đầu côn 1ml | cái | 2,000 |
| 11 | Đầu côn 100µl - 200 µl | Cái | 3,000 |
| 12 | Axit ngâm rửa | ml | 10,000 |
| 13 | Nước cất | ml | 250,000 |
| 14 | Ống nghiệm thủy tinh | Ống | 2,000 |
| 15 | Mũ | Cái | 0,020 |
| 16 | Khẩu trang | Cái | 0,020 |
| 17 | Găng tay | Đôi | 2,000 |
| 18 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 19 | Quần áo bảo hộ | Bộ | 0,001 |
| 20 | Bút viết kính | Cái | 0,020 |
| 21 | Bút bi | Cái | 0,010 |
| 22 | Sổ lưu kết quả xét nghiệm | Quyển | 0,001 |
| 23 | Cồn sát trùng tay nhanh | ml | 1,000 |
| 24 | Dung dịch nước rửa tay | ml | 8,000 |
| 25 | Khăn lau tay | Cái | 0,010 |
| 26 | Giấy trả kết quả xét nghiệm | Tờ | 2,000 |
| 27 | Ngoại kiểm (nếu có)* |
| 0,020 |
* Ghi chú: Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/50 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 3 lần/1 năm).
3. Bệnh phẩm
Huyết thanh hoặc huyết tương của người bệnh
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu phiếu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
- Theo đúng quy định của chuyên ngành Vi sinh: xem chi tiết phụ lục 2.
- Từ chối những bệnh phẩm không đạt yêu cầu: xem chi tiết phụ lục 6.
2. Tiến hành kỹ thuật
Bộ sinh phẩm Measles Platelia IgM - Biorad (VD)
2.1. Ly tâm ống bệnh phẩm, chuẩn bị huyết thanh hoặc huyết tương
2.2. Chuẩn bị hóa chất: pha dung dịch rửa, chứng âm, chứng dương…
2.3. Viết sơ đồ mẫu
2.4. Nhỏ dung dịch trung hòa, mẫu, chứng theo sơ đồ vào các giếng
2.5. Ủ mẫu
2.6. Rửa giếng, thêm cộng hợp, ủ mẫu
2.7. Rửa giếng, thêm cơ chất, ủ tránh sáng
2.8. Thêm chất dừng phản ứng, đọc kết quả bằng máy đo quang
IV. NHẬN ĐỊNH KẾT QUẢ
- Kết quả được chấp nhận khi giá trị OD của các giếng chứng đạt đủ điều kiện theo hướng dẫn của nhà sản xuất
- Tính C.O theo hướng dẫn của nhà sản xuất
+ Dương tính khi: OD mẫu > 1.2*C.O
+ Mẫu cần kiểm tra lại khi:
C.O ≤ OD mẫu xét nghiệm ≤ 1.2*C.O
+ Âm tính khi: OD mẫu < C.O
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
1. Sai sót: Có thể xảy ra hiện tượng âm tính giả hoặc dương tính giả, thường do:
- Chứng âm và những mẫu bệnh phẩm âm tính bị nhiễm chéo bởi huyết thanh/huyết tương có nồng độ kháng thể cao.
- Hóa chất bị nhiễm bẩn, nhiễm các tác nhân oxid hóa.
- Đọc kết quả quá 20 phút sau khi dừng phản ứng.
2. Xử trí
- Tuân thủ đúng các bước quy trình hướng dẫn của nhà sản xuất và hướng dẫn về độ ổn định hóa chất xét nghiệm trong bộ sinh phẩm sử dụng.
- Kiểm tra và vệ sinh máy rửa thường xuyên trước và sau khi làm xét nghiệm.
- Chia hóa chất (chất cộng hợp, dung dịch hiện màu và dừng phản ứng) vào ống nghiệm sạch trước mỗi lần nhỏ.
169. Rotavirus test nhanh
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Phát hiện kháng nguyên rota virus trong bệnh phẩm phân.
2. Nguyên lý
Phát hiện kháng nguyên rota virus dựa trên nguyên lý của kỹ thuật sắc ký miễn dịch.
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện: Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: Cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Que tăm bông lấy bệnh phẩm.
- Ống nghiệm (được cung cấp sẵn trong bộ kit).
- Nước muối sinh lý.
- Đồng hồ bấm giây.
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
Thực hiện xét nghiệm 02 mẫu/lần
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Tăm bông vô trùng | Cái | 1,000 |
| 2 | Lọ vô trùng | Cái | 1,000 |
| 3 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 4 | Hộp vận chuyển bệnh phẩm | Cái | 0,001 |
| 5 | Sinh phẩm chẩn đoán | Test | 1,000 |
| 6 | Khấu hao sinh phẩm cho chạy chứng, kiểm tra chất lượng | Test | 0,100 |
| 7 | Giấy thấm | Cuộn | 0,100 |
| 8 | Giấy xét nghiệm | Tờ | 2,000 |
| 9 | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 10 | Bút viết kính | Cái | 0,020 |
| 11 | Bút bi | Cái | 0,010 |
| 12 | Mũ | Cái | 0,020 |
| 13 | Khẩu trang | Cái | 0,020 |
| 14 | Găng tay | Đôi | 0,100 |
| 15 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 16 | Quần áo bảo hộ | Bộ | 0,005 |
| 17 | Dung dịch nước rửa tay | ml | 8,000 |
| 18 | Cồn sát trùng tay nhanh | ml | 1,000 |
| 19 | Dung dịch khử trùng | ml | 10,000 |
| 20 | Khăn lau tay | Cái | 0,010 |
3. Bệnh phẩm
Phân của người bệnh
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu phiếu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
- Theo đúng quy định của chuyên ngành Vi sinh: xem chi tiết phụ lục 2.
- Từ chối những bệnh phẩm không đạt yêu cầu: xem chi tiết phụ lục 6.
2. Tiến hành kỹ thuật
Bộ sinh phẩm chẩn đoán SD Bioline Rotavirus (VD).
| Các bước | Xét nghiệm phát hiện Rota virus |
| 1. | - Đưa test cần làm để ổn định ở nhiệt độ phòng trước khi làm. Lấy thanh xét nghiệm cần thiết. |
| 2. | - Hút hút dung dịch pha loãng bệnh phẩm theo hướng dẫn |
| 3. | - Lấy khoảng 50 mg phân bằng que tăm bông vô trùng nhúng vào ống nghiệm có chứa dung dịch pha loãng. |
| 4. | - Xoay tròn que tăm bông để bệnh phẩm hoà vào dung dịch pha loãng theo hướng dẫn. Đậy nắp ống nghiệm đã có bệnh phẩm lại. |
| 5. | - Nhỏ dung dich bệnh phẩm đã pha loãng vào giếng nhỏ bệnh phẩm (có chữ S). |
| 6. | - Đọc kết quả sau 10-20 phút. Quá 20 phút, kết quả không có giá trị. |
IV. NHẬN ĐỊNH KẾT QUẢ
- Âm tính: Chỉ 1 một đường màu xuất hiện ở vùng chứng C.
- Dương tinh: 2 đường màu xuất hiện ở vùng chứng (C) và vùng thử nghiệm (T).
- Không có giá trị: Không thấy xuất hiện đường màu nào hoặc chỉ có một đường màu tại vùng thử nghiệm (T). Khi đó phải tiến hành làm lại xét nghiệm với một thanh thử khác.
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
- Âm tính giả: Lượng virus đào thải ra ngoài quá thấp, hoặc do sai sót trong quá trình lấy và xử lý mẫu.
- Tham khảo thêm hướng dẫn của nhà sản xuất.
170. RSV Ab miễn dịch bán tự động
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Phát hiện kháng thể IgM kháng RSV (Respiratory syncytial virus) trong huyết thanh hoặc huyết tương.
2. Nguyên lý
Phát hiện kháng thể IgM kháng RSV (Respiratory syncytial virus) dựa trên nguyên lý của kỹ thuật ELISA (miễn dịch gắn enzyme) (VD).
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện: Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: Cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Hệ thống máy ELISA
- Đồng hồ bấm giây
- Máy ly tâm thường
- Tủ lạnh 2 oC - 8 oC
- Micropipette các loại
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
Thực hiện xét nghiệm 05 mẫu/lần.
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Ống lấy bệnh phẩm | Ống | 1,000 |
| 2 | Bơm tiêm | Cái | 1,000 |
| 3 | Bông | Kg | 0,001 |
| 4 | Cồn 90 độ (vệ sinh dụng cụ) | ml | 10,000 |
| 5 | Panh | Cái | 0,0001 |
| 6 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 7 | Hộp vận chuyển bệnh phẩm | Cái | 0,0001 |
| 8 | Sinh phẩm chẩn đoán | Test | 1,000 |
| 9 | Khấu hao sinh phẩm cho chạy chứng, kiểm tra chất lượng | Test | 0,500 |
| 10 | Đầu côn 1ml | cái | 2,000 |
| 11 | Đầu côn 100µl - 200 µl | Cái | 3,000 |
| 12 | Axít ngâm rửa | ml | 10,000 |
| 13 | Nước cất | ml | 250,000 |
| 14 | Ống nghiệm thủy tinh | Ống | 2,000 |
| 15 | Mũ | Cái | 0,020 |
| 16 | Khẩu trang | Cái | 0,020 |
| 17 | Găng tay | Đôi | 2,000 |
| 18 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 19 | Quần áo bảo hộ | Bộ | 0,001 |
| 20 | Bút viết kính | Cái | 0,020 |
| 21 | Bút bi | Cái | 0,010 |
| 22 | Sổ lưu kết quả xét nghiệm | Quyển | 0,001 |
| 23 | Cồn sát trùng tay nhanh | ml | 1,000 |
| 24 | Dung dịch nước rửa tay | ml | 8,000 |
| 25 | Khăn lau tay | Cái | 0,010 |
| 26 | Giấy trả kết quả xét nghiệm | Tờ | 2,000 |
| 27 | Ngoại kiểm (nếu có)* |
| 0,020 |
* Ghi chú: Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/50 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 3 lần/1 năm).
3. Bệnh phẩm
Huyết thanh, huyết tương.
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu phiếu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
- Theo đúng quy định của chuyên ngành Vi sinh: xem chi tiết phụ lục 2.
- Từ chối những bệnh phẩm không đạt yêu cầu: xem chi tiết phụ lục 6.
2. Tiến hành kỹ thuật
2.1. Ly tâm ống bệnh phẩm, chuẩn bị huyết thanh hoặc huyết tương
2.2. Chuẩn bị hóa chất: pha dung dịch rửa, chứng âm, chứng dương…
2.3. Viết sơ đồ mẫu
2.4. Nhỏ dung dịch trung hòa, mẫu, chứng theo sơ đồ vào các giếng
2.5. Ủ mẫu
2.6. Rửa giếng, thêm cộng hợp, ủ mẫu
2.7. Rửa giếng, thêm cơ chất, ủ tránh sáng
2.8. Thêm chất dừng phản ứng, đọc kết quả
IV. NHẬN ĐỊNH KẾT QUẢ
- Kết quả được chấp nhận khi giá trị OD của các giếng chứng đạt đủ điều kiện theo hướng dẫn của nhà sản xuấ.
- Tính C.O theo hướng dẫn của nhà sản xuất
+ Dương tính khi: OD mẫu ≥ C.O
+ Âm tính khi: OD mẫu < C.O
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
1. Sai sót
Có thể xảy ra hiện tượng âm tính giả hoặc dương tính giả, thường do:
- Chứng âm và những mẫu bệnh phẩm âm tính bị nhiễm chéo bởi huyết thanh/huyết tương có nồng độ kháng thể cao.
- Hóa chất bị nhiễm bẩn.
- Đọc kết quả quá thời gian qui định sau khi dừng phản ứng.
2. Xử trí
- Tuân thủ đúng các bước quy trình hướng dẫn của nhà sản xuất và hướng dẫn về độ ổn định hóa chất xét nghiệm trong bộ sinh phẩm sử dụng.
- Kiểm tra và vệ sinh máy rửa thường xuyên trước và sau khi làm xét nghiệm.
- Chia hóa chất (chất cộng hợp, dung dịch hiện màu và dừng phản ứng) vào ống nghiệm sạch trước mỗi lần nhỏ.
171. RSV Real-time PCR
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Xác định sự có mặt gen đặc trưng của RSV (Respiratory syncytial virus) trong huyết thanh hoặc huyết tương.
2. Nguyên lý
Sử dụng cặp mồi đặc hiệu để xác định sự có mặt gen đặc trưng của RSV (Respiratory syncytial virus) bằng kỹ thuật Real-time RT - PCR
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ
hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: Cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Tủ an toàn sinh học cấp 2
- Máy Real-time PCR và hệ thống máy tính
- Bộ lưu điện
- Máy ly tâm 25000 x g
- Máy ly tâm dùng cho tube 0,2 ml
- Máy ủ nhiệt
- Máy vortex
- Tủ lạnh 2 oC - 8 oC
- Tủ âm sâu (-20 oC hoặc -70 oC)
- Micropipette
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
Thực hiện xét nghiệm 02 mẫu/lần.
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Bông | kg | 0,001 |
| 2 | Cồn | ml | 1,000 |
| 3 | Bơm kim tiêm | Cái | 1,000 |
| 4 | Panh | Cái | 0,0001 |
| 5 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 6 | Hộp vận chuyển bệnh phẩm | Test | 0,001 |
| 7 | Tube đựng bệnh phẩm | Cái | 2,000 |
| 8 | Găng không có bột (DNase-RNase free) | Cái | 0,500 |
| 9 | Sinh phẩm chẩn đoán | Test | 1,000 |
| 10 | Khấu hao sinh phẩm cho kiểm tra lại | Test | 1,350 |
| 11 | Kit tách chiết RNA từ virus | Test | 2,350 |
| 12 | Primer 1 | ml | 0,0001 |
| 13 | Primer 2 | ml | 0,0001 |
| 14 | Probe | ml | 0,0001 |
| 15 | Ống Eppendorf 1,5 ml | Tube | 3,000 |
| 16 | Ống Eppendorf 0,2 ml | Tube | 1,000 |
| 17 | Đầu côn 10 µl có lọc | Cái | 1,000 |
| 18 | Đầu côn 30 µl | Cái | 1,200 |
| 19 | Đầu côn 200 µl có lọc | Cái | 2,200 |
| 20 | Đầu côn 1 ml có lọc | Cái | 3,200 |
| 21 | Ethanol BDH | ml | 0,500 |
| 22 | Water-DEPC Treated | ml | 2,000 |
| 23 | Giấy thấm | Cuộn | 0,100 |
| 24 | Giấy xét nghiệm | Tờ | 2,000 |
| 25 | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 26 | Bút viết kính | Cái | 0,020 |
| 27 | Bút bi | Cái | 0,010 |
| 28 | Mũ | Cái | 0,020 |
| 29 | Khẩu trang | Cái | 0,020 |
| 30 | Găng tay | Đôi | 0,100 |
| 31 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 32 | Quần áo bảo hộ | Bộ | 0,005 |
| 33 | Dung dịch nước rửa tay | ml | 8,000 |
| 34 | Cồn sát trùng tay nhanh | ml | 1,000 |
| 35 | Dung dịch khử trùng | ml | 10,000 |
| 36 | Khăn lau tay | cái | 0,010 |
| 37 | Ngoại kiểm (nếu có)* |
| 0,020 |
* Ghi chú: Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/50 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 3 lần/1 năm).
3. Bệnh phẩm
Dịch ngoáy họng, dịch đường hô hấp, các loại dịch khác …
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu phiếu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1.Lấy bệnh phẩm
- Theo đúng quy định của chuyên ngành Vi sinh: xem chi tiết phụ lục 2.
- Từ chối những bệnh phẩm không đạt yêu cầu: xem chi tiết phụ lục 6.
2.Tiến hành kỹ thuật
2.1. Tách chiết RNA tổng số
2.2. Thực hiện Real-time RT-PCR
2.3. Phân tích và đánh giá kết quả
2.4. In và trả kết quả
IV. NHẬN ĐỊNH KẾT QUẢ
Chứng dương phải xuất hiện đồ thị huỳnh quang trên đường giới hạn cơ bản, chứng âm không có bất kỳ đường đồ thị huỳnh quang nào xuất hiện. Đường đồ thị huỳnh quang của mẫu có thể xuất hiện hoặc không xuất hiện trên đường giới hạn cơ bản, căn cứ vào đó để kết luận kết quả.
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
- Trong trường positive control (PC) và negative (NC) xuất hiện không đúng với diễn giải ở phần IV thì phải kiểm tra lại Master mix và chứng dương và quá trình tách RNA tổng số, và thực hiện lại toàn bộ xét nghiệm.
- Nếu đường đồ thị huỳnh quang của mẫu xuất hiện ở ngoài chu kỳ thứ 40 thì phải cẩn thận kiểm tra và đánh giá lại mẫu
172. Rubella virus IgM miễn dịch bán tự động
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Phát hiện kháng thể IgM kháng Rubella virus trong huyết thanh hoặc huyết tương.
2. Nguyên lý
Phát hiện kháng thể IgM kháng Rubella virus dựa trên nguyên lý của kỹ thuật ELISA (miễn dịch gắn enzyme) (VD).
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: Cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Dàn máy ELISA
- Máy ly tâm thường
- Tủ lạnh 2 oC - 8 oC
- Tủ âm sâu (- 20 oC hoặc - 70 oC) (nếu có)
- Micropipette đơn kênh thể tích từ 10µl đến 1000µl.
- Bộ pipetman 8 kênh (nếu có)
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
Thực hiện xét nghiệm 02 mẫu/lần.
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Bông | Kg | 0,001 |
| 2 | Dây garô | Cái | 0,001 |
| 3 | Cồn | ml | 1,000 |
| 4 | Bơm kim tiêm | Cái | 1,000 |
| 5 | Panh | Cái | 0,0001 |
| 6 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 7 | Hộp vận chuyển bệnh phẩm | Cái | 0,001 |
| 8 | Tube đựng bệnh phẩm | Cái | 2,000 |
| 9 | Sinh phẩm chẩn đoán | Test | 1,000 |
| 10 | Khấu hao sinh phẩm cho chạy chứng, kiểm chất lượng | Test | 2,000 |
| 11 | Chứng ngoại kiểm âm (nếu có) | ml | 0,100 |
| 12 | Chứng ngoại kiểm dương (nếu có) | ml | 0,100 |
| 13 | Ngoại kiểm (nếu có)* |
| 0,020 |
| 14 | Nước cất | ml | 2,000 |
| 15 | Đầu côn 1000 µl | Cái | 3,000 |
| 16 | Đầu côn 200 µl | Cái | 5,000 |
| 17 | Giấy thấm | Cuộn | 0,100 |
| 18 | Giấy xét nghiệm | Tờ | 2,000 |
| 19 | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 20 | Bút viết kính | Cái | 0,020 |
| 21 | Bút bi | Cái | 0,010 |
| 22 | Mũ | Cái | 0,020 |
| 23 | Khẩu trang | Cái | 0,020 |
| 24 | Găng tay | Đôi | 0,100 |
| 25 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 26 | Quần áo bảo hộ | Bộ | 0,005 |
| 27 | Dung dịch nước rửa tay | ml | 8,000 |
| 28 | Cồn sát trùng tay nhanh | ml | 1,000 |
| 29 | Dung dịch khử trùng | ml | 10,000 |
| 30 | Khăn lau tay | Cái | 0,010 |
* Ghi chú:
Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/50 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 3 lần/1 năm).
3. Bệnh phẩm
Huyết thanh hoặc huyết tương.
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
- Theo đúng quy định của chuyên ngành Vi sinh: xem chi tiết phụ lục 2.
- Từ chối những bệnh phẩm không đạt yêu cầu: xem chi tiết phụ lục 6.
2. Tiến hành kỹ thuật
Bộ sinh phẩm PlateliaTM Rubella IgM - BioRad (VD)
| Các bước | Xét nghiệm định tính Rubella IgM |
| 2.1 | Để Số lượng sinh phẩm cần dùng ở nhiệt độ phòng 30 phút trước khi làm xét nghiệm |
| 2.2 | Đánh số, sắp xếp bệnh phẩm và viết sơ đồ theo thứ tự. |
| 2.3 | Chuẩn bị dung dịch rửa |
| 2.4 | Lấy đủ số giếng cần dùng và đặt vào giá. |
| 2.5 | Chuẩn bị dung dich cộng hợp |
| 2.6 | Pha loãng chứng và bệnh phẩm với dung dịch pha loãng theo tỷ lệ 1:21 |
| 2.7 | Nhỏ chứng và mẫu huyết thanh người bệnh đã pha loãng |
| 2.8 | Đậy tấm và ủ |
| 2.9 | Rửa phiến nhựa. |
| 2.10 | Nhỏ chất cộng hợp vào mỗi giếng |
| 2.11 | Đậy tấm và ủ |
| 2.12 | Rửa phiến nhựa |
| 2.13 | Nhỏ dung dịch hiện màu vào mỗi giếng |
| 2.14 | Ủ, không đậy tấm và tránh ánh sáng |
| 2.15 | Dừng phản ứng. |
| 2.16 | Đọc kết quả ở bước sóng 450 và 620nm trong vòng 30 phút sau khi dừng phản ứng. |
IV. NHẬN ĐỊNH KẾT QUẢ
1. Tính giá trị ngưỡng (CO):
CO = Trung bình cộng của các chứng ngưỡng (OD R4)
2. Tính tỷ số mẫu bệnh phẩm: Tỷ số bệnh phẩm = OD bệnh phẩm/CO
3. Điều kiện của phản ứng:
- CO ≥ 0,3
- 0,8 x CO < OD R4 ≤ 1 ,2 x CO
(OD của mỗi giá trị R4 phải nhỏ hơn 20 % giá trị CO)
- OD chứng âm (R3)/CO ≤ 0,3
- OD chứng dương (R5)/CO ≥ 1,5
Nếu các chỉ số kiểm tra chất lượng không đáp ứng các điều kiện trên thì phải làm lại xét nghiệm.
4. Diễn giải kết quả
+ Âm tính: Tỷ số bệnh phẩm < 0,8
+ Nghi ngờ: 0,8 ≤ tỷ số bệnh phẩm < 1 → Yêu cầu làm lại xét nghiệm sau 3 tuần với một mẫu bệnh phẩm khác.
+ Dương tính: tỷ số bệnh phẩm ≥ 1
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
1. Sai sót
Có thể xảy ra hiện tượng âm tính giả hoặc dương tính giả, thông thường do:
- Thực hiện sai các bước trong quy trình hướng dẫn.
- Chứng âm và những mẫu bệnh phẩm âm tính bị nhiễm chéo bởi huyết thanh/ huyết tương có nồng độ kháng thể cao.
- Dung dịch cơ chất bị nhiễm bởi các tác nhân oxid hoá (thuốc tẩy, ion kim loại v.v…)
- Dung dịch dừng phản ứng bị nhiễm bẩn.
2. Xử trí
- Tuân thủ đúng các bước quy trình hướng dẫn của nhà sản xuất và hướng dẫn về độ ổn định hóa chất xét nghiệm trong bộ sinh phẩm sử dụng.
- Kiểm tra và vệ sinh máy rửa thường xuyên trước và sau khi làm xét nghiệm
- Chia hóa chất (chất cộng hợp, dung dịch hiện màu và dừng phản ứng) vào ống nghiệm sạch trước mỗi lần nhỏ.
- Tuân thủ đúng quy trình xét nghiệm
- Chia hóa chất (chất cộng hợp, dung dịch hiện màu và dừng phản ứng) vào ống nghiệm sạch trước mỗi lần nhỏ.
173. Rubella virus IgM miễn dịch tự động
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Phát hiện kháng thể IgM kháng rubella virus trong huyết thanh hoặc huyết tương.
2. Nguyên lý
Phát hiện kháng thể IgM kháng rubella virus dựa trên nguyên lý của kỹ thuật CLIA (miễn dịch điện hóa phát quang) (VD).
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện: Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: Cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Hệ thống máy miễn dịch tự động
- Bộ lưu điện
- Máy ly tâm thường
- Tủ lạnh 2 oC - 8 oC
- Tủ âm sâu (- 20 oC hoặc - 70 oC) (nếu có)
- Micropipette.
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
Thực hiện xét nghiệm 02 mẫu/lần.
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Bông | Kg | 0,001 |
| 2 | Dây garô | Cái | 0,001 |
| 3 | Cồn | ml | 1,000 |
| 4 | Bơm kim tiêm | Cái | 1,000 |
| 5 | Panh | Cái | 0,0001 |
| 6 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 7 | Hộp vận chuyển bệnh phẩm | Test | 0,001 |
| 8 | Tube đựng bệnh phẩm | Cái | 1,000 |
| 9 | Sinh phẩm chẩn đoán | Test | 1,000 |
| 10 | Khấu hao sinh phẩm cho chạy chuẩn | Test | 0,100 |
| 11 | Khấu hao sinh phẩm cho chạy chứng, kiểm tra chất lượng | Test | 2,000 |
| 12 | Chứng ngoại kiểm âm (nếu có) | ml | 0,150 |
| 13 | Chứng ngoại kiểm dương (nếu có) | ml | 0,150 |
| 14 | Ngoại kiểm (nếu có)* |
| 0,020 |
| 15 | Control | Test | 0,100 |
| 16 | Cleancell M | ml | 3,000 |
| 17 | Procell M | ml | 3,000 |
| 18 | Probe Wash M | ml | 2,000 |
| 19 | Preclean M | ml | 2,000 |
| 20 | Assay Tip/Cup E170 | chiếc | 3,000 |
| 21 | ISE Cleaning Solution F. HIT | ml | 0,500 |
| 22 | Nước cất | ml | 5,000 |
| 23 | Sample cup | Cái | 1,000 |
| 24 | Giấy thấm | Cuộn | 0,100 |
| 25 | Giấy xét nghiệm | Tờ | 2,000 |
| 26 | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 27 | Bút viết kính | Cái | 0,020 |
| 28 | Bút bi | Cái | 0,010 |
| 29 | Mũ | Cái | 0,020 |
| 30 | Khẩu trang | Cái | 0,020 |
| 31 | Găng tay | Đôi | 0,100 |
| 32 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 33 | Quần áo bảo hộ | Bộ | 0,005 |
| 34 | Dung dịch nước rửa tay | ml | 8,000 |
| 35 | Cồn sát trùng tay nhanh | ml | 1,000 |
| 36 | Dung dịch khử trùng | ml | 10,000 |
| 37 | Khăn lau tay | Cái | 0,010 |
* Ghi chú:
Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/50 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 3 lần/1 năm).
3. Bệnh phẩm
Huyết thanh hoặc huyết tương
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
- Theo đúng quy định của chuyên ngành Vi sinh: xem chi tiết phụ lục 2.
- Từ chối những bệnh phẩm không đạt yêu cầu: xem chi tiết phụ lục 6.
2. Tiến hành kỹ thuật: Bộ sinh phẩm Rubella IgM Elecsys - Roche (VD)
| Các bước | Xét nghiệm định tính Rubella IgM |
| 2.1 | Vào Reagent để kiểm tra Số lượng tests |
| 2.2 | Vào Calibration → Status để kiểm tra hiệu chuẩn |
| 2.3 | Chạy chứng |
| Chạy mẫu không dùng barcode | |
| 1. | Đánh số sample cup theo mã số bệnh phẩm. Hút huyết thanh/huyết tương vào sample cup tương ứng |
| 2. | Vào màn hình Workplace → Test Selection |
| 3. | Nhập mã bệnh phẩm |
| 4. | Chọn tên test là Rubella IgM |
| 5. | Vào Barcode Read Error |
| 6. | Nhập số rack và vị trí mẫu → Add → OK → Save |
| 7. | Đặt mẫu huyết thanh người bệnh cần chạy đã được hút vào Sample Cup lên Rack màu xám đúng vị trí đã order rồi đưa vào khu nạp giá mẫu. |
| 8. | Chọn Start → Chọn START ở màn hình Start Conditions |
| Chạy mẫu có barcode | |
| 1 | Nhập chỉ định xét nghiệm trên máy tính bằng phần mềm LIS |
| 2 | Đặt ống máu đã được dán barcode vào rack màu xám, quay mặt barcode ra phía ngoài rồi đưa vào khu nạp giá mẫu |
| 3 | Chọn Start → Chọn START ở màn hình Start Conditions |
IV. NHẬN ĐỊNH KẾT QUẢ
1. Đánh giá theo tiêu chuẩn nhà sản xuất
- Chạy kiểm tra chứng 1 và chứng 2 trên tất cả các điện cực dùng để chạy xét nghiệm.
- Giá trị chứng đạt được phải nằm trong khoảng giới hạn xác định.
2. Đánh giá theo tiêu chuẩn phòng xét nghiệm
Chứng nội kiểm, ngoại kiểm: Đánh giá kết quả dựa trên biểu đồ Levey-Jenning (nếu có)
3. Kết quả và báo cáo
- Âm tính: Nếu COI < 0.80
- Nghi ngờ: Nếu 0.80 ≤ COI < 1.0 → cần phải kiểm tra lại
- Dương tính: Nếu COI ≥ 1.0:
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
- Máy báo sample short (do bệnh phẩm bị đông hoặc không đủ) → Chú ý ly tâm mẫu thật kỹ ngay từ đầu hoặc hút mẫu ra cup.
- Không sử dụng thuốc thử đã quá hạn sử dụng.
- Tránh tạo bọt ở lọ thuốc thử và các loại mẫu (bệnh phẩm, calibration và chứng).
174. Rubella virus IgG miễn dịch bán tự động
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Xác định nồng độ kháng thể IgG kháng Rubella virus tong huyết thanh hoặc huyết tương.
2. Nguyên lý
Xác định nồng độ kháng thể IgG kháng Rubella virus dựa trên nguyên lý của kỹ thuật ELISA (miễn dịch gắn enzyme) (VD).
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện: Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: Cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Dàn máy ELISA
- Máy ly tâm thường.
- Tủ lạnh 2 oC - 8 oC
- Tủ âm sâu (- 20 oC hoặc - 70 oC) (nếu có)
- Micropipette đơn kênh thể tích từ 10µl đến 1000µl.
- Bộ pipetman 8 kênh (nếu có)
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
Thực hiện xét nghiệm 02 mẫu/lần.
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Bông | Kg | 0,001 |
| 2 | Dây garô | Cái | 0,001 |
| 3 | Cồn | ml | 1,000 |
| 4 | Bơm kim tiêm | Cái | 1,000 |
| 5 | Panh | Cái | 0,0001 |
| 6 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 7 | Hộp vận chuyển bệnh phẩm | Cái | 0,001 |
| 8 | Tube đựng bệnh phẩm | Cái | 2,000 |
| 9 | Sinh phẩm chẩn đoán | Test | 1,000 |
| 10 | Khấu hao sinh phẩm cho chạy chứng, kiểm tra chất lượng | Test | 2,000 |
| 11 | Chứng ngoại kiểm âm (nếu có) | ml | 0,100 |
| 12 | Chứng ngoại kiểm dương (nếu có) | ml | 0,100 |
| 13 | Ngoại kiểm (nếu có)* |
| 0,020 |
| 14 | Nước cất | ml | 2,000 |
| 15 | Đầu côn 1000 µl | Cái | 3,000 |
| 16 | Đầu côn 200 µl | Cái | 5,000 |
| 17 | Giấy thấm | Cuộn | 0,100 |
| 18 | Giấy xét nghiệm | Tờ | 2,000 |
| 19 | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 20 | Bút viết kính | Cái | 0,020 |
| 21 | Bút bi | Cái | 0,010 |
| 22 | Mũ | Cái | 0,020 |
| 23 | Khẩu trang | Cái | 0,020 |
| 24 | Găng tay | Đôi | 0,100 |
| 25 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 26 | Quần áo bảo hộ | Bộ | 0,005 |
| 27 | Dung dịch nước rửa tay | ml | 8,000 |
| 28 | Cồn sát trùng tay nhanh | ml | 1,000 |
| 29 | Dung dịch khử trùng | ml | 10,000 |
| 30 | Khăn lau tay | Cái | 0,010 |
* Ghi chú: Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/50 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 3 lần/1 năm).
3. Bệnh phẩm
Huyết thanh hoặc huyết tương.
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
- Theo đúng quy định của chuyên ngành Vi sinh: xem chi tiết phụ lục 2.
- Từ chối những bệnh phẩm không đạt yêu cầu: xem chi tiết phụ lục 6.
2.Tiến hành kỹ thuật
Bộ sinh phẩm PlateliaTM Rubella IgG - BioRad (VD)
| Các bước | Xét nghiệm định lượng Rubella IgG |
| 2.1 | Để Số lượng sinh phẩm cần dùng ở nhiệt độ phòng 30 phút trước khi làm xét nghiệm |
| 2.2 | Đánh số, sắp xếp bệnh phẩm và viết sơ đồ theo thứ tự. |
| 2.3 | Chuẩn bị dung dịch rửa |
| 2.4 | Lấy đủ số giếng cần dùng và đặt vào giá. |
| 2.5 | Pha loãng chứng và bệnh phẩm với dung dịch pha loãng theo tỷ lệ 1:21 |
| 2.6 | Nhỏ chứng và mẫu huyết thanh người bệnh đã pha loãng |
| 2.7 | Đậy tấm và ủ |
| 2.8 | Chuẩn bị dung dich cộng hợp |
| 2.9 | Rửa phiến nhựa. |
| 2.10 | Nhỏ chất cộng hợp vào mỗi giếng |
| 2.11 | Đậy tấm và ủ |
| 2.12 | Rửa phiến nhựa |
| 2.13 | Nhỏ dung dịch hiện màu vào mỗi giếng |
| 2.14 | Ủ, không đậy tấm và tránh ánh sáng |
| 2.15 | Dừng phản ứng. |
| 2.16 | Đọc kết quả ở bước sóng 450 và 620nm trong vòng 30 phút sau khi dừng phản ứng. |
IV. NHẬN ĐỊNH KẾT QUẢ
1. Xây dựng đường cong chuẩn
- Sự xuất hiện và nồng độ của kháng thể Rubella IgG có trong mẫu bệnh phẩm sẽ được xác định bằng cách so sánh độ hấp thụ của mẫu bệnh phẩm với nồng độ tính theo Đơn vị quốc tế (IU/ml) của các giá trị ngưỡng của đường cong chuẩn theo tiêu chuẩn của WHO RUBI 1-94.
- Vẽ đường cong chuẩn:
+ Trục tung (Y): Chấm các giá trị OD của R3, R4a, R4b, R4c.
+ Trục hoành (X): Chấm các điểm biểu thị các giá trị nồng độ tương ứng của R3, R4a, R4b, R4c (IU/ml)
- Đối với mỗi mẫu bệnh phẩm, tính hiệu giá kháng thể Rubella IgG bằng cách xác định nồng độ tương ứng từ đường cong chuẩn vẽ được với độ hấp thụ đo được.
2. Điều kiện của phản ứng
- OD chứng ngưỡng 15 (R4a) ≥ 0,2
- OD chứng ngưỡng 60 (R4b) ≥ 0 ,4
- OD R4a/OD R3 (chứng ng ưỡng 0) ≥ 0,5
- OD R4b/OD R4a ≥ 1,5
- OD chứng ngưỡng 200 (R4c)/OD R4b ≥ 1,2
3. Diễn giải kết quả
+ Âm tính: nếu hiệu giá < 10 IU/ml
+ Nghi ngờ: nếu 10 IU/ml ≤ hiệu giá < 15 IU/ml
+ Dương tính: nếu hiệu giá ≥ 15 IU/ml
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
1. Sai sót
Có thể xảy ra hiện tượng âm tính giả hoặc dương tính giả, thông thường do:
- Thực hiện sai các bước trong quy trình hướng dẫn.
- Chứng âm và những mẫu bệnh phẩm âm tính bị nhiễm chéo bởi huyết thanh/ huyết tương có nồng độ kháng thể cao.
- Dung dịch cơ chất bị nhiễm bởi các tác nhân oxid hoá (thuốc tẩy, ion kim loại v.v…)
- Dung dịch dừng phản ứng bị nhiễm bẩn.
2. Xử trí
- Tuân thủ đúng các bước quy trình hướng dẫn của nhà sản xuất và hướng dẫn về độ ổn định hóa chất xét nghiệm trong bộ sinh phẩm sử dụng.
- Kiểm tra và vệ sinh máy rửa thường xuyên trước và sau khi làm xét nghiệm
- Chia hóa chất (chất cộng hợp, dung dịch hiện màu và dừng phản ứng) vào ống nghiệm sạch trước mỗi lần nhỏ.
- Tuân thủ đúng quy trình xét nghiệm
- Chia hóa chất (chất cộng hợp, dung dịch hiện màu và dừng phản ứng) vào ống nghiệm sạch trước mỗi lần nhỏ.
175. Rubella virus IgG miễn dịch tự động
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Xác định nồng độ kháng thể IgG kháng rubella virus trong huyết thanh hoặc huyết tương.
2. Nguyên lý
Xác định nồng độ kháng thể IgG kháng rubella virus dựa trên nguyên lý của của kỹ thuật CLIA (miễn dịch điện hóa phát quang) (VD).
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: Cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Hệ thống máy miễn dịch tự động
- Bộ lưu điện
- Máy ly tâm thường.
- Tủ lạnh 2 oC - 8 oC
- Tủ âm sâu (- 20 oC hoặc - 70 oC) (nếu có)
- Micropipette đơn kênh thể tích từ 50 µl đến 200 µl..
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
Thực hiện xét nghiệm 02 mẫu/lần
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Bông | Kg | 0,001 |
| 2 | Dây garô | Cái | 0,001 |
| 3 | Cồn | ml | 1,000 |
| 4 | Bơm kim tiêm | Cái | 1,000 |
| 5 | Panh | Cái | 0,0001 |
| 6 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 7 | Hộp vận chuyển bệnh phẩm | Test | 0,001 |
| 8 | Tube đựng bệnh phẩm | Cái | 1,000 |
| 9 | Sinh phẩm chẩn đoán | Test | 1,000 |
| 10 | Khấu hao sinh phẩm cho chạy chuẩn | Test | 0,100 |
| 11 | Khấu hao sinh phẩm cho chạy chứng, kiểm tra chất lượng | Test | 2,000 |
| 12 | Control | Test | 0,100 |
| 13 | Chứng ngoại kiểm âm (nếu có) | ml | 0,150 |
| 14 | Chứng ngoại kiểm dương (nếu có) | ml | 0,150 |
| 15 | Ngoại kiểm (nếu có)* |
| 0,020 |
| 16 | Cleancell M | ml | 3,000 |
| 17 | Procell M | ml | 3,000 |
| 18 | Probe Wash M | ml | 2,000 |
| 19 | Preclean M | ml | 2,000 |
| 20 | Assay Tip/Cup E170 | chiếc | 3,000 |
| 21 | ISE Cleaning Solution F. HIT | ml | 0,500 |
| 22 | Nước cất | ml | 5,000 |
| 23 | Sample cup | Cái | 1,000 |
| 24 | Giấy thấm | Cuộn | 0,100 |
| 25 | Giấy xét nghiệm | Tờ | 2,000 |
| 26 | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 27 | Bút viết kính | Cái | 0,020 |
| 28 | Bút bi | Cái | 0,010 |
| 29 | Mũ | Cái | 0,020 |
| 30 | Khẩu trang | Cái | 0,020 |
| 31 | Găng tay | Đôi | 0,100 |
| 32 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 33 | Quần áo bảo hộ | Bộ | 0,005 |
| 34 | Dung dịch nước rửa tay | ml | 8,000 |
| 35 | Cồn sát trùng tay nhanh | ml | 1,000 |
| 36 | Dung dịch khử trùng | ml | 10,000 |
| 37 | Khăn lau tay | Cái | 0,010 |
* Ghi chú: Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/50 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 3 lần/1 năm).
3. Bệnh phẩm
Huyết thanh hoặc huyết tương
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
- Theo đúng quy định của chuyên ngành Vi sinh: xem chi tiết phụ lục 2.
- Từ chối những bệnh phẩm không đạt yêu cầu: xem chi tiết phụ lục 6.
2. Tiến hành kỹ thuật
Bộ sinh phẩm Rubella IgG Elecsys - Roche (VD)
| Các bước | Xét nghiệm định lượng Rubella IgG |
| 2.1 | Vào Reagent để kiểm tra Số lượng tests |
| 2.2 | Vào Calibration → Status để kiểm tra hiệu chuẩn |
| 2.3 | Chạy chứng |
| Chạy mẫu không dùng barcode | |
| 9. | Đánh số sample cup theo mã số bệnh phẩm. Hút huyết thanh/huyết tương vào sample cup tương ứng |
| 10. | Vào màn hình Workplace → Test Selection |
| 11. | Nhập mã bệnh phẩm |
| 12. | Chọn tên test là Rubella IgG |
| 13. | Vào Barcode Read Error |
| 14. | Nhập số rack và vị trí mẫu → Add → OK → Save |
| 15. | Đặt mẫu huyết thanh người bệnh cần chạy đã được hút vào Sample Cup lên Rack màu xám đúng vị trí đã order rồi đưa vào khu nạp giá mẫu. |
| 16. | Chọn Start → Chọn START ở màn hình Start Conditions |
| Chạy mẫu có barcode | |
| 1 | Nhập chỉ định xét nghiệm trên máy tính bằng phần mềm LIS |
| 2 | Đặt ống máu đã được dán barcode vào rack màu xám, quay mặt barcode ra phía ngoài rồi đưa vào khu nạp giá mẫu |
| 3 | Chọn Start → Chọn START ở màn hình Start Conditions |
IV. NHẬN ĐỊNH KẾT QUẢ
1. Đánh giá theo tiêu chuẩn nhà sản xuất
- Chạy kiểm tra chứng 1 và chứng 2 trên tất cả các điện cực dùng để chạy xét nghiệm.
- Giá trị chứng đạt được phải nằm trong khoảng giới hạn xác định.
2. Đánh giá theo tiêu chuẩn phòng xét nghiệm
Chứng nội kiểm, ngoại kiểm: Đánh giá kết quả dựa trên biểu đồ Levey-Jenning (nếu có)
3. Kết quả và báo cáo
- Âm tính: Nếu COI < 10 IU/ml
- Dương tính: Nếu COI ≥ 10 IU/ml
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
- Máy báo sample short (do bệnh phẩm bị đông hoặc không đủ) → Chú ý ly tâm mẫu thật kỹ ngay từ đầu hoặc hút mẫu ra cup.
- Không sử dụng thuốc thử đã quá hạn sử dụng.
- Tránh tạo bọt ở lọ thuốc thử và các loại mẫu (bệnh phẩm, calibration và chứng).
176. Rubella virus PCR
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Xác định sự có mặt của virus Rubella trong huyết thanh hoặc huyết tương.
2. Nguyên lý
Xác định sự có mặt của gen đặc trưng cho virus Rubella bằng kỹ thuật RT- PCR
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện: Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: Cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Tủ an toàn sinh học cấp 2
- Máy PCR
- Bộ lưu điện
- Máy điện di
- Máy đọc điện di
- Máy ly tâm 25000 x g
- Máy ly tâm dùng cho tube 0,2 ml
- Máy ủ nhiệt
- Máy vortex
- Tủ lạnh 2 oC - 8 oC
- Tủ âm sâu (-20 oC hoặc -70 oC)
- Micropipette
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
Thực hiện xét nghiệm 02 mẫu bệnh phẩm/lần
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Bông | kg | 0,001 |
| 2 | Cồn | ml | 1,000 |
| 3 | Bơm kim tiêm | Cái | 1,000 |
| 4 | Panh | Cái | 0,0001 |
| 5 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 6 | Hộp vận chuyển bệnh phẩm | Test | 0,001 |
| 7 | Tube đựng bệnh phẩm | Cái | 2,000 |
| 8 | Găng không có bột | Cái | 0,500 |
| 9 | Sinh phẩm chẩn đoán | Test | 1,000 |
| 10 | Khấu hao sinh phẩm cho chạy chứng và kiểm tra chất lượng | Test | 1,350 |
| 11 | Kit tách RNA từ virus | Test | 2,350 |
| 12 | Primer 1 | ml | 0,0001 |
| 13 | Primer 2 | ml | 0,0001 |
| 14 | Ống Eppendorf 1,5 ml | Tube | 3,000 |
| 15 | Ống Eppendorf 0,2 ml | Tube | 1,000 |
| 16 | Đầu côn 10 µl có lọc | Cái | 1,000 |
| 17 | Đầu côn 30 µl | Cái | 1,200 |
| 18 | Đầu côn 200 µl có lọc | Cái | 2,200 |
| 19 | Đầu côn 1 ml có lọc | Cái | 3,200 |
| 20 | Ethanol BDH | ml | 0,500 |
| 21 | Water-DEPC Treated | ml | 2,000 |
| 22 | Thạch | Gam | 0.075 |
| 23 | Ladder | ml | 0.0025 |
| 24 | Blue Juice Gel loading dye | ml | 0.003 |
| 25 | Ethidium Bromide | ml | 0.100 |
| 26 | TAE Buffer | ml | 0.100 |
| 27 | Giấy thấm | Cuộn | 0,100 |
| 28 | Giấy xét nghiệm | Tờ | 2,000 |
| 29 | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 30 | Bút viết kính | Cái | 0,020 |
| 31 | Bút bi | Cái | 0,010 |
| 32 | Mũ | Cái | 0,020 |
| 33 | Khẩu trang | Cái | 0,020 |
| 34 | Găng tay | Đôi | 0,100 |
| 35 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 36 | Quần áo bảo hộ | Bộ | 0,005 |
| 37 | Dung dịch nước rửa tay | ml | 8,000 |
| 38 | Cồn sát trùng tay nhanh | ml | 1,000 |
| 39 | Dung dịch khử trùng | ml | 10,000 |
| 40 | Khăn lau tay | cái | 0,010 |
| 41 | Ngoại kiểm (nếu có)* |
| 0,020 |
* Ghi chú:
Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/50 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 3 lần/1 năm).
3. Bệnh phẩm
Chất tiết của đường hô hấp, máu, dịch não tủy, nước tiểu
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu phiếu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
- Theo đúng quy định của chuyên ngành Vi sinh: xem chi tiết phụ lục 2.
- Từ chối những bệnh phẩm không đạt yêu cầu: xem chi tiết phụ lục 6.
2. Tiến hành kỹ thuật
2.1. Tách chiết RNA tổng số
2.2. Thực hiện RT-PCR
2.3. Điện di kiểm tra sản phẩm
2.4. Đánh giá và kết luận
IV. NHẬN ĐỊNH KẾT QUẢ
Sản phẩm PCR phải có một băng đặc hiệu duy nhất, rõ nét và không bị đứt gẫy và có kích thước tương ứng với thang DNA chuẩn.
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
Trong trường hợp không có sản phẩm PCR, cần phải kiểm tra lại quá trình tách chiết RNA tổng số, chất lượng primers và master mix, và thực hiện lại toàn bộ xét nghiệm.
177. Rubella virus giải trình tự gene
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Xác định sự có mặt của virus Rubella trong huyết thanh hoặc huyết tương.
2. Nguyên lý
Xác định virus Rubella bằng kỹ thuật giải trình tự nucleotide của đoạn gen đặc trưng.
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: Cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Tủ an toàn sinh học cấp 2
- Máy PCR
- Bộ lưu điện
- Máy điện di
- Máy đọc điện di
- Máy giải trình tự gen
- Máy ly tâm 25000 x g
- Máy ly tâm dùng cho tube 0,2 ml
- Máy ủ nhiệt
- Máy vortex
- Tủ lạnh 2 oC - 8 oC
- Tủ âm sâu (-20 oC hoặc -70 oC)
- Micropipette
2.2 Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
Thực hiện xét nghiệm 02 mẫu bệnh phẩm/lần
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Bông | kg | 0,001 |
| 2 | Cồn | ml | 1,000 |
| 3 | Bơm kim tiêm | Cái | 1,000 |
| 4 | Panh | Cái | 0,0001 |
| 5 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 6 | Hộp vận chuyển bệnh phẩm | Test | 0,001 |
| 7 | Tube đựng bệnh phẩm | Cái | 2,000 |
| 8 | Găng không có bột | Cái | 0,500 |
| 9 | Sinh phẩm chẩn đoán | Test | 1,000 |
| 10 | Khấu hao sinh phẩm cho chạy chứng, kiểm tra chất lượng | Test | 1,350 |
| 11 | Kit tách chiết RNA từ virus | Test | 2,350 |
| 12 | Primer 1 (primer đặc hiệu) | ml | 0,0001 |
| 13 | Primer 2 (primer đặc hiệu) | ml | 0,0001 |
| 14 | Primer 3 (primer đặc hiệu) | ml | 0,0001 |
| 15 | Primer 4 (primer đặc hiệu) | ml | 0,0001 |
| 16 | Ống Eppendorf 1,5 ml | Tube | 3,000 |
| 17 | Ống Eppendorf 0,2 ml | Tube | 1,000 |
| 18 | Đầu côn 10 µl có lọc | Cái | 1,000 |
| 19 | Đầu côn 30 µl | Cái | 1,200 |
| 20 | Đầu côn 200 µl có lọc | Cái | 2,200 |
| 21 | Đầu côn 1 ml có lọc | Cái | 3,200 |
| 22 | Ethanol BDH | ml | 0,500 |
| 23 | Water-DEPC Treated | ml | 2,000 |
| 24 | Thạch | Gam | 0.075 |
| 25 | Ladder | ml | 0.0025 |
| 26 | Blue Juice Gel loading dye | ml | 0.003 |
| 27 | Ethidium Bromide | ml | 0.100 |
| 28 | TAE Buffer | ml | 0.100 |
| 29 | Giấy thấm | Cuộn | 0,100 |
| 30 | Giấy xét nghiệm | Tờ | 2,000 |
| 31 | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 32 | Bút viết kính | Cái | 0,020 |
| 33 | Bút bi | Cái | 0,010 |
| 34 | Mũ | Cái | 0,020 |
| 35 | Khẩu trang | Cái | 0,020 |
| 36 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 37 | Quần áo bảo hộ | Bộ | 0,005 |
| 38 | Dung dịch nước rửa tay | ml | 8,000 |
| 39 | Cồn sát trùng tay nhanh | ml | 1,000 |
| 40 | Dung dịch khử trùng | ml | 10,000 |
| 41 | Khăn lau tay | cái | 0,010 |
| 42 | Ngoại kiểm (nếu có)* |
| 0,020 |
* Ghi chú:
Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/50 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 3 lần/1 năm).
3. Bệnh phẩm
Chất tiết của đường hô hấp, máu, dịch não tủy, nước tiểu
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu phiếu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
- Theo đúng quy định của chuyên ngành Vi sinh: xem chi tiết phụ lục 3.
- Từ chối những bệnh phẩm không đạt yêu cầu: xem chi tiết phụ lục 6.
2. Tiến hành kỹ thuật
2.1. Tách chiết RNA tổng số
2.2. Thực hiện RT-PCR
2.3. Điện di kiểm tra sản phẩm
2.4. Giải trình tự gen
2.5. Kiểm tra và so sánh trình tự gen của virus Rubella trên ngân hàng dữ liệu gen quốc tế
IV. NHẬN ĐỊNH KẾT QUẢ
Sản phẩm PCR phải có một băng đặc hiệu duy nhất, rõ nét và không bị đứt gẫy. Trình tự DNA của gen đích không bị nhiễu và phải có độ tương đồng ≥ 90 % mới có thể kết luận được virus Rubella
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
- Trong trường hợp không có sản phẩm PCR, cần phải kiểm tra lại quá trình tách chiết RNA tổng số, chất lượng primers và master mix, và thực hiện lại toàn bộ xét nghiệm.
- Nếu trình tự DNA bị nhiễu cần phải kiểm tra lại độ đặc hiệu của sản phẩm PCR hoặc quá trình chạy PCR sequencing bị nhiễm chéo.
178. Hồng cầu, bạch cầu trong phân soi tươi
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Phát hiện hồng cầu, bạch cầu trong phân.
2. Nguyên lý
Nhận định hồng cầu, bạch cầu trong phân khi làm tiêu bản soi tươi dưới kính hiển vi quang học dựa trên hình thể, kích thước, và cấu tạo.
II. CHUẨN BỊ
1.Người thực hiện
- Người thực hiện Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh - Ký sinh trùng
- Người nhận định và phê duyệt kết quả: cán bộ có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh - Ký sinh trùng
2.Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Kính hiển vi quang học
- Tủ an toàn sinh học cấp 2
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Lọ lấy bệnh phẩm | Lọ | 1,000 |
| 2 | Que cấy | Cái | 2,000 |
| 3 | Lam kính | Cái | 1,000 |
| 4 | Lá kính | Cái | 2,000 |
| 5 | Bông | Kg | 0,001 |
| 6 | Cồn 90 độ (vệ sinh dụng cụ) | ml | 10,000 |
| 7 | Panh | Cái | 0,0001 |
| 8 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 9 | Hộp vận chuyển bệnh phẩm | Cái | 0,0001 |
| 10 | Nước muối sinh lý | ml | 5,000 |
| 11 | Lugol | ml | 2,000 |
| 13 | Pipet nhựa | Cái | 2,000 |
| 14 | Axit ngâm lam | ml | 10,000 |
| 15 | Mũ | Cái | 0,020 |
| 16 | Khẩu trang | Cái | 0,020 |
| 17 | Găng tay | Đôi | 3,000 |
| 18 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 19 | Quần áo bảo hộ | Bộ | 0,001 |
| 20 | Bút viết kính | Cái | 0,020 |
| 21 | Bút bi | Cái | 0,010 |
| 22 | Bật lửa | Cái | 0,010 |
| 23 | Sổ lưu kết quả xét nghiệm | Quyển | 0,001 |
| 24 | Cồn sát trùng tay nhanh | ml | 1,000 |
| 25 | Dung dịch nước rửa tay | ml | 8,000 |
| 26 | Khăn lau tay | Cái | 0,010 |
| 27 | Giấy trả kết quả xét nghiệm | Tờ | 2,000 |
| 28 | QC (nếu thực hiện) * |
| 0,1 |
| 29 | EQAS (nếu thực hiện) * |
| 0,005 |
* Ghi chú:
- Chi phí nội kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình nội kiểm (QC) là 1/10 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lượng ≥ 10 mẫu cho 1 lần tiến hành kỹ thuật).
- Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/200 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 2 lần/1 năm).
3. Bệnh phẩm
Phân
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu phiếu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
Theo đúng quy định của chuyên ngành Vi sinh ( xem Phụ lục 4).
2. Tiến hành kỹ thuật
2.1. Nhỏ dung dịch NaCL 9 ‰ và dung dịch Lugol 1% lên trên một lam kính.
2.2. Dùng que lấy một lượng phân (bao kín đầu que) hòa đều với giọt NaCL 9 ‰ đến khi có màu đục, làm tương tự đối với giọt Lugol 1%.
2.3. Đặt lá kính lên trên giọt dung dịch.
2.4. Quan sát kính hiển vi ở vật kính 40X.
IV. NHẬN ĐỊNH KẾT QUẢ
1. Dương tính
- Hồng cầu: hình tròn kích thước 7-8µm màu hồng nhạt, trung tâm nhạt màu.
- Hồng cầu thoái hóa: bờ răng cưa không đều.
- Bạch cầu đa nhân hình tròn kích thước lớn 10 - 15µm.
![]() - Bạch cầu đơn nhân hình tròn, bầu dục, đa giác kích thước 20 - 25 µm.
- Bạch cầu đơn nhân hình tròn, bầu dục, đa giác kích thước 20 - 25 µm.
2. Âm tính
Không tìm thấy hồng cầu, bạch cầu.
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
1. Sai sót
- Nhỏ quá nhiều dung dịch lên lam kính.
- Làm tiêu bản quá dầy hoặc quá mỏng.
2. Xử trí
Đặt tiêu bản trên tờ báo vẫn đọc được chữ là đạt. Nếu làm tiêu bản quá dầy sẽ khó soi, làm mỏng quá sẽ bỏ sót không phát hiện được hồng cầu, bạch cầu.
179. Hồng cầu trong phân test nhanh
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Phát hiện hồng cầu trong phân.
2. Nguyên lý
Phát hiện hemoglobin trong phân dựa trên nguyên lý sắc ký miễn dịch.
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện: Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh - Ký sinh trùng.
- Người nhận định và phê duyệt kết quả: Cán bộ có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh - Ký sinh trùng
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Đồng hồ bấm giờ (nếu có)
- Tủ an toàn sinh học cấp 2
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Lọ lấy bệnh phẩm | Lọ | 1,000 |
| 2 | Que cấy | Cái | 2,000 |
| 3 | Bông | Kg | 0,001 |
| 4 | Cồn 90 độ (vệ sinh dụng cụ) | ml | 10,000 |
| 5 | Panh | Cái | 0,0001 |
| 6 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 7 | Hộp vận chuyển bệnh phẩm | Cái | 0,0001 |
| 9 | Sinh phẩm chẩn đoán | Test | 1,000 |
| 10 | Pipet nhựa | Cái | 2,000 |
| 11 | Ống nghiệm thủy tinh | Ống | 1,000 |
| 12 | Mũ | Cái | 0,020 |
| 13 | Khẩu trang | Cái | 0,020 |
| 14 | Găng tay | Đôi | 3,000 |
| 15 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 16 | Quần áo bảo hộ | Bộ | 0,001 |
| 17 | Bút viết kính | Cái | 0,020 |
| 18 | Bút bi | Cái | 0,010 |
| 19 | Bật lửa | Cái | 0,010 |
| 20 | Sổ lưu kết quả xét nghiệm | Quyển | 0,001 |
| 21 | Cồn sát trùng tay nhanh | ml | 1,000 |
| 22 | Dung dịch nước rửa tay | ml | 8,000 |
| 23 | Khăn lau tay | Cái | 0,010 |
| 24 | Giấy trả kết quả xét nghiệm | Tờ | 2,000 |
| 25 | QC (nếu thực hiện) * |
| 0,1 |
| 26 | EQAS (nếu thực hiện) * |
| 0,005 |
* Ghi chú:
- Chi phí nội kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình nội kiểm (QC) là 1/10 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lượng ≥ 10 mẫu cho 1 lần tiến hành kỹ thuật).
- Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/200 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 2 lần/1 năm).
3. Bệnh phẩm
Phân
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu phiếu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
Theo đúng quy định của chuyên ngành Vi sinh ( xem Phụ lục 4).
2.Tiến hành kỹ thuật
Bộ sinh phẩm chẩn đoán Hemosure iFOB Test.
2.1. Lấy thanh thử ra khỏi bao để ở nhiệt độ phòng .
2.2. Dùng que lấy bệnh phẩm (bao kín đầu que) nhúng que vào lọ dung dịch trong test thử, lắc đều.
2.3. Nhỏ 3 giọt dung dịch trên vào thanh thử.
2.4. Đọc kết quả trong vòng 5- 10 phút.
IV. NHẬN ĐỊNH KẾT QUẢ
1. Dương tính
Xuất hiện 2 vạch trên thanh thử ở vị trí C và T.
2. Âm tính
Xuất hiện 1 vạch trên thanh thử ở vị trí C.
3. Không có giá trị
Không thấy xuất hiện vạch nào trên thanh thử. Phải tiến hành làm lại xét nghiệm với một thanh thử khác.
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
Đọc kết quả sau quá 10 phút dễ gây phản ứng dương tính giả. Nên có đồng hồ đặt giờ để đọc kết quả đúng giờ qui định.
180. Đơn bào đường ruột soi tươi
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Phát hiện đơn bào đường ruột gây bệnh (Entamoeba histolytica, Giardia lamblia, Isospora belli, Trichomonas intestinalis…) trong phân.
2. Nguyên lý
Đơn bào đường ruột gây bệnh được phát hiện qua hình thể, kích thước, tính chất di động và bắt màu trong môi trường có NaCL 9‰ và Lugol 1% soi dưới kính hiển vi quang học.
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện: Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh - Ký sinh trùng.
- Người nhận định và phê duyệt kết quả: Cán bộ có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh - Ký sinh trùng
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Kính hiển vi quang học
- Tủ an toàn sinh học cấp 2
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
| STT | Chi phí hóa chất, vật tư tiêu hao | ĐƠN VỊ | SỐ LƯỢNG |
| 1 | Lọ lấy bệnh phẩm | Lọ | 1,000 |
| 2 | Que cấy | Cái | 2,000 |
| 3 | Lam kính | Cái | 2,000 |
| 4 | Lá kính | Cái | 2,000 |
| 5 | Bông | Kg | 0,001 |
| 6 | Cồn 900 (vệ sinh dụng cụ) | ml | 10,000 |
| 7 | Panh | Cái | 0,0001 |
| 8 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 9 | Hộp vận chuyển bệnh phẩm | Cái | 0,0001 |
| 10 | Nước muối sinh lý | ml | 5,000 |
| 11 | Lugol | ml | 2,000 |
| 12 | Pipet nhựa | Cái | 2,000 |
| 13 | Axit ngâm lam | ml | 10,000 |
| 14 | Mũ | Cái | 0,020 |
| 15 | Khẩu trang | Cái | 0,020 |
| 16 | Găng tay | Đôi | 3,000 |
| 17 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 18 | Quần áo bảo hộ | Bộ | 0,001 |
| 19 | Bút viết kính | Cái | 0,020 |
| 20 | Bút bi | Cái | 0,010 |
| 21 | Bật lửa | Cái | 0,010 |
| 22 | Sổ lưu kết quả xét nghiệm | Quyển | 0,001 |
| 23 | Cồn sát trùng tay nhanh | ml | 1,000 |
| 24 | Dung dịch nước rửa tay | ml | 8,000 |
| 25 | Khăn lau tay | Cái | 0,010 |
| 26 | Giấy trả kết quả xét nghiệm | Tờ | 2,000 |
| 27 | QC (nếu thực hiện) * |
| 0,1 |
| 28 | EQAS (nếu thực hiện) * |
| 0,005 |
* Ghi chú:
- Chi phí nội kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình nội kiểm (QC) là 1/10 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lượng ≥ 10 mẫu cho 1 lần tiến hành kỹ thuật).
- Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/200 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 2 lần/1 năm).
3.Bệnh phẩm
Phân
4.Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu phiếu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
Theo đúng quy định của chuyên ngành Vi sinh (xem Phụ lục 4).
Lưu ý: - Không lấy phân làm XN khi uống thuốc Bismuth hoặc Barium.
- Mẫu phân làm xét nghiệm tránh lẫn nước tiểu.
2. Tiến hành kỹ thuật
2.1. Nhỏ giọt dung dịch NaCL 9 ‰ và giọt dung dịch Lugol 1% lên trên một lam kính.
2.2. Dùng que lấy một lượng phân (bao kín đầu que) hòa đều vào dung dịch NaCL 9 ‰ đến khi có màu đục, làm tương tự đối với dung dịch Lugol.
2.3. Đặt lá kính lên trên dung dịch.
2.4. Quan sát kính hiển vi ở vật kính 40X.
IV. NHẬN ĐỊNH KẾT QUẢ
1. Dương tính
Quan sát ở vật kính 40X tìm thể hoạt động và bào nang của đơn bào. Thể hoạt động của Amip kích thước 13-30µm chuyển động bằng chân giả.
- Thể hoạt động của Giardia hình thìa kích thước 9-21 x 5-15µm chuyển động bằng roi.
- Trichomonas hình quả lê kích thước 5-12 x 5-6µm chuyển động được nhờ các roi.
- Bào nang Amip hình tròn có vỏ dày bắt màu vàng, kích thước trung bình 12µm bên trong có từ 2-4 nhân.
- Bào nang Giardia hình bầu dục kích thước 10-14 x7-9µm, bên trong có từ 2-4 nhân có thể thấy vết roi cuộn lại trong bào nang.
2. Âm tính
Không thấy thể hoạt động, bào nang của đơn bào đường ruột.
Lưu ý
Trong trường hợp xét nghiệm lần đầu âm tính, để phát hiện KST gây bệnh có thể xét nghiệm 2 mẫu phân tiếp theo trong vòng từ 7-10 ngày.
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
1. Sai sót
- Nhỏ quá nhiều dung dịch lên lam kính .
- Tiêu bản quá dầy hoặc quá mỏng.
2. Xử trí
Đặt tiêu bản trên tờ báo vẫn đọc được chữ là đạt. Nếu làm tiêu bản quá dầy sẽ khó soi, làm mỏng sẽ bỏ sót không phát hiện được đơn bào đường ruột.
181. Đơn bào đường ruột nhuộm soi
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Phát hiện đơn bào đường ruột gây bệnh (Isospora belli, Cryptosporidium, Cyclospora) trong phân.
2. Nguyên lý
Một số đơn bào đường ruột có đặc điểm kháng cồn/acid nên có thể được phát hiện bằng kỹ thuật nhuộm Ziehl-Neelsen.
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh - Ký sinh trùng.
- Người nhận định và phê duyệt kết quả: Cán bộ có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh - Ký sinh trùng
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Kính hiển vi quang học.
- Tủ an toàn sinh học cấp 2
- Đồng hồ bấm giờ.
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Lọ lấy bệnh phẩm | Lọ | 1,000 |
| 2 | Lam kính | Cái | 2,000 |
| 3 | Dầu soi kính | ml | 1,000 |
| 4 | Xylen lau kính | ml | 1,000 |
| 5 | Thuốc nhuộm đỏ Fucsin | ml | 5,000 |
| 6 | Axit H2SO4 | ml | 10,000 |
| 7 | Que cấy | Cái | 1,000 |
| 8 | Cồn tẩy 96 độ | ml | 10,000 |
| 9 | Thuốc nhuộm Xanh methylen | ml | 5,000 |
| 10 | Bông | Kg | 0,001 |
| 11 | Cồn 90 độ (vệ sinh dụng cụ) | ml | 10,000 |
| 12 | Đèn cồn | Cái | 0,0001 |
| 13 | Panh | Cái | 0,0001 |
| 14 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 15 | Hộp vận chuyển bệnh phẩm | Cái | 0,0001 |
| 16 | Mũ | Cái | 0,020 |
| 17 | Khẩu trang | Cái | 0,020 |
| 18 | Găng tay | Đôi | 3,000 |
| 19 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 20 | Quần áo bảo hộ | Bộ | 0,001 |
| 21 | Axit ngâm lam | ml | 10,000 |
| 22 | Ống nghiệm thủy tinh | Ống | 1,000 |
| 23 | Bút viết kính | Cái | 0,020 |
| 24 | Bút bi | Cái | 0,010 |
| 25 | Bật lửa | Cái | 0,010 |
| 26 | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 27 | Cồn sát trùng tay nhanh | ml | 1,000 |
| 28 | Dung dịch nước rửa tay | ml | 8,000 |
| 29 | Khăn lau tay | Cái | 0,030 |
| 30 | Giấy trả kết quả xét nghiệm | Tờ | 2,000 |
| 31 | QC (nếu thực hiện) * |
| 0,1 |
| 32 | EQAS (nếu thực hiện) * |
| 0,005 |
* Ghi chú:
- Chi phí nội kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình nội kiểm (QC) là 1/10 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lượng ≥ 10 mẫu cho 1 lần tiến hành kỹ thuật).
- Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/200 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 2 lần/1 năm).
3. Bệnh phẩm
Phân
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu phiếu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
1. Lấy bệnh phẩm
Theo đúng quy định của chuyên ngành Vi sinh ( xem Phụ lục 4).
2. Tiến hành kỹ thuật
2.1. Dùng que gỗ lấy phân phết lên lam kính, để khô.
2.2. Nhỏ dung dịch đỏ Fucsin phủ kín lên trên bệnh phẩm.
2.3. Rửa nước.
2.4. Tẩy màu bằng H2SO4 5% đến khi hết màu đỏ.
2.5. Rửa nước
2.6. Nhỏ dung dịch xanh methylen.
2.7. Rửa nước.
2.8. Quan sát dưới kính hiển vi vật kính 10X- 100X.
IV. NHẬN ĐỊNH KẾT QUẢ
1. Dương tính
- Nang trứng của Cryptosporidium hình tròn bắt màu đỏ kích thước từ 4-6µm.
- Nang trứng của Cyclospora hình tròn bắt màu đỏ kích thước từ 8-10µm.
- Nang trứng của Isospora hình bầu dục bắt màu đỏ kích thước 20- 30 x 10- 19µm.
2. Âm tính
Không tìm thấy đơn bào đường ruột.
Lưu ý: Trong trường hợp xét nghiệm lần đầu âm tính, để phát hiện KST gây bệnh có thể xét nghiệm 2 mẫu phân tiếp theo trong vòng từ 7-10 ngày.
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
1. Sai sót
Tẩy chưa hết màu đỏ Fucsin.
2. Xử trí
Nếu bệnh phẩm dày để đủ thời gian nhưng vẫn còn màu đỏ Fucsin cần phải tẩy lại lần 2 bằng H2SO4 5% đến khi bệnh phẩm phai hết màu đỏ.
182. Trứng giun, sán soi tươi
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Phát hiện trứng giun, sán trong phân.
2. Nguyên lý
Nhận định trứng giun, sán dựa vào hình thể, kích thước, cấu tạo và tính chất bắt màu khi soi tươi.
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh - Ký sinh trùng.
- Người nhận định và phê duyệt kết quả: Cán bộ có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh - Ký sinh trùng
3. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
Kính hiển vi quang học
Tủ an toàn sinh học cấp 2
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Lọ lấy bệnh phẩm | Lọ | 1,000 |
| 2 | Que cấy | Cái | 2,000 |
| 3 | Lam kính | Cái | 2,000 |
| 4 | Lá kính | Cái | 2,000 |
| 5 | Bông | Kg | 0,001 |
| 6 | Cồn 900 (vệ sinh dụng cụ) | ml | 10,000 |
| 7 | Panh | Cái | 0,0001 |
| 8 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 9 | Hộp vận chuyển bệnh phẩm | Cái | 0,0001 |
| 10 | Nước muối sinh lý | ml | 5,000 |
| 11 | Lugol | ml | 2,000 |
| 13 | Pipet nhựa | Cái | 2,000 |
| 14 | Axit ngâm lam | ml | 10,000 |
| 15 | Mũ | Cái | 0,020 |
| 16 | Khẩu trang | Cái | 0,020 |
| 17 | Găng tay | Đôi | 3,000 |
| 18 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 19 | Quần áo bảo hộ | Bộ | 0,001 |
| 20 | Bút viết kính | Cái | 0,020 |
| 21 | Bút bi | Cái | 0,010 |
| 22 | Bật lửa | Cái | 0,010 |
| 23 | Sổ lưu kết quả xét nghiệm | Quyển | 0,001 |
| 24 | Cồn sát trùng tay nhanh | ml | 1,000 |
| 25 | Dung dịch nước rửa tay | ml | 8,000 |
| 26 | Khăn lau tay | Cái | 0,010 |
| 27 | Giấy trả kết quả xét nghiệm | Tờ | 2,000 |
| 28 | QC (nếu thực hiện) * |
| 0,1 |
| 29 | EQAS (nếu thực hiện) * |
| 0,005 |
* Ghi chú:
- Chi phí nội kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình nội kiểm (QC) là 1/10 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lượng ≥ 10 mẫu cho 1 lần tiến hành kỹ thuật).
- Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/200 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 2 lần/1 năm).
3. Bệnh phẩm
Phân
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu phiếu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
1.Lấy bệnh phẩm
Theo đúng quy định của chuyên ngành Vi sinh ( xem Phụ lục 4).
2. Tiến hành kỹ thuật
2.1. Nhỏ dung dịch NaCL 9 ‰ và dung dịch Lugol 1% lên trên 1 lam kính.
2.2. Dùng que lấy một lượng phân (bao kín đầu que) hòa đều vào giọt dung dịch NaCL 9 ‰ đến khi có màu đục, làm tương tự đối với giọt dung dịch Lugol 1%.
2.3. Đặt lá kính lên trên giọt dung dịch.
2.4. Quan sát kính hiển vi ở vật kính 10X- 40X.
IV. NHẬN ĐỊNH KẾT QUẢ
1. Dương tính
- Trứng giun đũa hình tròn hoặc bầu dục kích thước 35-50 x 45-75 mm, ngoài cùng là lớp albumin xù xì bắt màu vàng, vỏ dầy, trong là khối nhân sẫm màu. Ngoài ra có thể còn gặp trứng giun đũa mất tầng albumin.
- Trứng giun đũa không thụ tinh hình bầu dục kích thước 43- 47 x 85-95µm. Vỏ mỏng ít xù xì bên trong có những tế bào hoàng thể.
- Trứng giun móc hình bầu dục kích thước 40-60 mm màu trong vỏ mỏng, trong là khối nhân phân chia từ 2-4 phần .
- Trứng giun tóc hình bầu dục, kích thước 22-50 mm giống hình quả cau, màu vàng vỏ dầy, 2 cực có 2 nắp.
- Trứng sán lá gan nhỏ bắt màu vàng hình bầu dục một đầu có nắp một đầu có gai, kích thước 27-35 x 12-19µm.
- Trứng sán lá gan lớn hình bầu dục kích thước lớn từ 130-150 x 63-90µm, màu vàng nhạt vỏ mỏng, một đầu có nắp.
- Trứng sán lá phổi hình bầu dục màu vàng nâu sẫm kích thước lớn từ 80-120 x 50- 70µm, ở đầu có nắp trong trứng thấy có 1 đám tế bào.
- Trứng sán dây hình tròn vỏ dầy màu nâu sẫm kích thước từ 36-51µm.
2. Âm tính
Không thấy trứng giun, sán.
Lưu ý
Trong trường hợp xét nghiệm lần đầu âm tính, để phát hiện KST gây bệnh có thể xét nghiệm 2 mẫu phân tiếp theo trong vòng từ 7-10 ngày.
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
1. Sai sót
- Nhỏ quá nhiều dung dịch lên lam kính.
- Làm tiêu bản quá dầy hoặc quá mỏng.
2. Xử trí
Đặt tiêu bản trên tờ báo vẫn đọc được chữ là đạt. Nếu làm tiêu bản quá dầy sẽ khó soi, làm mỏng quá sẽ bỏ sót trứng giun sán.
183. Trứng giun soi tập trung
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Phát hiện trứng giun đũa, tóc, móc trong phân.
2. Nguyên lý
Nước muối bão hòa có tỷ trọng lớn hơn tỷ trọng của trứng giun đũa, tóc, móc vì vậy sẽ làm cho trứng giun nổi lên trên bề mặt của dung dịch và bám vào bề mặt của lá kính.
II. CHUẨN BỊ
1.Người thực hiện
- Người thực hiện: Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh - Ký sinh trùng.
- Người nhận định và phê duyệt kết quả: Cán bộ có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh - Ký sinh trùng
2.Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Kính hiển vi
- Tủ an toàn sinh học cấp 2
- Đồng hồ bấm giờ
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Lọ lấy bệnh phẩm | Lọ | 1,000 |
| 2 | Que cấy | Cái | 2,000 |
| 3 | Lam kính | Cái | 1,000 |
| 4 | Lá kính | Cái | 1,000 |
| 5 | Bông | Kg | 0,001 |
| 6 | Cồn 90 độ (vệ sinh dụng cụ) | ml | 10,000 |
| 7 | Panh | Cái | 0,0001 |
| 8 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 9 | Hộp vận chuyển bệnh phẩm | Cái | 0,0001 |
| 10 | Nước muối bão hòa | ml | 15,000 |
| 11 | Sinh phẩm chẩn đoán | Test | 1,000 |
| 12 | Pipet nhựa | Cái | 2,000 |
| 13 | Axit ngâm lam | ml | 10,000 |
| 14 | Mũ | Cái | 0,020 |
| 15 | Khẩu trang | Cái | 0,020 |
| 16 | Găng tay | Đôi | 3,000 |
| 17 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 18 | Quần áo bảo hộ | Bộ | 0,001 |
| 19 | Bút viết kính | Cái | 0,020 |
| 20 | Bút bi | Cái | 0,010 |
| 21 | Bật lửa | Cái | 0,010 |
| 22 | Sổ lưu kết quả xét nghiệm | Quyển | 0,001 |
| 23 | Cồn sát trùng tay nhanh | ml | 1,000 |
| 24 | Dung dịch nước rửa tay | ml | 8,000 |
| 25 | Khăn lau tay | Cái | 0,010 |
| 26 | Giấy trả kết quả xét nghiệm | Tờ | 2,000 |
| 27 | QC (nếu thực hiện) * |
| 0,1 |
| 28 | EQAS (nếu thực hiện) * |
| 0,005 |
* Ghi chú:
- Chi phí nội kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình nội kiểm (QC) là 1/10 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lượng ≥ 10 mẫu cho 1 lần tiến hành kỹ thuật).
- Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/200 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 2 lần/1 năm).
3. Bệnh phẩm
Phân
3. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu phiếu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
1. Lấy bệnh phẩm
Theo đúng quy định của chuyên ngành Vi sinh ( xem Phụ lục 4).
2. Tiến hành kỹ thuật
2.1. Cho nước muối bão hòa vào lọ đựng bệnh phẩm (1/3 lọ), dùng que đánh tan bệnh phẩm.
2.2. Nhỏ nước muối bão hòa vào gần đầy lọ gạt bỏ bệnh phẩm nổi trên bề mặt sau đó nhỏ tiếp dung dịch vào đầy miệng lọ.
2.3. Đậy lá kính lên trên lọ bệnh phẩm để thời gian 15 phút.
2.4. Nhấc lá kính đặt trên lam kính.
2.5. Quan sát kính hiển vi ở vật kính 10X.
IV. NHẬN ĐỊNH KẾT QUẢ
1. Dương tính
Quan sát tất cả các vi trường ở vật kính 10X tìm trứng giun, chọn vi trường có số trứng giun cao nhất để đánh giá kết quả:
- Trứng giun đũa hình tròn hoặc bầu dục kích thước 35-50 x 45-75m, ngoài cùng là lớp Albumin xù xì bắt màu vàng, vỏ dầy, trong là khối nhân sẫm màu. Ngoài ra có thể còn gặp trứng giun đũa mất tầng Albumin.
- Trứng giun móc hình bầu dục kích thước 40-60m màu trong vỏ mỏng, trong là khối nhân phân chia từ 2-4.
- Trứng giun tóc hình bầu dục, kích thước 22-50m giống hình quả cau, màu vàng vỏ dầy, 2 cực có 2 nắp.
Ghi tên trứng giun và mức độ nhiễm:
- 1 trứng giun / vi trường: (+)
- 2 - 5 trứng giun / vi trường: (++)
- 6 - 20 trứng giun / vi trường: (+++)
- > 20 trứng giun / vi trường: (++++)
2. Âm tính
Không thấy trứng giun
Lưu ý
Trong trường hợp xét nghiệm lần đầu âm tính, để phát hiện KST gây bệnh có thể xét nghiệm 2 mẫu phân tiếp theo trong vòng từ 7-10 ngày.
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
1. Sai sót
- Không gạt bỏ bệnh phẩm nổi trên miệng lọ, kết quả có thể bị sai.
- Để thời gian quá ngắn trứng giun chưa kịp nổi trên bề mặt dung dịch.
2. Xử trí
- Gạt bỏ sạch bệnh phẩm nổi trên mặt dung dịch.
- Để đủ thời gian quy định.
184. Strongyloides stercoralis (Giun lươn) ấu trùng soi tươi
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Phát hiện ấu trùng S. stercoralis trong phân.
2. Nguyên lý
Ấu trùng S. stercoralis được phát hiện dựa vào hình thể, kích thước và chuyển động khi soi tươi phân.
II. CHUẨN BỊ
1.Người thực hiện
- Người thực hiện: Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh - Ký sinh trùng.
- Người nhận định và phê duyệt kết quả: Cán bộ có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh - Ký sinh trùng
2.Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Kính hiển vi quang học
- Tủ an toàn sinh học cấp 2
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Lọ lấy bệnh phẩm | Lọ | 1,000 |
| 2 | Que cấy | Cái | 2,000 |
| 3 | Lam kính | Cái | 1,000 |
| 4 | Lá kính | Cái | 1,000 |
| 5 | Bông | Kg | 0,001 |
| 6 | Cồn 900 (vệ sinh dụng cụ) | ml | 10,000 |
| 7 | Panh | Cái | 0,0001 |
| 8 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 9 | Hộp vận chuyển bệnh phẩm | Cái | 0,0001 |
| 10 | Nước muối sinh lý | ml | 5,000 |
| 11 | Pipet nhựa | Cái | 2,000 |
| 12 | Axit ngâm lam | ml | 10,000 |
| 13 | Mũ | Cái | 0,020 |
| 14 | Khẩu trang | Cái | 0,020 |
| 15 | Găng tay | Đôi | 3,000 |
| 16 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 17 | Quần áo bảo hộ | Bộ | 0,001 |
| 18 | Bút viết kính | Cái | 0,020 |
| 19 | Bút bi | Cái | 0,010 |
| 20 | Bật lửa | Cái | 0,010 |
| 21 | Sổ lưu kết quả xét nghiệm | Quyển | 0,001 |
| 22 | Cồn sát trùng tay nhanh | ml | 1,000 |
| 23 | Dung dịch nước rửa tay | ml | 8,000 |
| 24 | Khăn lau tay | Cái | 0,010 |
| 25 | Giấy trả kết quả xét nghiệm | Tờ | 2,000 |
| 26 | QC (nếu thực hiện) * |
| 0,1 |
| 27 | EQAS (nếu thực hiện) * |
| 0,005 |
* Ghi chú:
- Chi phí nội kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình nội kiểm (QC) là 1/10 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lượng ≥ 10 mẫu cho 1 lần tiến hành kỹ thuật).
- Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/200 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 2 lần/1 năm).
3. Bệnh phẩm
Phân
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu phiếu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
1. Lấy bệnh phẩm
Dùng que sạch lấy phân ở nhiều vị trí, cho vào lọ sạch có dán nhãn ghi đủ các thông tin tên, tuổi người bệnh, khoa phòng gửi xét nghiệm, ngày giờ lấy bệnh phẩm.
Thời gian để mẫu làm xét nghiệm không quá 1 giờ.
2. Tiến hành kỹ thuật
2.1. Nhỏ dung dịch NaCL 9 ‰ lên lam kính.
2.2. Dùng que lấy bệnh phẩm hòa lên trên dung dịch NaCL 9 ‰ đến khi đục.
2.3. Đặt lá kính lên trên giọt dung dịch.
2.4. Quan sát kính hiển vi ở vật kính 10X- 40X.
IV. NHẬN ĐỊNH KẾT QUẢ
1. Dương tính
- Ấu trùng giun lươn có kích thước 16 x 220µm, chuyển động.
- Phân biệt ấu trùng giun lươn và ấu trùng giun móc, mỏ: hình thể 2 loại ấu trùng khó có thể phân biệt, nhưng ấu trùng giun lươn xuất hiện ngay sau khi phân mới bài xuất còn ấu trùng giun móc, mỏ xuất hiện muộn (18- 24 giờ).
2. Âm tính
Không thấy ấu trùng giun lươn.
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
1. Sai sót
- Nhỏ quá nhiều dung dịch lên lam kính.
- Làm tiêu bản quá dầy hoặc quá mỏng.
2. Xử trí
Nhỏ dung dịch vừa phải.
185. Angiostrongylus cantonensis (Giun tròn chuột) Ab miễn dịch bán tự động
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Phát hiện kháng thể IgG kháng với Angiostrongylus cantonensis có trong mẫu huyết thanh.
2. Nguyên lý
Phát hiện kháng thể IgG kháng với Angiostrongylus cantonensis có trong mẫu huyết thanh bằng kỹ thuật miễn dịch gắn men (ELISA).
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh - Ký sinh trùng.
- Người nhận định và phê duyệt kết quả: Cán bộ có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh - Ký sinh trùng
2.Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Máy đọc ELISA.
- Tủ an toàn sinh học cấp 2
- Máy ly tâm
- Tủ lạnh 2-8ºC
- Micropipette 10 µl, 200 µl, 1000 µl.
- Giá đựng ống máu
- Ống nghiệm.
- Ống đong chia vạch.
- Giấy thấm.
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Giấy xét nghiệm | Tờ | 2,000 |
| 2 | Tube lấy bệnh phẩm | Cái | 1,000 |
| 3 | Mũ | Cái | 0,100 |
| 4 | Khẩu trang | Cái | 0,100 |
| 5 | Găng tay | Đôi | 2,000 |
| 6 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 7 | Quần áo bảo hộ | Bộ | 0,001 |
| 8 | Bút viết kính | Cái | 0,020 |
| 9 | Bút bi | Cái | 0,010 |
| 10 | Sổ lưu kết quả xét nghiệm | Quyển | 0,001 |
| 11 | Dung dịch rửa tay | ml | 8,000 |
| 12 | Khăn lau tay | Cái | 0,010 |
| 13 | Panh | Cái | 0,0001 |
| 14 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 15 | Hộp vận chuyển bệnh phẩm | Cái | 0,0001 |
| 16 | Đầu côn 10 ml | Cái | 1,000 |
| 17 | Đầu côn 200 ml | Cái | 4,000 |
| 18 | Đầu côn 1000 ml | Cái | 1,000 |
| 19 | Pipet nhựa | Cái | 1,000 |
| 20 | Sinh phẩm chẩn đoán (QC) | Test | 0,400 |
| 21 | Sinh phẩm chẩn đoán | Test | 1,000 |
| 22 | EQAS (nếu thực hiện ) * |
| 0,005 |
* Ghi chú:
- Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/200 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 2 lần/1 năm).
3. Bệnh phẩm
Huyết thanh.
3. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu phiếu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
Theo đúng quy định của chuyên ngành Vi sinh ( xem Phụ lục 4).
2. Tiến hành kỹ thuật
2.1. Lấy bộ kít ra khỏi tủ lạnh, lấy đủ số giếng cần làm.
2.2. Nhỏ chứng dương, chứng âm và mẫu huyết thanh đã pha loãng vào mỗi giếng.
2.3. Ủ ở nhiệt độ 15-25°C.
2.4. Rửa với dung dịch rửa đã pha loãng, lắc sạch nước.
2.5. Thêm Conjugate vào mỗi giếng, ủ ở nhiệt độ phòng.
2.6. Rửa với dung dịch rửa đã pha loãng, lắc sạch nước.
2.7. Nhỏ TMB vào mỗi giếng ủ ở nhiệt độ phòng.
2.8. Nhỏ stop solution.
IV. NHẬN ĐỊNH KẾT QUẢ
1. Đọc kết quả
Cài đặt bước sóng máy đọc là 450nm/650nm-620nm.
Đọc kết quả theo hướng dẫn của bộ kít.
2. Kiểm tra chất lượng
Kiểm tra chất lượng cho phép đánh giá sự ổn định của bộ kít. Bộ kít không được sử dụng nếu bất kỳ chứng dương hoặc chứng âm rơi ra khỏi ngưỡng quy định.
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
Rửa kỹ các giếng thử. Sau khi rửa vỗ nhẹ thanh nhựa vào giấy thấm cho ráo nước và làm tiếp các bước tiếp theo ngay không để các giếng bị khô.
186. Clonorchis/Opisthorchis (Sán lá gan nhỏ) Ab miễn dịch bán tự động
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Phát hiện kháng thể IgG đặc hiệu với sán lá gan nhỏ có trong mẫu huyết thanh.
2. Nguyên lý
Phát hiện kháng thể IgG đặc hiệu với sán lá gan nhỏ dựa trên nguyên lý của kỹ thuật miễn dịch gắn men (ELISA).
II. CHUẨN BỊ
1.Người thực hiện
- Người thực hiện Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh - Ký sinh trùng.
- Người nhận định và phê duyệt kết quả: Cán bộ có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh - Ký sinh trùng
2.Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Tủ an toàn sinh học cấp 2
- Tủ lạnh 2 - 8 oC
- Hệ thống máy ELISA
- Micropipette các loại
- Máy in
- Đồng hồ bấm giây
- Máy ly tâm thường
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Ống lấy bệnh phẩm | Ống | 1,000 |
| 2 | Bơm tiêm | Cái | 1,000 |
| 3 | Bông | Kg | 0,001 |
| 4 | Cồn 90 độ (vệ sinh dụng cụ) | Ml | 10,000 |
| 5 | Panh | Cái | 0,0001 |
| 6 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 7 | Hộp vận chuyển bệnh phẩm | Cái | 0,0001 |
| 8 | Hóa chất chính | Test | 1,000 |
| 9 | Khấu hao sinh phẩm cho chạy chứng và kiểm tra chất lượng (QC) | Test | 0,500 |
| 10 | Đầu côn xanh | Cái | 2,000 |
| 11 | Đầu côn vàng | Cái | 3,000 |
| 12 | Axít ngâm rửa | Ml | 10,000 |
| 13 | Nước cất | Ml | 250,000 |
| 14 | Ống nghiệm thủy tinh | Ống | 2,000 |
| 15 | Mũ | Cái | 0,020 |
| 16 | Khẩu trang | Cái | 0,020 |
| 17 | Găng tay | Đôi | 2,000 |
| 18 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 19 | Quần áo bảo hộ | Bộ | 0,001 |
| 20 | Bút viết kính | Cái | 0,020 |
| 21 | Bút bi | Cái | 0,010 |
| 22 | Sổ lưu kết quả xét nghiệm | Quyển | 0,001 |
| 23 | Cồn sát trùng tay nhanh | Ml | 1,000 |
| 24 | Dung dịch nước rửa tay | Ml | 8,000 |
| 25 | Khăn lau tay | Cái | 0,010 |
| 26 | Giấy trả kết quả xét nghiệm | Tờ | 2,000 |
| 27 | EQAS (nếu thực hiện) * |
| 0,005 |
* Ghi chú:
- Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/200 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 2 lần/1 năm).
3. Bệnh phẩm
Huyết thanh
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu phiếu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
Theo đúng quy định của chuyên ngành Vi sinh (xem Phụ lục 4).
2. Tiến hành kỹ thuật
2.1. Lấy bộ kít ra khỏi tủ lạnh, lấy đủ số giếng cần làm.
2.2. Chuẩn bị hóa chất: pha dung dịch rửa, chứng âm, chứng dương…
2.3. Nhỏ mẫu, chứng theo sơ đồ vào các giếng
2.4. Ủ mẫu
2.5. Rửa giếng, thêm cộng hợp, ủ mẫu
2.6. Rửa giếng, thêm cơ chất, ủ tránh sáng
2.7. Thêm chất dừng phản ứng, đọc kết quả bằng máy đo quang
IV. NHẬN ĐỊNH KẾT QUẢ
- Kết quả được chấp nhận khi giá trị OD của các giếng chứng đạt đủ điều kiện theo hướng dẫn của nhà sản xuất
- Tính C.O theo hướng dẫn của nhà sản xuất
+ Dương tính khi: OD mẫu ≥ C.O
+ Âm tính khi: OD mẫu < C.O
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
1. Sai sót
Có thể xảy ra hiện tượng âm tính giả hoặc dương tính giả, thường do:
- Chứng âm và những mẫu bệnh phẩm âm tính bị nhiễm chéo bởi huyết thanh/huyết tương có nồng độ kháng thể cao.
- Hóa chất bị nhiễm bẩn, nhiễm các tác nhân oxid hóa.
- Đọc kết quả quá thời gian qui định sau khi dừng phản ứng.
2. Xử trí
- Tuân thủ đúng các bước quy trình hướng dẫn của nhà sản xuất và hướng dẫn về độ ổn định hóa chất xét nghiệm trong bộ sinh phẩm sử dụng.
- Kiểm tra và vệ sinh máy rửa thường xuyên trước và sau khi làm xét nghiệm.
- Chia hóa chất (chất cộng hợp, dung dịch hiện màu và dừng phản ứng) vào ống nghiệm sạch trước mỗi lần nhỏ.
- Tham khảo thêm hướng dẫn của nhà sản xuất
187. Cysticercus cellulosae (Sán lợn) Ab miễn dịch bán tự động
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Phát hiện kháng thể IgG kháng với Cysticercus cellulosae có trong mẫu huyết thanh.
2. Nguyên lý
Phát hiện kháng thể IgG kháng với Cysticercus cellulosae có trong mẫu huyết thanh bằng kỹ thuật miễn dịch gắn men (ELISA).
II. CHUẨN BỊ
1.Người thực hiện
- Người thực hiện Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh - Ký sinh trùng.
- Người nhận định và phê duyệt kết quả: Cán bộ có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh - Ký sinh trùng
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Máy đọc ELISA
- Tủ an toàn sinh học cấp 2
- Máy ly tâm
- Tủ lạnh 2 - 8ºC
- Micropipette 10 µl, 200 µl, 1000 µl.
- Giá đựng ống máu
- Ống nghiệm.
- Ống đong chia vạch.
- Giấy thấm.
2.1. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Giấy xét nghiệm | Tờ | 2,000 |
| 2 | Tube lấy bệnh phẩm | Cái | 1,000 |
| 3 | Mũ | Cái | 0,100 |
| 4 | Khẩu trang | Cái | 0,100 |
| 5 | Găng tay | Đôi | 2,000 |
| 6 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 7 | Quần áo bảo hộ | Bộ | 0,001 |
| 8 | Bút viết kính | Cái | 0,020 |
| 9 | Bút bi | Cái | 0,010 |
| 10 | Sổ lưu kết quả xét nghiệm | Quyển | 0,001 |
| 11 | Dung dịch rửa tay | ml | 8,000 |
| 12 | Khăn lau tay | Cái | 0,010 |
| 13 | Panh | Cái | 0,0001 |
| 14 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 15 | Hộp vận chuyển bệnh phẩm | Cái | 0,0001 |
| 16 | Đầu côn 10 ml | Cái | 1,000 |
| 17 | Đầu côn 200 ml | Cái | 4,000 |
| 18 | Đầu côn 1000 ml | Cái | 1,000 |
| 19 | Pipet nhựa | Cái | 1,000 |
| 20 | Sinh phẩm chẩn đoán (kiểm chuẩn) | Test | 0,400 |
| 21 | Sinh phẩm chẩn đoán | Test | 1,000 |
| 22 | EQAS (nếu thực hiện) * |
| 0,005 |
* Ghi chú:
Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/200 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 2 lần/1 năm).
3. Bệnh phẩm
Huyết thanh
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu phiếu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
Theo đúng quy định của chuyên ngành Vi sinh ( xem Phụ lục 4).
2. Tiến hành kỹ thuật
Bộ sinh phẩm chẩn đoán của Scimedx (USA)
2.1. Lấy bộ kít ra khỏi tủ lạnh, lấy đủ số giếng cần làm.
2.2. Nhỏ chứng dương, chứng âm và mẫu huyết thanh đã pha loãng 1/64 vào mỗi giếng.
2.3. Ủ ở nhiệt độ 15-25°C
2.4. Rửa với dung dịch rửa đã pha loãng, lắc sạch nước.
2.5. Thêm Conjugate vào mỗi giếng, ủ ở nhiệt độ phòng.
2.6. Rửa với dung dịch rửa đã pha loãng, lắc sạch nước.
2.7. Nhỏ TMB vào mỗi giếng ủ ở nhiệt độ phòng.
2.8. Nhỏ Stop Solution.
IV. NHẬN ĐỊNH KẾT QUẢ
1. Đọc kết quả
Cài đặt bước sóng máy đọc là 450nm/650nm-620nm.
Đọc kết quả theo hướng dẫn của bộ kít.
2. Kiểm tra chất lượng
Kiểm tra chất lượng cho phép đánh giá sự ổn định của bộ kít. Bộ kít không được sử dụng nếu bất kỳ chứng dương hoặc chứng âm rơi ra khỏi ngưỡng quy định.
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
Rửa kỹ các giếng thử. Sau khi rửa vỗ nhẹ thanh nhựa vào giấy thấm cho ráo nước và làm tiếp các bước tiếp theo ngay không để các giếng bị khô.
188. Entamoeba histolytica (Amip) Ab miễn dịch bán tự động
I. MỤC ĐÍCH, NGUYÊN LÝ
1. Mục đích
Phát hiện kháng thể IgG kháng với Entamoeba histolytica có trong mẫu huyết thanh.
2. Nguyên lý
Phát hiện kháng thể IgG kháng với Entamoeba histolytica có trong mẫu huyết thanh bằng kỹ thuật miễn dịch gắn men (ELISA).
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh - Ký sinh trùng.
- Người nhận định và phê duyệt kết quả: Cán bộ có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh - Ký sinh trùng
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Máy đọc ELISA
- Tủ an toàn sinh học cấp 2
- Máy ly tâm
- Tủ lạnh 2- 8ºC
- Micropipette 10 µl, 200 µl, 1000 µl.
- Giá đựng ống máu
- Ống nghiệm.
- Ống đong chia vạch.
- Giấy thấm.
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Giấy xét nghiệm | Tờ | 2,000 |
| 2 | Tube lấy bệnh phẩm | Cái | 1,000 |
| 3 | Mũ | Cái | 0,100 |
| 4 | Khẩu trang | Cái | 0,100 |
| 5 | Găng tay | Đôi | 2,000 |
| 6 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 7 | Quần áo bảo hộ | Bộ | 0,001 |
| 8 | Bút viết kính | Cái | 0,020 |
| 9 | Bút bi | Cái | 0,010 |
| 10 | Sổ lưu kết quả xét nghiệm | Quyển | 0,001 |
| 11 | Dung dịch rửa tay | ml | 8,000 |
| 12 | Khăn lau tay | Cái | 0,010 |
| 13 | Panh | Cái | 0,0001 |
| 14 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 15 | Hộp vận chuyển bệnh phẩm | Cái | 0,0001 |
| 16 | Đầu côn 10 ml | Cái | 1,000 |
| 17 | Đầu côn 200 ml | Cái | 4,000 |
| 18 | Đầu côn 1000 ml | Cái | 1,000 |
| 19 | Pipet nhựa | Cái | 1,000 |
| 20 | Sinh phẩm chẩn đoán (QC) | Test | 0,400 |
| 21 | Sinh phẩm chẩn đoán | Test | 1,000 |
| 22 | EQAS (nếu thực hiện) * |
| 0,005 |
* Ghi chú:
Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/200 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 2 lần/1 năm).
3. Bệnh phẩm
Huyết thanh.
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu phiếu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
Theo đúng quy định của chuyên ngành Vi sinh ( xem Phụ lục 4).
2. Tiến hành kỹ thuật
Bộ sinh phẩm chẩn đoán của Scimedx (USA)
2.1. Lấy bộ kít ra khỏi tủ lạnh, lấy đủ số giếng cần làm.
2.2. Nhỏ chứng dương, chứng âm và mẫu huyết thanh đã pha loãng 1/64 vào mỗi giếng.
2.3. Ủ ở nhiệt độ 15-25°C
2.4. Rửa với dung dịch rửa đã pha loãng, lắc sạch nước.
2.5. Thêm Conjugate vào mỗi giếng, ủ ở nhiệt độ phòng.
2.6. Rửa với dung dịch rửa đã pha loãng, lắc sạch nước.
2.7. Nhỏ TMB vào mỗi giếng ủ ở nhiệt độ phòng.
2.8. Nhỏ Stop Solution.
IV. NHẬN ĐỊNH KẾT QUẢ
1. Đọc kết quả
Cài đặt bước sóng máy đọc là 450nm/650nm-620nm.
Đọc kết quả theo hướng dẫn của bộ kít.
2. Kiểm tra chất lượng
Kiểm tra chất lượng cho phép đánh giá sự ổn định của bộ kít. Bộ kít không được sử dụng nếu bất kỳ chứng dương hoặc chứng âm rơi ra khỏi ngưỡng quy định.
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
Rửa kỹ các giếng thử. Sau khi rửa vỗ nhẹ thanh nhựa vào giấy thấm cho ráo nước và làm tiếp các bước tiếp theo ngay không để các giếng bị khô.
189. Fasciola (Sán lá gan lớn) Ab miễn dịch bán tự động
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Phát hiện kháng thể IgG kháng với Fasciola có trong mẫu huyết thanh.
2. Nguyên lý
Phát hiện kháng thể IgG kháng Fasciola có trong mẫu huyết thanh bằng kỹ thuật miễn dịch gắn men (ELISA).
II. CHUẨN BỊ
1.Người thực hiện
- Người thực hiện Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh - Ký sinh trùng.
- Người nhận định và phê duyệt kết quả: Cán bộ có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh - Ký sinh trùng
2.Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Máy đọc ELISA
- Máy ly tâm
- Tủ an toàn sinh học cấp 2
- Tủ lạnh 2 - 8 oC
- Micropipette 10 µl, 200 µl, 1000 µl.
- Giá đựng ống máu.
- Ống nghiệm.
- Ống đong chia vạch.
- Giấy thấm.
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Giấy xét nghiệm | Tờ | 2,000 |
| 2 | Tube lấy bệnh phẩm | Cái | 1,000 |
| 3 | Mũ | Cái | 0,100 |
| 4 | Khẩu trang | Cái | 0,100 |
| 5 | Găng tay | Đôi | 2,000 |
| 6 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 7 | Quần áo bảo hộ | Bộ | 0,001 |
| 8 | Bút viết kính | Cái | 0,020 |
| 9 | Bút bi | Cái | 0,010 |
| 10 | Sổ lưu kết quả xét nghiệm | Quyển | 0,001 |
| 11 | Dung dịch rửa tay | ml | 8,000 |
| 12 | Khăn lau tay | Cái | 0,010 |
| 13 | Panh | Cái | 0,0001 |
| 14 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 15 | Hộp vận chuyển bệnh phẩm | Cái | 0,0001 |
| 16 | Đầu côn 10 ml | Cái | 1,000 |
| 17 | Đầu côn 200 ml | Cái | 4,000 |
| 18 | Đầu côn 1000 ml | Cái | 1,000 |
| 19 | Pipet nhựa | Cái | 1,000 |
| 20 | Sinh phẩm chẩn đoán(QC) | Test | 0,400 |
| 21 | Sinh phẩm chẩn đoán | Test | 1,000 |
| 22 | QC (nếu thực hiện) * |
| 0,1 |
| 23 | EQAS (nếu thực hiện) * |
| 0,005 |
* Ghi chú:
- Chi phí nội kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình nội kiểm (QC) là 1/10 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lượng ≥ 10 mẫu cho 1 lần tiến hành kỹ thuật).
- Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/200 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 2 lần/1 năm).
3.Bệnh phẩm
Huyết thanh.
4.Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu phiếu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
Theo đúng quy định của chuyên ngành Vi sinh ( xem Phụ lục 4).
2.Tiến hành kỹ thuật
Bộ sinh phẩm chẩn đoán của Scimedx (USA)
2.1. Lấy bộ kít ra khỏi tủ lạnh, lấy đủ số giếng cần làm.
2.2. Nhỏ chứng dương, chứng âm và mẫu huyết thanh đã pha loãng 1/100 vào mỗi giếng.
2.3. Ủ ở nhiệt độ 15-25°C.
2.4. Rửa với dung dịch rửa đã pha loãng, lắc sạch nước.
2.5. Thêm Conjugate vào mỗi giếng, ủ ở nhiệt độ phòng.
2.6. Rửa với dung dịch rửa đã pha loãng, lắc sạch nước.
2.7. Nhỏ Chromogen vào mỗi giếng ủ ở nhiệt độ phòng.
2.8. Nhỏ Stop Solution.
IV. NHẬN ĐỊNH KẾT QUẢ
1. Đọc kết quả
Cài đặt bước sóng máy đọc là 450nm/650nm-620nm.
Đọc kết quả theo hướng dẫn của bộ kít.
2. Kiểm tra chất lượng
Kiểm tra chất lượng cho phép đánh giá sự ổn định của bộ kít. Bộ kít không được sử dụng nếu bất kỳ chứng dương hoặc chứng âm rơi ra khỏi ngưỡng quy định.
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
Rửa kỹ các giếng thử. Sau khi rửa vỗ nhẹ thanh nhựa vào giấy thấm cho ráo nước và làm tiếp các bước tiếp theo ngay không để các giếng bị khô.
190. Filaria (Giun chỉ) ấu trùng trong máu nhuộm soi
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Phát hiện ấu trùng giun chỉ trong máu.
2. Nguyên lý
Nhận định ấu trùng giun chỉ trong máu trên tiêu bản nhuộm Giemsa dựa trên hình thể, cấu tạo, kích thước và tính chất bắt màu.
II. CHUẨN BỊ
1.Người thực hiện
- Người thực hiện Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh - Ký sinh trùng.
- Người nhận định và phê duyệt kết quả: Cán bộ có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh - Ký sinh trùng
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Kính hiển vi.
- Tủ an toàn sinh học cấp 2
- Đồng hồ bấm giờ
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Tube lấy bệnh phẩm | Cái | 1,000 |
| 2 | Que cấy | Cái | 1,000 |
| 3 | Lam kính | Cái | 2,000 |
| 4 | Lá kính | Cái | 2,000 |
| 5 | Giemsa cốt | ml | 1,000 |
| 6 | Dung dịch đệm | ml | 10,000 |
| 7 | Bông | Kg | 0,001 |
| 8 | Cồn 90 độ (vệ sinh dụng cụ) | ml | 10,000 |
| 9 | Panh | Cái | 0,0001 |
| 10 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 11 | Hộp vận chuyển bệnh phẩm | Cái | 0,0001 |
| 12 | Pipet nhựa | Cái | 2,000 |
| 13 | Axit ngâm lam | ml | 10,000 |
| 14 | Mũ | Cái | 0,100 |
| 15 | Khẩu trang | Cái | 0,100 |
| 16 | Găng tay | Đôi | 3,000 |
| 17 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 18 | Quần áo bảo hộ | Bộ | 0,001 |
| 19 | Dung dịch rửa tay | ml | 8,000 |
| 20 | Khăn lau tay | Cái | 0,010 |
| 21 | Bút viết kính | Cái | 0,020 |
| 22 | Bút bi | Cái | 0,010 |
| 23 | Bật lửa | Cái | 0,010 |
| 24 | Sổ lưu kết quả xét nghiệm | Quyển | 0,001 |
| 25 | Cồn sát trùng tay nhanh | ml | 1,000 |
| 26 | Giấy trả kết quả xét nghiệm | Tờ | 2,000 |
| 27 | QC (nếu thực hiện) * |
| 0,1 |
| 28 | EQAS (nếu thực hiện) * |
| 0,005 |
* Ghi chú:
- Chi phí nội kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình nội kiểm (QC) là 1/10 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lượng ≥ 10 mẫu cho 1 lần tiến hành kỹ thuật).
- Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/200 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 2 lần/1 năm)
3. Bệnh phẩm
Máu toàn phần có chống đông.
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu phiếu yêu cầu.
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1.Lấy bệnh phẩm
+ Thời gian lấy máu
Lấy máu về đêm từ 22 giờ đêm đến 4 giờ sáng.
+ Cách lấy máu
Theo đúng quy định của chuyên ngành Vi sinh (xem Phụ lục 4).
2. Tiến hành kỹ thuật
2.1. Làm 3 giọt máu đặc trên cùng 1 lam để khô.
2.2. Pha dung dịch Giemsa cốt với dung dịch đệm nồng độ 10%.
2.3. Nhuộm lam với dung dịch Giemsa đã pha để 10 phút.
2.4. Rửa nước, để khô.
2.5. Quan sát kính hiển vi vật kính 10X- 40X.
IV. NHẬN ĐỊNH KẾT QUẢ
1. Dương tính
Ấu trùng giun chỉ có kích thước 180 - 220 X 5 - 6µm bắt màu xanh tím. Ngoài cùng là lớp áo dài hơn thân, trên thân có các hạt nhiễm sắc.
2. Âm tính
Không tìm thấy ấu trùng giun chỉ.
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
1. Sai sót
Giọt máu đặc bị bong sau khi nhuộm do lấy máu quá nhiều hoặc khi rửa dưới vòi nước chảy mạnh.
2. Xử trí
Lấy máu vừa phải, rửa dưới vòi nước chảy nhẹ hoặc đưa vào trong chậu rửa.
191. Gnathostoma(Giun đầu gai) Ab Miễn dịch bán tự động
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Phát hiện kháng thể IgG kháng với Gnathostoma có trong mẫu huyết thanh.
2. Nguyên lý
Phát hiện kháng thể IgG kháng với Gnathostoma có trong mẫu huyết thanh bằng kỹ thuật miễn dịch gắn men (ELISA).
II. CHUẨN BỊ
1.Người thực hiện
- Người thực hiện: Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh - Ký sinh trùng.
- Người nhận định và phê duyệt kết quả: Cán bộ có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh - Ký sinh trùng
2.Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Máy đọc ELISA
- Tủ an toàn sinh học cấp 2
- Máy ly tâm
- Tủ lạnh 2 - 8ºC
- Micropipette 10 µl, 200 µl, 1000 µl.
- Giá đựng ống máu
- Ống nghiệm.
- Ống đong chia vạch.
- Giấy thấm.
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Giấy xét nghiệm | Tờ | 2,000 |
| 2 | Tube lấy bệnh phẩm | Cái | 1,000 |
| 3 | Mũ | Cái | 0,100 |
| 4 | Khẩu trang | Cái | 0,100 |
| 5 | Găng tay | Đôi | 2,000 |
| 6 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 7 | Quần áo bảo hộ | Bộ | 0,001 |
| 8 | Bút viết kính | Cái | 0,020 |
| 9 | Bút bi | Cái | 0,010 |
| 10 | Sổ lưu kết quả xét nghiệm | Quyển | 0,001 |
| 11 | Dung dịch rửa tay | ml | 8,000 |
| 12 | Khăn lau tay | Cái | 0,010 |
| 13 | Panh | Cái | 0,0001 |
| 14 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 15 | Hộp vận chuyển bệnh phẩm | Cái | 0,0001 |
| 16 | Đầu côn 10 ml | Cái | 1,000 |
| 17 | Đầu côn 200 ml | Cái | 4,000 |
| 18 | Đầu côn 1000 ml | Cái | 1,000 |
| 19 | Pipet nhựa | Cái | 1,000 |
| 20 | Sinh phẩm chuẩn đoán | Test | 1,000 |
| 21 | QC (nếu thực hiện) * |
| 0,1 |
| 22 | EQAS (nếu thực hiện) * |
| 0,005 |
* Ghi chú:
- Chi phí nội kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình nội kiểm (QC) là 1/10 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lượng ≥ 10 mẫu cho 1 lần tiến hành kỹ thuật).
- Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/200 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 2 lần/1 năm).
3. Bệnh phẩm
Huyết thanh
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu phiếu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
Theo đúng quy định của chuyên ngành Vi sinh ( xem Phụ lục 4).
2. Tiến hành kỹ thuật
2.1. Lấy bộ kít ra khỏi tủ lạnh, lấy đủ số giếng cần làm.
2.2. Nhỏ chứng dương, chứng âm và mẫu huyết thanh đã pha loãng vào mỗi giếng.
2.3. Ủ ở nhiệt độ 15-25°C.
2.4. Rửa với dung dịch rửa đã pha loãng, lắc sạch nước.
2.5. Thêm Conjugate vào mỗi giếng, ủ ở nhiệt độ phòng.
2.6. Rửa với dung dịch rửa đã pha loãng, lắc sạch nước.
2.7. Nhỏ TMB vào mỗi giếng ủ ở nhiệt độ phòng.
2.8. Nhỏ Stop Solution.
IV. NHẬN ĐỊNH KẾT QUẢ
1. Đọc kết quả
Cài đặt bước sóng máy đọc là 450nm/650nm-620nm.
Đọc kết quả theo hướng dẫn của bộ kít.
2. Kiểm tra chất lượng
- Kiểm tra chất lượng cho phép đánh giá sự ổn định của bộ kít. Bộ kít không được sử dụng nếu bất kỳ chứng dương hoặc chứng âm rơi ra khỏi ngưỡng quy định.
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
Rửa kỹ các giếng thử. Sau khi rửa vỗ nhẹ thanh nhựa vào giấy thấm cho ráo nước và làm tiếp các bước tiếp theo ngay không để các giếng bị khô.
192. Plasmodium (Ký sinh trùng sốt rét) nhuộm soi định tính
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Phát hiện ký sinh trùng sốt rét trong máu.
2. Nguyên lý
Nhận định ký sinh trùng sốt rét trong máu nhuộm Giemsa dựa trên hình thể, cấu tạo, kích thước và tính chất bắt màu.
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh - Ký sinh trùng.
- Người nhận định và phê duyệt kết quả: Cán bộ có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh - Ký sinh trùng
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Kính hiển vi.
- Tủ an toàn sinh học cấp 2
- Đồng hồ bấm giờ
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Tube lấy bệnh phẩm | Cái | 1,000 |
| 2 | Que cấy | Cái | 1,000 |
| 4 | Lam kính | Cái | 2,000 |
| 5 | Giemsa cốt | ml | 1,000 |
| 6 | Dung dịch đệm | ml | 10,000 |
| 7 | Bông | Kg | 0,001 |
| 8 | Cồn 96 độ (vệ sinh dụng cụ) | ml | 10,000 |
| 9 | Panh | Cái | 0,0001 |
| 10 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 11 | Hộp vận chuyển bệnh phẩm | Cái | 0,0001 |
| 12 | Pipet nhựa | Cái | 2,000 |
| 13 | Axit ngâm lam | ml | 10,000 |
| 14 | Mũ | Cái | 0,100 |
| 15 | Khẩu trang | Cái | 0,100 |
| 16 | Găng tay | Đôi | 3,000 |
| 17 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 18 | Quần áo bảo hộ | Bộ | 0,001 |
| 19 | Dung dịch rửa tay | ml | 8,000 |
| 20 | Khăn lau tay | Cái | 0,010 |
| 21 | Bút viết kính | Cái | 0,020 |
| 22 | Bút bi | Cái | 0,010 |
| 23 | Bật lửa | Cái | 0,010 |
| 24 | Sổ lưu kết quả xét nghiệm | Quyển | 0,001 |
| 25 | Cồn sát trùng tay nhanh | ml | 1,000 |
| 26 | Đũa thủy tinh | Cái | 1,000 |
| 27 | Giấy trả kết quả xét nghiệm | Tờ | 2,000 |
| 28 | QC (nếu thực hiện) * |
| 0,1 |
| 29 | EQAS (nếu thực hiện) * |
| 0,005 |
* Ghi chú:
- Chi phí nội kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình nội kiểm (QC) là 1/10 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lượng ≥ 10 mẫu cho 1 lần tiến hành kỹ thuật).
- Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/200 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 2 lần/1 năm).
3. Bệnh phẩm
Máu toàn phần có chống đông.
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu phiếu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
Theo đúng quy định của chuyên ngành Vi sinh ( xem Phụ lục 4).
2. Tiến hành kỹ thuật
2.1. Làm tiêu tiêu bản giọt máu đặc và giọt máu đàn để khô.
2.2. Cố định giọt máu đàn bằng cồn 96°.
2.3. Pha dung dịch Giemsa cốt với dung dịch đệm nồng độ 10%.
2.4. Nhuộm lam với dung dịch Giemsa đã pha để 10 phút.
2.5. Rửa nước, để khô.
2.6. Quan sát kính hiển vi vật kính 100X.
IV. NHẬN ĐỊNH KẾT QUẢ
1. Dương tính
- Có 4 loài ký sinh trùng sốt rét gây bệnh cho người
Plasmodium falciparum, Plasmodium vivax, Plasmodium malariae, Plasmodium ovale.
- Các thể gặp khi xét nghiệm máu
- Plasmodium falciparum: Thể tư dưỡng, thể giao bào ở máu ngoại vi, hiếm gặp thể phân liệt.
- Plasmodium vivax, Plasmodium malariae, Plasmodium ovale: Cả 3 thể: thể tư dưỡng, thể phân liệt, thể giao bào ở máu ngoại vi.
Đánh giá mức độ nhiễm KSTSR ở giọt máu đặc theo 4 mức độ
- 1 - 10 KST / 100 vi trường: (+).
- 11 - 100 KST / 100 vi trường: (++).
- 1 - 10 KST / 1 vi trường: (+++).
- > 10 KST / 1 vi trường: (++++).
2. Âm tính
Không tìm thấy ký sinh trùng sốt rét.
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
1. Sai sót
Giọt máu đặc bị bong sau khi nhuộm do lấy máu quá nhiều hoặc khi rửa dưới vòi nước chảy mạnh.
2. Xử trí
Lấy máu vừa phải, rửa dưới vòi nước chảy nhẹ hoặc đưa vào trong chậu rửa.
193. Plasmodium (Ký sinh trùng sốt rét) nhuộm soi định lượng
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Đếm số lượng ký sinh trùng sốt rét có trong 1mm³ máu trên tiêu bản nhuộm Giemsa.
2. Nguyên lý
Đếm số lượng ký sinh trùng sốt rét trong máu nhuộm Giemsa dựa trên hình thể, cấu tạo, kích thước và tính chất bắt màu.
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh - Ký sinh trùng.
- Người nhận định và phê duyệt kết quả: Cán bộ có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh - Ký sinh trùng
2.Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Kính hiển vi.
- Tủ an toàn sinh học cấp 2
- Đồng hồ bấm giờ.
- Hai máy đếm.
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Tube lấy bệnh phẩm | Cái | 1,000 |
| 2 | Lam kính | Cái | 2,000 |
| 3 | Que thủy tinh | Cái | 1,000 |
| 4 | Giemsa cốt | ml | 1,000 |
| 5 | Dung dịch đệm | ml | 10,000 |
| 6 | Bông | Kg | 0,001 |
| 7 | Cồn 96 độ | ml | 10,000 |
| 8 | Panh | Cái | 0,0001 |
| 9 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 10 | Hộp vận chuyển bệnh phẩm | Cái | 0,0001 |
| 11 | Pipet nhựa | Cái | 2,000 |
| 12 | Axit ngâm lam | ml | 10,000 |
| 13 | Mũ | Cái | 0,100 |
| 14 | Khẩu trang | Cái | 0,100 |
| 15 | Găng tay | Đôi | 3,000 |
| 16 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 17 | Quần áo bảo hộ | Bộ | 0,001 |
| 18 | Dung dịch rửa tay | ml | 8,000 |
| 19 | Khăn lau tay | Cái | 0,010 |
| 20 | Bút viết kính | Cái | 0,020 |
| 21 | Bút bi | Cái | 0,010 |
| 22 | Bật lửa | Cái | 0,010 |
| 23 | Sổ lưu kết quả xét nghiệm | Quyển | 0,001 |
| 24 | Cồn sát trùng tay nhanh | ml | 1,000 |
| 25 | Giấy trả kết quả xét nghiệm | Tờ | 2,000 |
| 26 | QC (nếu thực hiện) * |
| 0,1 |
| 27 | EQAS (nếu thực hiện) * |
| 0,005 |
* Ghi chú:
- Chi phí nội kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình nội kiểm (QC) là 1/10 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lượng ≥ 10 mẫu cho 1 lần tiến hành kỹ thuật).
- Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/200 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 2 lần/1 năm).
3. Bệnh phẩm
Máu toàn phần có chứa chống đông.
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu phiếu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
Theo đúng quy định của chuyên ngành Vi sinh (xem Phụ lục 4).
2. Tiến hành kỹ thuật
2.1. Làm tiêu bản giọt máu đặc và giọt máu đàn trên cùng 1 lam để khô.
2.2. Cố định giọt máu đàn bằng cồn 96º, để khô.
2.3. Pha dung dịch Giemsa cốt với dung dịch đệm nồng độ 10%.
2.4. Nhuộm dung dịch Giemsa 10% để 10 phút, rửa nước, để khô.
2.5. Quan sát kính hiển vi vật kính 100X.
IV. NHẬN ĐỊNH KẾT QUẢ
- Xác định số lượng ký sinh trùng sốt rét trên 1mm³ máu theo bạch cầu (Dựa vào số lượng bạch cầu chuẩn 8.000 BC).
- Nếu đếm được 200 BC, số lượng KSTSR > 10, áp dụng công thức
| Số lượng KSTSR đếm được x 8000 | = Số KSTSR/ml (*) |
| Số lượng bạch cầu đếm được |
- Nếu đếm được 200 BC, số lượng KSTSR < 10 thì tiếp tục đếm cho đủ 500 BC hoặc 1.000 BC rồi áp dụng công thức trên.
- Trường hợp mật độ KSTSR trên lam nhiều: Đếm chưa đủ 200 BC, số lượng KSTSR ≥ 500 thì không đếm tiếp mà áp dụng công thức trên.
- Cách trả lời kết quả xét nghiệm với kết quả đếm được (VD nhiễm P. falciparum thể tư dưỡng)
KSTSR: P.FT+ = Số lượng KST đếm được/µl.
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
1. Sai sót
Giọt máu đặc bị bong sau khi nhuộm do lấy máu quá nhiều hoặc khi rửa dưới vòi nước chảy mạnh.
2. Xử trí
Lấy máu vừa phải, rửa dưới vòi nước chảy nhẹ hoặc đưa vào trong chậu rửa.
194. Plasmodium (Ký sinh trùng sốt rét) Ag test nhanh
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Phát hiện kháng nguyên ký sinh trùng sốt rét trong máu.
2. Nguyên lý
Kháng thể kháng ký sinh trùng sốt rét sẽ gắn đặc hiệu với kháng nguyên (ký sinh trùng sốt rét) có trong bệnh phẩm máu. Phản ứng xảy ra theo nguyên lý sắc ký miễn dịch.
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh - Ký sinh trùng.
- Người nhận định và phê duyệt kết quả: Cán bộ có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh - Ký sinh trùng
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Micropipette.
- Đồng hồ bấm giờ.
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Tube lấy bệnh phẩm | Cái | 1,000 |
| 2 | Sinh phẩm chẩn đoán | Test | 1,000 |
| 3 | Bông | Kg | 0,001 |
| 4 | Cồn 90 độ (vệ sinh dụng cụ) | ml | 10,000 |
| 5 | Panh | Cái | 0,0001 |
| 6 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 7 | Hộp vận chuyển bệnh phẩm | Cái | 0,0001 |
| 8 | Pipet nhựa | Cái | 2,000 |
| 9 | Mũ | Cái | 0,100 |
| 10 | Khẩu trang | Cái | 0,100 |
| 11 | Găng tay | Đôi | 3,000 |
| 12 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 13 | Quần áo bảo hộ | Bộ | 0,001 |
| 14 | Dung dịch rửa tay | ml | 8,000 |
| 15 | Khăn lau tay | Cái | 0,010 |
| 16 | Bút viết kính | Cái | 0,020 |
| 17 | Bút bi | Cái | 0,010 |
| 18 | Bật lửa | Cái | 0,010 |
| 19 | Sổ lưu kết quả xét nghiệm | Quyển | 0,001 |
| 20 | Cồn sát trùng tay nhanh | ml | 1,000 |
| 21 | Giấy trả kết quả xét nghiệm | Tờ | 2,000 |
3. Bệnh phẩm
Máu toàn phần có chống đông.
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu phiếu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
Theo đúng quy định của chuyên ngành Vi sinh ( xem Phụ lục 4).
2.Tiến hành kỹ thuật
Sinh phẩm chẩn đoán của SD BIOLINE
2.1. Lấy thanh thử ra khỏi bao, để trên mặt phẳng khô sạch.
2.2. Lấy 5µl máu đầu ngón tay bằng ống hút đến ngang vạch có sẵn hoặc máu tĩnh mạch cho vào giếng tròn S.
2.3. Nhỏ 4 giọt buffer vào giếng vuông bên cạnh.
2.4. Đọc kết quả sau 15 -30 phút.
IV. NHẬN ĐỊNH KẾT QUẢ
1. Âm tính
Chỉ có vạch C.
2. Dương tính
- P. falciparum dương tính: có 2 vạch C và P.f
- P. vivax dương tính: có 2 vạch C và P.v
- Nhiễm phối hợp cả P. falciparum và P.vivax: có 3 vạch : vạch C, P. f và P.v
3. Không giá trị
Không có vạch C. Phải tiến hành làm lại xét nghiệm với một thanh thử khác.
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
Không đọc kết quả quá 30 phút vì có thể dẫn đến kết quả sai.
195. Strongyloides stercoralis (Giun lươn) Ab miễn dịch bán tự động
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Phát hiện kháng thể IgG kháng với Strongyloides stercoralis có trong mẫu huyết thanh.
2. Nguyên lý
Phát hiện kháng thể IgG kháng với Strongyloides stercoralis có trong mẫu huyết thanh bằng kỹ thuật miễn dịch gắn men (ELISA).
II. CHUẨN BỊ
1.Người thực hiện
- Người thực hiện Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh - Ký sinh trùng.
- Người nhận định và phê duyệt kết quả: Cán bộ có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh - Ký sinh trùng
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Máy đọc ELISA.
- Tủ an toàn sinh học cấp 2
- Máy ly tâm
- Tủ lạnh 2-8°C
- Micropipette 10 µl, 200 µl, 1000 µl.
- Giá đựng ống máu
- Ống nghiệm.
- Ống đong chia vạch.
- Giấy thấm.
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Giấy xét nghiệm | Tờ | 2,000 |
| 2 | Tube lấy bệnh phẩm | Cái | 1,000 |
| 3 | Mũ | Cái | 0,100 |
| 4 | Khẩu trang | Cái | 0,100 |
| 5 | Găng tay | Đôi | 2,000 |
| 6 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 7 | Quần áo bảo hộ | Bộ | 0,001 |
| 8 | Bút viết kính | Cái | 0,020 |
| 9 | Bút bi | Cái | 0,010 |
| 10 | Sổ lưu kết quả xét nghiệm | Quyển | 0,001 |
| 11 | Dung dịch rửa tay | ml | 8,000 |
| 12 | Khăn lau tay | Cái | 0,010 |
| 13 | Panh | Cái | 0,0001 |
| 14 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 15 | Hộp vận chuyển bệnh phẩm | Cái | 0,0001 |
| 16 | Đầu côn 10 ml | Cái | 1,000 |
| 17 | Đầu côn 200 ml | Cái | 4,000 |
| 18 | Đầu côn 1000 ml | Cái | 1,000 |
| 19 | Pipet nhựa | Cái | 1,000 |
| 20 | Sinh phẩm chẩn đoán (QC) | Test | 0,400 |
| 21 | Sinh phẩm chẩn đoán | Test | 1,000 |
| 22 | EQAS (nếu thực hiện) * |
| 0,005 |
* Ghi chú:
Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/200 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 2 lần/1 năm).
3. Bệnh phẩm
Huyết thanh
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu phiếu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
Theo đúng quy định của chuyên ngành Vi sinh ( xem Phụ lục 4).
2. Tiến hành kỹ thuật
Bộ sinh phẩm chẩn đoán của Scimedx (USA)
2.1. Lấy bộ kít ra khỏi tủ lạnh, lấy đủ số giếng cần làm.
2.2. Nhỏ chứng dương, chứng âm và mẫu huyết thanh đã pha loãng 1/64 vào mỗi giếng.
2.3. Ủ ở nhiệt độ 15-25°C.
2.4. Rửa với dung dịch rửa đã pha loãng, lắc sạch nước.
2.5. Thêm Conjugate vào mỗi giếng, ủ ở nhiệt độ phòng.
2.6. Rửa với dung dịch rửa đã pha loãng, lắc sạch nước.
2.7. Nhỏ TMB vào mỗi giếng ủ ở nhiệt độ phòng.
2.8. Nhỏ Stop Solution.
IV. NHẬN ĐỊNH KẾT QUẢ
1. Đọc kết quả
Cài đặt bước sóng máy đọc là 450nm/650nm-620nm.
Đọc kết quả theo hướng dẫn của bộ kít.
2. Kiểm tra chất lượng
Kiểm tra chất lượng cho phép đánh giá sự ổn định của bộ kít. Bộ kít không được sử dụng nếu bất kỳ chứng dương hoặc chứng âm rơi ra khỏi ngưỡng quy định.
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
Rửa kỹ các giếng thử. Sau khi rửa vỗ nhẹ thanh nhựa vào giấy thấm cho ráo nước và làm tiếp các bước tiếp theo ngay không để các giếng bị khô.
196. Toxocara (Giun đũa chó mèo) Ab miễn dịch bán tự động
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Phát hiện kháng thể IgG kháng với Toxocara có trong mẫu huyết thanh.
2. Nguyên lý
Phát hiện kháng thể IgG kháng với Toxocara có trong mẫu huyết thanh bằng kỹ thuật miễn dịch gắn men (ELISA).
II. CHUẨN BỊ
1.Người thực hiện
- Người thực hiện Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh - Ký sinh trùng.
- Người nhận định và phê duyệt kết quả: Cán bộ có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh - Ký sinh trùng
2.Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Máy đọc ELISA.
- Tủ an toàn sinh học cấp 2
- Máy ly tâm
- Tủ lạnh 2-8ºC
- Micropipette 10 µl, 200 µl, 1000 µl.
- Giá đựng ống máu
- Ống nghiệm.
- Ống đong chia vạch.
- Giấy thấm.
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Giấy xét nghiệm | Tờ | 2,000 |
| 2 | Tube lấy bệnh phẩm | Cái | 1,000 |
| 3 | Mũ | Cái | 0,100 |
| 4 | Khẩu trang | Cái | 0,100 |
| 5 | Găng tay | Đôi | 2,000 |
| 6 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 7 | Quần áo bảo hộ | Bộ | 0,001 |
| 8 | Bút viết kính | Cái | 0,020 |
| 9 | Bút bi | Cái | 0,010 |
| 10 | Sổ lưu kết quả xét nghiệm | Quyển | 0,001 |
| 11 | Dung dịch rửa tay | ml | 8,000 |
| 12 | Khăn lau tay | Cái | 0,010 |
| 13 | Panh | Cái | 0,0001 |
| 14 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 15 | Hộp vận chuyển bệnh phẩm | Cái | 0,0001 |
| 16 | Đầu côn 10 ml | Cái | 1,000 |
| 17 | Đầu côn 200 ml | Cái | 4,000 |
| 18 | Đầu côn 1000 ml | Cái | 1,000 |
| 19 | Pipet nhựa | Cái | 1,000 |
| 20 | Sinh phẩm chẩn đoán (QC) | Test | 0,400 |
| 21 | Sinh phẩm chẩn đoán | Test | 1,000 |
| 22 | EQAS (nếu thực hiện) * |
| 0,005 |
* Ghi chú:
Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/200 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 2 lần/1 năm).
3. Bệnh phẩm
Huyết thanh
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu phiếu yêu cầu
III. Các bước tiến hành
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
Theo đúng quy định của chuyên ngành Vi sinh ( xem Phụ lục 4).
2. Tiến hành kỹ thuật
Bộ sinh phẩm chẩn đoán của Scimedx (USA)
2.1. Lấy bộ kít ra khỏi tủ lạnh, lấy đủ số giếng cần làm.
2.2. Nhỏ chứng dương, chứng âm và mẫu huyết thanh đã pha loãng 1/64 vào mỗi giếng.
2.3. Ủ ở nhiệt độ 15-25°C trong 10 phút
2.4. Rửa với dung dịch rửa đã pha loãng, lắc sạch nước.
2.5. Thêm Conjugate vào mỗi giếng, ủ ở nhiệt độ phòng trong 5 phút.
2.6. Rửa với dung dịch rửa đã pha loãng, lắc sạch nước.
2.7. Nhỏ TMB vào mỗi giếng ủ ở nhiệt độ phòng trong 5 phút.
2.8. Nhỏ Stop Solution.
IV. NHẬN ĐỊNH KẾT QUẢ
1. Đọc kết quả
Cài đặt bước sóng máy đọc là 450nm/650nm-620nm.
Đọc kết quả theo hướng dẫn của bộ kít.
2. Kiểm tra chất lượng
Kiểm tra chất lượng cho phép đánh giá sự ổn định của bộ kít. Bộ kít không được sử dụng nếu bất kỳ chứng dương hoặc chứng âm rơi ra khỏi ngưỡng quy định.
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
Rửa kỹ các giếng thử. Sau khi rửa vỗ nhẹ thanh nhựa vào giấy thấm cho ráo nước và làm tiếp các bước tiếp theo ngay không để các giếng bị khô.
197. Toxoplasma IgM miễn dịch tự động
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Phát hiện kháng thể IgM kháng toxoplasma virus trong huyết thanh hoặc huyết tương.
2. Nguyên lý
Phát hiện kháng thể IgM kháng toxoplasma virus dựa trên nguyên lý của kỹ CLIA (miễn dịch điện hóa phát quang) (VD).
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh - Ký sinh trùng.
- Người nhận định và phê duyệt kết quả: Cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh - Ký sinh trùng.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Hệ thống máy Cobas e 6000
- Tủ an toàn sinh học cấp 2
- Bộ lưu điện
- Máy ly tâm
- Tủ lạnh 2 oC - 8 oC
- Tủ âm sâu (- 20 oC) hoặc (- 70 oC) (nếu có)
- Micropipette thể tích từ 50 µl đến 200 µl..
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
Thực hiện xét nghiệm 01 mẫu/lần.
| STT | Chi phí hóa chất, vật tư tiêu hao | ĐƠN VỊ | SỐ LƯỢNG |
| 1 | Bông | Kg | 0,001 |
| 2 | Dây garô | Cái | 0,001 |
| 3 | Cồn | ml | 1,000 |
| 4 | Bơm kim tiêm | Cái | 1,000 |
| 5 | Panh | Cái | 0,0001 |
| 6 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 7 | Hộp vận chuyển bệnh phẩm | Test | 0,001 |
| 8 | Tube đựng bệnh phẩm | Cái | 1,000 |
| 9 | Sinh phẩm chẩn đoán | Test | 1,000 |
| 10 | Khấu hao sinh phẩm cho chạy chuẩn | Test | 0,100 |
| 11 | Khấu hao sinh phẩm cho chạy chứng, kiểm tra chất lượng | Test | 2,000 |
| 12 | Control | Test | 0,100 |
| 13 | Chứng ngoại kiểm âm (nếu có) | ml | 0,150 |
| 14 | Chứng ngoại kiểm dương (nếu có) | ml | 0,150 |
| 15 | Ngoại kiểm (nếu có)* |
| 0,020 |
| 16 | Cleancell M | ml | 3,000 |
| 17 | Procell M | ml | 3,000 |
| 18 | Probe Wash M | ml | 2,000 |
| 19 | Preclean M | chiếc | 2,000 |
| 20 | Assay Tip/Cup E170 | ml | 3,000 |
| 21 | ISE Cleaning Solution F. HIT | ml | 0,500 |
| 22 | Nước cất | chiếc | 5,000 |
| 23 | Sample cup | Cái | 1,000 |
| 24 | Giấy thấm | Cuộn | 0,100 |
| 25 | Giấy xét nghiệm | Tờ | 2,000 |
| 26 | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 27 | Bút viết kính | Cái | 0,020 |
| 28 | Bút bi | Cái | 0,010 |
| 29 | Mũ | Cái | 0,020 |
| 30 | Khẩu trang | Cái | 0,020 |
| 31 | Găng tay | Đôi | 0,100 |
| 32 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 33 | Quần áo bảo hộ | Bộ | 0,005 |
| 34 | Dung dịch nước rửa tay | ml | 8,000 |
| 35 | Cồn sát trùng tay nhanh | ml | 1,000 |
| 36 | Dung dịch khử trùng | ml | 10,000 |
| 37 | Khăn lau tay | Cái | 0,010 |
* Ghi chú: Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/50 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 3 lần/1 năm).
3. Bệnh phẩm
Huyết thanh hoặc huyết tương.
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
- Theo đúng quy định của chuyên ngành Vi sinh: xem chi tiết phụ lục 2.
- Từ chối những bệnh phẩm không đạt yêu cầu: xem chi tiết phụ lục 6.
2. Tiến hành kỹ thuật: Bộ sinh phẩm Toxo IgM Elecsys Roche (VD)
| Các bước | Xét nghiệm định lượng Toxo IgM |
| 1 | Vào Reagent để kiểm tra số lượng tests. |
| 2 | Vào Calibration → Status để kiểm tra hiệu chuẩn |
| 3 | Chạy chứng |
| Chạy mẫu không dùng barcode | |
| 1 | Đánh số sample cup theo mã số bệnh phẩm. Hút huyết thanh/huyết tương vào sample cup tương ứng. |
| 2 | Vào màn hình Workplace → Test Selection |
| 3 | Nhập mã bệnh phẩm |
| 4 | Chọn tên test là Toxo IgM |
| 5 | Vào Barcode Read Error |
| 6 | Nhập số rack và vị trí mẫu → Add → OK → Save |
| 7 | Đặt mẫu đã được hút vào Sample Cup lên Rack màu xám đúng vị trí đã order rồi đưa vào khu nạp giá mẫu. |
| 8 | Chọn Start → Chọn START ở màn hình Start Conditions |
| Chạy mẫu có barcode | |
| 1 | Nhập chỉ định xét nghiệm trên máy tính bằng phần mềm LIS |
| 2 | Đặt ống máu đã được dán barcode vào rack màu xám, quay mặt barcode ra phía ngoài rồi đưa vào khu nạp giá mẫu |
| 3 | Chọn Start → Chọn START ở màn hình Start Conditions |
IV. NHẬN ĐỊNH KẾT QUẢ
1. Đánh giá theo tiêu chuẩn nhà sản xuất
- Chạy kiểm tra chứng 1 và chứng 2 trên tất cả các điện cực dùng để chạy xét nghiệm.
- Giá trị chứng đạt được phải nằm trong khoảng giới hạn xác định.
2. Đánh giá theo tiêu chuẩn phòng xét nghiệm
Chứng nội kiểm, ngoại kiểm: Đánh giá kết quả dựa trên biểu đồ Levey-Jenning (nếu có)
3. Kết quả và báo cáo
- Âm tính: Nếu COI < 0,8.
- Không xác định: Nếu 0,8 ≤ COI < 1.
- Dương tính: Nếu COI ≥ 1.
Những mẫu không xác định cần kiểm tra lại lần 2. Nếu vẫn lặp lại kết quả lần đầu thì nên xét nghiệm lại với mẫu bệnh phẩm thứ hai sau 2 - 3 tuần.
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
- Máy báo sample short (do bệnh phẩm bị đông hoặc không đủ) → Chú ý ly tâm mẫu thật kỹ ngay từ đầu hoặc hút mẫu ra cup.
- Không sử dụng thuốc thử đã quá hạn sử dụng.
- Tránh tạo bọt ở lọ thuốc thử và các loại mẫu (bệnh phẩm, calibration và chứng).
198. Toxoplasma IgG miễn dịch tự động
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Phát hiện kháng thể IgG kháng toxoplasma virus trong huyết thanh hoặc huyết tương.
2. Nguyên lý
Phát hiện kháng thể IgG kháng toxoplasma virus dựa trên nguyên lý của kỹ CLIA (miễn dịch điện hóa phát quang) (VD).
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện: Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh - Ký sinh trùng.
- Người nhận định và phê duyệt kết quả: Cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh - Ký sinh trùng.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Hệ thống máy Cobas e 6000
- Tủ an toàn sinh học cấp 2
- Bộ lưu điện
- Máy ly tâm
- Tủ lạnh 2 oC - 8 oC
- Tủ âm sâu (- 20 oC) hoặc (- 70 oC) (nếu có)
- Micropipette thể tích từ 50 µl đến 200 µl..
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
Thực hiện xét nghiệm 01 mẫu/lần.
| STT | Chi phí hóa chất, vật tư tiêu hao | ĐƠN VỊ | SỐ LƯỢNG |
| 1 | Bông | Kg | 0,001 |
| 2 | Dây garô | Cái | 0,001 |
| 3 | Cồn | ml | 1,000 |
| 4 | Bơm kim tiêm | Cái | 1,000 |
| 5 | Panh | Cái | 0,0001 |
| 6 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 7 | Hộp vận chuyển bệnh phẩm | Test | 0,001 |
| 8 | Tube đựng bệnh phẩm | Cái | 1,000 |
| 9 | Sinh phẩm chẩn đoán | Test | 1,000 |
| 10 | Khấu hao sinh phẩm cho chạy chuẩn | Test | 0,100 |
| 11 | Khấu hao sinh phẩm cho chạy chứng, kiểm tra chất lượng | Test | 2,000 |
| 12 | Control | Test | 0,100 |
| 13 | Chứng ngoại kiểm âm (nếu có) | ml | 0,150 |
| 14 | Chứng ngoại kiểm dương (nếu có) | ml | 0,150 |
| 15 | Ngoại kiểm (nếu có)* |
| 0,020 |
| 16 | Cleancell M | ml | 3,000 |
| 17 | Procell M | ml | 3,000 |
| 18 | Probe Wash M | ml | 2,000 |
| 19 | Preclean M | chiếc | 2,000 |
| 20 | Assay Tip/Cup E170 | ml | 3,000 |
| 21 | ISE Cleaning Solution F. HIT | ml | 0,500 |
| 22 | Nước cất | chiếc | 5,000 |
| 23 | Sample cup | Cái | 1,000 |
| 24 | Giấy thấm | Cuộn | 0,100 |
| 25 | Giấy xét nghiệm | Tờ | 2,000 |
| 26 | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 27 | Bút viết kính | Cái | 0,020 |
| 28 | Bút bi | Cái | 0,010 |
| 29 | Mũ | Cái | 0,020 |
| 30 | Khẩu trang | Cái | 0,020 |
| 31 | Găng tay | Đôi | 0,100 |
| 32 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 33 | Quần áo bảo hộ | Bộ | 0,005 |
| 34 | Dung dịch nước rửa tay | ml | 8,000 |
| 35 | Cồn sát trùng tay nhanh | ml | 1,000 |
| 36 | Dung dịch khử trùng | ml | 10,000 |
| 37 | Khăn lau tay | Cái | 0,010 |
* Ghi chú: Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/50 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 3 lần/1 năm).
3. Bệnh phẩm
Huyết thanh hoặc huyết tương.
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
- Theo đúng quy định của chuyên ngành Vi sinh: xem chi tiết phụ lục 2.
- Từ chối những bệnh phẩm không đạt yêu cầu: xem chi tiết phụ lục 6.
2. Tiến hành kỹ thuật: Bộ sinh phẩm Toxo IgG Elecsys Roche (VD)
| Các bước | Xét nghiệm định lượng Toxo IgG |
| 1 | Vào Reagent để kiểm tra số lượng tests. |
| 2 | Vào Calibration → Status để kiểm tra hiệu chuẩn |
| 3 | Chạy chứng |
| Chạy mẫu không dùng barcode | |
| 1 | Đánh số sample cup theo mã số bệnh phẩm. Hút huyết thanh/huyết tương vào sample cup tương ứng. |
| 2 | Vào màn hình Workplace → Test Selection |
| 3 | Nhập mã bệnh phẩm |
| 4 | Chọn tên test là Toxo IgG |
| 5 | Vào Barcode Read Error |
| 6 | Nhập số rack và vị trí mẫu → Add → OK → Save |
| 7 | Đặt mẫu đã được hút vào Sample Cup lên Rack màu xám đúng vị trí đã order rồi đưa vào khu nạp giá mẫu. |
| 8 | Chọn Start → Chọn START ở màn hình Start Conditions |
| Chạy mẫu có barcode | |
| 1 | Nhập chỉ định xét nghiệm trên máy tính bằng phần mềm LIS |
| 2 | Đặt ống máu đã được dán barcode vào rack màu xám, quay mặt barcode ra phía ngoài rồi đưa vào khu nạp giá mẫu |
| 3 | Chọn Start → Chọn START ở màn hình Start Conditions |
IV. NHẬN ĐỊNH KẾT QUẢ
1. Đánh giá theo tiêu chuẩn nhà sản xuất
- Chạy kiểm tra chứng 1 và chứng 2 trên tất cả các điện cực dùng để chạy xét nghiệm.
- Giá trị chứng đạt được phải nằm trong khoảng giới hạn xác định.
2. Đánh giá theo tiêu chuẩn phòng xét nghiệm:
Chứng nội kiểm, ngoại kiểm: Đánh giá kết quả dựa trên biểu đồ Levey-Jenning (nếu có)
3. Kết quả và báo cáo
- Âm tính: Nếu COI < 1 IU/ml
- Không xác định: Nếu 1 ≤ COI < 30 IU/ml
- Dương tính: Nếu COI ≥ 30 IU/ml
Những mẫu không xác định cần kiểm tra lại lần 2. Nếu vẫn lặp lại kết quả lần đầu thì nên xét nghiệm lại với mẫu bệnh phẩm thứ hai sau 2 - 3 tuần.
* Ngưỡng phát hiện và dải định lượng:
- Ngưỡng phát hiện: 0,13 IU/ml
- Dải định lượng: 0,13 - 650 IU/ml
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
- Máy báo sample short (do bệnh phẩm bị đông hoặc không đủ) → Chú ý ly tâm mẫu thật kỹ ngay từ đầu hoặc hút mẫu ra cup.
- Không sử dụng thuốc thử đã quá hạn sử dụng.
- Tránh tạo bọt ở lọ thuốc thử và các loại mẫu (bệnh phẩm, calibration và chứng).
199. Toxoplasma Avidity miễn dịch tự động
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
Xác định ái tính của các kháng thể IgG kháng T. gondii trong huyết thanh và huyết tương người dựa trên nguyên lý của kỹ thuật ECLIA (miễn dịch điện hóa phát quang (VD).
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện: Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh - Ký sinh trùng.
- Người nhận định và phê duyệt kết quả: cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2. Phương tiện, hóa chất
2.1. Trang thiết bị
- Hệ thống máy miễn dịch tự động.
- Tủ an toàn sinh học cấp 2
- Máy ly tâm thường.
- Tủ âm 200C (nếu có).
- Tủ lạnh 40C -80C
- Pipet vi lượng thể tích 50 µl - 200 µl
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
| STT | Chi phí hóa chất, vật tư tiêu hao | ĐƠN VỊ | SỐ LƯỢNG |
| 1 | Bông | Kg | 0,001 |
| 2 | Dây garô | Cái | 0,001 |
| 3 | Cồn | ml | 1,000 |
| 4 | Bơm kim tiêm | Cái | 1,000 |
| 5 | Panh | Cái | 0,0001 |
| 6 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 7 | Hộp vận chuyển bệnh phẩm | Cái | 0,001 |
| 8 | Tube đựng bệnh phẩm | Cái | 1,000 |
| 9 | Sinh phẩm chẩn đoán | Test | 1,000 |
| 10 | Khấu hao sinh phẩm cho chạy chuẩn | Test | 0,100 |
| 11 | Khấu hao sinh phẩm cho chạy chứng, kiểm tra lại | Test | 0,150 |
| 12 | Chứng ngoại kiểm âm (nếu có) | ml | 0,010 |
| 13 | Chứng ngoại kiểm dương (nếu có) | ml | 0,010 |
| 14 | Chứng nội kiểm | Test | 0,100 |
| 15 | Ngoại kiểm (nếu có)* |
| 0,020 |
| 16 | Cleancell M | ml | 3,000 |
| 17 | Procell M | ml | 3,000 |
| 18 | Probe Wash M | ml | 2,000 |
| 19 | Preclean M | ml | 2.000 |
| 20 | Assay Tip/Cup E170 | Chiếc | 3.000 |
| 21 | ISE Cleaning Solution F. HIT | ml | 0.500 |
| 22 | Nước cất | ml | 5.000 |
| 23 | Sample cup | Cái | 1.000 |
| 24 | Giấy thấm | Cuộn | 0.100 |
| 25 | Giấy xét nghiệm | Tờ | 2.000 |
| 26 | Sổ lưu kết quả xét nghiệm | Tờ | 0.001 |
| 27 | Bút viết kính | Cái | 0.020 |
| 28 | Bút bi | Cái | 0.010 |
| 29 | Mũ | Cái | 0.020 |
| 30 | Khẩu trang | Cái | 0.020 |
| 31 | Găng tay | Đôi | 0.100 |
| 32 | Găng tay xử lý dụng cụ | Đôi | 0.020 |
* Ghi chú: Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/50 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 3 lần/1 năm).
3. Bệnh phẩm
Huyết thanh hoặc huyết tương của người bệnh
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu phiếu yêu cầu
III. CÁC BƯỚC THỰC HIỆN
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
- Theo đúng quy định của chuyên ngành Vi sinh: xem chi tiết phụ lục 2.
- Từ chối những bệnh phẩm không đạt yêu cầu: xem chi tiết phụ lục 4.
2. Tiến hành kỹ thuật
Bộ sinh phẩm Elecsys Toxo IgG Avidity (Roche) (VD)
| Các bước | Xét nghiệm xác định Toxo IgG Avidity |
| 1 | Để số lượng sinh phẩm cần dùng ở nhiệt độ phòng 30 phút trước khi làm xét nghiệm. |
| 2 | Để tối ưu hiệu năng XN nên tuân theo tờ hướng dẫn kèm theo bộ thuốc thử. |
| 3 | Tham khảo hướng dẫn vận hành cho từng XN đặc hiệu tương ứng. |
| 4 | Thiết bị tự động trộn các vi hạt trước khi sử dụng. |
| 5 | Máy đọc thông số đặc hiệu của XN trên mã vạch của thuốc thử, trong trường hợp ngoại lệ nếu máy không đọc được mã vạch hãy nhập chuỗi 15 con số vào. |
| 6 | Thuốc thử dạng pha sẵng để sử dụng và được đựng trong lọ tương thích với hệ thống |
| 7 | Đưa thuốc thử đang lạnh về nhiệt độ 200C và đặt vào khay thuốc thử trên máy phân tích, tránh tạo bọt, hệ thống sẽ tự động điều hòa nhiệt độ của thuốc thử và tự động đóng/mở nắp chai. |
| 8 | Đặt mẫu chuẩn hoàn nguyên lên vùng đặt mẫu, máy phân tích tự động ghi nhận tất cả thông tin cần thiết cho việc chuẩn XN, sau khi hoàn thành chuẩn, lưu trữ cal1 và cal2 ở 20C -80C hoặc loại bỏ chúng. |
| 9 | Chạy các mẫu chứng với nồng độ khác nhau tối thiểu 1 lần cho mỗi 24 giờ khi XN vẫn đang sử dụng, một lần với mỗi hộp thuốc thử và sau mỗi lần chuẩn, kết quả mẫu chứng phải nằm trong thang. |
| 10 | Trước khi đo ái tính, nồng độ mẫu phải được xác định bằng XN Toxo IgG (REF 04618815190) |
| 11 | Các mẫu phản ứng khi sử dụng XN Elecsys Toxo IgG có nồng độ 6-500 IU/mL được tách vào 2 aliquot |
| 12 | Nếu mẫu phản ứng khi sử dụng XN Elecsys Toxo IgG có nồng độ > 500 IU/mL thì mẫu phải được pha loãng thủ công bằng Diluent Universal trước khi tách vào 2 aliquot. |
| 13 | Kiểm tra chất lượng: sử dụng Elecsys Precicontrol Toxo IgG Avidity, chạy các mẫu chứng với nồng độ khác nhau ít nhất 1 lần cho mỗi 24 giờ khi XN vẫn đang sử dụng và sau mỗi lần chuẩn định. |
IV. NHẬN ĐỊNH KẾT QUẢ
1. Tính toán
- Máy phân tích tự động tính toán nồng độ chất phân tích trong mỗi mẫu đo dưới dạng U/ml
- Ái tính (Avi%) được tính toán theo công thức:
Avi% = 100 - [(IU/ml của aliquot xử lý với DilToxoAv /IU/ml của aliquot xử lý với DilUni x 100%]
Chú ý:
+ Nếu mẫu pha loãng bằng DilUni có nồng độ < 3 IU/mL (kết quả không xác định) thì không thể tính toán ái tính.
+ Nếu mẫu pha loãng bằng DilToxoAv có nồng độ < 0.130 IU/mL (< giới hạn phát hiện thấp hơn) thì không thể tính toán ái tính.
2. Diễn giải kết quả
Kết quả thu được với XN Elecsys Toxo IgG Avidity được diễn giải như sau:
| Ái tính | Diễn giải kết quả |
| < 70 | Ái tính thấp |
| 70 - 79 | Vùng xám |
| ≥ 80 | Ái tính cao |
- Nếu kết quả vùng xám, khuyến cáo lấy lại mẫu trong khoảng thời gian thích hợp (khoảng 2-4 tuần sau) → làm lại xét nghiệm.
Các kết quả Elecsys Toxo IgG Avidity nên được sử dụng kết hợp với bệnh sử, thăm khám lâm sàng và các kết quả XN khác như Toxo IgG, Toxo IgM đặc hiệu.
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
- Máy sẽ báo sample short (bệnh phẩm đông hoặc không đủ) →. Chú ý ly tâm mẫu thật kỹ ngay từ đầu hoặc hút mẫu ra cup (thực hiện theo đúng yêu cầu của lấy mẫu xét nghiệm Vi sinh)
- Không sử dụng thuốc thử đã quá hạn sử dụng.
- Tránh tạo bọt ở lọ thuốc thử và các loại mẫu (bệnh phẩm, calibration và chứng).
- Các kết quả trên người bệnh HIV, người bệnh đang tham gia liệu pháp ức chế miễn dịch hay trên những người bệnh có các rối loạn khác dẫn đến ức chế miễn dịch thì nên thận trọng khi diễn giải kết quả
- Tham khảo thêm hướng dẫn của nhà sản xuất.
200. Demodex soi tươi
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Phát hiện hình thái các loài Demodex gây bệnh ngoài da.
2. Nguyên lý
Dưới tác dụng của KOH 10% biểu mô sừng mềm và mỏng do đó bộc lộ hình thái Demodex.
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện: Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh - Ký sinh trùng.
- Người nhận định và phê duyệt kết quả: Cán bộ có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh - Ký sinh trùng
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Kính hiển vi quang học
- Tủ an toàn sinh học cấp 2
- Dụng cụ sấy lam (nếu có)
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Lá kính | Cái | 1,000 |
| 2 | Lam kính | Cái | 2,000 |
| 3 | Lam kính (QC) | Cái | 0,200 |
| 4 | Dầu thực vật | Ml | 1,000 |
| 5 | Mỏ vịt | Cái | 2,000 |
| 6 | Bông | Kg | 0,001 |
| 7 | Cồn 90 độ (vệ sinh dụng cụ) | Ml | 10,000 |
| 8 | KOH 10% | Cái | 1,000 |
| 9 | Đèn cồn | Cái | 0,0001 |
| 10 | Panh | Cái | 0,0001 |
| 11 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 12 | Hộp vận chuyển bệnh phẩm | Cái | 0,0001 |
| 13 | Mũ | Cái | 0,020 |
| 14 | Khẩu trang | Cái | 0,020 |
| 15 | Găng tay | Đôi | 3,000 |
| 16 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 17 | Quần áo bảo hộ | Bộ | 0,001 |
| 18 | Ống nghiệm thủy tinh | Ống | 1,000 |
| 19 | Bút viết kính | Cái | 0,020 |
| 20 | Bút bi | Cái | 0,010 |
| 21 | Bật lửa | Cái | 0,010 |
| 22 | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 23 | Cồn sát trùng tay nhanh | ml | 2,000 |
| 24 | Dung dịch nước rửa tay | ml | 8,000 |
| 25 | Khăn lau tay | Cái | 0,030 |
| 26 | Giấy trả kết quả xét nghiệm | Tờ | 2,000 |
QC ký sinh trùng Demodex: Có bộ tiêu bản mẫu
3. Bệnh phẩm
Bệnh phẩm vẩy da, chất bã nhờn
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu yêu cầu
III. Các bước tiến hành
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
- Dùng dao cùn đặt vuông góc với bề mặt da và song song với lam kính, sau đó cạo vẩy da ở vị trí được chỉ định
- Cạo sâu hơn cạo nấm da
- Vị trí thường lấy: Mặt, đầu, lưng, ngực
2. Tiến hành kỹ thuật
Tập trung bệnh phẩm lên lam kính
- Nhỏ KOH 10%, đậy lamen, ấn nhẹ để bệnh phẩm ngấm hoá chất và dàn đều.
- Nếu bệnh phẩm là chất bã hòa tan vào 1-2 giọt dầu thực vật. Đọc sau vài phút.
- Thời gian thực hiên: 5- 7 phút và đọc kết quả sau 1-2giờ.
IV. Nhận định kết quả
- Quan sát đặc điểm hình thể của Demodex
- Đối với Demodex trưởng thành, cơ thể chia làm 3 phần rõ: Đầu, ngực, đuôi. Chúng chỉ khác nhau ở phần đuôi (D. folliculorum đuôi dài, D. brevis đuôi ngắn). Còn phần đầu và ngực tương tự nhau
- Đánh giá độ tập trung của Demodex:
+ Nếu độ tập trung của Demodex > hoặc = 5 con/ vi trường ở độ phóng đại thấp (100): Demodex là tác nhân gây bệnh.
+ Nếu độ tập trung của Demodex < 5/ vi trường ở độ phóng đại thấp (100) thì Demodex chưa hẳn là tác nhân gây bệnh.
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
1. Sai sót
- Lấy bệnh phẩm tại thương tổn không điển hình
- Bệnh phẩm lẫn nhiều chất bã và vẩy da
- Bệnh phẩm quá dầy hoặc quá mỏng
- Không lấy được bệnh phẩm ở sâu
- Người bệnh bôi thuốc diệt ký sinh trùng
2. Xử trí
- Chọn thương tổn điển hình (như mô tả)
- Dùng ngón trỏ dàn mỏng bệnh phẩm
- Cạo sâu hơn cạo nấm một chút
- Người bệnh không bôi thuốc diệt ký sinh trùng trước đó 3-5 ngày.
201. Demodex nhuộm soi
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Phát hiện hình thái các loài Demodex gây bệnh ngoài da
2. Nguyên lý
Hình thái Demodex được quan sát rõ khi bệnh phẩm được hòa tan trong dầu thực vật.
II. CHUẨN BỊ
1.Người thực hiện
- Người thực hiện: Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh - Ký sinh trùng.
- Người nhận định và phê duyệt kết quả: Cán bộ có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh - Ký sinh trùng
2.Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Kính hiển vi quang học
- Tủ an toàn sinh học cấp 2
- Bàn lấy bệnh phẩm
- Hộp đựng dao cùn đã tiệt trùng
- Giá đựng lam
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Dao cùn đã tiệt trùng | Cái | 1,000 |
| 2 | Dầu thực vật (Oliu, đậu nành) | ml | 2,000 |
| 3 | Lam kính, lá kính | Cái | 1,000 |
| 4 | Găng tay | Đôi | 1,000 |
| 5 | Bút viết kính | Cái | 1,000 |
QC ký sinh trùng Demodex: Có bộ tiêu bản mẫu.
3. Bệnh phẩm: Chất bã
4. Phiếu xét nghiệm: Điền đầy đủ thông tin theo mẫu phiếu yêu cầu.
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
- Vị trí vùng mặt: Mũi, rãnh mũi má, giữa hai cung mày, cằm
- Ngoài ra, còn lấy ở vị trí khác:
+ Lưng
+ Ngực…
2. Các bước thực hiện
2.1. Dùng hai ngón trỏ và ngón cái nặn chất bã.
2.2. Dùng dao cùn gạt lượng chất bã vừa nặn trên bề mặt da
2.3. Tập trung bệnh phẩm lên lam kính
2.4. Nhỏ dầu thực vật 10%,
2.5. Hòa chất bã vào giọt dầu thực vật đến khi tan hoàn toàn
2.6. Đậy lamen, ấn nhẹ để bệnh phẩm ngấm hoá chất và dàn đều.
VI. NHẬN ĐỊNH KẾT QUẢ
Dùng vật kính 10X quan sát sơ bộ hình thể, đếm số lượng và độ tập trung của Demodex. Còn vật kính 20X, 40X nhận định rõ hình thể, cấu tạo của từng loại và từng giai đoạn Demodex.
- Quan sát kỹ đặc điểm hình thể của Demodex trưởng thành
Đối với Demodex trưởng thành, cơ thể chia làm 3 phần rõ rệt:
+ Đầu: Có 1 đôi râu, ở giữa là cái mỏ nhọn, có thể chuyển động được.
+ Ngực: Bốn đôi chân ngắn đối xứng nhau, chuyển động nhiều.
+ Đuôi: Dạng hình ống giống như giun, bên trong chứa đầy hạt và không bào. Có thể chuyển động nhưng ít hơn so với chân.
- Có hai loài Demodex nhưng về hình thái chúng chỉ khác nhau ở phần đuôi (D. folliculorum đuôi dài, D. brevis đuôi ngắn). Còn phần đầu và ngực tương tự nhau
- Chiều dài của Demodex
+ D.folliculorum: Con đực 0,219mm, con cái 0,294mm.
+ D.brevis: Con đực 0,165mm, con cái 0,208mm.
- Đánh giá độ tập trung của Demodex
+ Nếu độ tập trung của Demodex > hoặc = 5 con/ vi trường ở độ phóng đại thấp (100): Demodex là tác nhân gây bệnh.
+ Nếu độ tập trung của Demodex < 5/ vi trường ở độ phóng đại thấp (100) thì Demodex chưa hẳn là tác nhân gây bệnh.
- Bên cạnh đó, trên tiêu bản dầu thực vật có thể quan sát được sự chuyển động của Demodex rất sinh động
V. NHỮNG SAI XÓT VÀ XỬ TRÍ
1. Sai sót
- Nặn quá nhiều chất bã và nhỏ ít dầu thực vật
- Hòa bệnh phẩm chưa tan hoàn toàn
2. Xử trí
- Nặn chất bã vừa phải tương ứng với lượng dầu thực vật để chất bã tan hoàn toàn trong dầu thực vật.
- Dùng ngón tay dàn mỏng bệnh phẩm.
202. Phthirus pubis (Rận mu) soi tươi
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Phát hiện hình thái Phthirus pubis gây bệnh ngoài da
2. Nguyên lý
Dưới tác dụng của KOH 10% biểu mô sừng mềm và mỏng do đó bộc lộ hình thái Phthirus pubis.
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện: Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh - Ký sinh trùng.
- Người nhận định và phê duyệt kết quả: Cán bộ có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh - Ký sinh trùng
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1 Trang thiết bị
Bàn lấy bệnh phẩm
2.2 Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Lược mau | Cái | 1,000 |
| 2 | Giấy trắng | Tờ | 1,000 |
| 3 | Găng tay | Đôi | 1,000 |
| 4 | Kính núp | Cái | 1,000 |
3. Bệnh phẩm
Vẩy da, sợi lông mu
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu phiếu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
1. Lấy bệnh phẩm
- Dùng kính lúp soi vùng lông và da mu
- Chú ý vùng chân lông tìm rận mu
- Ở thân lông có thể tìm thấy trứng rận
2. Các bước tiến hành
2.1. Dùng lược mau chải từ chân lông ra ngọn một cách nhẹ nhàng .
2.2. Đặt tờ giấy trắng vuông góc vùng da mu và song song với lược mau.
2.3. Dùng kính lúp soi vào tờ giấy trắng tìm rận hoặc có thể soi vào vùng da mu và thân lông tìm ấu trùng, trứng rận.
VI. NHẬN ĐỊNH KẾT QUẢ
- Rận mu:
+ Cơ thể chia làm 3 phần rõ rệt: Đầu có vòi, ăng ten, mắt đơn, ngực có 3 đốt, bụng có 9 đốt.
+ Rận trưởng thành có 3 cặp chân, ấu trùng có 4 cặp chân đối xứng nhau.
- Ngoài ra, có thể thấy trứng của rận bám trên thân lông.
V. NHỮNG SAI XÓT VÀ XỬ TRÍ
1. Sai sót
- Cần phân biệt rận mu với: Chấy, Ghẻ và các loại Rận trên súc vật.
- Người bệnh dùng thuốc diệt ký sinh trùng
2. Xử trí
- Khi tìm thấy rận mu theo đúng mô tả như trên là tiêu chuẩn chẩn đoán xác định.
- Người bệnh bôi thuốc diệt ký sinh trùng phải ngừng từ 3-5 ngày.
203. Phthirus pubis (Rận mu) nhuộm soi
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Phát hiện hình thái ký sinh trùng Rận gây bệnh ngoài da
2. Nguyên lý
Dưới tác dụng của glycerin hoặc dầu thực vật bộc lộ hình thái Rận
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện: Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh - Ký sinh trùng.
- Người nhận định và phê duyệt kết quả: Cán bộ có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh - Ký sinh trùng
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1.Trang thiết bị
- Kính hiển vi quang học
- Dụng cụ sấy lam (nếu có)
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Lá kính | Cái | 1,000 |
| 2 | Lam kính | Cái | 2,000 |
| 3 | Lam kính (kiểm chuẩn) | Cái | 0,200 |
| 4 | Dung dịch KOH 10% | Ml | 1,000 |
| 5 | Dao cùn | Cái | 2,000 |
| 6 | Bông | Kg | 0,001 |
| 7 | Cồn 90 độ (vệ sinh dụng cụ) | Ml | 10,000 |
| 8 | Kính lúp | Ml | 10,000 |
| 10 | Đèn cồn | Cái | 0,0001 |
| 11 | Panh | Cái | 0,0001 |
| 12 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 13 | Hộp vận chuyển bệnh phẩm | Cái | 0,0001 |
| 14 | Mũ | Cái | 0,020 |
| 15 | Khẩu trang | Cái | 0,020 |
| 16 | Găng tay | Đôi | 3,000 |
| 17 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 18 | Quần áo bảo hộ | Bộ | 0,001 |
| 19 | Ống nghiệm thủy tinh | Ống | 1,000 |
| 20 | Bút viết kính | Cái | 0,020 |
| 21 | Bút bi | Cái | 0,010 |
| 22 | Bật lửa | Cái | 0,010 |
| 23 | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 24 | Cồn sát trùng tay nhanh | ml | 2,000 |
| 25 | Dung dịch nước rửa tay | ml | 8,000 |
| 26 | Khăn lau tay | Cái | 0,030 |
| 27 | Giấy trả kết quả xét nghiệm | Tờ | 2,000 |
5. Bệnh phẩm
Vẩy da.
6. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
- Dùng kính lúp soi vùng lông và da mu, chú ý vùng chân lông tìm rận mu, thân lông để tìm ấu trùng hoặc trứng. Sau đó, dùng lược mau chải từ chân lông ra ngọn một cách nhẹ nhàng và hứng vào 1 tờ giấy trắng.
- Có thể dùng dao cùn cạo vùng lông và da mu, hứng vào lam kính
- Nhỏ 1 giọt KOH 20%, hoặc dầu Parafin, đậy lamen, soi ngay dưới kính hiển vi quang học.
Thực hiên xét nghiêm trong 5 phút và đọc kết quả sau 10 phút
IV. NHẬN ĐỊNH KẾT QUẢ
Dùng vật kính 10X để quan sát
- Rận mu:
+ Cơ thể chia làm 3 phần rõ rệt: Đầu có vòi, ăng ten, mắt đơn, ngực có 3 đốt, bụng có 9 đốt.
+ Rận trưởng thành có 3 cặp chân, ấu trùng có 4 cặp chân đối xứng nhau.
- Ngoài ra, trên tiêu bản có thể thấy trứng rận bám trên thân lông.
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
1. Sai sót
- Lấy bệnh phẩm tại thương tổn không điển hình
- Bệnh phẩm quá dầy hoặc quá mỏng
- Phân biệt với Rận gây bệnh ở súc vật: Rận, Ghẻ chó, mèo…
- Người bệnh bôi thuốc diệt ký sinh trùng
2. Xử trí
- Chọn thương tổn điển hình (như mô tả)
- Dùng ngón trỏ dàn mỏng bệnh phẩm
- Nhận định hình thái điển hình ký sinh trùng rận (như mô tả trên)
- Người bệnh không bôi thuốc diệt ký sinh trùng trước đó 3-5 ngày.
204. Sarcoptes scabies hominis (Ghẻ) soi tươi
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Phát hiện hình thái ký sinh trùng ghẻ gây bệnh ngoài da
2. Nguyên lý
Dưới tác dụng của KOH 10% biểu mô sừng mềm và mỏng do đó bộc lộ hình thái ghẻ.
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện: Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh - Ký sinh trùng.
- Người nhận định và phê duyệt kết quả: Cán bộ có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh - Ký sinh trùng.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Kính hiển vi quang học
- Dụng cụ sấy lam (nếu có)
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Lá kính | Cái | 1,000 |
| 2 | Lam kính | Cái | 2,000 |
| 3 | Lam kính (kiểm chuẩn) | Cái | 0,200 |
| 4 | Dung dịch KOH 10% | Ml | 1,000 |
| 5 | Dao cùn | Cái | 2,000 |
| 6 | Bông | Kg | 0,001 |
| 7 | Cồn 90 độ (vệ sinh dụng cụ) | Ml | 10,000 |
| 8 | Đèn cồn | Cái | 0,0001 |
| 9 | Panh | Cái | 0,0001 |
| 10 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 11 | Hộp vận chuyển bệnh phẩm | Cái | 0,0001 |
| 12 | Mũ | Cái | 0,020 |
| 13 | Khẩu trang | Cái | 0,020 |
| 14 | Găng tay | Đôi | 3,000 |
| 15 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 15 | Quần áo bảo hộ | Bộ | 0,001 |
| 16 | Ống nghiệm thủy tinh | Ống | 1,000 |
| 17 | Bút viết kính | Cái | 0,020 |
| 18 | Bút bi | Cái | 0,010 |
| 19 | Bật lửa | Cái | 0,010 |
| 20 | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 21 | Cồn sát trùng tay nhanh | ml | 2,000 |
| 22 | Dung dịch nước rửa tay | ml | 8,000 |
| 23 | Khăn lau tay | Cái | 0,030 |
| 24 | Giấy trả kết quả xét nghiệm | Tờ | 2,000 |
QC ký sinh trùng Demodex: Có bộ tiêu bản mẫu
3. Bệnh phẩm
Vẩy da.
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
1. Lấy bệnh phẩm
Theo đúng quy định của chuyên ngành Vi sinh.
2. Tiến hành kỹ thuật
- Xác định luống ghẻ
- Làm test BI
- Nhỏ dung dịch KOH 10%, đậy lamen xem dưới kính hiển vi. Thực hiên kỹ thuật trong 5 phút và nhận định kết quả trong 10 phút.
IV. NHẬN ĐỊNH KẾT QUẢ
Cái ghẻ:
+ Hình thái: Cơ thể chia làm 3 phần rõ rệt. Hình dạng bầu dục, màu trắng xám, miệng ngắn lưng gồ.
+ Con trưởng thành có 4 cặp chân, ấu trùng có 3 cặp chân đối xứng nhau
+ Ngoài ra, thấy các thành phần khác như: Trứng, ấu trùng hoặc chất thải của Ghẻ.
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
1. Sai sót
- Lấy bệnh phẩm tại thương tổn không điển hình
- Bệnh phẩm nhiều vẩy da
- Bệnh phẩm quá dầy hoặc quá mỏng
- Phân biệt với ghẻ gây bệnh ở súc vật: ghẻ chó, mèo…
- Người bệnh bôi thuốc diệt ký sinh trùng
2. Xử trí
- Chọn thương tổn điển hình (như mô tả)
- Dùng ngón trỏ dàn mỏng bệnh phẩm
- Nhận định hình thái điển hình ký sinh trùng ghẻ (như mô tả trên)
- Người bệnh không bôi thuốc diệt ký sinh trùng trước đó 3-5 ngày.
205. Sarcoptes scabies hominis (Ghẻ) nhuộm soi
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Phát hiện hình thái ghẻ gây bệnh ngoài da
2. Nguyên lý
Dưới tác dụng của glycerin hoăc dầu thực vật bộc lộ hình thái ghẻ
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện: Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh - Ký sinh trùng.
- Người nhận định và phê duyệt kết quả: Cán bộ có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh - Ký sinh trùng.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Kính hiển vi quang học
- Bàn lấy bệnh phẩm
- Hộp đựng dao cùn đã tiệt trùng
- Giá đựng lam
- Kính núp
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Dao cùn đã tiệt trùng | Cái | 1,000 |
| 2 | Dầu thực vật | Ml | 2,000 |
| 3 | Lam kính, lá kính | Cái | 1,000 |
| 4 | Găng tay | Đôi | 1,000 |
| 5 | Bút viết kính | Cái | 1,000 |
| 6. | Dung dịch Xanhmetylen | Ml | 2,000 |
3. Bệnh phẩm
Vẩy da
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu phiếu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
1. Lấy bệnh phẩm
- Cạo vẩy da bằng dao cùn
- Xác định luống ghẻ:
+ Là đường chỉ nhỏ ngoằn nghoèo dài từ 3 đến 10 mm
+ Có màu xám hoặc đen
+ Cuối luống ghẻ là điểm phình to
+ Lấy dao cùn cạo sâu vào da có thể bắt được cái ghẻ
- Ngoài ra nên lấy nhiều vị trí khác:
+ Kẽ tay
+ Nếp lằn vú
+ Vùng bẹn
+ Mông
+ Quy đầu
2. Tiến hành kỹ thuật
2.2. Làm test Burown ink
- Nhỏ 2-3 giọt Xanhmetylen vào điểm đầu đường hầm (rãnh ghẻ)
- Giữ yên trong thời gian 10 - 15 phút
- Sau đó đem soi ngay dưới ánh đèn
2.3. Dùng dao cùn cạo vào điểm phình to cuối luống ghẻ
2.4. Phết lên lam đã nhỏ sẵn 1 giọt dầu thực vật
2.5. Đậy lamen, soi dưới kính hiển vi quang học.
Thực hiện kỹ thuật trong 10 phút và đọc kết quả sau 5 - 10 phút
IV. NHẬN ĐỊNH KẾT QUẢ
Dùng vật kính 10X để xác định:
- Cái ghẻ
+ Hình thể: Cơ thể không chia làm 3 phần rõ rệt. Hình dạng bầu dục, màu trắng xám, miệng ngắn, lưng gồ và không có mắt, đầu có vòi hút thức ăn, đồng thời đào hầm vào thượng bì.
+ Con trưởng thành có 4 cặp chân, ấu trùng có 3 cặp chân, đối xứng nhau.
+ Kích thước: Cái ghẻ: 330 - 250 mm. Ghẻ đực: 220 - 150 mm
- Trong dầu thực vật cái ghẻ di động được dễ dàng
- Ngoài ra, ta còn thấy các thành phần khác của ghẻ như: Trứng, ấu trùng hoặc chất thải của ghẻ.
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
1. Sai sót
- Bệnh phẩm nhiều vẩy da nên khó nhận định khi soi trong dầu hay glycerin.
- Lấy thương tổn không điển hình và ít vị trí
- Phân biệt với các loại Ghẻ khác gây bệnh cho súc vật như: Ghẻ chó, mèo
- Người bệnh bôi thuốc diệt ký sinh trùng.
2. Xử trí
- Đối với Ghẻ tăng sừng (Ghẻ Na-uy) có thể cạo bỏ lớp vẩy da, sau đó dùng kính lúp soi vào vùng thương tổn để cạo vẩy và đôi khi có thể thấy rất nhiều cái ghẻ.
- Chọn thương tổn điển hình và lấy nhiều vị trí. Mỗi vị trí một lam
- Khi tìm thấy được cái ghẻ với đặc điểm mô tả như trên là tiêu chuẩn vàng để chẩn đoán xác định. Ngoài ra, trên tiêu bản có thể thấy ấu trùng, trứng, phân hoặc một trong các loại trên.
- Người bệnh bôi thuốc diệt ký sinh trùng phải ngừng từ 3-5 ngày.
206. Cysticercus cellulosae (Sán lợn) ấu trùng soi mảnh sinh thiết
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
Phát hiện các ấu trùng Cysticercus cellulosae (sán lợn) trong mảnh sinh thiết.
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện: Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh - Ký sinh trùng.
- Người nhận định và phê duyệt kết quả: Cán bộ có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh - Ký sinh trùng
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Kính hiển vi quang học
- Tủ an toàn sinh học cấp 2
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Lọ lấy bệnh phẩm | Lọ | 1,000 |
| 2 | Lam kính | Cái | 2,000 |
| 3 | Lam kính (QC) | Cái | 0,200 |
| 4 | Băng dính trắng | Cuộn | 0,010 |
| 5 | Xylen lau kính | ml | 1,000 |
| 6 | Dung dịch NaCl 0,9% | ml | 1,000 |
| 7 | Dung dịch NaCl 0,9% (kiểm chuẩn) | ml | 0,200 |
| 8 | Bông | Kg | 0,001 |
| 9 | Cồn 90 độ (vệ sinh dụng cụ) | ml | 10,000 |
| 10 | Cồn 70 độ (sát trùng) | ml | 5,000 |
| 11 | Đèn cồn | Cái | 0,0001 |
| 12 | Panh | Cái | 0,0001 |
| 13 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 14 | Hộp vận chuyển bệnh phẩm | Cái | 0,0001 |
| 15 | Mũ | Cái | 0,020 |
| 16 | Khẩu trang | Cái | 0,020 |
| 17 | Găng tay | Đôi | 3,000 |
| 18 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 19 | Quần áo bảo hộ | Bộ | 0,001 |
| 20 | Axít ngâm lam | ml | 10,000 |
| 21 | Bút viết kính | Cái | 0,020 |
| 22 | Bút bi | Cái | 0,010 |
| 23 | Bật lửa | Cái | 0,010 |
| 24 | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 25 | Cồn sát trùng tay nhanh | ml | 2,000 |
| 26 | Dung dịch nước rửa tay | ml | 8,000 |
| 27 | Khăn lau tay | Cái | 0,030 |
| 28 | Giấy trả kết quả xét nghiệm | Tờ | 2,000 |
3. Bệnh phẩm
Tổn thương da hoặc các tổ chức, cơ quan, bộ phận trong cơ thể,...nghi ngờ có ấu trùng Cysticercus cellulosae (sán lợn)
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
Mảnh sinh thiết nguyên tổ chức khối u, nghi ngờ có ấu trùng Cysticercus cellulosae, tổ chức không bị vỡ.
2. Tiến hành kỹ thuật
2.1. Chuẩn bị tiêu bản
- Dùng dao tách nhẹ nhàng khối u, bộc lộ từ ngoài vào trong, đến khi gặp tổ chức khác thường so với xung quanh (cục trắng giống hạt đu đủ non), thì nhẹ nhàng tách bỏ tổ chức đó ra khỏi khối u và đặt lên lam kính.
- Dùng một lam kính khác, đặt lên lam kính có tổ chức rồi ép nhẹ 2 lam kính
- Dùng băng dính trắng, quấn 2 đầu của 2 lam ép, kết thúc quá trình làm lam.
2.2. Soi tìm ấu trùng dưới kính hiển vi quang học.
Soi kính hiển vi vật kính 10X
IV. NHẬN ĐỊNH KẾT QUẢ
Ấu trùng cư trú ở cơ vân: xuất hiện các nang dưới da với kích thước 17-20 x 7-10 mm, mầu trắng đục nang chứa nước và có một đầu sán cùng với đốt cổ lộn vào bên trong, đầu có 4 giác và 2 vòng móc.
| Nang ấu trùng Cysticercus cellulosae | Đầu ấu trùng |
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
1. Tách bệnh phẩm không đúng vị trí có ấu trùng, hoặc đúng nhưng không còn nguyên vẹn ấu trùng. Khắc phục bằng cách làm cẩn thận và chính xác.
207. Gnathostoma ấu trùng soi mảnh sinh thiết
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
Phát hiện ấu trùng Gnathostoma bằng phương pháp soi mảnh sinh thiết.
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh - Ký sinh trùng.
- Người nhận định và phê duyệt kết quả: Cán bộ có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh - Ký sinh trùng
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Kính hiển vi quang học
- Tủ an toàn sinh học cấp 2
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Lọ lấy bệnh phẩm | Lọ | 1,000 |
| 2 | Lam kính | Cái | 2.000 |
| 3 | Lam kính (QC) | Cái | 0,200 |
| 4 | Băng dính trắng | Cuộn | 0,010 |
| 5 | Xylen lau kính | ml | 1,000 |
| 6 | Dung dịch NaCl 0,9% | ml | 1,000 |
| 7 | Dung dịch NaCl 0,9% (QC) | ml | 0,200 |
| 8 | Bông | Kg | 0,001 |
| 9 | Cồn 90 độ (vệ sinh dụng cụ) | ml | 10,000 |
| 10 | Cồn 70 độ (sát trùng) | ml | 5,000 |
| 11 | Đèn cồn | Cái | 0,0001 |
| 12 | Panh | Cái | 0,0001 |
| 13 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 14 | Hộp vận chuyển bệnh phẩm | Cái | 0,0001 |
| 15 | Mũ | Cái | 0,020 |
| 16 | Khẩu trang | Cái | 0,020 |
| 17 | Găng tay | Đôi | 3,000 |
| 18 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 19 | Quần áo bảo hộ | Bộ | 0,001 |
| 20 | Axít ngâm lam | ml | 10,000 |
| 21 | Bút viết kính | Cái | 0,020 |
| 22 | Bút bi | Cái | 0,010 |
| 23 | Bật lửa | Cái | 0,010 |
| 24 | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 25 | Cồn sát trùng tay nhanh | ml | 2,000 |
| 26 | Dung dịch nước rửa tay | ml | 8,000 |
| 27 | Khăn lau tay | Cái | 0,030 |
| 28 | Giấy trả kết quả xét nghiệm | Tờ | 2,000 |
3. Bệnh phẩm
Tổn thương các tổ chức dưới da, các đường hầm dưới da hoặc các ổ áp xe dưới da nghi ngờ có ấu trùng Gnathostoma.
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu phiếu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
- Mảnh sinh thiết hoặc dịch ổ áp xe.
- Yêu cầu bệnh phẩm: Nếu tổ chức sinh thiết dưới da thì lấy đầy đủ cục u sinh thiết, không bị vỡ. Nếu bệnh phẩm là dịch ổ áp xe thì dùng bơm kim tiêm to hút dịch hoặc dùng các các dụng cụ chuyên dụng khác lấy dịch bệnh phẩm cho vào ống đựng bệnh phẩm.
2. Tiến hành kỹ thuật
2.1. Chuẩn bị tiêu bản
- Nếu bệnh phẩm là tổ chức sinh thiết dưới da thì dùng dao tách nhẹ để tổ chức lên lam kính, dùng một lam kính khác ép nhẹ và dùng băng dính trắng quấn hai đầu lam.
- Nếu bệnh phẩm là dịch ổ áp xe thì lấy dịch cho lên lam kính và ép lam giống như trên để soi kính hiển vi.
2.2. Soi tìm ấu trùng dưới kính hiển vi quang học
Soi kính hiển vi quang học vật kính 10X hoặc 40X.
IV. NHẬN ĐỊNH KẾT QUẢ
- Ấu trùng có kích thước 3-4 mm xuất hiện trong mô hoặc trong ổ áp xe.
- Hình thể không cân đối một đầu to, một đầu nhỏ. Đầu có 4 hàng gai, chạy theo chiều ngang, gai to, thô, miệng gồm 2 môi.
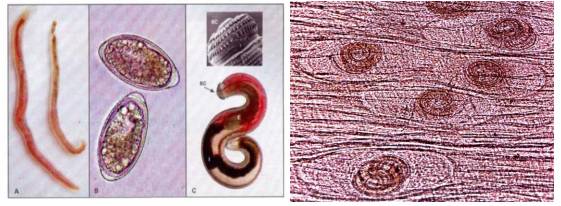
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
- Tách bệnh phẩm không đúng vị trí có ấu trùng, hoặc đúng nhưng không còn nguyên vẹn ấu trùng. Khắc phục bằng cách làm cẩn thận và chính xác.
- Nếu dịch, lấy không đúng chỗ tổn thương, có ít hoặc không có ấu trùng. Khắc phục bằng cách lấy đúng vị trí và lấy nhiều bệnh phẩm, làm nhiều lần để tránh bỏ sót.
208. Taenia (Sán dây) soi tươi định danh
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
Phân biệt đốt sán dây bò và đốt sán dây lợn bằng phương pháp quan sát sự khác nhau về cấu trúc của đốt sán được nhuộm bằng mực tàu.
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện: Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh - Ký sinh trùng.
- Người nhận định và phê duyệt kết quả: Cán bộ có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh - Ký sinh trùng
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1.Trang thiết bị
- Kính hiển vi quang học
- Tủ an toàn sinh học cấp 2
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Lọ lấy bệnh phẩm | Lọ | 1,000 |
| 2 | Lam kính | Cái | 2,000 |
| 3 | Lam kính (kiểm chuẩn) | Cái | 0,200 |
| 4 | Băng dính trắng | Cuộn | 0,010 |
| 5 | Xylen lau kính | ml | 1,000 |
| 6 | Dung dịch NaCl 0,9% | ml | 1,000 |
| 7 | Dung dịch NaCl 0,9% (kiểm chuẩn) | ml | 0,200 |
| 8 | Bông | Kg | 0,001 |
| 9 | Cồn 90 độ (vệ sinh dụng cụ) | ml | 10,000 |
| 10 | Cồn 70 độ (sát trùng) | ml | 5,000 |
| 11 | Đèn cồn | Cái | 0,0001 |
| 12 | Panh | Cái | 0,0001 |
| 13 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 14 | Hộp vận chuyển bệnh phẩm | Cái | 0,0001 |
| 15 | Mũ | Cái | 0,020 |
| 16 | Khẩu trang | Cái | 0,020 |
| 17 | Găng tay | Đôi | 3,000 |
| 18 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 19 | Quần áo bảo hộ | Bộ | 0,001 |
| 20 | Axít ngâm lam | ml | 10,000 |
| 21 | Bút viết kính | Cái | 0,020 |
| 22 | Bút bi | Cái | 0,010 |
| 23 | Bật lửa | Cái | 0,010 |
| 24 | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 25 | Cồn sát trùng tay nhanh | ml | 2,000 |
| 26 | Dung dịch nước rửa tay | ml | 8,000 |
| 27 | Khăn lau tay | Cái | 0,030 |
| 28 | Mực tầu | Lọ | 0,100 |
| 29 | Bơm tiêm 1ml | cái | 1,000 |
| 30 | Giấy trả kết quả xét nghiệm | Tờ | 2,000 |
3. Bệnh phẩm
Đốt sán già theo phân ra ngoài hoặc tự ra ngoài.
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
1. Lấy bệnh phẩm
Lấy bệnh phẩm phân có đốt sán hoặc đốt sán tự do không theo phân.
2. Tiến hành kỹ thuật
2.1. Chuẩn bị tiêu bản
- Dùng 1 lam kính đặt 1 đốt sán già lên lam kính, dùng một lam kính khác đặt lên đốt sán và ép nhẹ.
- Lấy băng dính trắng quấn chặt 2 đầu lam kính
- Dùng bơm tiêm 10, tiêm mực tầu vào lỗ sinh dục, để cho mực tầu thấm vào các nhánh tử cung.
2.2. Quan sát
Bằng mắt thường để quan sát chiều dài đốt sán và dưới kính hiển vi quang học vật kính 10X hoặc 40X để đếm số lượng nhánh tử cung.
IV. NHẬN ĐỊNH KẾT QUẢ
1. Sán dây lợn: Đốt già dài 10-12 mm, tử cung chia 6-12 nhánh
2. Sán dây bò: Đốt già dài 18-20 mm, tử cung chia 18-35 nhánh.
| Đốt sán dây bò | Đốt sán dây lợn |
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
Quá trình tiêm phải chính xác đảm bảo mực tầu thấm hết cố lượng nhánh tử cung, như vậy đếm mới chính xác số lượng nhánh tử cung.
209. Toxocara (Giun đũa chó, mèo) soi mảnh sinh thiết
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
Phát hiện các ấu trùng Toxocara (giun đũa chó, mèo) bằng phương pháp soi mảnh sinh thiết.
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện: Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh - Ký sinh trùng.
- Người nhận định và phê duyệt kết quả: Cán bộ có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh - Ký sinh trùng
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Kính hiển vi quang học
- Tủ an toàn sinh học cấp 2
- Lò hấp dụng cụ phẫu thuật
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Lọ lấy bệnh phẩm | Lọ | 1,000 |
| 2 | Lam kính | Cái | 2,000 |
| 3 | Lam kính (kiểm chuẩn) | Cái | 0,200 |
| 4 | Băng dính trắng | Cuộn | 0,010 |
| 5 | Xylen lau kính | ml | 1,000 |
| 6 | Dung dịch NaCl 0,9% | ml | 1,000 |
| 7 | Dung dịch NaCl 0,9% (kiểm chuẩn) | ml | 0,200 |
| 8 | Bông | Kg | 0,001 |
| 9 | Cồn 90 độ (vệ sinh dụng cụ) | ml | 10,000 |
| 10 | Cồn 70 độ (sát trùng) | ml | 5,000 |
| 11 | Đèn cồn | Cái | 0,0001 |
| 12 | Panh | Cái | 0,0001 |
| 13 | Dao mổ (dao tiểu phẫu) | Cái | 1,000 |
| 14 | Chỉ khâu | Sợi | 1,000 |
| 15 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 16 | Thuốc gây tê | Ống | 1,000 |
| 17 | Khay quả đậu | Cái | 0,0001 |
| 18 | Khăn phẫu thuật | cái | 1,000 |
| 19 | Gạc vô khuẩn | cái | 2,000 |
| 20 | Băng dính vải | Cuộn | 0,010 |
| 21 | Hộp vận chuyển bệnh phẩm | Cái | 0,0001 |
| 22 | Mũ | Cái | 0,020 |
| 23 | Khẩu trang | Cái | 0,020 |
| 24 | Găng tay | Đôi | 3,000 |
| 25 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 26 | Quần áo bảo hộ | Bộ | 0,001 |
| 27 | Axít ngâm lam | ml | 10,000 |
| 28 | Bút viết kính | Cái | 0,020 |
| 29 | Bút bi | Cái | 0,010 |
| 30 | Bật lửa | Cái | 0,010 |
| 31 | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 32 | Cồn sát trùng tay nhanh | ml | 2,000 |
| 33 | Dung dịch nước rửa tay | ml | 8,000 |
| 34 | Khăn lau tay | Cái | 0,030 |
| 35 | Giấy trả kết quả xét nghiệm | Tờ | 2,000 |
3. Bệnh phẩm
Sinh thiết gan ở các u hạt, phổi, não, thận, nghi ngờ có ấu trùng Toxocara (giun đũa chó, mèo).
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu phiếu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
1. Lấy bệnh phẩm
Bệnh phẩm là mảnh sinh thiết gan ở các u hạt, phổi, não, thận, nghi ngờ có ấu trùng Toxocara.
Yêu cầu bệnh phẩm sinh thiết phải nguyên vạn các u hạt.
2. Tiến hành kỹ thuật
2.1. Chuẩn bị tiêu bản
- Làm tiêu bản bằng phương tách bệnh phẩm sinh thiết và lấy các u hạt
- Đặt u hạt lên lam kính và dùng 1 lam kính khác ép nhẹ
- Lấy băng dính trắng quấn 2 đầu lam kính.
2.2. Soi tìm ấu trùng dưới kính hiển vi quang học.
Soi kính hiển vi vật kính 10X hoặc 40X.
IV. NHẬN ĐỊNH KẾT QUẢ
Ấu trùng có kích thước kích thước 0,5-1mm xuất hiện trong bệnh phẩm sinh thiết.
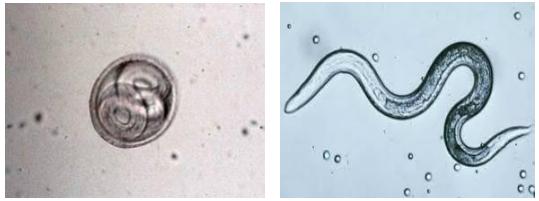
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
Bệnh phẩm lấy không đúng chỗ tổn thương hoặc lấy nhưng các u hạt bị vỡ không còn nguyên vẹn, hoặc lấy nguyên vẹn nhưng khi tiến hành làm thì bi vỡ hoặc không đầy đủ. Khắc phục bằng cách lấy cẩn thận và chính xác.
210. Trichinella spiralis (Giun xoắn) soi mảnh sinh thiết
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
Phát hiện các ấu trùng Trichinella spiralis (giun xoắn) trong mảnh sinh thiết.
II. CHUẨN BỊ
1.Người thực hiện
- Người thực hiện: Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh - Ký sinh trùng.
- Người nhận định và phê duyệt kết quả: Cán bộ có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh - Ký sinh trùng
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1.Trang thiết bị
- Kính hiển vi quang học
- Tủ an toàn sinh học cấp 2
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Lọ lấy bệnh phẩm | Lọ | 1,000 |
| 2 | Lam kính | Cái | 2,000 |
| 3 | Lam kính (QC) | Cái | 0,200 |
| 4 | Băng dính trắng | Cuộn | 0,010 |
| 5 | Xylen lau kính | ml | 1,000 |
| 6 | Dung dịch NaCl 0,9% | ml | 1,000 |
| 7 | Dung dịch NaCl 0,9% (QC) | ml | 0,200 |
| 8 | Bông | Kg | 0,001 |
| 9 | Cồn 90 độ (vệ sinh dụng cụ) | ml | 10,000 |
| 10 | Cồn 70 độ (sát trùng) | ml | 5,000 |
| 11 | Đèn cồn | Cái | 0,0001 |
| 12 | Panh | Cái | 0,0001 |
| 13 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 14 | Hộp vận chuyển bệnh phẩm | Cái | 0,0001 |
| 15 | Mũ | Cái | 0,020 |
| 16 | Khẩu trang | Cái | 0,020 |
| 17 | Găng tay | Đôi | 3,000 |
| 18 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 19 | Quần áo bảo hộ | Bộ | 0,001 |
| 20 | Axít ngâm lam | ml | 10,000 |
| 21 | Bút viết kính | Cái | 0,020 |
| 22 | Bút bi | Cái | 0,010 |
| 23 | Bật lửa | Cái | 0,010 |
| 24 | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 25 | Cồn sát trùng tay nhanh | ml | 2,000 |
| 26 | Dung dịch nước rửa tay | ml | 8,000 |
| 27 | Khăn lau tay | Cái | 0,030 |
| 28 | Giấy trả kết quả xét nghiệm | Tờ | 2,000 |
3. Bệnh phẩm
Tổn thương cơ (thường gặp là cơ ở cơ dép, cẳng chân) hoặc các tổ chức, cơ quan, bộ phận trong cơ thể, nghi ngờ có ấu trùng Trichinella spiralis (giun xoắn)
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu phiếu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
1. Lấy bệnh phẩm
Mảnh sinh thiết.
Yêu cầu bệnh phẩm là các nang trong tổ chức cơ, lấy nguyên vẹn các nang nghi ngờ.
2. Tiến hành kỹ thuật
2.1. Chuẩn bị tiêu bản
- Dùng dao tách nhẹ nhàng nang và đặt lên lam kính
- Dùng một lam kính khác, đặt lên lam kính có nang rồi ép nhẹ 2 lam kính
- Dùng băng dính trắng, quấn 2 đầu của 2 lam ép, kết thúc quá trình làm lam
2.2. Soi tìm ấu trùng
Quan sát ấu trùng ở vật kính 10X hoặc 40X .
IV. NHẬN ĐỊNH KẾT QUẢ
Ấu trùng cư trú ở cơ dép, cẳng chân, xuất hiện các nang với kích thước 900-1300 x 35-49 µm, thường cuộn lại như vòng soắn lò xo trong một nang hình quả cau ở tổ chức, trong một nang có thể có 2-3 ấu trùng.
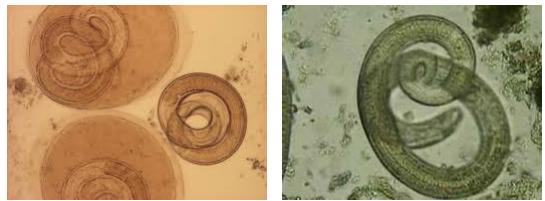
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
Tách bệnh phẩm không đúng vị trí có ấu trùng, hoặc đúng nhưng không còn nguyên vẹn ấu trùng. Khắc phục bằng cách làm cẩn thận và chính xác.
211. Trichomonas vaginalis soi tưoi
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Phát hiện Trichomonas vaginalis gây bệnh đường sinh dục
2. Nguyên lý
Trichomonas vaginalis được phát hiện qua hình thể, kích thước, tính chất di động trong môi trường có NaCL 9‰ soi dưới kính hiển vi quang học.
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện: Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh - Ký sinh trùng.
- Người nhận định và phê duyệt kết quả: Cán bộ có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh - Ký sinh trùng
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1.Trang thiết bị
- Kính hiển vi quang học
- Tủ an toàn sinh học cấp 2
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Lá kính | Cái | 1,000 |
| 2 | Lam kính | Cái | 2,000 |
| 3 | Lam kính (QC) | Cái | 0,200 |
| 4 | Nước muối sinh lý 0,9% | Ml | 1,000 |
| 5 | Mỏ vịt | Cái | 2,000 |
| 6 | Bông | Kg | 0,001 |
| 7 | Cồn 90 độ (vệ sinh dụng cụ) | Ml | 10,000 |
| 8 | Bàn phụ khoa | Cái | 1,000 |
| 10 | Đèn cồn | Cái | 0,0001 |
| 11 | Panh | Cái | 0,0001 |
| 12 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 13 | Hộp vận chuyển bệnh phẩm | Cái | 0,0001 |
| 14 | Mũ | Cái | 0,020 |
| 15 | Khẩu trang | Cái | 0,020 |
| 16 | Găng tay | Đôi | 3,000 |
| 17 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 18 | Quần áo bảo hộ | Bộ | 0,001 |
| 19 | Ống nghiệm thủy tinh | Ống | 1,000 |
| 20 | Bút viết kính | Cái | 0,020 |
| 21 | Bút bi | Cái | 0,010 |
| 22 | Bật lửa | Cái | 0,010 |
| 23 | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 24 | Cồn sát trùng tay nhanh | Ml | 2,000 |
| 25 | Dung dịch nước rửa tay | Ml | 8,000 |
| 26 | Khăn lau tay | Cái | 0,030 |
| 27 | Giấy trả kết quả xét nghiệm | Tờ | 2,000 |
3. Bệnh phẩm
Khí hư âm đạo
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
1. Lấy bệnh phẩm
Theo đúng quy định của chuyên ngành Vi sinh.
2. Tiến hành kỹ thuật
Bệnh phẩm sau khi lấy hoà vào giọt nước muối sinh lý 0,9% đã nhỏ sẵn trên lam kính. Đậy lá kính soi ngay trên kính hiển vi quang học.
Thực hiện kỹ thuật trong 10 phút và đọc kết quả sau 3-5 phút
IV. NHẬN ĐỊNH KẾT QUẢ
Quan sát kính hiển vi quang học vật kính 10X, 40X
- Hình thể trùng roi giống hạt chanh, di động xoay tròn
- Có 5 roi: 4 roi trước, 1 roi sau
- Chiều dài 10-20µm. Chiều rộng 5-12 µm.
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
1. Sai sót
- Phân biệt trùng roi với bọt khí, bạch cầu
- Trùng roi nhanh chết ở nhiệt độ phòng
- Bệnh phẩm quá dày
2.Xử trí
- Hình thái trùng roi và tính chất di động điển hình như mô tả trên
- Dùng ngón tay ấn nhẹ vào giữa lam đuổi bọt khí ra rìa tiêu bản
- Lau bớt dịch tiết và hòa đều bệnh phẩm vào giọt nước muối sinh lý.
212. Trichomonas vaginalis nhuộm soi
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Phát hiện Trichomonas vaginalis gây bệnh đường sinh dục
2. Nguyên lý
Trichomonas vaginalis được phát hiện qua hình thể, kích thước cấu tạo khi nhuộm HE, soi dưới kính hiển vi quang học.
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện: Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh - Ký sinh trùng.
- Người nhận định và phê duyệt kết quả: Cán bộ có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh - Ký sinh trùng.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Kính hiển vi quang học
- Tủ an toàn sinh học cấp 2
- Dụng cụ sấy lam (nếu có)
2.2.Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Lam kính | Cái | 2,000 |
| 2 | Lam kính (QC) | Cái | 0,200 |
| 3 | Mỏ vịt | Cái | 2,000 |
| 4 | Bông | Kg | 0,001 |
| 5 | Cồn 90 độ (vệ sinh dụng cụ) | Ml | 10,000 |
| 6 | Bàn phụ khoa | Cái | 1,000 |
| 7 | Đèn cồn | Cái | 0,0001 |
| 8 | Panh | Cái | 0,0001 |
| 9 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 10 | Hộp vận chuyển bệnh phẩm | Cái | 0,0001 |
| 11 | Mũ | Cái | 0,020 |
| 12 | Khẩu trang | Cái | 0,020 |
| 13 | Găng tay | Đôi | 3,000 |
| 14 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 15 | Quần áo bảo hộ | Bộ | 0,001 |
| 16 | Bút viết kính | Cái | 0,020 |
| 17 | Bút bi | Cái | 0,010 |
| 18 | Bật lửa | Cái | 0,010 |
| 19 | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 20 | Cồn sát trùng tay nhanh | ml | 2,000 |
| 21 | Dung dịch nước rửa tay | ml | 8,000 |
| 22 | Khăn lau tay | Cái | 0,030 |
| 23 | Giấy trả kết quả xét nghiệm | Tờ | 2,000 |
| 24 | Eosin | ml | 5,000 |
| 25 | Hematoxylin | ml | 5,000 |
| 26 | Cồn acid HCL1% | ml | 10,000 |
3. Bệnh phẩm
Khí hư âm đạo
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
Theo đúng quy định của chuyên ngành Vi sinh.
2. Tiến hành kỹ thuật
Bệnh phẩm sau khi lấy dàn mỏng trên lam kính sau đó tiến hành nhuộm: rửa nước, Hematoxylin 3-5 phút, tẩy cồn acid 3-5 phút, gắn lá kính. Soi trên kính hiển vi quang học.
Thực hiện kỹ thuật trong 10 -15 phút và đọc kết quả sau 10 phút
IV. NHẬN ĐỊNH KẾT QUẢ
Quan sát kính hiển vi quang học ở vật kính 10X, 40X thấy
- Hình thể trùng roi giống hạt chanh
- Có 5 roi: 4 roi trước, 1 roi sau
- Chiều dài 10-20µm. Chiều rộng 5-12 µm.
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
1. Sai sót
- Phân biệt Trùng roi với bạch cầu
- Tẩy acid quá lâu làm mất mầu của trùng roi
- Bệnh phẩm quá dày
2. Xử trí
- Nhận biết hình thể trùng roi điển hình như mô tả.
- Thực hiện đúng kỹ thuật nhuộm
- Dàn bệnh phẩm đúng kỹ thuật
213. Pneumocystis jirovecii nhuộm soi
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Phát hiện Pneumocystis jirovecii có trong bệnh phẩm.
2. Nguyên lý
Phát hiện Pneumocystis jirovecii bằng kỹ thuật nhuộm bạc dựa vào hình thể, kích thước, cấu tạo.
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện: Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh - Ký sinh trùng.
- Người nhận định và phê duyệt kết quả: Cán bộ có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh - Ký sinh trùng.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
- Bộ thuốc nhuộm Bạc bao gồm: Dung dịch acid Chromic hoặc acid Perioric; Dung dịch nhuộm Bạc; Dung dịch Gold clorid 0,1%; Dung dịch Bouins; Dung dịch Thiosunphat; Dung dịch Chromotrope 5%.
- Nước cân bằng
2.1. Trang thiết bị
- Kính hiển vi quang học
- Tủ an toàn sinh học cấp 2
- Máy lắc
- Máy ly tâm 3000 vòng/phút
- Tủ ấm 60-70 độ C
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1. | Lọ lấy bệnh phẩm | Lọ | 1,000 |
| 2. | Lam kính | Cái | 2,000 |
| 3. | Lam kinh kiểm chuẩn | Cái | 0,200 |
| 4. | Dầu kính | ml | 1,000 |
| 5. | Xylen lau kính | ml | 1,000 |
| 6. | Dung dịch NaCl 0,9% | ml | 1,000 |
| 7. | Cồn 90 độ (vệ sinh dụng cụ) | ml | 10,000 |
| 8. | Que cấy | cái | 1,000 |
| 9. | Đèn cồn | Cái | 0,0001 |
| 10. | Bộ thuốc nhuộm Bạc | ml | 1,000 |
| 11. | Dung dịch đệm | ml | 10,000 |
| 12. | Que cấy | Cái | 1,000 |
| 13. | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 14. | Ống nghiệm thủy tinh | Ống | 1,000 |
| 15. | Mũ | Cái | 0,020 |
| 16. | Bông | kg | 0,001 |
| 17. | Khẩu trang | Cái | 0,020 |
| 18. | Găng tay | Đôi | 3,000 |
| 19. | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 20. | Quần áo bảo hộ | Bộ | 0,001 |
| 21. | Axít ngâm lam | ml | 10,000 |
| 22. | Bút viết kính | Cái | 0,020 |
| 23. | Bút bi | Cái | 0,010 |
| 24. | Bật lửa | Cái | 0,010 |
| 25. | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 26. | Cồn sát trùng tay nhanh | ml | 2,000 |
| 27. | Dung dịch nước rửa tay | ml | 8,000 |
| 28. | Khăn lau tay | Cái | 0,030 |
| 29. | Giấy trả kết quả xét nghiệm | Tờ | 2,000 |
3. Bệnh phẩm
Đờm, dịch rửa phế quản, phế nang, hoặc sinh thiết phổi.
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu phiếu yêu cầu.
III. CÁC BƯỚC TIẾN HÀNH
1. Lấy bệnh phẩm
- Đờm, dịch rửa phế quản, phế nang, hoặc sinh thiết phổi.
- Nếu bệnh phẩm là dịch hoặc đờm thì lấy 2-5ml.
2. Tiến hành kỹ thuật
2.1. Chuẩn bị bệnh phẩm: Xử lý bệnh phẩm
- Đối với dịch rửa phế quản, dịch màng phổi: lấy khoảng 2 ml vào ống thủy tinh ly tâm với tốc độ 3000 vòng/phút x 10 phút, lấy cặn.
- Đối với bệnh phẩm đờm: lấy khoảng 1ml đờm, cho thêm 1 ml nước muối sinh lý 0.9%, làm tan đờm bằng máy lắc hoặc đũa lắc thủy tinh sau đó ly tâm với tốc độ 3000 vòng/phút x 10 phút, lấy cặn.
2.2. Làm tiêu bản
Dùng que cấy lấy bệnh phẩm đã ly tâm lấy cặn dàn tiêu bản lên lam kính (đường kính từ 1 - 1,5 cm) và để khô tự nhiên.
2.3. Các bước nhuộm
- Ngâm lam trong dung dịch acid Chromic hoặc acid Perioric - 1 giờ, rồi rửa nước
- Ngâm trong dung dịch nhuộm Bạc - 1 giờ, rồi rửa nước
- Ngâm trong dung dịch Gold clorid 0,1% - 1 phút, rửa nước
- Ngâm trong dung dịch Bouins - 5 phút, rửa nước
- Ngâm trong dung dịch Thiosunphat - 2 phút, rửa nước
- Ngâm trong dung dịch Chromotrope 5% - 15 phút, rửa nước
- Để khô tự nhiên và soi vật kính dầu với vật kính 100X
IV. NHẬN ĐỊNH KẾT QUẢ Có 4 hình thể khác nhau
- Thể hoạt động dạng nhỏ (đơn bội): Có hình quả trứng hoặc hình lưỡi liềm, kích thước 1-3 µm, có một nhân ở giữa, tế bào chất đậm đặc.
- Thể hoạt động dạng lớn (lưỡng bội): Có hình thể không đều, kích thước > 4 - 10 µm, có một nhân và tế bào chất loãng hơn.
- Thể tiền bào nang: Hình quả trứng, kích thước 3,5 - 5,5 µm, thành ngoài rất dầy, thường nhẵn và đều, nhân chia nhiều mảnh (2 - 8 mảnh).
- Thể bào nang: hình tròn, kích thước 4 - 8 µm, thành bào nang tiếp tục dày thêm, bên trong có 8 ký sinh trùng non hoàn chỉnh. Mỗi ký sinh trùng con có một nhân, tế bào chất và một màng mỏng bao quanh. Các thể trong bào nang có hình tròn, quả chuối, hoặc dạng amíp.
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
1. Sai sót
Bệnh phẩm dịch lấy không đúng kỹ thuật, mảnh sinh thiết không đúng chỗ bị tổn thương, bệnh phẩm đờm lấy không đúng kỹ thuật (chỉ có nước bọt), đờm không qua xử lý làm tan sẽ không ly tâm lấy cặn được.
2. Xử trí: Lấy bệnh phẩm và thao tác đúng kỹ thuật.
214. Vi nấm soi tươi
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Nhận định sơ bộ vi nấm.
2. Nguyên lý
Nhận định sơ bộ vi nấm dựa vào hình thể, kích thước, cấu tạo và tính chất bắt màu.
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện: Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh - Ký sinh trùng.
- Người nhận định và phê duyệt kết quả: Cán bộ có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh - Ký sinh trùng
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Kính hiển vi.
- Tủ an toàn sinh học cấp 2
- Máy li tâm
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Lọ lấy bệnh phẩm | Lọ | 1,000 |
| 2 | Lam kính | Cái | 2,000 |
| 3 | Lá kính | Cái | 2,000 |
| 4 | Bông | Kg | 0,001 |
| 5 | Cồn 90 độ (vệ sinh dụng cụ) | ml | 10,000 |
| 6 | Panh | Cái | 0,0001 |
| 7 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 8 | Hộp vận chuyển bệnh phẩm | Cái | 0,0001 |
| 9 | Hóa chất (KOH, mực tàu, nước muối sinh lý) | ml | 5,000 |
| 10 | Pipet nhựa | Cái | 2,000 |
| 11 | Axit ngâm lam | ml | 10,000 |
| 12 | Ống nghiệm thủy tinh | Ống | 1,000 |
| 13 | Mũ | Cái | 0,020 |
| 14 | Khẩu trang | Cái | 0,020 |
| 15 | Găng tay | Đôi | 3,000 |
| 16 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 17 | Quần áo bảo hộ | Bộ | 0,001 |
| 18 | Bút viết kính | Cái | 0,020 |
| 19 | Bút bi | Cái | 0,010 |
| 20 | Bật lửa | Cái | 0,010 |
| 21 | Sổ lưu kết quả xét nghiệm | Quyển | 0,001 |
| 22 | Cồn sát trùng tay nhanh | ml | 1,000 |
| 23 | Dung dịch nước rửa tay | ml | 8,000 |
| 24 | Khăn lau tay | Cái | 0,010 |
| 25 | Giấy trả kết quả xét nghiệm | Tờ | 2,000 |
| 26 | QC (nếu thực hiện) * |
| 0,1 |
| 27 | EQAS (nếu thực hiện) * |
| 0,005 |
* Ghi chú:
- Chi phí nội kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình nội kiểm (QC) là 1/10 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lượng ≥ 10 mẫu cho 1 lần tiến hành kỹ thuật).
- Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/200 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 2 lần/1 năm).
3. Bệnh phẩm
Máu, dịch, mủ, đờm, phân, nước tiểu, da, tóc, móng.
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu phiếu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
1. Lấy bệnh phẩm
Theo đúng quy định của chuyên ngành Vi sinh( xem Phụ lục 5).
2. Tiến hành kỹ thuật
2.1. Lấy bệnh phẩm cho lên lam kính: tùy từng loại bệnh phẩm sử dụng hóa chất khác nhau.
- Bệnh phẩm da, tóc, móng: Lấy bệnh phẩm lên lam kính, nhỏ dung dịch KOH 20% lên trên bệnh phẩm.
- Bệnh phẩm dịch tiết( lấy bằng que tăm bông), phân, đờm: Nhỏ NaCl 9‰ lên trên lam kính, lấy bệnh phẩm hòa lên trên giọt dung dịch đến khi đục.
- Bệnh phẩm là dịch não tủy nghi ngờ nhiễm Cryptococcus spp làm tiêu bản bằng mực tàu.
- Đối với bệnh phẩm là các chất dịch lỏng lấy trực tiếp bệnh phẩm lên lam kính.
2.2. Lấy lá kính đậy lên trên giọt dung dịch.
2.3. Quan sát kính hiển vi vật kính 10X - 40X.
IV. NHẬN ĐỊNH KẾT QUẢ
1. Dương tính
- Tế bào nấm men hình tròn hoặc bầu dục kích thước 3- 5µm nảy chồi hoặc không.
- Tế bào nấm men có quầng sáng bao quanh khi làm tiêu bản mực tàu.
- Sợi nấm giả (Sợi nhánh được tạo thành từ các chỗ thắt).
- Nấm sợi có vách ngăn (sợi nhánh được tách ra cách vách ngăn).
2. Âm tính
Không thấy vi nấm.
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
- Đối với bệnh phẩm da, tóc, móng để thời gian ngắn chưa tan hết phải để thêm thời gian.
- Tiêu bản mực tàu làm quá đen phải pha thêm nước muối sinh lý.
215. Vi nấm test nhanh
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Phát hiện vi nấm
2. Nguyên lý
Phát hiện kháng nguyên vi nấm qua phản ứng kết hợp đặc hiệu của kháng nguyên và kháng thể tương ứng.
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện: Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh - Ký sinh trùng.
- Người nhận định và phê duyệt kết quả: Cán bộ có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh - Ký sinh trùng
2.Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Tủ an toàn sinh học 2
- Micropipette
- Đồng hồ bấm giây
- Máy ly tâm thường
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Ống lấy bệnh phẩm | Ống | 1,000 |
| 2 | Bơm tiêm | Cái | 1,000 |
| 3 | Bông | Kg | 0,001 |
| 4 | Cồn 90 độ (vệ sinh dụng cụ) | Ml | 10,000 |
| 5 | Panh | Cái | 0,0001 |
| 6 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 7 | Hộp vận chuyển bệnh phẩm | Cái | 0,0001 |
| 8 | Hóa chất chính | Test | 1,000 |
| 9 | Khấu hao sinh phẩm cho chạy chứng và kiểm tra chất lượng | Test | 0,400 |
| 10 | Đầu côn vàng | Cái | 2,000 |
| 11 | Axit ngâm rửa | Ml | 10,000 |
| 12 | Ống nghiệm thủy tinh | Ống | 1,000 |
| 13 | Mũ | Cái | 0,020 |
| 14 | Khẩu trang | Cái | 0,020 |
| 15 | Găng tay | Đôi | 2,000 |
| 16 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 17 | Quần áo bảo hộ | Bộ | 0,001 |
| 18 | Bút viết kính | Cái | 0,020 |
| 19 | Bút bi | Cái | 0,010 |
| 20 | Sổ lưu kết quả xét nghiệm | Quyển | 0,001 |
| 21 | Cồn sát trùng tay nhanh | Ml | 1,000 |
| 22 | Dung dịch nước rửa tay | Ml | 8,000 |
| 23 | Khăn lau tay | Cái | 0,010 |
| 24 | Giấy trả kết quả xét nghiệm | Tờ | 2,000 |
3. Bệnh phẩm
Dịch não tủy, huyết thanh hoặc huyết tương của người bệnh
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu phiếu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
1. Lấy bệnh phẩm
Theo đúng quy định của chuyên ngành Vi sinh ( xem Phụ lục 5).
2. Tiến hành kỹ thuật
2.1. Ly tâm ống bệnh phẩm (nếu bệnh phẩm là máu)
2.2. Nhỏ dung dịch pha loãng vào tube sạch
2.3. Nhỏ bệnh phẩm vào tube có dung dịch pha loãng, ghi mã bệnh phẩm tương ứng
2.4. Cắm thanh xét nghiệm vào tube, đọc kết quả đúng thời gian qui định
IV. NHẬN ĐỊNH KẾT QUẢ
Kết quả được chấp nhận khi xuất hiện màu rõ ràng, sắc nét ở vạch chứng C
+ Dương tính khi xuất hiện màu ở vạch C và vạch T
+ Âm tính khi xuất hiện màu ở vạch chứng C và không xuất hiện màu ở vạch T.
+ Không có giá trị: Vạch chứng C không xuất hiện sau thời gian qui định thì cần kiểm tra lại hóa chất, các bước thực hiện, làm lại test khác.
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
- Đọc kết quả trước hoặc sau thời gian qui định có thể làm sai lệch kết quả.
- Cho quá ít bệnh phẩm, hay quá nhiều dung dịch pha loãng có thể ảnh hưởng đến nhận định kết quả.
- Tham khảo thêm hướng dẫn của nhà sản xuất.
216. Vi nấm nhuộm soi
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đich
Phát hiện Pneumocystis jirovecii
2. Nguyên lý
Pneumocystis jirovecii được phát hiện nhờ hình thể, kích thước, tính chất bắt màu khi nhuộm TBO ( Toludine Blue O).
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện: Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh - Ký sinh trùng.
- Người nhận định và phê duyệt kết quả: Cán bộ có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh - Ký sinh trùng
2. Phương tiện, hóa chất
2.1. Trang thiết bị
Kính hiển vi quang học
Tủ an toàn sinh học cấp 2
Máy ly tâm
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Lọ lấy bệnh phẩm | Lọ | 1,000 |
| 2 | Que lấy bệnh phẩm | Cái | 2,000 |
| 3 | Lam kính | Cái | 1,000 |
| 5 | Bông | Kg | 0,001 |
| 6 | Cồn 90 độ (vệ sinh dụng cụ) | ml | 10,000 |
| 7 | Panh | Cái | 0,0001 |
| 8 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 9 | Hộp vận chuyển bệnh phẩm | Cái | 0,0001 |
| 10 | Dung dịch TBO | ml | 3,000 |
| 11 | Pipet nhựa | Cái | 2,000 |
| 12 | Axit ngâm lam | ml | 10,000 |
| 13 | Ống nghiệm thủy tinh | Ống | 1,000 |
| 14 | Mũ | Cái | 0,020 |
| 15 | Khẩu trang | Cái | 0,020 |
| 16 | Găng tay | Đôi | 3,000 |
| 17 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 18 | Quần áo bảo hộ | Bộ | 0,001 |
| 19 | Bút viết kính | Cái | 0,020 |
| 20 | Bút bi | Cái | 0,010 |
| 21 | Bật lửa | Cái | 0,010 |
| 22 | Sổ lưu kết quả xét nghiệm | Quyển | 0,001 |
| 23 | Cồn sát trùng tay nhanh | ml | 1,000 |
| 24 | Dung dịch nước rửa tay | ml | 8,000 |
| 25 | Khăn lau tay | Cái | 0,010 |
| 26 | Giấy trả kết quả xét nghiệm | Tờ | 2,000 |
| 27 | QC (nếu thực hiện) * |
| 0,1 |
| 28 | EQAS (nếu thực hiện) * |
| 0,005 |
* Ghi chú:
- Chi phí nội kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình nội kiểm (QC) là 1/10 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lượng ≥ 10 mẫu cho 1 lần tiến hành kỹ thuật).
- Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/200 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 2 lần/1 năm).
3. Bệnh phẩm
Đờm, dịch phế quản.
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu phiếu yêu cầu
III. Các bước tiến hành
1. Lấy bệnh phẩm
Theo đúng quy định của chuyên ngành Vi sinh ( xem Phụ lục 5).
2. Tiến hành kỹ thuật
2.1. Lấy bệnh phẩm phết lên lam kính, để khô.
2.2. Phủ thuốc nhuộm TBO lên trên bệnh bệnh phẩm.
2.3. Rửa nước, để khô.
2.4. Quan sát kính hiển vi vật kính 40X- 100X.
IV. NHẬN ĐỊNH KẾT QUẢ
1. Dương tính
- Thể hoạt động Pneumocystis jirovecii kích thước từ 1- 4µm.
- Thể bào nang bắt màu xanh tím hình tròn vỏ mỏng kích thước 1- 7µm bên trong có từ 1-8 nhân.
2. Âm tính
Không tìm thấy Pneumocystis jirovecii.
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
- Tiêu bản bị bong.
- Xử trí
- Khi phết lam phải để bệnh phẩm khô mới tiến hành nhuộm.
217. Vi nấm nuôi cấy và định danh bằng phương pháp thông thường
I. MỤC ĐÍCH, NGUYÊN LÝ
1. Mục đích
Định danh vi nấm gây bệnh
2. Nguyên lý
Nuôi cấy, định danh vi nấm dựa trên các tính chất về hình thể, cấu tạo, bắt màu và một số tính chất sinh vật, hóa học của nấm.
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện: Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh - Ký sinh trùng.
- Người nhận định và phê duyệt kết quả: Cán bộ có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh - Ký sinh trùng.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Kính hiển vi.
- Tủ an toàn sinh học cấp 2
- Máy ly tâm.
- Tủ ấm.
- Máy tính cài phần mềm đọc API ( nếu có).
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Lọ lấy bệnh phẩm | Lọ | 1,000 |
| 2 | Que cấy | Cái | 2,000 |
| 3 | Lam kính | Cái | 2,000 |
| 4 | Lá kính | Cái | 1,000 |
| 5 | Lactophenol Coton Blue | Ml | 1,000 |
| 6 | Nước muối sinh lý | Ml | 5,000 |
| 7 | KOH 20 % | Ml | 5,000 |
| 8 | Mực tàu | Ml | 0,500 |
| 9 | Sabouraud | Đĩa | 1,000 |
| 10 | Candiselect | Đĩa | 0,500 |
| 11 | Giá đường API | Test | 0,500 |
| 12 | RAT | Ống | 1,000 |
| 13 | Bông | Kg | 0,001 |
| 14 | Cồn 90 độ (vệ sinh dụng cụ) | ml | 10,000 |
| 15 | Đèn cồn | Cái | 0,0001 |
| 16 | Panh | Cái | 0,0001 |
| 17 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 18 | Hộp vận chuyển bệnh phẩm | Cái | 0,0001 |
| 19 | Mũ | Cái | 0,020 |
| 20 | Khẩu trang | Cái | 0,020 |
| 21 | Găng tay | Đôi | 3,000 |
| 22 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 23 | Quần áo bảo hộ | Bộ | 0,001 |
| 24 | Axit ngâm lam | ml | 10,000 |
| 25 | Ống nghiệm thủy tinh | Ống | 1,000 |
| 26 | Bút viết kính | Cái | 0,00 |
| 27 | Bút bi | Cái | 0,010 |
| 28 | Bật lửa | Cái | 0,010 |
| 29 | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 30 | Cồn sát trùng tay nhanh | ml | 1,000 |
| 31 | Dung dịch nước rửa tay | ml | 8,000 |
| 32 | Khăn lau tay | Cái | 0,030 |
| 33 | Giấy trả kết quả xét nghiệm | Tờ | 2,000 |
| 34 | QC (nếu thực hiện) * |
| 0,1 |
| 35 | EQAS (nếu thực hiện) * |
| 0,005 |
* Ghi chú:
- Chi phí nội kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình nội kiểm (QC) là 1/10 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lượng ≥ 10 mẫu cho 1 lần tiến hành kỹ thuật).
- Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/200 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 2 lần/1 năm).
3. Bệnh phẩm: Máu, dịch, mủ, đờm, phân, nước tiểu, da, tóc, móng.
4. Phiếu xét nghiệm: Điền đầy đủ thông tin theo mẫu phiếu yêu cầu.
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
Theo đúng quy định của chuyên ngành Vi sinh (Tham khảo phụ lục 5).
2. Tiến hành kỹ thuật
2.1. Nuôi cấy nấm trên môi trường Sabouraud ủ ấm ở nhiệt độ 30°C.
- Bệnh phẩm là da, tóc, móng: Cắt nhỏ bệnh phẩm cấy 6- 8 điểm trên đĩa Sabouraud.
- Bệnh phẩm là các chất dịch: Hút 3- 5 giọt dịch cấy dàn trên đĩa Sabouraud.
- Bệnh phẩm là nước tiểu: Sử dụng kỹ thuật cấy định lượng.
2.2. Soi tươi tìm nấm: Đánh giá sơ bộ.
2.3. Đọc kết quả hàng ngày
IV. NHẬN ĐỊNH KẾT QUẢ
- Quan sát hình thể cấu tạo, tính chất, màu sắc khuẩn lạc.
+ Khuẩn lạc nấm men:
Khuẩn lạc Candida có dạng trơn, nhẵn màu kem thường mọc nhanh sau 24 giờ.
Khuẩn lạc Cryptococcus trơn nhẵn màu be (khô hơn so với nấm Candida) mọc chậm thường sau 48 giờ.
+ Khuẩn lạc nấm mốc:
Aspergillus màu sắc khuẩn lạc khác nhau.
P. marneffei: sinh sắc tố màu đỏ nâu đến đỏ rượu vang khuếch tán vào môi trường khi nuôi cấy ở nhiệt độ phòng.
- Quan sát kính hiển vi sau cấy:
Tế bào nấm men hình tròn hoặc bầu dục ( đối với nấm Candida), nẩy chồi hoặc không. Cryptococcus thường hình tròn, kích thước lớn.
- Định danh loài nấm men
+ Định danh sơ bộ 4 loài nấm men tiến hành nuôi cấy vào môi trường Candida select.
+ Định danh nấm men bằng bộ API 20C AUX. Trả kết quả loài nấm theo kết quả định danh.
- Định danh nấm mốc
Làm tiêu bản bằng Lactophenol Coton Blue.
Dựa vào hình thái, màu sắc khuẩn lạc, dựa vào đặc điểm vi thể của từng loài Aspergillus để kết luận loài.
P. marneffei : Trên môi trường Sabouraud khuẩn lạc mọc nhanh, kiểu da lộn cho đến có dạng phủ đầy lông tơ, sinh sắc tố màu đỏ nâu đến đỏ rượu vang khuếch tán vào môi trường.
- Âm tính: Không thấy khuẩn lạc mọc sau 4 ngày trả kết quả sơ bộ: Âm tính.
- Các đĩa cấy được bỏ sau 7 ngày nuôi cấy.
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
Để định danh nấm men bằng bộ API 20C AUX cho kết quả chính xác khi lấy khuẩn lạc nấm phải thuần( khuẩn lạc riêng rẽ) tránh bị lẫn .
218. Vi nấm nuôi cấy và định danh hệ thống tự động
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Định danh vi nấm gây bệnh
2. Nguyên lý
Định danh vi nấm gây bệnh dựa vào phương pháp đo mầu để nhận biết các tính chất sinh vật hóa học của vi nấm thông qua sự đổi mầu các giếng môi trường có sẵn trong Card.
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện: Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh - Ký sinh trùng.
- Người nhận định và phê duyệt kết quả: Cán bộ có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh - Ký sinh trùng
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Máy ly tâm
- Tủ ấm thường
- Tủ an toàn sinh học cấp 2
- Máy định danh VITEK 2 - COMPACT và hệ thống máy tính, máy in, lưu điện
- Máy đo độ đục.
- Dispencer (Dụng cụ bơm nước muối 0,45%)
- Pipet loại 200µl và 1000µl
- Cassette có dán mã.
- Ống tube định danh 5ml
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1. | Lọ lấy bệnh phẩm | Lọ | 1,000 |
| 2. | Que cấy | Cái | 2,000 |
| 3. | Lam kính | Cái | 1,000 |
| 4. | Bông | Kg | 0,001 |
| 5. | Cồn 90 độ (vệ sinh dụng cụ) | ml | 10,000 |
| 6. | Nước muối sinh lý | ml | 5,000 |
| 7. | Thuốc nhuộm Fucsin | ml | 5,000 |
| 8. | Thuốc nhuộm tím Gentian | ml | 5,000 |
| 9. | Cồn 96 độ | ml | 5,000 |
| 10. | Lugol | ml | 5,000 |
| 11. | Thuốc nhuộm Xanh Methylen | ml | 5,000 |
| 12. | Sabouraud | Đĩa | 1,000 |
| 13. | Đầu côn 200µl | cái | 1,000 |
| 14. | Đầu côn 1000µl | cái | 1,000 |
| 15. | Đèn cồn | cái | 0,001 |
| 16. | Nước muối 0.45% | ml | 0,003 |
| 17. | Khay đựng bệnh phẩm | Cái | 1,000 |
| 18. | Card định danh nấm | Cái | 1,000 |
| 19. | Axít ngâm lam | ml | 10,000 |
| 20. | Ống nghiệm thủy tinh | Ống | 1,000 |
| 21. | Mũ | Cái | 0,020 |
| 22. | Khẩu trang | Cái | 0,020 |
| 23. | Găng tay | Đôi | 3,000 |
| 24. | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 25. | Quần áo bảo hộ | Bộ | 0,001 |
| 26. | Bút viết kính | Cái | 0,020 |
| 27. | Bút bi | Cái | 0,010 |
| 28. | Bật lửa | Cái | 0,010 |
| 29. | Sổ lưu kết quả xét nghiệm | Quyển | 0,001 |
| 30. | Cồn sát trùng tay nhanh | ml | 1,000 |
| 31. | Dung dịch nước rửa tay | ml | 8,000 |
| 32. | Khăn lau tay | Cái | 0,010 |
| 33. | Giấy trả kết quả xét nghiệm | Tờ | 2,000 |
| 34. | QC (nếu thực hiện) * |
| 0,1 |
| 35. | EQAS (nếu thực hiện) * |
| 0,005 |
* Ghi chú:
- Chi phí nội kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình nội kiểm (QC) là 1/10 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lượng ≥ 10 mẫu cho 1 lần tiến hành kỹ thuật).
- Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/200 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 2 lần/1 năm).
3.Bệnh phẩm
Máu, dịch, mủ, đờm, phân, nước tiểu, da, tóc, móng.
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu phiếu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
Theo đúng quy định của chuyên ngành Vi sinh (Xem Phụ lục 5).
2. Tiến hành kỹ thuật
2.1. Nuôi cấy nấm từ bệnh phẩm
+ Chuẩn bị bệnh phẩm, đĩa thạch sabouraud, đèn cồn và ăng cấy.
+ Để đĩa thạch lấy từ tủ lạnh vào tủ ấm khoảng 10 - 15 phút trước khi cấy.
+ Cấy phân vùng từ bệnh phẩm vào đĩa thạch sabouraud theo quy trình vào.
Chú ý: Các thao tác phải tiến hành nhanh chóng tránh bị nhiễm bẩn từ ngoài
- Theo dõi nuôi cấy
+ Nếu trên đĩa sabouraud có khuẩn lạc nấm mọc, ta tiến hành làm tiêu bản soi trực tiếp bằng NaCl sinh lý xem để xác định nấm men hay nấm sợi.
+ Nếu trên đĩa thạch mọc nấm men lấy một khuẩn lạc nấm ria riêng rẽ, để được chủng nấm thuần chạy Vitek định loại nấm.
2.2. Cách tiến hành chạy Vitek như sau
+ Chuẩn bị Worksheet cho cassette (Điền các thông tin cần biết về người bệnh như tên, lab ID…)
+ Chuẩn bị card: lấy card ra khỏi tủ lạnh và để ở nhiệt độ phòng khoảng 15 phút.
+ Chuẩn bị ống làm định danh với độ đục 2 McF
+ Cho cassette vào buồng hút và nhấn Start Fill
+ Khi đèn báo nháy, mở cửa buồng hút lấy cassette ra và mở của buồng vận hành rồi cho cassette vào. Đóng cả hai cửa và đợi.
+ Nhập thông tin cassette. Nhấn Save cassette data để xác nhận.
+ Nhập thống tin người bệnh. Nhấn save để xác nhận
IV. NHẬN ĐỊNH KẾT QUẢ
Nếu chủng nấm thuần máy Vitek sẽ cho ra kết quả một loại nấm
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
- Khi sử dụng card hết hạn máy sẽ báo lỗi, do đó phải kiểm tra hạn dùng của card trước khi tiến hành thí nghiệm
- Chủng nấm không thuần thì kết quả định danh cho nhiều đáp án, khi đó ta phải ria lại riêng rẽ để được chủng nấm thuần.
219. Vi nấm nuôi cấy, định danh và kháng thuốc hệ thống tự động
I. MỤC ĐÍCH, NGUYÊN LÝ
1. Mục đích
Định danh vi nấm gây bệnh và xác định nồng độ ức chế tối thiểu của thuốc kháng nấm
2. Nguyên lý
Định danh vi nấm gây bệnh dựa vào phương pháp đo mầu để nhận biết các tính chất sinh vật hóa học của vi nấm thông qua sự đổi mầu các giếng môi trường có sẵn trong Card.
Xác định nồng độ ức chế tối thiếu MIC của thuốc kháng nấm (cho các loại nấm men) bằng máy Vitek2 .
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện: Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh - Ký sinh trùng.
- Người nhận định và phê duyệt kết quả: Cán bộ có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh - Ký sinh trùng
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Máy ly tâm.
- Tủ ấm thường.
- Tủ an toàn sinh học cấp 2
- Máy định danh VITEK 2 - COMPACT và hệ thống máy tính, máy in, lưu điện.
- Máy đo độ đục.
- Dispencer (Dụng cụ bơm nước muối 0,45%)
- Pipet loại 200µl và 1000µl.
- Cassette có dán mã.
- Ống tube định danh 5ml.
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
| STT | Chi phí hóa chất, vật tư tiêu hao | ĐƠN VỊ | SỐ LƯỢNG |
| 36. | Lọ lấy bệnh phẩm | Lọ | 1,000 |
| 37. | Que cấy | Cái | 2,000 |
| 38. | Lam kính | Cái | 2,000 |
| 39. | Lá kính | Cái | 2,000 |
| 40. | Bông | Kg | 0,001 |
| 41. | Cồn 90 độ (vệ sinh dụng cụ) | ml | 10,000 |
| 42. | Nước muối sinh lý | ml | 5,000 |
| 43. | KOH 20 % | ml | 5,000 |
| 44. | Mực tàu | ml | 0,500 |
| 45. | Cồn 96 độ | ml | 5,000 |
| 46. | Sabouraud | Đĩa | 1,000 |
| 47. | Đầu côn 200µl | cái | 1,000 |
| 48. | Đầu côn 1000µl | cái | 1,000 |
| 49. | Đèn cồn | cái | 0,001 |
| 50. | Nước muối 0.45% | ml | 0,003 |
| 51. | Khay đựng bệnh phẩm | Cái | 1,000 |
| 52. | Card định danh nấm | Cái | 1,000 |
| 53. | Card kháng sinh đồ nấm | Cái | 1,00 |
| 54. | Axít ngâm lam | ml | 10,000 |
| 55. | Ống nghiệm thủy tinh | Ống | 1,000 |
| 56. | Mũ | Cái | 0,020 |
| 57. | Khẩu trang | Cái | 0,020 |
| 58. | Găng tay | Đôi | 3,000 |
| 59. | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 60. | Quần áo bảo hộ | Bộ | 0,001 |
| 61. | Bút viết kính | Cái | 0,020 |
| 62. | Bút bi | Cái | 0,010 |
| 63. | Bật lửa | Cái | 0,010 |
| 64. | Sổ lưu kết quả xét nghiệm | Quyển | 0,001 |
| 65. | Cồn sát trùng tay nhanh | ml | 1,000 |
| 66. | Dung dịch nước rửa tay | ml | 8,000 |
| 67. | Khăn lau tay | Cái | 0,010 |
| 68. | Giấy trả kết quả xét nghiệm | Tờ | 2,000 |
3. Bệnh phẩm
Máu, dịch, mủ, đờm, phân, nước tiểu, da, tóc, móng.
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu phiếu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
Theo đúng quy định của chuyên ngành Vi sinh( Tham khảo phụ lục 3).
2. Tiến hành kỹ thuật
2.1. Nuôi cấy nấm từ bệnh phẩm
Nuôi cấy nấm trên môi trường Sabouraud ủ ấm ở nhệt độ 30°C.
Theo dõi nuôi cấy:
+ Nếu trên đĩa sabouraud có khuẩn lạc nấm mọc, tiến hành làm tiêu bản soi trực tiếp bằng NaCl sinh lý để xác định nấm men hay nấm sợi.
+ Nếu trên đĩa thạch mọc nấm men lấy một vài khuẩn lạc nấm ria riêng rẽ, để được chủng nấm thuần chạy Vitek định danh và làm kháng sinh đồ nấm.
2.2. Cách tiến hành chạy Vitek
- Chuẩn bị Worksheet cho cassette (Điền các thông tin cần biết về người bệnh như tên, lab ID…)
- Chuẩn bị card định danh và card kháng sinh đồ.
- Chuẩn bị ống làm định danh với độ đục 1,8 - 2,2 McF.
- Chuẩn bị ống làm kháng sinh đồ: lấy 3ml saline vào ống nghiệm mới và đặt vào cassette. Dùng pipette hút 280 µl từ ống nghiệm làm định danh sang ống nghiệm làm kháng sinh đồ.
- Cho cassette vào buồng hút và nhấn Start Fill
- Khi đèn báo nháy, mở cửa buồng hút lấy cassette ra và mở của buồng vận hành rồi cho cassette vào. Đóng cả hai cửa và đợi.
- Nhập thông tin cassette. Nhấn Save cassette data để xác nhận.
- Nhập thống tin người bệnh. Nhấn save để xác nhận
IV. NHẬN ĐỊNH KẾT QUẢ
Nếu chủng nấm thuần máy Vitek sẽ cho ra kết quả một loại nấm và
kết quả kháng sinh đồ MIC cho 4 loại thuốc kháng nấm: Flucytosine, Fluconazole, Voriconazole, Amphotericin B.
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
Khi sử dụng card hết hạn máy sẽ báo lỗi, do đó phải kiểm tra hạn dùng của card trước khi tiến hành thí nghiệm.
Chủng nấm không thuần thì kết quả định danh cho nhiều đáp án, khi đó ta phải ria lại riêng rẽ để được chủng nấm thuần.
220. Vi nấm khẳng định (tham chiếu)
I. MỤC ĐÍCH, NGUYÊN LÝ
1. Mục đích
Xác định vi nấm gây bệnh
2. Nguyên lý
Nuôi cấy, định danh vi nấm dựa trên các tính chất về hình thể, cấu tạo, bắt màu và một số tính chất sinh vật, hóa học của nấm.
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện: Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh - Ký sinh trùng.
- Người nhận định và phê duyệt kết quả: Cán bộ có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh - Ký sinh trùng
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Kính hiển vi.
- Tủ an toàn sinh học cấp 2
- Máy ly tâm.
- Tủ ấm.
- Máy tính cài phần mềm đọc API( nếu có).
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
| STT | Chi phí hóa chất, vật tư tiêu hao | ĐƠN VỊ | SỐ LƯỢNG |
| 1 | Lọ lấy bệnh phẩm | Lọ | 1,000 |
| 2 | Que cấy | Cái | 2,000 |
| 3 | Lam kính | Cái | 2,000 |
| 4 | Lá kính | Cái | 2,000 |
| 5 | Lactophenol Coton Blue | ml | 1,000 |
| 6 | Nước muối sinh lý | ml | 5,000 |
| 7 | KOH 20 % | ml | 5,000 |
| 8 | Mực tàu | ml | 0,500 |
| 9 | Sabouraud | Đĩa | 1,000 |
| 10 | Candiselect | Đĩa | 0,500 |
| 11 | Giá đường API 20C AUX | Test | 1,000 |
| 12 | RAT | Ống | 1,000 |
| 13 | Bông | Kg | 0,001 |
| 14 | Cồn 90 độ (vệ sinh dụng cụ) | ml | 10,000 |
| 15 | Đèn cồn | Cái | 0,0001 |
| 16 | Panh | Cái | 0,0001 |
| 17 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 18 | Hộp vận chuyển bệnh phẩm | Cái | 0,0001 |
| 19 | Mũ | Cái | 0,020 |
| 20 | Khẩu trang | Cái | 0,020 |
| 21 | Găng tay | Đôi | 3,000 |
| 22 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 23 | Quần áo bảo hộ | Bộ | 0,001 |
| 24 | Axit ngâm lam | ml | 10,000 |
| 25 | Ống nghiệm thủy tinh | Ống | 1,000 |
| 26 | Bút viết kính | Cái | 0,00 |
| 27 | Bút bi | Cái | 0,010 |
| 28 | Bật lửa | Cái | 0,010 |
| 29 | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 30 | Cồn sát trùng tay nhanh | ml | 1,000 |
| 31 | Dung dịch nước rửa tay | ml | 8,000 |
| 32 | Khăn lau tay | Cái | 0,030 |
| 33 | Giấy trả kết quả xét nghiệm | Tờ | 2,000 |
3. Bệnh phẩm
Máu, dịch, mủ, đờm, phân, nước tiểu, da, tóc, móng.
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu phiếu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
Theo đúng quy định của chuyên ngành Vi sinh( Tham khảo phụ lục 5).
2. Tiến hành kỹ thuật
2.1. Nuôi cấy nấm trên môi trường Sabouraud ủ ấm ở nhiệt độ 30°C.
- Bệnh phẩm là da, tóc, móng: Cắt nhỏ bệnh phẩm cấy 6-8 điểm trên đĩa Sabouraud.
- Bệnh phẩm là các chất dịch: Hút 3-5 giọt dịch cấy dàn trên đĩa Sabouraud.
- Bệnh phẩm là nước tiểu: Sử dụng kỹ thuật cấy định lượng.
2.2. Soi tươi tìm nấm: Đánh giá sơ bộ.
2.3. Đọc kết quả hàng ngày.
IV. NHẬN ĐỊNH KẾT QUẢ
- Quan sát hình thể cấu tạo, tính chất, màu sắc khuẩn lạc.
+ Khuẩn lạc nấm men
Khuẩn lạc Candida có dạng trơn, nhẵn màu kem thường mọc nhanh sau 24giờ.
Khuẩn lạc Cryptococcus trơn nhẵn màu be( khô hơn so với nấm Candida) mọc chậm thường sau 48giờ.
+ Khuẩn lạc nấm mốc:
Aspergillus màu sắc khuẩn lạc khác nhau.
P. marneffei: sinh sắc tố màu đỏ nâu đến đỏ rượu vang khuếch tán vào môi trường khi nuôi cấy ở nhiệt độ phòng.
- Quan sát kính hiển vi sau cấy:
Tế bào nấm men hình tròn hoặc bầu dục ( đối với nấm Candida), nẩy chồi hoặc không. Cryptococcus thường hình tròn, kích thước lớn.
- Định danh loài nấm men:
+ Định danh sơ bộ 4 loài nấm men tiến hành nuôi cấy vào môi trường Candida select.
+ Định danh nấm men bằng bộ API 20C AUX. Trả kết quả loài nấm theo kết quả định danh.
- Định danh nấm mốc:
Làm tiêu bản bằng Lactophenol Coton Blue.
Dựa vào hình thái, màu sắc khuẩn lạc, dựa vào đặc điểm vi thể của từng loài Aspergillus để kết luận loài.
P. marneffei: Trên môi trường Sabouraud khuẩn lạc mọc nhanh, kiểu da lộn cho đến có dạng phủ đầy lông tơ, sinh sắc tố màu đỏ nâu đến đỏ rượu vang khuếch tán vào môi trường.
- Âm tính: Không thấy khuẩn lạc mọc sau 4 ngày trả kết quả sơ bộ: Âm tính.
- Các đĩa cấy được bỏ sau 7 ngày nuôi cấy.
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
Để định danh nấm men bằng bộ API 20C AUX cho kết quả chính xác khi lấy khuẩn lạc nấm phải thuần (khuẩn lạc riêng rẽ) tránh bị lẫn .
221. Vi nấm kháng thuốc định lượng (MIC) (Cho 1 loại kháng sinh)
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Xác định nồng độ ức chế tối thiếu MIC của thuốc kháng nấm
2. Nguyên lý
Xác định nồng độ ức chế tối thiếu MIC của thuốc kháng nấm (cho các loại nấm men) bằng máy làm kháng sinh đồ tự động Vitek2
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh - Ký sinh trùng.
- Người nhận định và phê duyệt kết quả: Cán bộ có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh - Ký sinh trùng
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Máy ly tâm
- Tủ ấm thường
- Tủ an toàn sinh học cấp 2
- Máy định danh VITEK 2 - COMPACT và hệ thống máy tính, máy in, lưu điện
- Máy đo độ đục.
- Dispencer (Dụng cụ bơm nước muối 0,45%)
- Pipet loại 200µl và 1000µl
- Cassette có dán mã.
- Ống tube định danh 5ml
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Lọ lấy bệnh phẩm | Lọ | 1,000 |
| 2 | Que cấy | Cái | 2,000 |
| 3 | Lam kính | Cái | 1,000 |
| 4 | Bông | Kg | 0,001 |
| 5 | Cồn 90 độ (vệ sinh dụng cụ) | ml | 10,000 |
| 6 | Nước muối sinh lý | ml | 5,000 |
| 7 | Thuốc nhuộm Fucsin | ml | 5,000 |
| 8 | Thuốc nhuộm tím Gentian | ml | 5,000 |
| 9 | Cồn 96 độ | ml | 5,000 |
| 10 | Lugol | ml | 5,000 |
| 11 | Sabouraud | Đĩa | 1,000 |
| 12 | Đầu côn 200µl | cái | 1,000 |
| 13 | Đầu côn 1000µl | cái | 1,000 |
| 14 | Đèn cồn | cái | 0,001 |
| 15 | Nước muối 0.45% | ml | 0,003 |
| 16 | Khay đựng bệnh phẩm | Cái | 1,000 |
| 17 | Card kháng sinh đồ cho nấm | Cái | 1,000 |
| 18 | Axít ngâm lam | ml | 10,000 |
| 19 | Ống nghiệm thủy tinh | Ống | 1,000 |
| 20 | Mũ | Cái | 0,020 |
| 21 | Khẩu trang | Cái | 0,020 |
| 22 | Găng tay | Đôi | 3,000 |
| 23 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 24 | Quần áo bảo hộ | Bộ | 0,001 |
| 25 | Bút viết kính | Cái | 0,020 |
| 26 | Bút bi | Cái | 0,010 |
| 27 | Bật lửa | Cái | 0,010 |
| 28 | Sổ lưu kết quả xét nghiệm | Quyển | 0,001 |
| 29 | Cồn sát trùng tay nhanh | ml | 1,000 |
| 30 | Dung dịch nước rửa tay | ml | 8,000 |
| 31 | Khăn lau tay | Cái | 0,010 |
| 32 | Giấy trả kết quả xét nghiệm | Tờ | 2,000 |
| 33 | QC (nếu thực hiện) * |
| 0,1 |
| 34 | EQAS (nếu thực hiện) * |
| 0,005 |
* Ghi chú:
- Chi phí nội kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình nội kiểm (QC) là 1/10 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lượng ≥ 10 mẫu cho 1 lần tiến hành kỹ thuật).
- Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/200 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 2 lần/1 năm).
3. Bệnh phẩm/chủng nấm
Chủng nấm đã được phân lập
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu phiếu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
Theo đúng quy định của chuyên ngành Ký sinh trùng( Xem Phụ lục 4).
2. Tiến hành kỹ thuật
- Chuẩn bị chủng nấm đã được phân lập, nuôi cấy đúng thời gian
- Chuẩn bị Worksheet cho cassette
- Chuẩn bị card: lấy card ra khỏi tủ lạnh và để ở nhiệt độ phòng khoảng 15 phút.
- Chuẩn bị ống như làm định danh với độ đục 2 McF.
- Chuẩn bị ống làm kháng sinh đồ: lấy 3ml saline vào ống nghiệm mới và đặt vào cassette. Dùng pipette hút 280 µl từ ống nghiệm làm định danh sang ống nghiệm làm kháng sinh đồ. Cho cassette vào buồng hút và nhấn Start Fill
- Mở cửa buồng hút lấy cassette ra và mở của buồng vận hành rồi cho cassette vào. Đóng cả hai cửa và đợi.
- Nhập thông tin cassette. Save cassette data để xác nhận.
- Nhập thông tin người bệnh. Nhấn save để xác nhận
IV. NHẬN ĐỊNH KẾT QUẢ
Nếu chủng nấm thuần máy Vitek sẽ cho ra kết quả kháng sinh đồ MIC cho 4 loại thuốc kháng nấm:Flucytosine, Fluconazole, Voriconazole, Amphotericin.
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
- Khi sử dụng card hết hạn máy sẽ báo lỗi , do đó phải kiểm tra hạn dùng của card trước khi tiến hành thí nghiệm
- Chủng nấm không thuần hoặc định danh không đúng chủng nấm thì kết quả sẽ không chính xác, khi đó ta phải ria lại riêng rẽ để được chủng nấm thuần
222. Vi nấm PCR
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Đinh danh vi nấm
2. Nguyên lý
Đinh danh vi nấm sử dụng cặp mồi đặc hiệu để xác định sự có mặt của gen đặc trưng cho vi nấm bằng kỹ thuật PCR
II. CHUẨN BỊ
1.Người thực hiện
- Người thực hiện: Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh - Ký sinh trùng.
- Người nhận định và phê duyệt kết quả: Cán bộ có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh - Ký sinh trùng
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Tủ an toàn sinh học cấp 2
- Máy PCR
- Máy điện di
- Máy đọc điện di
- Máy ly tâm 16000 vòng/phút
- Máy ủ nhiệt
- Máy vortex
- Pipette
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Bông | kg | 0,001 |
| 2 | Cồn | ml | 1,000 |
| 3 | Bơm kim tiêm | Cái | 1,000 |
| 4 | Panh | Cái | 0,0001 |
| 5 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 6 | Hộp vận chuyển bệnh phẩm | Test | 0,001 |
| 7 | Tube đựng bệnh phẩm | Cái | 2,000 |
| 8 | Găng không có bột (DNase-RNase free) | Cái | 0,500 |
| 9 | Sinh phẩm chẩn đoán | Test | 1,000 |
| 10 | Khấu hao sinh phẩm cho kiểm tra lại | Test | 1,350 |
| 11 | Kit tách chiết ADN từ nấm | Test | 2,350 |
| 12 | DNA marker | Bộ | 1,000 |
| 13 | Primer 1 | ml | 0,0001 |
| 14 | Primer 2 | ml | 0,0001 |
| 15 | Ống Eppendorf 1,5 ml | Tube | 3,000 |
| 16 | Ống Eppendorf 0,2 ml | Tube | 1,000 |
| 17 | Đầu côn 10 ul có lọc | Cái | 1,000 |
| 18 | Đầu côn 30 ul | Cái | 1,200 |
| 19 | Đầu côn 200 ul có lọc | Cái | 2,200 |
| 20 | Đầu côn 1 ml có lọc | Cái | 3,200 |
| 21 | Ethanol BDH | ml | 0,500 |
| 22 | Water-DEPC Treated | ml | 2,000 |
| 23 | Giấy thấm | Cuộn | 0,100 |
| 24 | Giấy xét nghiệm | Tờ | 2,000 |
| 25 | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 26 | Bút viết kính | Cái | 0,020 |
| 27 | Bút bi | Cái | 0,010 |
| 28 | Mũ | Cái | 0,020 |
| 29 | Khẩu trang | Cái | 0,020 |
| 30 | Găng tay | Đôi | 0,100 |
| 31 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 32 | Quần áo bảo hộ | Bộ | 0,005 |
| 33 | Dung dịch nước rửa tay | ml | 8,000 |
| 34 | Cồn sát trùng tay nhanh | ml | 1,000 |
| 35 | Dung dịch khử trùng | ml | 10,000 |
| 36 | Khăn lau tay | cái | 0,010 |
3. Bệnh phẩm
Chủng nấm đã được nuôi cấy thuần
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu phiếu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
Theo đúng quy định của chuyên ngành Vi sinh( Xem Phụ lục 5).
2. Tiến hành kỹ thuật
2.1. Tách chiết ADN tổng số
2.2. Thực hiện PCR
2.3. Điện di kiểm tra sản phẩm
2.4. Đánh giá và kết luận
IV. NHẬN ĐỊNH KẾT QUẢ
Sản phẩm PCR phải có một băng đặc hiệu duy nhất, rõ nét và không bị đứt gẫy và có kích thước tương ứng với thang ADN chuẩn.
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
Trong trường hợp không có sản phẩm PCR, cần phải kiểm tra lại quá trình tách chiết DNA tổng số, chất lượng của primers và master mix, và thực hiện lại toàn bộ xét nghiệm.
223. Vi nấm giải trình tự gene
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Định danh vi nấm
2. Nguyên lý
Định danh vi nấm bằng kỹ thuật xác định trình tự nucleotide của gen đặc trưng
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện: Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh - Ký sinh trùng.
- Người nhận định và phê duyệt kết quả: Cán bộ có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh - Ký sinh trùng.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Tủ an toàn Sinh học cấp 2
- Máy PCR
- Máy đọc điện di
- Máy giải trình tự gen
- Máy ly tâm 16000 vòng/phút
- Máy ủ nhiệt
- Máy vortex
- Micropipette
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Bông | kg | 0,001 |
| 2 | Cồn | ml | 1,000 |
| 3 | Bơm kim tiêm | Cái | 1,000 |
| 4 | Panh | Cái | 0,0001 |
| 5 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 6 | Hộp vận chuyển bệnh phẩm | Test | 0,001 |
| 7 | Tube đựng bệnh phẩm | Cái | 2,000 |
| 8 | Găng không có bột (DNase-RNase free) | Cái | 0,500 |
| 9 | Sinh phẩm chẩn đoán | Test | 1,000 |
| 10 | Khấu hao sinh phẩm cho kiểm tra lại | Test | 1,350 |
| 11 | Kit tách chiết ADN | Test | 2,350 |
| 12 | DNA marker | Bộ | 1,000 |
| 13 | Primer 1 (primer đặc hiệu) | ml | 0,0001 |
| 14 | Primer 2 (primer đặc hiệu) | ml | 0,0001 |
| 15 | Primer 3 (primer đặc hiệu) | ml | 0,0001 |
| 16 | Primer 4 (primer đặc hiệu) | ml | 0,0001 |
| 17 | Ống Eppendorf 1,5 ml | Tube | 3,000 |
| 18 | Ống Eppendorf 0,2 ml | Tube | 1,000 |
| 19 | Đầu côn 10 ul có lọc | Cái | 1,000 |
| 20 | Đầu côn 30 ul | Cái | 1,200 |
| 21 | Đầu côn 200 ul có lọc | Cái | 2,200 |
| 22 | Đầu côn 1 ml có lọc | Cái | 3,200 |
| 23 | Ethanol BDH | ml | 0,500 |
| 24 | Water-DEPC Treated | ml | 2,000 |
| 25 | Giấy thấm | Cuộn | 0,100 |
| 26 | Giấy xét nghiệm | Tờ | 2,000 |
| 27 | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 28 | Bút viết kính | Cái | 0,020 |
| 29 | Bút bi | Cái | 0,010 |
| 30 | Mũ | Cái | 0,020 |
| 31 | Khẩu trang | Cái | 0,020 |
| 32 | Găng tay | Đôi | 0,100 |
| 33 | Găng tay xử lý dụng cụ | Đôi | 0,020 |
| 34 | Quần áo bảo hộ | Bộ | 0,005 |
| 35 | Dung dịch nước rửa tay | ml | 8,000 |
| 36 | Cồn sát trùng tay nhanh | ml | 1,000 |
| 37 | Dung dịch khử trùng | ml | 10,000 |
| 38 | Khăn lau tay | cái | 0,010 |
3. Bệnh phẩm
Chủng nấm đã được nuôi cấy thuần.
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu phiếu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
1. Lấy bệnh phẩm
Theo đúng quy định của chuyên ngành Vi sinh (Xem Phụ lục 5).
2. Tiến hành kỹ thuật
2.1. Tách chiết DNA tổng số
2.2. Thực hiện PCR
2.3. Điện di kiểm tra sản phẩm
2.4. Giải trình tự gen
2.5. Kiểm tra và so sánh trình tự gen của nấm trên ngân hàng dữ liệu gen quốc tế
IV. NHẬN ĐỊNH KẾT QUẢ
Sản phẩm PCR phải có một băng đặc hiệu duy nhất, rõ nét và không bị đứt gẫy. Trình tự ADN của gen đích không bị nhiễu và phải có độ tương đồng ≥ 90 % mới có thể kết luận được loại nấm.
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
- Trong trường hợp không có sản phẩm PCR, cần phải kiểm tra lại quá trình tách chiết DNA tổng số, chất lượng của primers và master mix, và thực hiện lại toàn bộ xét nghiệm.
- Nếu trình tự DNA bị nhiễu cần phải kiểm tra lại độ đặc hiệu của sản phẩm PCR hoặc quá trình chạy PCR sequencing bị nhiễm chéo.
224. Vi sinh vật cấy kiểm tra không khí
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
- Đánh giá sự hiện diện của các vi sinh vật trong không khí về số lượng và chất lượng.
- Phát hiện nguồn nhiễm vi sinh vật gây nhiễm trùng bệnh viện có trong không khí.
2. Nguyên lý
Vi sinh vật được đánh giá về số lượng và chất lượng bằng phương pháp nuôi cấy kinh điển. Vi sinh vật được định danh dựa vào đặc điểm nuôi cấy, một số tính chất chuyển hóa, các đặc điểm về hình thái học và có thể kết hợp với tính chất kháng nguyên.
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện: Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Kính hiển vi quang học
- Tủ an toàn sinh học cấp 2
- Tủ ấm thường
- Tủ ấm CO2
- Máy tính cài phần mềm đọc API (nếu có)
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Lam kính | Cái | 2,000 |
| 2 | Que cấy | Cái | 2,000 |
| 3 | Dầu soi kính | ml | 1,000 |
| 4 | Cồn 96 độ lau kính | ml | 1,000 |
| 5 | Nước muối sinh lý | ml | 5,000 |
| 6 | Thuốc nhuộm đỏ Fucsin | ml | 5,000 |
| 7 | Thuốc nhuộm tím Gentian | ml | 5,000 |
| 8 | Cồn tẩy 96 độ | ml | 10,000 |
| 9 | Lugol | ml | 5,000 |
| 10 | Thuốc nhuộm Xanh Methylen | ml | 5,000 |
| 11 | Môi trường thạch máu thường | Đĩa | 5,000 |
| 12 | Môi trường Sabouraud | Đĩa | 5,000 |
| 13 | Giá đường API | Test | 1,000 |
| 14 | Bông | Kg | 0,001 |
| 15 | Cồn 90 độ (vệ sinh dụng cụ) | ml | 10,000 |
| 16 | Đèn cồn | Cái | 0,0001 |
| 17 | Panh | Cái | 0,0001 |
| 18 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 19 | Hộp vận chuyển bệnh phẩm | Cái | 0,0001 |
| 20 | Mũ | Cái | 0,02 |
| 21 | Khẩu trang | Cái | 0,02 |
| 22 | Găng tay | Đôi | 3,000 |
| 23 | Găng tay xử lý dụng cụ | Đôi | 0,02 |
| 24 | Quần áo | Bộ | 0,001 |
| 25 | Axits ngâm lam | ml | 10,000 |
| 26 | Ống nghiệm thủy tinh | Ống | 1,000 |
| 27 | Bút viết kính | Cái | 0,02 |
| 28 | Bút bi | Cái | 0,01 |
| 29 | Bật lửa | Cái | 0,01 |
| 30 | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 31 | Cồn sát trùng tay nhanh | ml | 1,000 |
| 32 | Dung dịch nước rửa tay | ml | 8,000 |
| 33 | Khăn lau tay | Cái | 0,03 |
| 34 | Giấy trả kết quả xét nghiệm | Tờ | 2,000 |
| 35 | QC |
| 0,1 |
| 36 | EQAS |
| 0,005 |
Môi trường nuôi cấy và hóa chất định danh vi khuẩn được tính trên tỉ lệ dương tính trung bình là 50 % cho các loại bệnh phẩm.
* Ghi chú:
- Chi phí nội kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình nội kiểm (QC) là 1/10 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lượng ≥ 10 mẫu cho 1 lần tiến hành kỹ thuật).
- Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/200 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 2 lần/1 năm).
3. Bệnh phẩm
- Không khí phòng mổ trước mổ, phòng vô trùng.
- Không khí phòng vô trùng.
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu phiếu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
Phương pháp lắng bụi trực tiếp của Koch
1. Thời điểm lấy mẫu
- Đối với phòng mổ mẫu không khí được lấy vào thời điểm trước khi mổ vào đầu buổi sang.
- Các mẫu không khí sẽ được lấy trong điều kiện hệ thống thông gió đang hoạt động bình thường.
2. Phương pháp lấy mẫu
Lấy mẫu tại 5 điểm: 1 ở giữa phòng và 4 ở góc phòng. Mỗi nơi đặt 1 đĩa thạch máu và 1 đĩa Sabauround đã được kiểm tra độ vô khuẩn. Đặt cách nền nhà 1m. Mở nắp đĩa 10 phút, sau đó đậy nắp đĩa.
3. Nuôi cấy và ủ ấm
- Thạch máu: 35-37 oC, 24-48 tiếng, khí trường thông thường.
- Thạch Sabauround: 22-25 oC, 7-10 ngày, khí trường thông thường
4. Đọc kết quả
Đếm số lượng khuẩn lạc mọc trên đĩa thạch. Đo đường kính của đĩa petri.
Đếm số lượng khuẩn lạc trên mỗi đĩa thạch. Tổng số VK/1m3 không khí được tính theo công thức của Omelanski V:
![]()
X: Tổng số vi khuẩn/m3 không khí
A: Số lượng vi khuẩn
S: Diện tích đĩa petri
k: Hệ số tính theo thời gian đặt hộp thạch (k = 2 nếu đặt 10 phút)
IV. NHẬN ĐỊNH KẾT QUẢ
Hiện nay chưa có một tiêu chuẩn qui định về số lượng VSV không khí của phòng mổ, phòng bệnh, phòng pha chế, cơ sở sản xuất. Tuy nhiên có thể khẳng định được rằng về nguyên tắc các phòng mổ trước mổ hoặc các phòng đòi hỏi vô khuẩn cao nhất thiết không còn sự hiện diện của bất cứ loài vi sinh vật nào. Tham khảo tiêu chuẩn đánh giá không khí phòng mổ, phòng vô trùng của CDC:
Đánh giá không khí sạch về số lượng:
+ Không khí rất sạch có dưới 500 VSV/1m3 không khí.
+ Không khí sạch có từ 500 - 1.000 VSV/1m3 không khí.
+ Không khí tương đối sạch có từ 1.000 - 2.000 VSV/1m3 không khí.
+ Không khí bẩn có trên 2.000 VSV/1m3 không khí.
+ Đánh giá không khí sạch về chất lượng:
+ Không có tụ cầu, liên cầu, nấm gây bệnh.
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
Mẫu không khí lấy, vận chuyển và bảo quản không đúng qui định có thể đưa đến kết quả âm tính hoặc dương tính giả.
Nếu kết quả cho thấy số lượng hoặc chất lượng vi sinh vật có trong không khí vượt quá tiêu chuẩn cho phép thì cần áp dụng các biện pháp can thiệp như làm sạch và khử trùng nền, tường, trần nhà, máy móc, trang thiết bị trong phòng...
225. Vi sinh vật cấy kiểm tra bàn tay
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Đánh giá sự hiện diện của các vi sinh vật trên bàn tay phẫu thuật viên sau khi rửa tay ngoại khoa.
2. Nguyên lý
Vi sinh vật được phát hiện bằng phương pháp nuôi cấy kinh điển. Vi sinh vật được định danh dựa vào đặc điểm nuôi cấy, một số tính chất chuyển hóa, các đặc điểm về hình thái học và có thể kết hợp với tính chất kháng nguyên.
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện: Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Kính hiển vi quang học
- Tủ an toàn sinh học cấp 2
- Tủ ấm thường
- Tủ ấm CO2
- Máy tính cài phần mềm đọc API (nếu có)
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Lam kính | Cái | 2,000 |
| 2 | Que cấy | Cái | 2,000 |
| 3 | Dầu soi kính | ml | 1,000 |
| 4 | Cồn 96 độ lau kính | ml | 1,000 |
| 5 | Nước muối sinh lý | ml | 5,000 |
| 6 | Thuốc nhuộm đỏ Fucsin | ml | 5,000 |
| 7 | Thuốc nhuộm tím Gentian | ml | 5,000 |
| 8 | Cồn tẩy 96 độ | ml | 10,000 |
| 9 | Lugol | ml | 5,000 |
| 10 | Thuốc nhuộm Xanh Methylen | ml | 5,000 |
| 11 | Canh thang hiếu khí 5 ml | ống | 1,000 |
| 12 | Canh thang yếm khí 5 ml | ống | 1,000 |
| 13 | Môi trường thạch máu thường | Đĩa | 1,000 |
| 14 | Môi trường Uri Select 4 | Đĩa | 1,000 |
| 15 | Panel định danh (ống Broth AST, ID, dd Indicator) | Test | 1,000 |
| 16 | Panel chứng | Bộ | 0,0002 |
| 17 | Bông | Kg | 0,001 |
| 18 | Cồn 90 độ (vệ sinh dụng cụ) | ml | 10,000 |
| 19 | Đèn cồn | Cái | 0,0001 |
| 20 | Panh | Cái | 0,0001 |
| 21 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 22 | Hộp vận chuyển bệnh phẩm | Cái | 0,0001 |
| 23 | Mũ | Cái | 0,02 |
| 24 | Khẩu trang | Cái | 0,02 |
| 25 | Găng tay | Đôi | 3,000 |
| 26 | Găng tay xử lý dụng cụ | Đôi | 0,02 |
| 27 | Quần áo | Bộ | 0,001 |
| 28 | Axits ngâm lam | ml | 10,000 |
| 29 | Ống nghiệm thủy tinh | Ống | 1,000 |
| 30 | Bút viết kính | Cái | 0,02 |
| 31 | Bút bi | Cái | 0,01 |
| 32 | Bật lửa | Cái | 0,01 |
| 33 | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 34 | Cồn sát trùng tay nhanh | ml | 1,000 |
| 35 | Dung dịch nước rửa tay | ml | 8,000 |
| 36 | Khăn lau tay | Cái | 0,03 |
| 37 | Giấy trả kết quả xét nghiệm | Tờ | 2,000 |
| 38 | QC |
| 0,1 |
| 39 | EQAS |
| 0,005 |
Môi trường nuôi cấy và hóa chất định danh vi khuẩn được tính trên tỉ lệ dương tính trung bình là 50 % cho các loại bệnh phẩm.
* Ghi chú:
- Chi phí nội kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình nội kiểm (QC) là 1/10 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lượng ≥ 10 mẫu cho 1 lần tiến hành kỹ thuật).
- Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/200 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 2 lần/1 năm).
3. Bệnh phẩm
Mẫu tay phẫu thuật viên sau rửa tay ngoại khoa, trước mổ.
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu phiếu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
Dùng 2 tăm bông vô khuẩn đã được làm ướt bằng nước muối sinh lý 0,9% quệt mạnh vào các vị trí đầu ngón trỏ, kẽ ngón trỏ và ngón giữa, lòng bàn tay. Cho 1 tăm bông vào ống canh thang thường và 1 tăm bông vào ống canh thang yếm khí, hơ qua ngọn lửa đèn cồn. Đậy nút ống.
2. Tiến hành kỹ thuật
- Nuôi cấy và ủ ấm ống canh thang ở 35- 37 oC, 16-18 tiếng, khí trường thường.
- Đánh giá độ đục của canh thang.
- Nếu canh thang đục thì nhuộm Gram để nhận định hình thể từng loại vi khuẩn.
- Định danh từng loại vi khuẩn dựa vào các tính chất sinh hóa vật học.
IV. NHẬN ĐỊNH KẾT QUẢ
- Dương tính: Có vi sinh vật trên bàn tay phẫu thuật viên. Phân lập và định danh được vi khuẩn gây bệnh. Trả kết quả tên vi khuẩn đến mức độ chi và/hoặc loài.
- Âm tính: Không tìm thấy hoặc không phân lập được vi sinh vật.
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
Lưu ý lấy mẫu cần tiến hành càng nhanh càng tốt để hạn chế tối đa sự ô nhiễm từ môi trường không khí. Mẫu bàn tay lấy, vận chuyển và bảo quản không đúng qui định có thể đưa đến kết quả âm tính hoặc dương tính giả.
Nếu kết quả xét nghiệm dương tính thì xem xét chất lượng nước rửa tay, quy trình rửa tay, khăn lau tay... để đưa ra những khuyến cáo thích hợp.
226. Vi sinh vật cấy kiểm tra dụng cụ đã tiệt trùng
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Phát hiện các vi sinh vật trên dụng cụ y tế đã tiệt trùng còn thời hạn sử dụng để đánh giá quá trình tiệt trùng.
2. Nguyên lý
Vi sinh vật được phát hiện bằng phương pháp nuôi cấy kinh điển. Vi sinh vật được định danh dựa vào đặc điểm nuôi cấy, một số tính chất chuyển hóa, các đặc điểm về hình thái học và có thể kết hợp với tính chất kháng nguyên.
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện: Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Kính hiển vi quang học
- Tủ an toàn sinh học cấp 2
- Tủ ấm thường
- Tủ ấm CO2
- Máy tính cài phần mềm đọc API (nếu có)
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Lam kính | Cái | 2,000 |
| 2 | Que cấy | Cái | 2,000 |
| 3 | Dầu soi kính | ml | 1,000 |
| 4 | Cồn 96 độ lau kính | ml | 1,000 |
| 5 | Nước muối sinh lý | ml | 5,000 |
| 6 | Thuốc nhuộm đỏ Fucsin | ml | 5,000 |
| 7 | Thuốc nhuộm tím Gentian | ml | 5,000 |
| 8 | Cồn tẩy 96 độ | ml | 10,000 |
| 9 | Lugol | ml | 5,000 |
| 10 | Thuốc nhuộm Xanh Methylen | ml | 5,000 |
| 11 | Canh thang hiếu khí 5 ml | ống | 1,000 |
| 12 | Canh thang yếm khí 5 ml | ống | 1,000 |
| 13 | Môi trường thạch máu thường | Đĩa | 1,000 |
| 14 | Môi trường Uri Select 4 | Đĩa | 1,000 |
| 15 | Panel định danh (ống Broth AST, ID, dd Indicator) | Test | 1,000 |
| 16 | Panel chứng | Bộ | 0,0002 |
| 17 | Bông | Kg | 0,001 |
| 18 | Cồn 90 độ (vệ sinh dụng cụ) | ml | 10,000 |
| 19 | Đèn cồn | Cái | 0,0001 |
| 20 | Panh | Cái | 0,0001 |
| 21 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 22 | Hộp vận chuyển bệnh phẩm | Cái | 0,0001 |
| 23 | Mũ | Cái | 0,02 |
| 24 | Khẩu trang | Cái | 0,02 |
| 25 | Găng tay | Đôi | 3,000 |
| 26 | Găng tay xử lý dụng cụ | Đôi | 0,02 |
| 27 | Quần áo | Bộ | 0,001 |
| 28 | Axits ngâm lam | ml | 10,000 |
| 29 | Ống nghiệm thủy tinh | Ống | 1,000 |
| 30 | Bút viết kính | Cái | 0,02 |
| 31 | Bút bi | Cái | 0,01 |
| 32 | Bật lửa | Cái | 0,01 |
| 33 | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 34 | Cồn sát trùng tay nhanh | ml | 1,000 |
| 35 | Dung dịch nước rửa tay | ml | 8 |
| 36 | Khăn lau tay | Cái | 0,03 |
| 37 | Giấy trả kết quả xét nghiệm | Tờ | 2,000 |
| 38 | QC |
| 0,1 |
| 39 | EQAS |
| 0,005 |
Môi trường nuôi cấy và hóa chất định danh vi khuẩn được tính trên tỉ lệ dương tính trung bình là 50 % cho các loại bệnh phẩm.
* Ghi chú:
- Chi phí nội kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình nội kiểm (QC) là 1/10 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lượng ≥ 10 mẫu cho 1 lần tiến hành kỹ thuật).
- Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/200 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 2 lần/1 năm).
3. Bệnh phẩm
Mẫu dụng cụ y tế đã tiệt trùng còn thời hạn sử dụng.
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu phiếu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
Dùng 2 que tăm bông vô khuẩn đã được làm ướt bằng nước muối sinh lý 0,9% quệt mạnh như nhau vào mỗi dụng cụ cần kiểm tra và trong thời gian 10 giây. Cho 1 tăm bông vào ống canh thang thường và 1 tăm bông vào ống canh thang yếm khí, hơ qua ngọn lửa đèn cồn. Đậy nút ống.
2. Tiến hành kỹ thuật
- Nuôi cấy và ủ ấm ống canh thang ở 35- 370 C, 16-18 tiếng, khí trường thường.
- Đánh giá độ đục của canh thang.
- Nếu canh thang đục thì nhuộm Gram để nhận định hình thể từng loại vi khuẩn.
- Định danh từng loại vi khuẩn dựa vào các tính chất sinh vật hóa học.
IV. NHẬN ĐỊNH KẾT QUẢ
- Dương tính: Có vi sinh vật trên dụng cụ y tế. Phân lập và định danh được vi khuẩn gây bệnh. Trả kết quả tên vi khuẩn đến mức độ chi và/hoặc loài.
- Âm tính: Không tìm thấy hoặc không phân lập được vi sinh vật.
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
Lưu ý lấy mẫu cần tiến hành càng nhanh càng tốt để hạn chế tối đa sự ô nhiễm từ môi trường không khí. Mẫu dụng cụ y tế lấy, vận chuyển và bảo quản không đúng qui định có thể đưa đến kết quả âm tính hoặc dương tính giả.
Nếu kết quả xét nghiệm dương tính thì xem xét các bước khử trùng, tiệt trùng và bảo quản dụng cụ y tế đã tiệt trùng còn thời hạn sử dụng để đưa ra những khuyến cáo thích hợp.
227. Vi sinh vật cấy kiểm tra bề mặt
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Đánh giá sự hiện diện của các vi sinh vật trên các bề mặt chăm sóc y tế.
2. Nguyên lý
Vi sinh vật được phát hiện bằng phương pháp nuôi cấy kinh điển. Vi sinh vật được định danh dựa vào đặc điểm nuôi cấy, một số tính chất chuyển hóa, các đặc điểm về hình thái học và có thể kết hợp với tính chất kháng nguyên.
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện: Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Kính hiển vi quang học
- Tủ an toàn sinh học cấp 2
- Tủ ấm thường
- Tủ ấm CO2
- Máy tính cài phần mềm đọc API (nếu có)
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Lam kính | Cái | 2,000 |
| 2 | Que cấy | Cái | 2,000 |
| 3 | Dầu soi kính | ml | 1,000 |
| 4 | Cồn 96 độ lau kính | ml | 1,000 |
| 5 | Nước muối sinh lý | ml | 5,000 |
| 6 | Thuốc nhuộm đỏ Fucsin | ml | 5,000 |
| 7 | Thuốc nhuộm tím Gentian | ml | 5,000 |
| 8 | Cồn tẩy 96 độ | ml | 10,000 |
| 9 | Lugol | ml | 5,000 |
| 10 | Thuốc nhuộm Xanh Methylen | ml | 5,000 |
| 11 | Canh thang hiếu khí 5 ml | ống | 1,000 |
| 12 | Canh thang yếm khí 5 ml | ống | 1,000 |
| 13 | Môi trường thạch máu thường | Đĩa | 1,000 |
| 14 | Môi trường Uri Select 4 | Đĩa | 1,000 |
| 15 | Panel định danh (ống Broth AST, ID, dd Indicator) | Test | 1,000 |
| 16 | Panel chứng | Bộ | 0,0002 |
| 17 | Bông | Kg | 0,001 |
| 18 | Cồn 90 độ (vệ sinh dụng cụ) | ml | 10,000 |
| 19 | Đèn cồn | Cái | 0,0001 |
| 20 | Panh | Cái | 0,0001 |
| 21 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 22 | Hộp vận chuyển bệnh phẩm | Cái | 0,0001 |
| 23 | Mũ | Cái | 0,02 |
| 24 | Khẩu trang | Cái | 0,02 |
| 25 | Găng tay | Đôi | 3,000 |
| 26 | Găng tay xử lý dụng cụ | Đôi | 0,02 |
| 27 | Quần áo | Bộ | 0,001 |
| 28 | Axits ngâm lam | ml | 10,000 |
| 29 | Ống nghiệm thủy tinh | Ống | 1,000 |
| 30 | Bút viết kính | Cái | 0,02 |
| 31 | Bút bi | Cái | 0,01 |
| 32 | Bật lửa | Cái | 0,01 |
| 33 | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 34 | Cồn sát trùng tay nhanh | ml | 1,000 |
| 35 | Dung dịch nước rửa tay | ml | 8,000 |
| 36 | Khăn lau tay | Cái | 0,03 |
| 37 | Giấy trả kết quả xét nghiệm | Tờ | 2,000 |
| 38 | QC |
| 0,1 |
| 39 | EQAS |
| 0,005 |
Môi trường nuôi cấy và hóa chất định danh vi khuẩn được tính trên tỉ lệ dương tính trung bình là 50 % cho các loại bệnh phẩm.
* Ghi chú:
- Chi phí nội kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình nội kiểm (QC) là 1/10 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lượng ≥ 10 mẫu cho 1 lần tiến hành kỹ thuật).
- Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/200 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 2 lần/1 năm).
3. Bệnh phẩm
Mẫu các bề mặt chăm sóc y tế.
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu phiếu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
Dùng 2 que tăm bông vô khuẩn đã được làm ướt bằng nước muối sinh lý 0,9% quệt mạnh như nhau vào mỗi bề mặt cần kiểm tra và trong thời gian 10 giây. Cho 1 tăm bông vào ống canh thang thường và 1 tăm bông vào ống canh thang yếm khí, hơ qua ngọn lửa đèn cồn. Đậy nút ống.
2. Tiến hành kỹ thuật
- Nuôi cấy và ủ ấm ống canh thang ở 35- 370 C, 16-18 tiếng, khí trường thường.
- Đánh giá độ đục của canh thang.
- Nếu canh thang đục thì nhuộm Gram để nhận định hình thể từng loại vi khuẩn.
- Định danh từng loại vi khuẩn dựa vào các tính chất sinh vật hóa học.
IV. NHẬN ĐỊNH KẾT QUẢ
- Dương tính: Có vi sinh vật trên bề mặt. Phân lập và định danh được vi khuẩn gây bệnh. Trả kết quả tên vi khuẩn đến mức độ chi và/hoặc loài.
- Âm tính: Không tìm thấy hoặc không phân lập được vi sinh vật.
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
Lưu ý lấy mẫu cần tiến hành càng nhanh càng tốt để hạn chế tối đa sự ô nhiễm từ môi trường không khí. Mẫu bề mặt lấy, vận chuyển và bảo quản không đúng qui định có thể đưa đến kết quả âm tính hoặc dương tính giả.
Nếu kết quả xét nghiệm dương tính thì xem xét quy trình khử trùng bề mặt, chất lượng nước sát trùng... để đưa ra những khuyến cáo thích hợp.
228. Vi sinh vật cấy kiểm tra nước sinh hoạt
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
- Đánh giá số lượng coliform.
- Phát hiện vi sinh vật gây hoặc có khả năng gây nhiễm trùng bệnh viện.
2. Nguyên lý
Vi sinh vật được phát hiện bằng phương pháp nuôi cấy kinh điển. Vi sinh vật được định danh dựa vào đặc điểm nuôi cấy, một số tính chất chuyển hóa, các đặc điểm về hình thái học và có thể kết hợp với tính chất kháng nguyên.
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện: Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Kính hiển vi quang học
- Tủ an toàn sinh học cấp 2
- Tủ ấm thường
- Tủ ấm CO2
- Máy tính cài phần mềm đọc API (nếu có)
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Lọ lấy bệnh phẩm | Lọ | 1,000 |
| 2 | Que cấy | Cái | 2,000 |
| 3 | Lam kính | Cái | 2,000 |
| 4 | Dầu soi kính | ml | 1,000 |
| 5 | Cồn 96 độ lau kính | ml | 1,000 |
| 6 | Nước muối sinh lý | ml | 5,000 |
| 7 | Thuốc nhuộm đỏ Fucsin | ml | 5,000 |
| 8 | Thuốc nhuộm tím Gentian | ml | 5,000 |
| 9 | Cồn tẩy 96 độ | ml | 10,000 |
| 10 | Lugol | ml | 5,000 |
| 11 | Thuốc nhuộm Xanh Methylen | ml | 5,000 |
| 12 | Canh thang Lactose đặc 10 ml | ống | 5,000 |
| 13 | Canh thang Lactose loãng 5 ml | ống | 2,000 |
| 14 | Môi trường thạch máu thường | Đĩa | 1,000 |
| 15 | Môi trường Uri select 4 | Đĩa | 1,000 |
| 16 | Panel định danh (ống Broth AST, ID, dd Indicator) | Test | 1,000 |
| 17 | Panel chứng | Bộ | 0,0002 |
| 18 | Bơm kim tiêm | Cái | 1,000 |
| 19 | Bông | Kg | 0,001 |
| 20 | Cồn 90 độ (vệ sinh dụng cụ) | ml | 10,000 |
| 21 | Đèn cồn | Cái | 0,0001 |
| 22 | Panh | Cái | 0,0001 |
| 23 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 24 | Hộp vận chuyển bệnh phẩm | Cái | 0,0001 |
| 25 | Mũ | Cái | 0,02 |
| 26 | Khẩu trang | Cái | 0,02 |
| 27 | Găng tay | Đôi | 3,000 |
| 28 | Găng tay xử lý dụng cụ | Đôi | 0,02 |
| 29 | Quần áo | Bộ | 0,001 |
| 30 | Axits ngâm lam | ml | 10,000 |
| 31 | Ống nghiệm thủy tinh | Ống | 1,000 |
| 32 | Bút viết kính | Cái | 0,02 |
| 33 | Bút bi | Cái | 0,01 |
| 34 | Bật lửa | Cái | 0,01 |
| 35 | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 36 | Cồn sát trùng tay nhanh | ml | 1,000 |
| 37 | Dung dịch nước rửa tay | ml | 8,000 |
| 38 | Khăn lau tay | Cái | 0,03 |
| 39 | Giấy trả kết quả xét nghiệm | Tờ | 2,000 |
| 40 | QC |
| 0,1 |
| 41 | EQAS |
| 0,005 |
Môi trường nuôi cấy và hóa chất định danh vi khuẩn được tính trên tỉ lệ dương tính trung bình là 50 % cho các loại bệnh phẩm.
* Ghi chú:
- Chi phí nội kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình nội kiểm (QC) là 1/10 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lượng ≥ 10 mẫu cho 1 lần tiến hành kỹ thuật).
- Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/200 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 2 lần/1 năm).
3. Bệnh phẩm
- Nước vô trùng rửa tay phẫu thuật, thủ thuật
- Nước sinh hoạt tại cơ sở y tế.
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu phiếu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
- Chọn địa điểm, số lượng và thời gian lấy mẫu có thể đánh giá chất lượng vi khuẩn toàn bộ hệ thống cung cấp nước từ đầu nguồn, giữa nguồn và cuối nguồn.
- Mở nước chảy hết cỡ 2-3 phút. Đóng vòi và khử khuẩn kỹ vòi bằng nhiệt độ bông cồn. Mở lại cho chảy mạnh 2-3 phút rồi điều chỉnh chảy vừa đủ để lấy mẫu, tránh không gây bắn ra ngoài. Dùng chai thuỷ tinh, nút mài vô khuẩn lấy 100 ml cho mục đích kiểm tra chất lượng về vi khuẩn học, 1000ml cho phân tích vi khuẩn gây bệnh. Lấy xong đốt miệng lọ để sát khuẩn và đậy kín ống nghiệm.
2. Tiến hành kỹ thuật
2.1. Định lượng coliform bằng kỹ thuật đếm số có xác xuất lớn nhất (MPN: Most probable number)
- Phương pháp cấy 7 ống:
+ 05 ống canh thang lactose đặc, mỗi ống cấy 10ml nước mẫu ở đậm độ nguyên chất.
+ 01 ống canh thang lactose loãng, cấy 1 ml nước nguyên chất.
+ 01 ống canh thang lactose loãng cấy 1ml nước ở đậm độ 10-1 hoặc 0,1 ml nước mẫu.
+ Hàng thứ 4, 5,... tiếp tục cấy đến đậm độ cần thiết.
- Nuôi cấy và ủ ấm: Ủ ấm 35-370C trong vòng 48 giờ ± 3, khí trường thường.
- Đọc kết quả: Những ống lên men lactose sinh acid, chuyển màu môi trường xanh sang vàng và sinh hơi trong ống sinh hơi được coi là dương tính (+). Ghi tất cả những ống (+) theo các đậm độ cấy:
+ 05 ống canh thang lactose đặc, cấy 10ml (+) ghi 5
+ 01 ống canh thang lactose loãng (+) ghi 1
+ 01 ống canh thang lactose loãng (+) ghi 1
Xác định dãy số phương pháp 7 ống là: 5 1 1
2.2. Phát hiện vi sinh vật gây bệnh:
- Nuôi cấy và ủ ấm canh thang ở 35-370C trong vòng 48 giờ ± 3, khí trường thường.
- Đánh giá độ đục của canh thang.
- Nếu canh thang đục thì nhuộm Gram để nhận định hình thể từng loại vi khuẩn.
- Định danh từng loại vi khuẩn dựa vào các tính chất sinh vật hóa học.
IV. NHẬN ĐỊNH KẾT QUẢ
1. Định lượng Coliform
Chọn các ống lên men lactose và sinh hơi trong canh thang để xác định được các dãy số. Tra bảng MPN cho phương pháp cấy 7 ống để tính số lượng vi khuẩn/100 ml nước.
2. Phát hiện vi sinh vật gây bệnh
- Dương tính: Có vi sinh vật gây bệnh trong nước sinh hoạt. Phân lập và định danh được vi khuẩn gây bệnh. Trả kết quả tên vi khuẩn đến mức độ chi và/hoặc loài.
- Âm tính: Không tìm thấy hoặc không phân lập được vi sinh vật.
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
Coliform là trực khuẩn Gram âm, hiếu khí, kỵ khí tuỳ tiện, không nha bào, có khả năng lên men lactose sinh acid, sinh hơi ở 35- 37oC trong vòng 48 giờ. Chúng được tìm thấy trong phân người, động vật và cả trong môi trường như đất, nước, rau quả… Coliform được coi là chỉ điểm vệ sinh quan trọng. Nồng độ coliform trong nước chứng minh rằng biện pháp khử khuẩn chưa đạt hiệu quả.
Khi xét nghiệm mẫu nước có vi khuẩn vượt quá tiêu chuẩn qui định cần áp dụng một số biện pháp can thiệp tạm thời cho đến khi nguồn nước được xử lý.
229. Vi sinh vật cấy kiểm tra nước thải
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Đánh giá số lượng coliform có trong nước thải sau xử lý tại cơ sở y tế.
2. Nguyên lý
Vi sinh vật được phát hiện bằng phương pháp nuôi cấy kinh điển. Vi sinh vật được định danh dựa vào đặc điểm nuôi cấy, một số tính chất chuyển hóa, các đặc điểm về hình thái học và có thể kết hợp với tính chất kháng nguyên.
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện: Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Kính hiển vi quang học
- Tủ an toàn sinh học cấp 2
- Tủ ấm thường
- Tủ ấm CO2
- Máy tính cài phần mềm đọc API (nếu có)
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Lọ lấy bệnh phẩm | Lọ | 1,000 |
| 2 | Que cấy | Cái | 2,000 |
| 3 | Lam kính | Cái | 2,000 |
| 4 | Dầu soi kính | ml | 1,000 |
| 5 | Cồn 96 độ lau kính | ml | 1,000 |
| 6 | Nước muối sinh lý | ml | 5,000 |
| 7 | Thuốc nhuộm đỏ Fucsin | ml | 5,000 |
| 8 | Thuốc nhuộm tím Gentian | ml | 5,000 |
| 9 | Cồn tẩy 96 độ | ml | 10,000 |
| 10 | Lugol | ml | 5,000 |
| 11 | Nước muối sinh lý 5ml | ống | 9,000 |
| 12 | Thuốc nhuộm Xanh Methylen | ml | 5,000 |
| 13 | Canh thang Lactose đặc 10 ml | ống | 3,000 |
| 14 | Canh thang Lactose loãng 5 ml | ống | 24,000 |
| 15 | Môi trường thạch máu thường | Đĩa | 1,000 |
| 16 | Môi trường Uri select 4 | Đĩa | 1,000 |
| 17 | Panel định danh (ống Broth AST, ID, dd Indicator) | Test | 1,000 |
| 18 | Panel chứng | Bộ | 0,0002 |
| 19 | Bơm kim tiêm | Cái | 1,000 |
| 20 | Bông | Kg | 0,001 |
| 21 | Cồn 90 độ (vệ sinh dụng cụ) | ml | 10,000 |
| 22 | Đèn cồn | Cái | 0,0001 |
| 23 | Panh | Cái | 0,0001 |
| 24 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 25 | Hộp vận chuyển bệnh phẩm | Cái | 0,0001 |
| 26 | Mũ | Cái | 0,02 |
| 27 | Khẩu trang | Cái | 0,02 |
| 28 | Găng tay | Đôi | 3,000 |
| 29 | Găng tay xử lý dụng cụ | Đôi | 0,02 |
| 30 | Quần áo | Bộ | 0,001 |
| 31 | Axits ngâm lam | ml | 10,000 |
| 32 | Ống nghiệm thủy tinh | Ống | 1,000 |
| 33 | Bút viết kính | Cái | 0,02 |
| 34 | Bút bi | Cái | 0,01 |
| 35 | Bật lửa | Cái | 0,01 |
| 36 | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 37 | Cồn sát trùng tay nhanh | ml | 1,000 |
| 38 | Dung dịch nước rửa tay | ml | 8,000 |
| 39 | Khăn lau tay | Cái | 0,03 |
| 40 | Giấy trả kết quả xét nghiệm | Tờ | 2,000 |
| 41 | QC |
| 0,1 |
| 42 | EQAS |
| 0,005 |
Môi trường nuôi cấy và hóa chất định danh vi khuẩn được tính trên tỉ lệ dương tính trung bình là 50 % cho các loại bệnh phẩm.
* Ghi chú:
- Chi phí nội kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình nội kiểm (QC) là 1/10 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lượng ≥ 10 mẫu cho 1 lần tiến hành kỹ thuật).
- Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/200 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 2 lần/1 năm).
3. Bệnh phẩm
Nước thải sau xử lý tại cơ sở y tế.
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu phiếu yêu cầu
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
- Chọn địa điểm, số lượng mẫu và thời gian lấy mẫu có thể đánh giá chất lượng vi khuẩn học toàn bộ nguồn nước thải bệnh viện. Thường lấy tại bể tập trung toàn bệnh viện để đánh giá ô nhiễm vi sinh từ đầu nguồn. Lấy mẫu sau từng giai đoạn xử lý và đầu ra sau xử lý. Vì lượng nước thải không đều, nên lấy mẫu vào nhiều thời điểm trong ngày rồi trộn các mẫu lại thành một mẫu gọi là mẫu trộn.
- Dùng quang chai đã khử khuẩn bằng nhiệt độ bông cồn. Dìm quang chai sâu cách mặt nước 30 cm, khi nước gần đầy chai thì kéo lên để lại trống chừng khoảng 2 - 3 cm từ mặt dưới nút chai trở xuống để tránh nhiễm khuẩn từ miệng nút chai và để khi phân tích lắc trộn mẫu được dễ dàng. Dùng chai thuỷ tinh, nút mài vô khuẩn lấy 100 ml cho mục đích kiểm tra chất lượng về vi khuẩn học, 1.000ml cho phân tích vi khuẩn gây bệnh. Lấy xong đốt miệng lọ để sát khuẩn và đậy kín ống nghiệm. Khử khuẩn tại miệng chai nút chai, đóng nút nhanh và bao lại miệng chai cẩn thận.
- Nếu không có quang chai, phải rửa tay xà phòng sạch sẽ, lau cồn khử khuẩn tay. Sau đó cầm gần đáy chai, dìm chai xuống nước, đặt chai nằm ngang hơi chúc đầu xuống độ sâu khoảng 15-20 cm để ngang chai tạo dòng nước tự chảy vào miệng chai, tránh lấy nước trên bề mặt. Các thao tác khác thực hiện như đã mô tả ở trên.
- Trường hợp không lấy được trực tiếp, phải dùng xô, gầu múc, cần đổ bỏ 3 lần, lần thứ tư mới rót nhẹ nhàng vào chai sao cho tay không làm nhiễm bẩn mẫu nước.
2. Tiến hành kỹ thuật dịnh lượng coliform bằng kỹ thuật đếm số có xác xuất lớn nhất (MPN: Most probable number):
Phương pháp cấy nhiều ống:
- Chuẩn bị: Có thể xếp 5 hàng, mỗi hàng 3 ống hoặc 5 ống, hàng đầu là những ống canh thang lactose đặc và 2 hàng sau là những ống canh thang lactose loãng.
- Pha loãng: hút vô khuẩn 1ml mẫu nước nguyên cho vào nước muối sinh lý 0,85% chứa 9 ml để có đậm độ pha loãng 10-1. Hút trộn lên xuống 20 - 25 lần để trộn đều mẫu với nước muối. Từ đậm độ này, lại hút 1ml chuyển sang ống nước muối thứ 2, có đậm độ pha loãng10-2. Cứ như thế pha loãng tới đậm độ cần thiết. Mỗi đậm độ thay pipet mới.
+ Hàng thứ nhất xếp 3 ống canh thang lactose đặc, cấy mỗi ống 10 ml nước mẫu.
+ Hàng thứ 2 xếp 3 ống canh thang lactose loãng, cấy mỗi ống 1 ml mẫu nước.
+ Hàng thứ 3 xếp 3 ống canh thang lactose loãng, cấy mỗi ống 1 ml mẫu nước đậm độ 10-1.
+ Hàng thứ 4, 5,... tiếp tục cấy đến đậm độ cần thiết.
- Nuôi cấy và ủ ấm 35-370C trong vòng 48 giờ ± 3, khí trường thường.
- Đọc kết quả: Những ống lên men lactose sinh acid, chuyển màu môi trường xanh sang vàng và sinh hơi trong ống sinh hơi được coi là dương tính (+). Ghi tất cả những ống (+) theo các đậm độ cấy:
+3 ống canh thang lactose đặc, cấy 10 ml, (+) cả 3 ghi 3
+3 ống canh thang lactose loãng, cấy 1 ml nước (+) cả 3 ghi 3
+3 ống canh thang lactose, loãng, cấy 1 ml nước 10-1 (+) cả 3 ghi 3
+3 ống canh thang lactose loãng, cấy 1 ml nước 10-2 , chỉ (+) 2 ghi 2
+3 ống canh thang lactose loãng, cấy 1 ml nước 10-3, (-) cả 3 ghi 0
Xác định dãy số phương pháp nhiều ống là: 3 3 3 2 0
IV. NHẬN ĐỊNH KẾT QUẢ
Định lượng Coliform: Chọn các ống lên men lactose và sinh hơi trong canh thang để xác định được các dãy số. Tra bảng MPN cho phương pháp cấy 9 ống hoặc 15 ống để tính số lượng vi khuẩn/100 ml nước.
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
Nếu xét nghiệm mẫu nước thải có số lượng coliform vượt quá tiêu chuẩn qui định cần áp dụng một số biện pháp can thiệp tạm thời cho đến khi nguồn nước được xử lý.
230. Vi khuẩn kháng thuốc - Phát hiện người mang
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Phát hiện chủng vi khuẩn kháng thuốc cư trú ở người.
2. Nguyên lý
Ở một số người bệnh hoặc nhân viên y tế có thể mang các chủng vi khuẩn kháng thuốc nhưng không gây bệnh cảnh nhiễm trùng. Tuy nhiên, đây lại có thể là nguồn gốc gây nhiễm trùng bệnh viện. Sàng lọc phát hiện người mang chủng vi khuẩn kháng thuốc có ý nghĩa trong chiến lược kiểm soát nhiễm trùng bệnh viện.
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện: Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1. Trang thiết bị
- Kính hiển vi quang học
- Tủ ấm thường
- Tủ ấm CO2
- Hệ thống định danh tự động
- Máy đo độ đục
- Lò hấp ướt
- Tủ an toàn sinh học 2
- Máy lắc
- Ống độ đục chuẩn McFarland 0.5
2.2. Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Lọ lấy bệnh phẩm | Lọ | 1,000 |
| 2 | Que cấy | Cái | 2,000 |
| 3 | Lam kính | Cái | 2,000 |
| 4 | Dầu soi kính | ml | 1,000 |
| 5 | Xylen lau kính | ml | 1,000 |
| 6 | Nước muối sinh lý | ml | 5,000 |
| 7 | Thuốc nhuộm đỏ Fucsin | ml | 5,000 |
| 8 | Thuốc nhuộm tím Gentian | ml | 5,000 |
| 9 | Cồn tẩy 96 độ | ml | 10,000 |
| 10 | Lugol | ml | 5,000 |
| 11 | Thuốc nhuộm Xanh Methylen | ml | 5,000 |
| 12 | Môi trường thạch máu thường | Đĩa | 1,000 |
| 13 | Môi trường thạch socola | Đĩa | 1,000 |
| 14 | Dải giấy kháng sinh | Cái | 1,000 |
| 15 | Thạch Muller Hinton | Đĩa | 1,000 |
| 16 | ID card | Test | 1,000 |
| 17 | AST card | Test | 1,000 |
| 18 | Dung dịch 0.45% Saline | ml | 5,000 |
| 19 | Unsensitized | Cái | 2,000 |
| 20 | Bơm kim tiêm | Cái | 1,000 |
| 21 | Bông | Kg | 0,001 |
| 22 | Cồn 90 độ (vệ sinh dụng cụ) | ml | 10,000 |
| 23 | Đèn cồn | Cái | 0,0001 |
| 24 | Panh | Cái | 0,0001 |
| 25 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 26 | Hộp vận chuyển bệnh phẩm | Cái | 0,0001 |
| 27 | Mũ | Cái | 0,02 |
| 28 | Khẩu trang | Cái | 0,02 |
| 29 | Găng tay | Đôi | 3,000 |
| 30 | Găng tay xử lý dụng cụ | Đôi | 0,02 |
| 31 | Quần áo | Bộ | 0,001 |
| 32 | Axits ngâm lam | ml | 10,000 |
| 33 | Ống nghiệm thủy tinh | Ống | 1,000 |
| 34 | Bút viết kính | Cái | 0,02 |
| 35 | Bút bi | Cái | 0,01 |
| 36 | Bật lửa | Cái | 0,01 |
| 37 | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 38 | Cồn sát trùng tay nhanh | ml | 1,000 |
| 39 | Dung dịch nước rửa tay | ml | 8,000 |
| 40 | Khăn lau tay | Cái | 0,03 |
| 41 | Giấy trả kết quả xét nghiệm | Tờ | 2,000 |
| 42 | QC |
| 0,1 |
| 43 | EQAS |
| 0,005 |
* Ghi chú:
- Chi phí nội kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình nội kiểm (QC) là 1/10 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lượng ≥ 10 mẫu cho 1 lần tiến hành kỹ thuật).
- Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/200 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 2 lần/1 năm).
3. Bệnh phẩm
Bệnh phẩm lấy ở ngoài da, niêm mạc bằng tăm bông hoặc tăm bông thấm nước muối sinh lý vô trùng.
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu phiếu yêu cầu.
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
Theo đúng quy định của chuyên ngành Vi sinh (Xem phụ lục 1).
2. Tiến hành kỹ thuật
- Cấy bệnh phẩm lên môi trường phân lập và môi trường canh thang tăng sinh
- Ủ ấm qua đêm
- Bắt khuẩn lạc nghi ngờ
- Nhuộm soi, thử nghiệm các tính chất sinh vật hóa học đơn giản và định danh bằng hệ thống tự động.
- Thử nghiệm kháng sinh đồ khoanh giấy khuếch tán
- Thử nghiệm kháng sinh đồ MIC.
IV. NHẬN ĐỊNH KẾT QUẢ
- Dương tính: Phân lập và định danh được vi khuẩn kháng thuốc liên quan đến nguồn gốc nhiễm trùng bệnh viện như MRSA, VRE... Trả kết quả tên vi khuẩn đến mức độ loài và đặc tính kháng thuốc của vi khuẩn.
- Âm tính: Không tìm thấy hoặc không phân lập được vi khuẩn gây bệnh
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
Quy trình này chỉ áp dụng tìm vi khuẩn hiếu kỵ khí tùy tiện dễ nuôi cấy, không áp dụng cho các vi khuẩn kỵ khí bắt buộc. Kết quả âm tính không có nghĩa là không có vi khuẩn gây bệnh trong bệnh phẩm mà là không tìm thấy căn nguyên vi khuẩn gây bệnh có thể phân lập được bằng quy trình nuôi cấy này.
Bệnh phẩm lấy, vận chuyển và bảo quản không đúng yêu cầu có thể đưa đến kết quả âm tính hoặc dương tính giả (Xem Phụ lục 5).
231. Vi khuẩn gây nhiễm trùng bệnh viện - Phát hiện nguồn nhiễm
I. MỤC ĐÍCH VÀ NGUYÊN LÝ
1. Mục đích
Phát hiện nguồn gốc chủng vi khuẩn gây thường gây nhiễm trùng bệnh viện cư trú.
2. Nguyên lý
Ở một số người bệnh, nhân viên y tế, vật dụng y tế hoặc các yếu tố trong môi trường bệnh viện có thể chứa đựng các chủng vi khuẩn có khả năng gây nhiễm trùng bệnh viện. Sàng lọc phát hiện nguồn mang các chủng vi khuẩn này có ý nghĩa trong chiến lược kiểm soát nhiễm trùng bệnh viện.
II. CHUẨN BỊ
1. Người thực hiện
- Người thực hiện: Cán bộ xét nghiệm đã được đào tạo và có chứng chỉ hoặc chứng nhận về chuyên ngành Vi sinh.
- Người nhận định và phê duyệt kết quả: cán bộ xét nghiệm có trình độ đại học hoặc sau đại học về chuyên ngành Vi sinh.
2. Phương tiện, hóa chất
Phương tiện, hóa chất như ví dụ dưới đây hoặc tương đương.
2.1 Trang thiết bị
- Kính hiển vi quang học
- Tủ ấm thường
- Tủ ấm CO2
- Hệ thống định danh tự động
- Máy đo độ đục
- Lò hấp ướt
- Tủ an toàn sinh học 2
2.2 Dụng cụ, hóa chất và vật tư tiêu hao (bao gồm nội kiểm, ngoại kiểm)
| STT | Chi phí hóa chất, vật tư tiêu hao | Đơn vị | Số lượng |
| 1 | Lọ lấy bệnh phẩm | Lọ | 1,000 |
| 2 | Que cấy | Cái | 2,000 |
| 3 | Lam kính | Cái | 2,000 |
| 4 | Dầu soi kính | ml | 1,000 |
| 5 | Xylen lau kính | ml | 1,000 |
| 6 | Nước muối sinh lý | ml | 5,000 |
| 7 | Thuốc nhuộm đỏ Fucsin | ml | 5,000 |
| 8 | Thuốc nhuộm tím Gentian | ml | 5,000 |
| 9 | Cồn tẩy 96 độ | ml | 10,000 |
| 10 | Lugol | ml | 5,000 |
| 11 | Thuốc nhuộm Xanh Methylen | ml | 5,000 |
| 12 | Môi trường thạch máu thường | Đĩa | 1,000 |
| 13 | Môi trường thạch socola | Đĩa | 1,000 |
| 14 | ID card | Test | 1,000 |
| 15 | AST card | Test | 1,000 |
| 16 | Dung dịch 0.45% Saline | ml | 5,000 |
| 17 | Unsensitized | Cái | 2,000 |
| 18 | Bơm kim tiêm | Cái | 1,000 |
| 19 | Bông | Kg | 0,001 |
| 20 | Cồn 90 độ (vệ sinh dụng cụ) | ml | 10,000 |
| 21 | Đèn cồn | Cái | 0,0001 |
| 22 | Panh | Cái | 0,0001 |
| 23 | Khay đựng bệnh phẩm | Cái | 0,0001 |
| 24 | Hộp vận chuyển bệnh phẩm | Cái | 0,0001 |
| 25 | Mũ | Cái | 0,02 |
| 26 | Khẩu trang | Cái | 0,02 |
| 27 | Găng tay | Đôi | 3,000 |
| 28 | Găng tay xử lý dụng cụ | Đôi | 0,02 |
| 29 | Quần áo | Bộ | 0,001 |
| 30 | Axits ngâm lam | ml | 10,000 |
| 31 | Ống nghiệm thủy tinh | Ống | 1,000 |
| 32 | Bút viết kính | Cái | 0,02 |
| 33 | Bút bi | Cái | 0,01 |
| 34 | Bật lửa | Cái | 0,01 |
| 35 | Sổ lưu kết quả xét nghiệm | Tờ | 0,001 |
| 36 | Cồn sát trùng tay nhanh | ml | 1,000 |
| 37 | Dung dịch nước rửa tay | ml | 8,000 |
| 38 | Khăn lau tay | Cái | 0,03 |
| 39 | Giấy trả kết quả xét nghiệm | Tờ | 2,000 |
| 40 | QC |
| 0,1 |
| 41 | EQAS |
| 0,005 |
Môi trường nuôi cấy được tính trên tỉ lệ dương là 50 % so với tổng số bệnh phẩm gửi xét nghiệm.
Bộ Panel sử dụng để kiểm chuẩn được tính trên 5000 Test/1 năm.
* Ghi chú:
- Chi phí nội kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình nội kiểm (QC) là 1/10 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lượng ≥ 10 mẫu cho 1 lần tiến hành kỹ thuật).
- Chi phí ngoại kiểm cho quy trình kỹ thuật được tính cụ thể theo Chương trình ngoại kiểm (EQAS) là 1/200 tổng chi phí dụng cụ, hóa chất, vật tư tiêu hao (với số lần ngoại kiểm trung bình 2 lần/1 năm).
3. Bệnh phẩm
Bệnh phẩm lấy ở các vị trí, các nguồn nghi ngờ có mang vi khuẩn gây nhiễm trùng bệnh viện.
4. Phiếu xét nghiệm
Điền đầy đủ thông tin theo mẫu phiếu yêu cầu.
III. CÁC BƯỚC TIẾN HÀNH
Các bước tiến hành thực hiện theo phương tiện, hóa chất được ví dụ ở trên.
1. Lấy bệnh phẩm
Theo đúng quy định của chuyên ngành Vi sinh (Xem phụ lục 1).
2. Tiến hành kỹ thuật
- Cấy bệnh phẩm lên môi trường phân lập và môi trường canh thang tăng sinh
- Ủ ấm qua đêm
- Bắt khuẩn lạc nghi ngờ
- Nhuộm soi, thử nghiệm các tính chất sinh vật hóa học đơn giản và định danh bằng hệ thống tự động.
IV. NHẬN ĐỊNH KẾT QUẢ
- Dương tính: Phân lập và định danh được vi khuẩn có khả năng gây nhiễm trùng bệnh viện. Trả kết quả tên vi khuẩn đến mức độ chi và/hoặc loài.
- Âm tính: Không tìm thấy hoặc không phân lập được vi khuẩn nghi ngờ gây nhiễm trùng bệnh viện.
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
Quy trình này chỉ áp dụng tìm vi khuẩn hiếu kỵ khí tùy tiện dễ nuôi cấy, không áp dụng cho các vi khuẩn kỵ khí bắt buộc. Kết quả âm tính không có nghĩa là không có vi khuẩn gây nhiễm trùng bệnh viện trong bệnh phẩm mà là không tìm thấy căn nguyên vi khuẩn gây nhiễm trùng bệnh viện có thể phân lập được bằng quy trình nuôi cấy này.
Bệnh phẩm lấy, vận chuyển và bảo quản không đúng yêu cầu có thể đưa đến kết quả âm tính hoặc dương tính giả (Xem Phụ lục 5).
- 1Quyết định 3805/QĐ-BYT năm 2014 về tài liệu Hướng dẫn quy trình, kỹ thuật Nội khoa, chuyên ngành Tiêu hóa do Bộ trưởng Bộ Y tế ban hành
- 2Quyết định 3154/QĐ-BYT năm 2014 về tài liệu "Hướng dẫn quy trình kỹ thuật Nội khoa, chuyên ngành Thần Kinh" do Bộ trưởng Bộ Y tế ban hành
- 3Quyết định 4420/QĐ-BYT năm 2016 về tài liệu Hướng dẫn quy trình kỹ thuật Ngoại khoa, chuyên khoa Phẫu thuật Gan Mật do Bộ trưởng Bộ Y tế ban hành
- 4Quyết định 6769/QĐ-BYT năm 2018 về tài liệu Hướng dẫn quy trình kỹ thuật chuyên ngành Vi sinh do Bộ trưởng Bộ Y tế ban hành
- 5Quyết định 3486/QĐ-BYT năm 2016 về thành lập Ban Biên soạn tài liệu "Kỹ thuật vi sinh lâm sàng" do Bộ trưởng Bộ Y tế ban hành
- 6Quyết định 1539/QĐ-BYT năm 2017 về tài liệu chuyên môn “Hướng dẫn thực hành kỹ thuật vi sinh lâm sàng" do Bộ trưởng Bộ Y tế ban hành
- 1Luật khám bệnh, chữa bệnh năm 2009
- 2Nghị định 63/2012/NĐ-CP quy định chức năng, nhiệm vụ, quyền hạn và cơ cấu tổ chức của Bộ Y tế
- 3Quyết định 3805/QĐ-BYT năm 2014 về tài liệu Hướng dẫn quy trình, kỹ thuật Nội khoa, chuyên ngành Tiêu hóa do Bộ trưởng Bộ Y tế ban hành
- 4Quyết định 3154/QĐ-BYT năm 2014 về tài liệu "Hướng dẫn quy trình kỹ thuật Nội khoa, chuyên ngành Thần Kinh" do Bộ trưởng Bộ Y tế ban hành
- 5Quyết định 4420/QĐ-BYT năm 2016 về tài liệu Hướng dẫn quy trình kỹ thuật Ngoại khoa, chuyên khoa Phẫu thuật Gan Mật do Bộ trưởng Bộ Y tế ban hành
- 6Quyết định 6769/QĐ-BYT năm 2018 về tài liệu Hướng dẫn quy trình kỹ thuật chuyên ngành Vi sinh do Bộ trưởng Bộ Y tế ban hành
- 7Quyết định 3486/QĐ-BYT năm 2016 về thành lập Ban Biên soạn tài liệu "Kỹ thuật vi sinh lâm sàng" do Bộ trưởng Bộ Y tế ban hành
- 8Quyết định 1539/QĐ-BYT năm 2017 về tài liệu chuyên môn “Hướng dẫn thực hành kỹ thuật vi sinh lâm sàng" do Bộ trưởng Bộ Y tế ban hành
Quyết định 26/QĐ-BYT năm 2013 về tài liệu Hướng dẫn quy trình kỹ thuật chuyên ngành Vi sinh Y học do Bộ trưởng Bộ Y tế ban hành
- Số hiệu: 26/QĐ-BYT
- Loại văn bản: Quyết định
- Ngày ban hành: 03/01/2013
- Nơi ban hành: Bộ Y tế
- Người ký: Nguyễn Thị Xuyên
- Ngày công báo: Đang cập nhật
- Số công báo: Đang cập nhật
- Ngày hiệu lực: 03/01/2013
- Tình trạng hiệu lực: Kiểm tra



