Để sử dụng toàn bộ tiện ích nâng cao của Hệ Thống Pháp Luật vui lòng lựa chọn và đăng ký gói cước.
| BỘ Y TẾ | CỘNG HÒA XÃ HỘI CHỦ NGHĨA VIỆT NAM |
| | Hà Nội, ngày 29 tháng 08 năm 2024 |
Kính gửi: Sở Y tế các tỉnh, thành phố trực thuộc Trung ương.
Căn cứ công văn số 4745/SYT-NVD ngày 24/8/2024 của Sở Y tế Thanh Hóa về việc kiểm tra, xác minh và cung cấp thông tin về các lô thuốc giả Công an Thanh Hóa đã phát hiện và công văn số 135/TTKN-KH đề ngày 21/8/2024 gửi kèm Phiếu kiểm nghiệm số 726/2024 ngày 21/08/2024 của Trung tâm Kiểm nghiệm tỉnh Thanh Hóa, báo cáo về việc mẫu sản phẩm có thông tin ghi trên nhãn: Viên nén bao phim Cefuroxim 500mg; Số đăng ký: VD-31978-19; Số lô: 900124; Ngày sản xuất: 140124; Hạn sử dụng: 140127; Nhà sản xuất: Chi nhánh công ty cổ phần dược phẩm Trung Ương Vidipha Bình Dương (địa chỉ: Khu phố Tân Bình, phường Tân Hiệp, thị xã Tân Uyên, tỉnh Bình Dương); mẫu thuốc do Trung tâm Kiểm nghiệm tỉnh Thanh Hóa lấy tại quầy thuốc Đức Linh (địa chỉ: đường 510B, thôn 2, xã Hoằng Ngọc, huyện Hoằng Hóa, tỉnh Thanh Hóa. Mẫu thuốc trên không có phản ứng định tính của Cefuroxim;
Căn cứ báo cáo tại văn thư số 383/CV-VDP ngày 17/8/2024 của Công ty cổ phần dược phẩm Trung Ương Vidipha Bình Dương liên quan đến đặc điểm, dấu hiệu phân biệt giữa mẫu thuốc lưu tại Công ty và mẫu thuốc do Trung tâm Kiểm nghiệm tỉnh Thanh Hóa thu được trên thị trường;
Sau khi đối chiếu, xem xét, để đảm bảo an toàn cho người sử dụng, tiếp theo công văn số 2824/QLD/CL ngày 17/8/2024, Cục Quản lý Dược đề nghị Sở Y tế các tỉnh, thành phố trực thuộc Trung ương, Y tế các ngành:
1. Thông báo cho các cơ sở kinh doanh, sử dụng thuốc thông tin về thuốc giả trên nhãn ghi: Viên nén bao phim Cefuroxim 500mg; Số đăng ký: VD- 31978-19; Số lô: 900124; Ngày sản xuất: 140124; Hạn sử dụng: 140127; Nhà sản xuất: Chi nhánh công ty cổ phần dược phẩm Trung Ương Vidipha Bình Dương có các đặc điểm, dấu hiệu phân biệt với thuốc thật như sau:
| Stt | Dấu hiệu nhận dạng | Thuốc do Vidipha sản xuất | Thuốc giả |
| 1 | Chi tiết in trên vỏ hộp | Hộp thật Vị trí dấu “)” so với ký tự “A” của chữ “CÁCH”
| Hộp giả Vị trí dấu “)” so với ký tự “A” của chữ “CÁCH”
|
| 2 | Chi tiết in trên vỏ hộp | Hộp thật Vị trí dấu giữa dấu “.” so với ký tự “ê” trong từ “hiện”
| Hộp giả Vị trí dấu giữa dấu “.” so với ký tự “ê” trong từ “hiện”
|
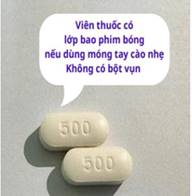
| 3 | Nhận diện trên viên | Viên thuốc có lớp bao phim bóng nếu dùng móng tay cào nhẹ. Không có bột vụn
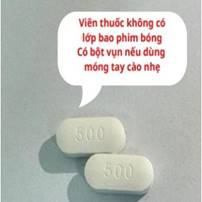
| Viên thuốc không có lớp bao phim bóng Có bột vụn nếu dùng móng tay cào nhẹ
|
| 4 | Nhận diện trên viên | Thuốc thật Cạnh viên thuốc thật nhẵn , sắc nét , không sứt mẻ | Thuốc giả Nhám , hay sứt mẻ |
2. Tiếp tục triển khai thực hiện nghiêm Chỉ thị 17/CT-TTg ngày 19/6/2018 của Thủ tướng Chính phủ về tăng cường đấu tranh chống buôn lậu, gian lận thương mại, sản xuất, kinh doanh hàng giả, hàng kém chất lượng thuộc nhóm hàng dược phẩm, mỹ phẩm, thực phẩm chức năng, dược liệu và vị thuốc y học cổ truyền; Thực hiện nghiêm các chỉ đạo tại Công văn số 7173/BYT-QLD ngày 12/12/2022 của Bộ Y tế về việc tăng cường quản lý, kiểm tra chất lượng thuốc, đấu tranh chống thuốc giả, thuốc không rõ nguồn gốc xuất xứ.
3. Phối hợp với các cơ quan truyền thông, thông tin tới các cơ sở buôn bán, sử dụng thuốc và người dân biết để không buôn bán, sử dụng thuốc giả Viên nén bao phim Cefuroxim 500mg có các dấu hiệu nhận biết nêu trên; Chỉ mua bán thuốc tại các cơ sở kinh doanh dược hợp pháp; không mua bán thuốc không rõ nguồn gốc; kịp thời thông báo các dấu hiệu nghi ngờ về sản xuất, kinh doanh thuốc giả, thuốc không rõ nguồn gốc tới cơ quan y tế và cơ quan có chức năng liên quan.
4. Phối hợp với cơ quan công an, quản lý thị trường, Ban chỉ đạo 389 và các cơ quan chức năng liên quan tiến hành kiểm tra các cơ sở kinh doanh thuốc trên địa bàn; điều tra, xác minh thông tin và truy tìm nguồn gốc về lô thuốc Viên nén bao phim Cefuroxim 500mg giả nêu trên, xử lý các tổ chức, cá nhân vi phạm theo quy định hiện hành; kịp thời phát hiện và ngăn chặn việc sản xuất, buôn bán và sử dụng lô thuốc Viên nén bao phim Cefuroxim 500mg giả.
5. Chỉ đạo Trung tâm kiểm nghiệm tăng cường lấy mẫu, kiểm tra chất lượng thuốc lưu hành trên địa bàn đối với các thuốc có nguy cơ bị làm giả hoặc kém chất lượng; báo cáo kịp thời các vụ việc phát hiện tới Sở Y tế và cơ quan chức năng liên quan.
6. Thiết lập đường dây nóng, tiếp nhận các thông tin về thuốc giả, thuốc nhập lậu, thuốc không rõ nguồn gốc xuất xứ trên địa bàn để kịp thời phối hợp với các cơ quan chức năng xác minh, xử lý.
Báo cáo kết quả kiểm tra, xử lý vi phạm và nguồn gốc lô thuốc giả về Cục Quản lý Dược.
Cục Quản lý Dược thông báo để các Sở Y tế biết và thực hiện ./.
|
| KT. CỤC TRƯỞNG |
- 1Chỉ thị 17/CT-TTg năm 2018 về tăng cường đấu tranh chống buôn lậu, gian lận thương mại, sản xuất kinh doanh hàng giả, hàng kém chất lượng thuộc nhóm hàng dược phẩm, mỹ phẩm, thực phẩm chức năng, dược liệu và vị thuốc y học cổ truyền do Thủ tướng Chính phủ ban hành
- 2Công văn 7173/BYT-QLD năm 2022 về tăng cường công tác quản lý, kiểm tra chất lượng thuốc, đấu tranh chống thuốc giả, thuốc không rõ nguồn gốc do Bộ Y tế ban hành
Công văn 2960/QLD-CL năm 2024 về Thuốc giả Cefuroxim 500mg do Cục Quản lý Dược ban hành
- Số hiệu: 2960/QLD-CL
- Loại văn bản: Công văn
- Ngày ban hành: 29/08/2024
- Nơi ban hành: Cục Quản lý dược
- Người ký: Tạ Mạnh Hùng
- Ngày công báo: Đang cập nhật
- Số công báo: Đang cập nhật
- Ngày hiệu lực: 29/08/2024
- Tình trạng hiệu lực: Kiểm tra